Similar presentations:
Химическая связь
1. Химическая связь
2.
• Химическая связь – это взаимодействие атомов,приводящее к их соединению в молекулы
простых и сложных веществ. Образование
молекул из атомов, сопровождается уменьшением
энергии по сравнению с невзаимодействующими
атомами(т.е. молекулярное состояние устойчивее
чем атомное).
• Учение о строение атома объясняет механизм
образования молекул и природу химической
связи.
• Различают
следующие
основные
виды
химической
связи:
ковалентная,
ионная,
металлическая, водородная, межмолекулярная.
3. Правило октета
У атомов на внешнем энергетическом уровне может бытьот 1 до8 электронов. Если на внешнем уровне содержится
max число электронов, то этот уровень называется
завершенным, такие уровни характеризуются повышенной
прочностью(у инертных газов). Атомы других элементов
имеют незавершенные энергетические уровни и в
процессе взаимодействия завершают их.
• В результате образования химической связи атомы могут
приобрести
электронную
конфигурацию
как
у
благородного газа (октет) за счет объединения ионов
(В.Коссель) или образования общих электронных пар
(Г.Льюис).
4. Ковалентная связь
В 1916г Льюис предложил теорию ковалентной химической связи.Химическая связь образуется при сближении двух атомов. В
результате чего их валентные электроны образуют пару, общую для
двух атомов, движущуюся в поле двух атомов и связывающую атомы
в единое целое.
Ковалентная связь – наиболее общий вид химической связи,
возникающий за счет обобществления электронной пары
посредством обменного механизма, когда каждый из
взаимодействующих атомов поставляет по одному электрону,
или по донорно-акцепторному механизму, если электронная
пара передается в общее пользование одним атомом (донор)
другому атому (акцептору)
Химическая связь обычно изображается черточками, соединяющими
взаимодействующие атомы; каждая черта эквивалентна обобщенной паре
электронов
5.
• Льюис Гильберт Ньютон американскийфизикохимик. Основные работы посвящены
химической
термодинамике
и
теории
строения вещества. Определил свободную
энергию многих соединений. Ввел понятие
термодинамической активности. Уточнил
формулировку закона действующих масс.
Развил
(1916)
теорию
ковалентной
химической
связи.
Его
концепция
обобщенной электронной пары оказалась
очень плодотворной для органической химии.
Предложил (1926) новую теорию кислот как
акцепторов пары электронов и оснований как
доноров пары электронов. Ввел (1929) термин
«фотон».
6. механизмы образования ковалентной связи
а)Обменный
б) донорно-акцепторный
[ ]
+
7. Разновидности ковалентной связи
• Различают две разновидности ковалентной связи:ковалентно-полярная и ковалентно-неполярная.
• Для ковалентно-неполярной связи электронное облако
распределяется в пространстве симметрично относительно
ядер двух атомов. При образовании молекул(H2, Cl2, O2)
каждое ядро атома с одинаковой силой притягивает
общую электронную пару.
• Для ковалентно-полярной связи общее электронное
облако
смещено
к
атому
с
большей
электроотрицательностью.(напр. HCl ,H2O, NH3)
8. Электрический дипольный момент связи
• Из за смещения электронной плотности от одного ядра кдругому., один из атомов приобретает избыточный «+»
заряд, а др. избыточный «–» заряд. Эти заряды
называются
эффективными
зарядами
атомов
в
молекуле(δ).
• Т.о. полярность связи выражается через смещение
электронной пары к более электроотрицательному атому.
Количественной
мерой
полярности
связи
является электрический дипольный момент μ,
равный произведению элементарного заряда на
длину диполя
μ = δ∙L
9. Свойства ковалентной связи
• Энергия связи - то количество энергии, котороенеобходимо для разрыва связи и служит мерой
прочности молекул.(Т.е. чем прочнее хим.связь,
тем больше энергии нужно затратить для ее
разрыва)
• Длина связи - это межъядерное расстояние.
Химическая связь тем прочнее, чем меньше это
расстояние.
• Насыщаемость – это способность атома
использовать все свои валентные возможности.
• Валентный угол – это угол между связями
обуславливает геометрию молекулы.
• .
10. Направленность- объясняет пространственную структуру молекул, т.е. их геометрию
• 1-пирамидальная• 2-угловая
• 3-тетраэдрическая
11. Структуры и формы молекул угловая, линейная, пирамидальная
CO2H 2O
O
O
H
104.50
C
O
NH3
N
1800
H
H 107.30
H
H
12. Виды и кратность связи. Направленность ковалентной химической связи
• Наиболее прочные химические связивозникают в направлении максимального
перекрывания атомных орбиталей.
• В
зависимости
от
направления
перекрывания
электронных
облаков
различают σ (сигма)
(пи) и
δ(дельта) связи.
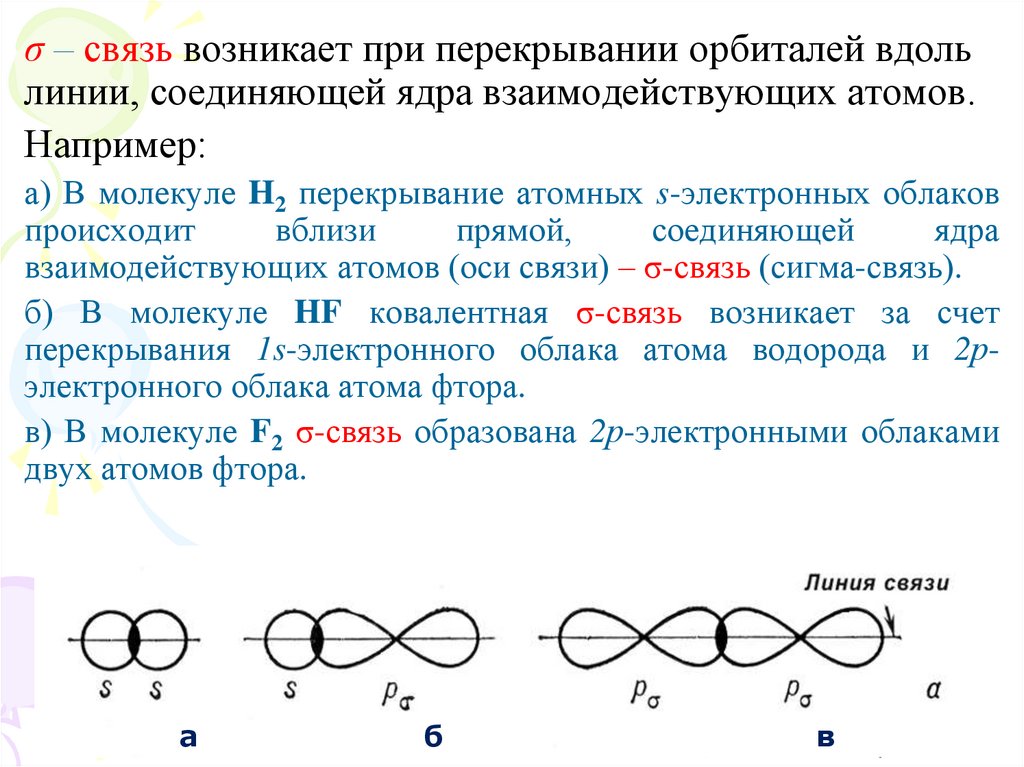
13.
σ – связь возникает при перекрывании орбиталей вдольлинии, соединяющей ядра взаимодействующих атомов.
Например:
а) В молекуле H2 перекрывание атомных s-электронных облаков
происходит
вблизи
прямой,
соединяющей
ядра
взаимодействующих атомов (оси связи) – σ-связь (сигма-связь).
б) В молекуле HF ковалентная σ-связь возникает за счет
перекрывания 1s-электронного облака атома водорода и 2рэлектронного облака атома фтора.
в) В молекуле F2 σ-связь образована 2р-электронными облаками
двух атомов фтора.
а
б
в
13
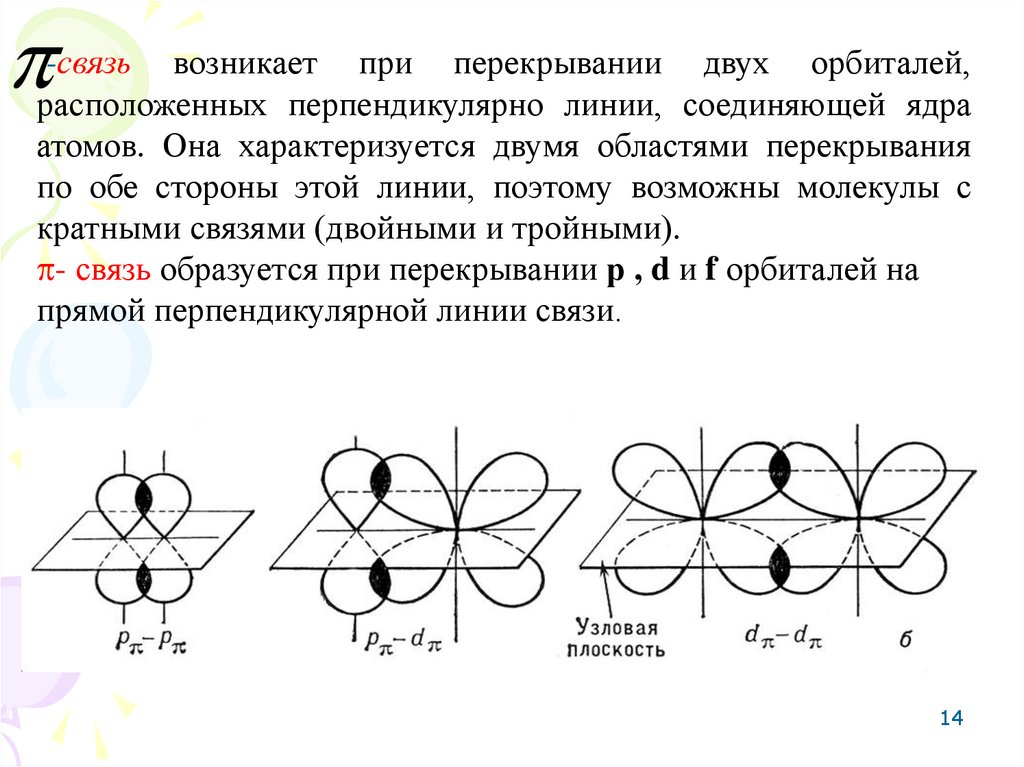
14.
-связьвозникает при перекрывании двух орбиталей,
расположенных перпендикулярно линии, соединяющей ядра
атомов. Она характеризуется двумя областями перекрывания
по обе стороны этой линии, поэтому возможны молекулы с
кратными связями (двойными и тройными).
- связь образуется при перекрывании р , d и f орбиталей на
прямой перпендикулярной линии связи.
14
15.
• δ(дельта)связь
возникает
при
перекрывании двух d орбиталей, расположенных в
параллельных плоскостях
16.
• Энергетически σ и – связи неравноценныЕ < Еσ.
• Разрыв – связи происходит первой.
• - связь может возникнуть только совместно с связью.
• Число связей соединяющих 2 атома, называется
кратностью связи.
• Кратность связи в молекулах H – H, H2C=CH2,
N N, соответственно равна 1, 2, 3.
17. Гибридизация атомных орбиталей
• Метод гибридизации атомных орбиталей исходит изпредположения, что при образовании молекулы вместо
исходных атомных s-, p- и d-электронных облаков
образуются равноценные гибридные электронные облака,
которые вытянуты по направлению к соседним атомам,
благодаря чему достигается их более полное
перекрывание с электронными облаками этих атомов и
образуется более прочная молекула.
Гибридизация АО – это смещение и выравнивание АО, по
форме и энергии.
Т.е, это состояние центрального атома, когда из «n»
неравноценных орбиталей образуется столько же
равноценных, но гибридных орбиталей.
Гибридная орбиталь имеет форму искаженной гантели.
Различают несколько типов гибридизации:
18.
sp-гибридизация- это гибридизация, в которой
участвуют атомные орбитали
одного s- и одного p-электронов
В результате образуются 2 гибридные орбитали, которые
ориентируются друг к другу под углом 180°
Пространственная конфигурация
молекулы, центральный атом которой
включает sp-гибридные орбитали
Примеры соединений, для которых характерна
sp-гибридизация: BeCl2, BeH2, CO, CO2, HCN
s
sp
sp
s
Модель орбиталей
в молекуле BeH2
18
19. SP- гибридизация на примере BeCl2
Вневозбужденном
состоянии
каждый
атом
Cl(1S22S22p53s23p5)имеет один не спаренный электрон, который будет
участвовать в образовании ковалентной связи.
У атома Be (1S22S2) в невозбужденном состоянии все
электроны спарены.Для перевода в возбужденное состояние Be*
(1S22S12p1) необходимо затратить энергию.
Be 1S22S2 → Be* 1S22S12p1
Если затратить небольшое количество энергии , то вместо
исходных S и p орбиталей можно получить две гибридные
Sp орбитали атома Be, которые будут глубже перекрываться
с р-орбиталями атомами Cl и тем самым образовывать
более прочную связь.
20.
Благодаря вытянутой форме гибридной орбитали,происходит
более
полное
перекрывание
электронных облаков. Энергия выделяющаяся при
образовании ковалентной связи значительно
превышает энергию на возбуждение Ве и на
гибридизацию. Поэтому образовании молекулы
BeCl2 энергетически выгодно.
Гибридныe орбитали (ГО) представляют собой линейную комбинацию
АО данного атома (s- и p-АО Be, B, C), обладают одинаковыми
энергией и формой, определенной ориентацией в пространстве
(симметрией). Так s- и p-орбитали дают две sp-ГО,
расположенные под углом 180° относительно друг друга
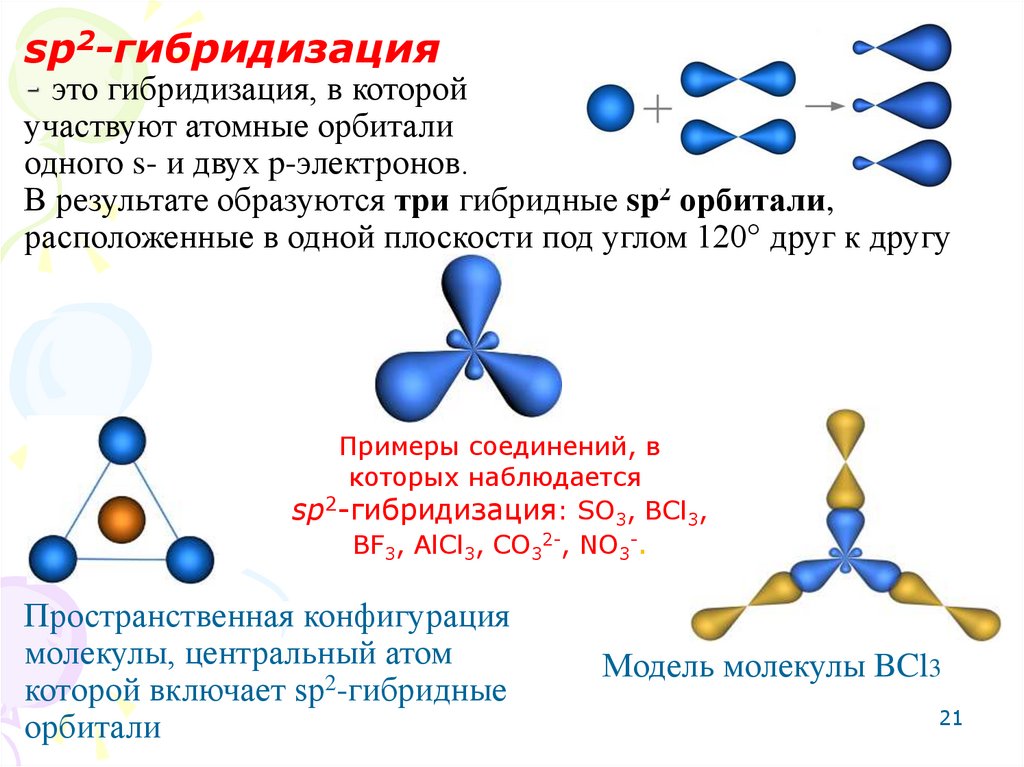
21.
sp2-гибридизация- это гибридизация, в которой
участвуют атомные орбитали
одного s- и двух p-электронов.
В результате образуются три гибридные sp2 орбитали,
расположенные в одной плоскости под углом 120° друг к другу
Примеры соединений, в
которых наблюдается
sp2-гибридизация: SO3, BCl3,
BF3, AlCl3, CO32-, NO3-.
Пространственная конфигурация
молекулы, центральный атом
которой включает sp2-гибридные
орбитали
Модель молекулы BCl3
21
22. SP2- гибридизация
• В молекуле ВCl3 осуществляется SP2- гибридизация.• В 1S22S22P1→B* 1S22S12P2
• У центрального атома бора в возбужденном состоянии
участвуют орбитали одного s и двух p-электронов. Что
приводит к образованию трех гибридных орбиталей
бора(s и две p), которые называются sp2-орбиталями, они
полностью эквивалентны энергетически и
пространственно направлены к вершинам треугольника.
Валентный угол - 1200
23.
sp3-гибридизация- это гибридизация, в которой
участвуют атомные орбитали
одного s- и трех p-электронов
В результате образуются четыре sp3-гибридные
орбитали симметрично ориентированные в
пространстве под углом 109°28'
Пространственная
конфигурация
молекулы, центральный
атом которой образован
sp3-гибридными
орбиталями – тетраэдр
Модель молекулы CH4
23
24. SP3- гибридизация СН4
• Центральный атом углерода в СН4 переходит ввозбужденное состояние и имеет 4 не спаренных
электрона, которые могут участвовать в образовании
хим.связи.
С 1S2 2S2 2P2 → С* 1S2 2S1 2P3
• При образовании молекулы СН4 у атома углерода
подверглись гибридизации орбитали одного S и трех P
электронов в результате получились четыре гибридные
орбитали SP3.
25.
Основные положения теории гибридизации :*Гибридные орбитали обеспечивают максимальное
перекрывание АО.
* Число гибридных орбиталей равно числу АО,
участвующих в гибридизации.
Гибридизация возможна, когда в образовании связей
данного атома, участвуют электроны разных типов орбиталей
Гибридизуются близкие по энергии валентные АО
независимо от того, заполнены они в атоме полностью,
наполовину
или
пусты.
В гибридизации участвуют АО, имеющие общие признаки
симметрии.
гибридные орбитали дают молекулы с углами 180°, 120°,
109°28', 90°. Это правильные геометрические фигуры.
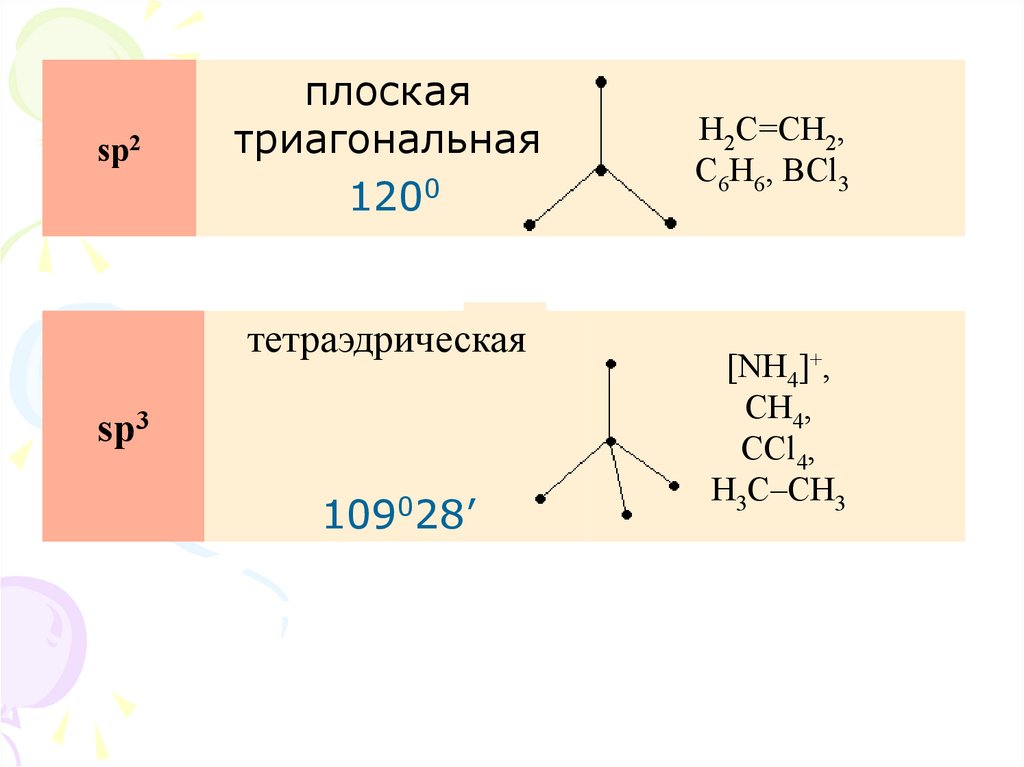
26.
линейная180°
H–Be–H,
sp
HC≡CH
180°
27.
sp2плоская
триагональная
120°
1200
H2C=CH2,
C6H6, BCl3
109°28'
тетраэдрическая
sp3
109028’
[NH4]+,
CH4,
CCl4,
H3C–CH3
28.
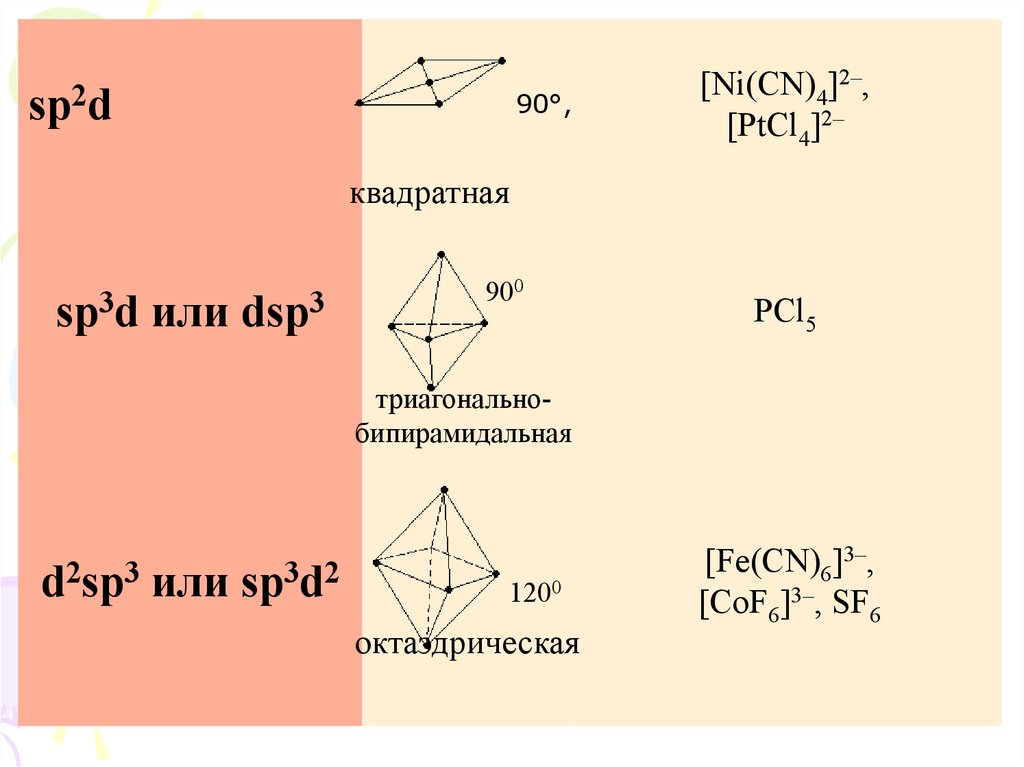
sp2d90°,
[Ni(CN)4]2–,
[PtCl4]2–
квадратная
sp3d или dsp3
900
PCl5
триагональнобипирамидальная
d2sp3 или sp3d2
120°
1200
октаэдрическая
[Fe(CN)6]3–,
[CoF6]3–, SF6
29.
• Валентность – это свойство атома элементаприсоединять или замещать определенное число атомов
другого элемента с образованием химической связи.
Количественно она определяется номером группы в
периодической системе Д.И. Менделеева, т.е. от единицы до
восьми. Валентность не имеет знака.
Мерой валентности может служить число химических связей,
образуемых данным атомом с другими атомами. С точки зрения
метода валентных связей числовое значение валентности равно числу
ковалентной связей, которые образует атом.
Часто валентность совпадает со степенью окисления, но это не
одно и то же.
Например: N2 (В=3, ст ок.=0)
N2H4(гидразин) В=3, ст.ок=-2
NH3 (В=3, ст.ок=-3)
30. Ионная связь
• Впервые понятие «ионная связь» ввел в1916 немецкий физик Коссель, согласно
которой:
• атомы благородных газов обладают особенно
устойчивой
восьми-электронной
внешней
оболочкой (атом гелия двухэлектронной )
• при взаимодействии двух атомов, один
отдает электроны, а другой их
принимает.
Благодаря
электростатическому
притяжению
происходит образование химического
соединения.
31.
Атом, потерявший электрон становится «+» заряженнымионом, а атом получивший электрон «-» заряженным ионом.
Na 1s22s22p63s1 -1ē→ 1s22s22p6(Na +)
}Na+ + F- → NaF
F 1s22s22p5 +1ē → 1s22s22p6 (F-)
Химическая связь обусловленая электростатическим
притяжением положительных и отрицательных ионов называется ионной связью, а образованные соединения
ионными. Все они имеют более высокие температуры кипения и
плавления, малолетучи и
образуют кристаллические решетки
ионного типа. Ионные соединения образованны элементами, резко
отличающимися по значению электроотрицательности (ЭО).
32.
• Ионная связь не зависит от направления и не обладаетсвойством насыщенности в отличие от ковалентной.
• Современная теория связи объясняет образование
ионной связи из ковалентной предельно полярной за
счет смещения общей электронной пары в сторону
атома с большей электроотрицательностью.
• Ионная связь - частный случай ковалентной связи, (т.е. в
действительности 100% ионной связи не бывает, т.к. не
происходит полного перехода электронов от одного атома
к другому).
33.
• Т.о. нет принципиального различия в механизмевозникновения связи(неполярной и полярной ковалентной
и ионной ).
Природа химической связи – едина.
• Различаются они между собой лишь по степени
полярности.
• Чем больше разность ЭО, входящих атомов. Тем
сильнее выражена полярность.
(напр. CsF=4,1-0.86=3.24—ионная,
Н2=0 - ков.неполярная)
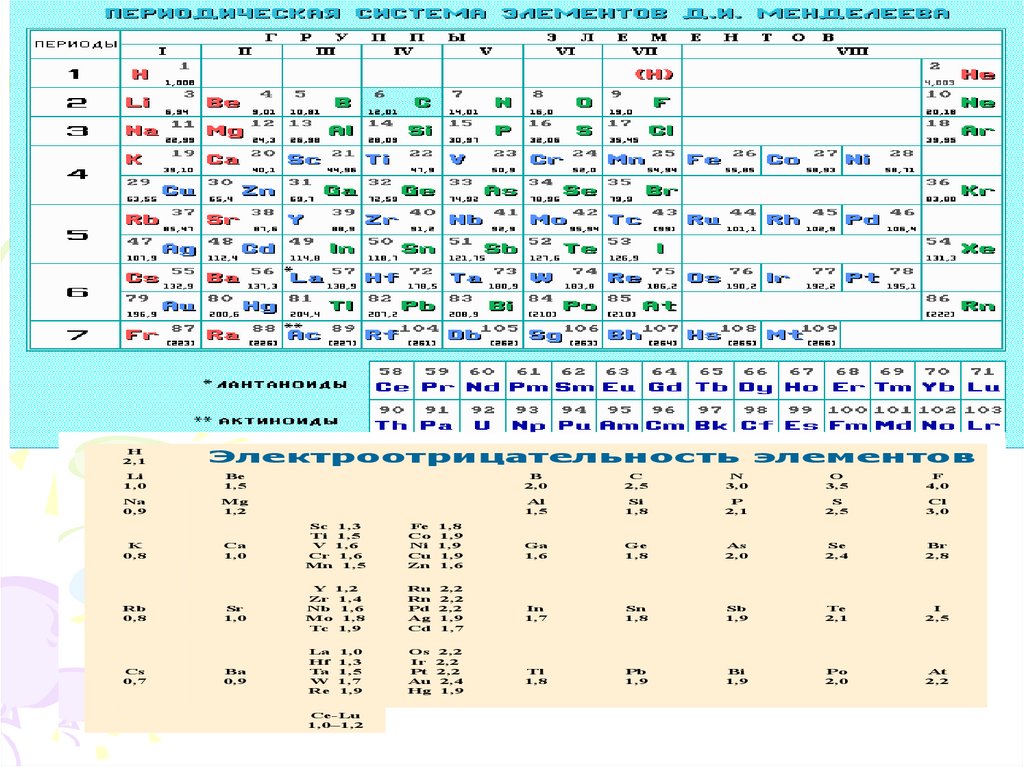
Предсказать полярность можно с помощью таблицы
электроотрицательности (Э.О.)
34.
H2,1
Электроотрицательность элементов
Li
1,0
Be
1,5
B
2,0
C
2,5
N
3,0
O
3,5
F
4,0
Na
0,9
Mg
1,2
Al
1,5
Si
1,8
P
2,1
S
2,5
Cl
3,0
Ga
1,6
Ge
1,8
As
2,0
Se
2,4
Br
2,8
In
1,7
Sn
1,8
Sb
1,9
Te
2,1
I
2,5
Tl
1,8
Pb
1,9
Bi
1,9
Po
2,0
At
2,2
K
0,8
Rb
0,8
Cs
0,7
Ca
1,0
Sr
1,0
Ba
0,9
Sc 1,3
Ti 1,5
V 1,6
Cr 1,6
Mn 1,5
Fe 1,8
Co 1,9
Ni 1,9
Cu 1,9
Zn 1,6
Y 1,2
Zr 1,4
Nb 1,6
Mo 1,8
Tc 1,9
Ru 2,2
Rn 2,2
Pd 2,2
Ag 1,9
Cd 1,7
La 1,0
Hf 1,3
Ta 1,5
W 1,7
Re 1,9
Os 2,2
Ir 2,2
Pt 2,2
Au 2,4
Hg 1,9
Ce-Lu
1,0–1,2
35.
Водородная связь36.
• Водородная связь - это своеобразная химическаясвязь. Она носит промежуточный характер между
ковалентной
связью и межмолекулярным
взаимодействием.
• Водородные связи могут быть внутри- и
межмолекулярными.
• Межмолекулярная водородная связь возникает
между молекулами в состав которых входит
водород и сильно электроотрицательный элемент.
В результате сильного смещения электронной
пары к электроотрицательному атому атом
водорода может взаимодействовать с другим
электроотрицательным атомом.
37.
Взаимодействие между молекулами НХ:Х Н … Х Н
сильно ЭО элемент: F, O, N, (Cl, S )
38.
• Внутримолекулярнаяводородная
связь
объединяет атомы одной и тоже молекулы.
Особенно распространены такие связи в
молекулах органических соединений. (Образуется,
например, в ацетилацетоне и сопровождается замыканием цикла.)
• Водородная связь обозначается точками … , что
говорит о том, что она намного слабее
ковалентной.
*Исключительно важную роль водородная связь играет в биологических
макромолекулах, таких неорганических соединениях как H2O, NH3.
*За счет водородных связей вода характеризуется столь высокими по сравнению
с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы
водородные связи отсутствовали, то вода плавилась бы при –100°С, а кипела
при –80°С.
39.
Внутримолекулярные Н - связиO
Н δ
О
N
C
OH
Оδ
Оδ
C
δ
ОН δ
O
2-нитрофенол
Н δ
NH–CH–CO
3
R
через три звена
салициловая кислота
белок
N
40.
Механизм образования Н-связи:Электростатическое
взаимодействие
(диполь-дипольное)
-Донорно-акцепторное взаимодействие:
акцептор
донор
Х Н … Х Н
41. Межмолекулярное взаимодействие силы Ван-дер-Ваальса
Хотя молекула в целом электронейтральна и способна к
самостоятельному существованию, все же ее химическая
устойчивость относительна и проявляется в системах где
расстояние между молекулами значительно больше их
собственных размеров.
• Уже на расстояние нескольких нанометров между
соседними молекулами возникают силы притяжения(силы
Ван-дер-Ваальса). Эти силы имеют электрическую
природу.
42.
Йоханнес Дидерик Ван дер Ва́альс 23 ноября 1837, — 8
марта 1923, — голландский физик, лауреат Нобелевской
премии по физике в 1910 г.
Большая часть работ Ван дер Ваальса относится к области
теоретической молекулярной физики. Он исследовал
поведение молекули занимался теориями, описывающими
состояния материи. В 1869 годуон открыл силы
взаимодействия между молекулами, которые впоследствии
были названы его именем — силы Ван-дер-Ваальса.
В 1873 году в своей диссертации он развил модель,
единообразно описывающую газообразную и жидкую фазы
вещества. На основе этой модели он вывел уравнение
состояния, показавшее, что при некоторой температуре
исчезают различия в физических свойствах жидкости и её
пара, находящихся в равновесии. При такой температуре,
называемой критической, плотность жидкости и её
насыщенного пара становятся одинаковыми и исчезает
видимая граница между ними.
За это достижение Ван дер Ваальс получил в 1910 г.
Нобелевскую премию по физике «за работу над уравнением
состояния газов и жидкостей».
43.
Различают 3 типа межмолекулярноговзаимодействия:
1. Ориентационное взаимодействие двух
полярных молекул;
2. индукционное взаимодействие между
полярной и неполярной молекулами;
3. дисперсионное взаимодействие между
двумя неполярными молекулами
Энергия Ван-дер-Ваальсовой связи
меньше водородной.
44. Комплексные соединения
-это соединения сложного состава, у которых можновыделить центральный атом(комплексообразователь) и
связанные с ним молекулы или ионы (лиганды).
Согласно теории Вернера(1893) в каждом комплексном
соединении (КС) имеется внутренняя и внешняя сфера.
Многие положительно заряженные ионы (Cu2+, Ag+) обладают
способностью присоединять ионы противоположного знака (Сl–, СN–)
или полярные молекулы (NН3, Н2О). Образующиеся частицы
(Сu(СN)42-, Аg(NН3)2+) называют комплексными ионами.
45. Примеры комплексных соединений:
K[Fe(NH3)2 (CN)4] тетроцианодиаммин феррат III калия,[Аg(NН3)2]Cl
[Ni(NH3)6]Cl2 –
K2[PtI6]
[Cr(H2O)3F3]
хлорид диамин серебра,
дихлорид гексааммин никеля,
- гексайодплатинат IV калия,
-трифторо триакво хром.
46.
• Каждое комплексное соединение имеетвнешнею и внутреннюю сферы.
↓
↓
K3[Fe(CN)6]
• Центральное положение в комплексном
соединении занимает ион металла –
комплексообразователь, или центральный
ион.
• Вокруг центрального иона располагаются
молекулы или кислотные остатки – лиганды.
• Число лигандов вокруг центрального иона –
это координационное число К.Ч.
47.
Например K3[Fe(CN)6] :K+3 – внешняя _сфера_
[Fe(CN)6]-3 внутренняя сфера
*Заряд внутренней сферы численно равен заряду внешней
сферы, но противоположен ему по знаку (-3)
• комплексообразователь Fe+3 его заряд+3,
*Заряд комплексообразователя численно равен и
противоположен по знаку алгебраической сумме зарядов
всех ионов
• CN- лиганды (заряд-1)
• Координационное число К.Ч=6
48.
Диссоциация К3[Fe (CN)6] протекает поэтапно:• (первичная): К3[Fe (CN)6] ↔3K+ + [Fe (CN)6]3• (вторичная):[Fe (CN)6]3- ↔ Fe3+ + 6CNОпределяется величиной нестойкости (Кнест.). Чем
меньше эта величина, тем устойчивее
комплексное соединение.
Fe CN
3
K нестойк
6
Fe CN
3
6
49.
• Заряд комплексного иона может быть:а) положительным:
[Cu (NH3)4]2+Cl2 – координирующее число=4
б) отрицательным:
K3[Fe (CN)6]3- – координирующее число=6
в) нулевым:
• [Pt (NH3)2CL4] – координирующее число=6
50.
• В комплексных соединениях лиганды являютсядонорами электронов . Например, нейтральные
молекулы NН3, Н2О, NO , или анионы (Сl–, СN–,
OH-, N02-) .
• Комплексообразователи
является
акцепторами электронов, т.е. предоставляет свои
свободные орбитали. Это , как правило, ионы
металлов (Cu2+, Ni2+, Fe2+, Fe3+) и
ионы
неметаллов (B3+, Si4+) – имеющие свободные
орбитали.
• При наличии у атомов одной из молекул
свободной орбитали, а у атомов другой молекулы
- электронной пары между этими молекулами
может возникнуть взаимодействие по донорноакцепторному механизму.
51. Задание
• Определитьзаряд
комплексного
иона,
координационное число и степень окисления
комплексообразователя
в
следующих
соединениях.
• а) K4[Fe (CN)6]
• б)Na[Ag(NO2)2]
• в)K2[MoF8]
• г)[Cr(H2O)2(NH3)3Cl]Cl2
52.
25H
2,1
Электроотрицательность элементов
Li
1,0
Be
1,5
B
2,0
C
2,5
N
3,0
O
3,5
F
4,0
Na
0,9
Mg
1,2
Al
1,5
Si
1,8
P
2,1
S
2,5
Cl
3,0
Ga
1,6
Ge
1,8
As
2,0
Se
2,4
Br
2,8
In
1,7
Sn
1,8
Sb
1,9
Te
2,1
I
2,5
Tl
1,8
Pb
1,9
Bi
1,9
Po
2,0
At
2,2
K
0,8
Rb
0,8
Cs
0,7
Ca
1,0
Sr
1,0
Ba
0,9
Sc 1,3
Ti 1,5
V 1,6
Cr 1,6
Mn 1,5
Fe 1,8
Co 1,9
Ni 1,9
Cu 1,9
Zn 1,6
Y 1,2
Zr 1,4
Nb 1,6
Mo 1,8
Tc 1,9
Ru 2,2
Rn 2,2
Pd 2,2
Ag 1,9
Cd 1,7
La 1,0
Hf 1,3
Ta 1,5
W 1,7
Re 1,9
Os 2,2
Ir 2,2
Pt 2,2
Au 2,4
Hg 1,9
Ce-Lu
1,0–1,2














































 chemistry
chemistry








