Similar presentations:
Ковалентная связь
1. Ковалентная связь.
Молчанова Е.Р.
МБОУ СОШ 144
Красноярск 2010.
2.
Химическая связь - это взаимодействие двух атомов,осуществляемое путем обмена электронами.
При образовании химической связи атомы стремятся
приобрести устойчивую восьмиэлектронную (или
двухэлектронную) внешнюю оболочку, соответствующую
строению атома ближайшего инертного газа.
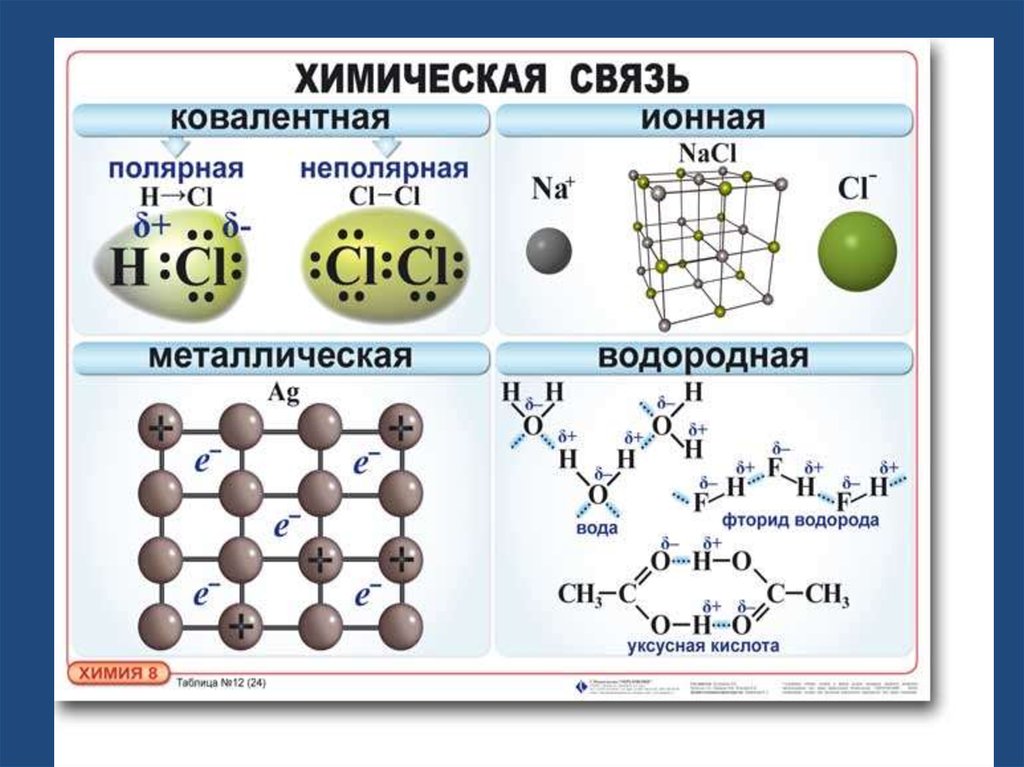
Различают следующие виды химической связи:
ковалентная (полярная и неполярная; обменная и
донорно-акцепторная), ионная,
водородная ,
металлическая.
3.
4.
5.
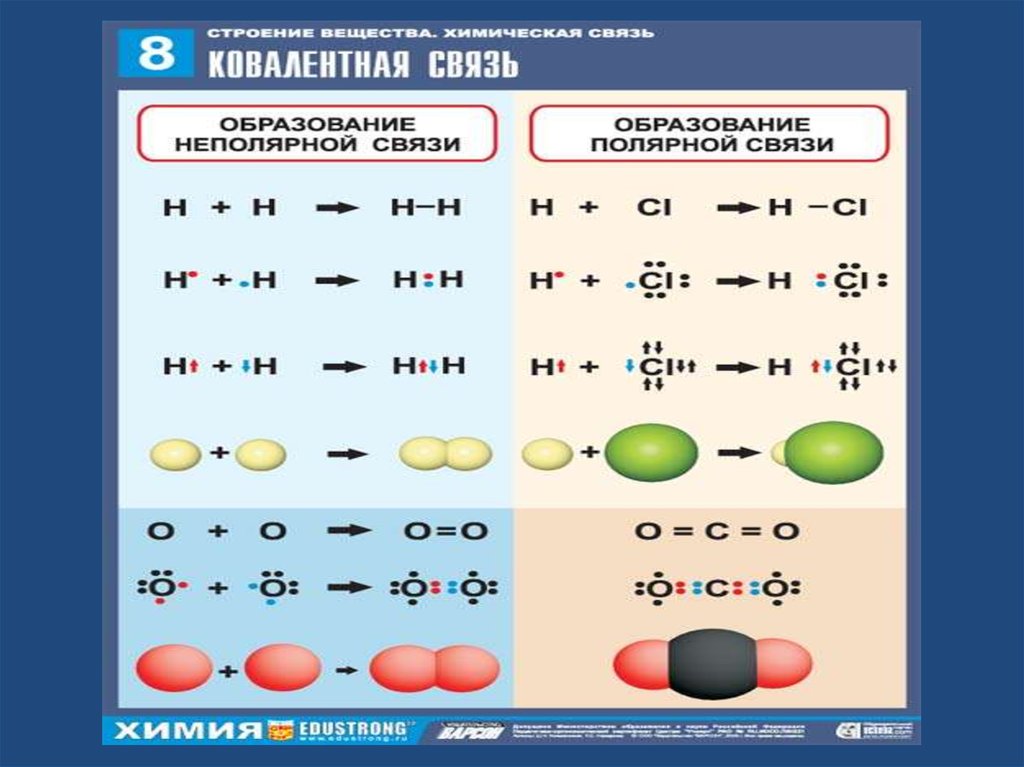
6. Ковалентная связь-
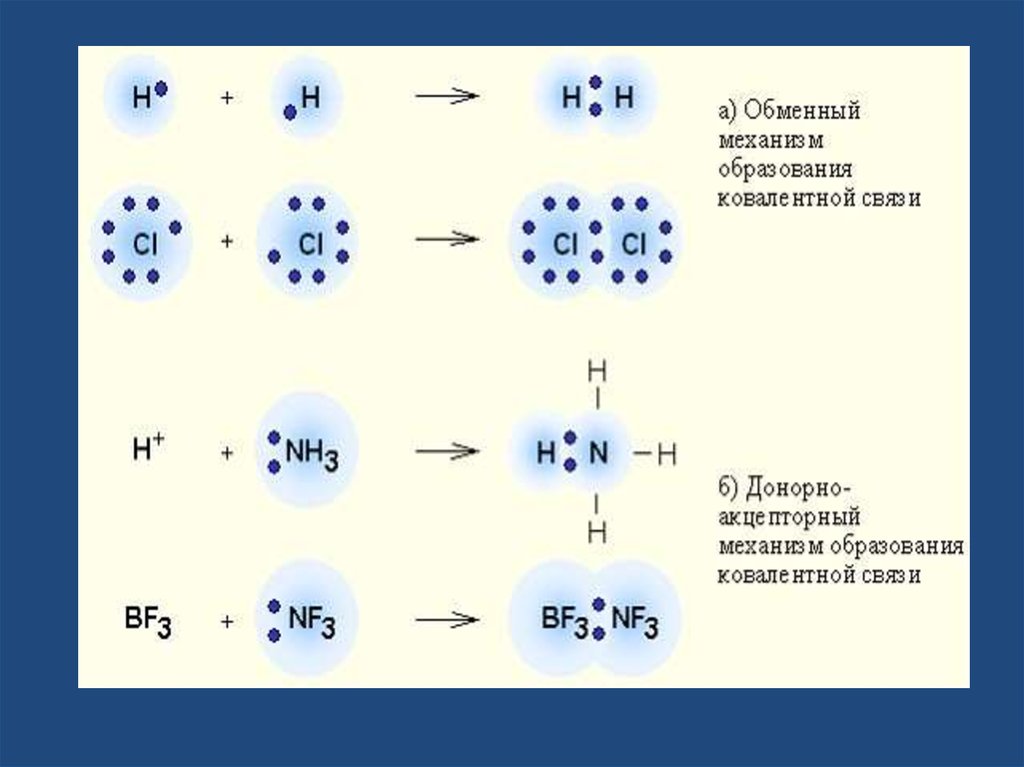
Ковалентная связь• химическая связь, возникающая за счетобразования общей пары электронов.
Ковалентная связь образуется между
маленькими атомами с одинаковыми или
близкими радиусами. Необходимое условие наличие неспаренных электронов у обоих
связываемых атомов (обменный механизм)
или неподеленной пары у одного атома и
свободной орбитали у другого (донорноакцепторный механизм).
7. КНС- это связь между атомами неметаллов с одинаковой эо.
8.
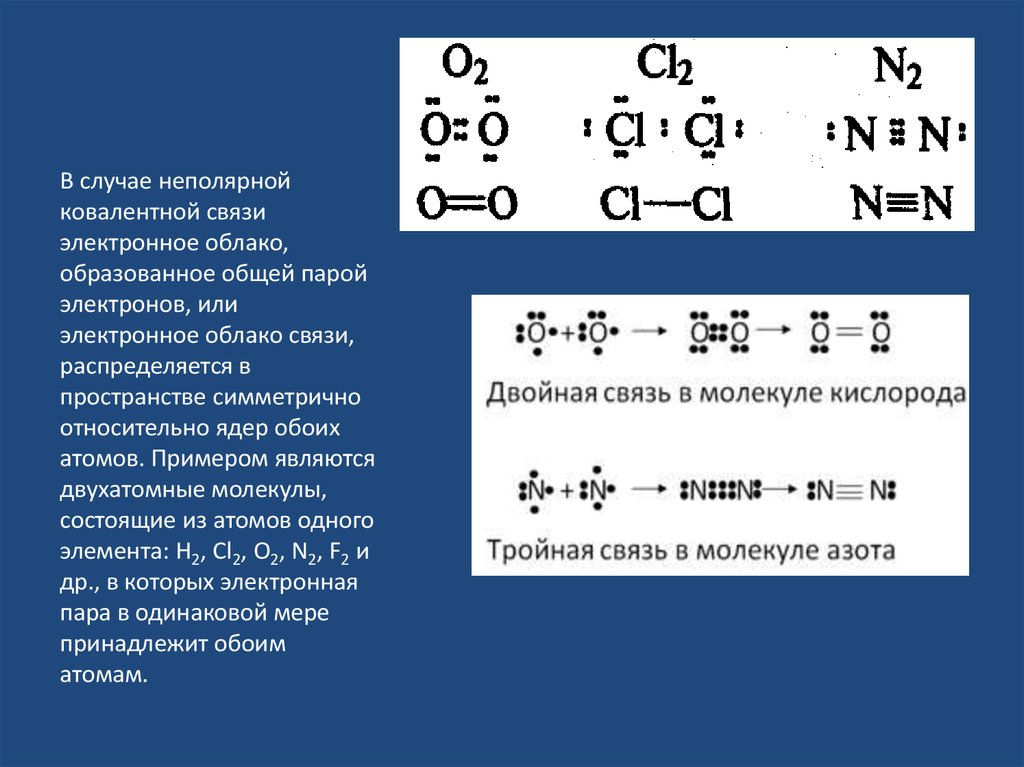
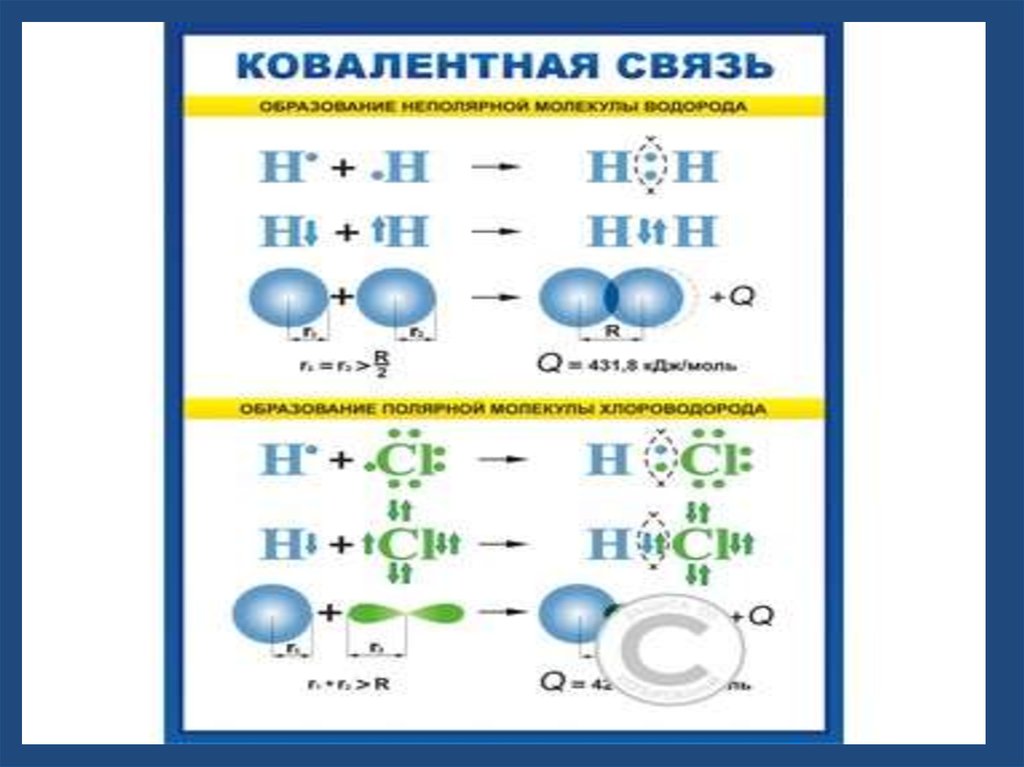
В случае неполярнойковалентной связи
электронное облако,
образованное общей парой
электронов, или
электронное облако связи,
распределяется в
пространстве симметрично
относительно ядер обоих
атомов. Примером являются
двухатомные молекулы,
состоящие из атомов одного
элемента: Н2, Сl2, О2, N2, F2 и
др., в которых электронная
пара в одинаковой мере
принадлежит обоим
атомам.
9.
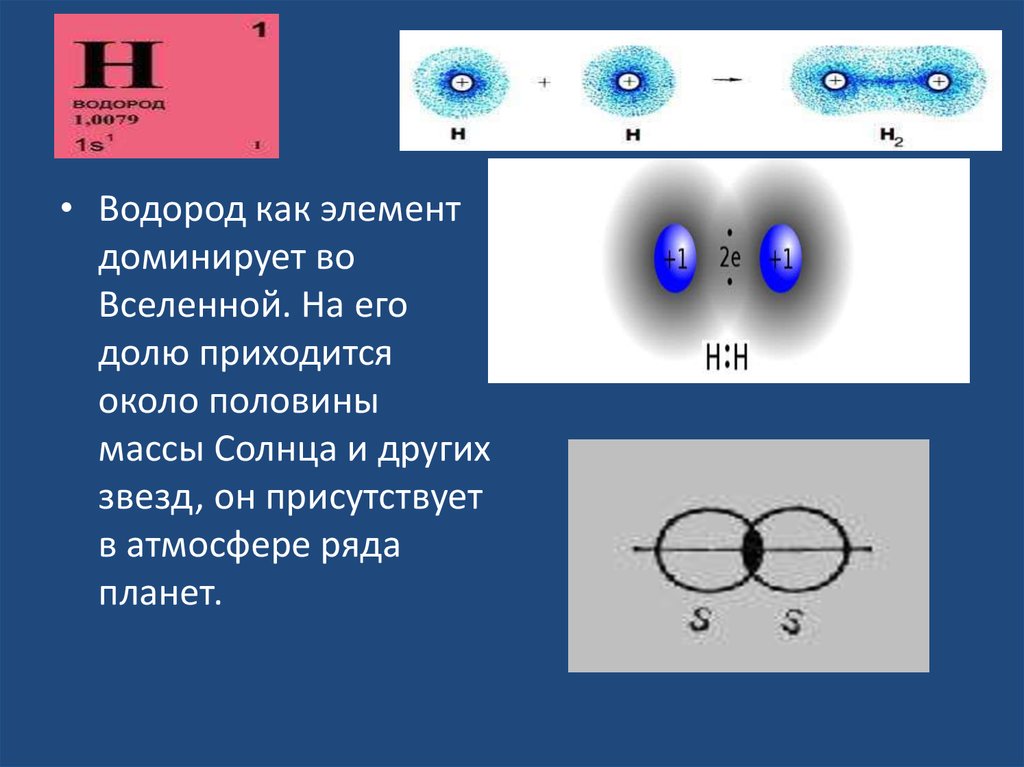
• Водород как элементдоминирует во
Вселенной. На его
долю приходится
около половины
массы Солнца и других
звезд, он присутствует
в атмосфере ряда
планет.
10.
11. Открытие кислорода
• Кислород был выделен впоследние десятилетия XVIII
века французом А. Боме,
шведом К. Шееле и
англичанином Д. Пристли.
Правда, ни один из них не
догадался , что открыл новое
простое вещество. До конца
жизни они так и не смогли
понять кислородной основы
горения и отстаивали
флогистонную точку зрения, по
которой причина горения –
особое вещество флогистон (от
греческого «флогиатос» –
зажженный). Но здесь важно
отметить другое.
• Все три первооткрывателя
кислорода были в химии
дилетантами. Антуан Боме и
Карл Шееле по профессии
аптекари, а Джозеф Пристли и
вовсе далек от химии да и от
естествознания вообще. По
образованию он филолог и
богослов. Заметим, однако, что,
несмотря на свое богословское
«происхождение», это был
выдающийся материалист,
философские идеи которого
шагнули далеко за пределы
своего времени.
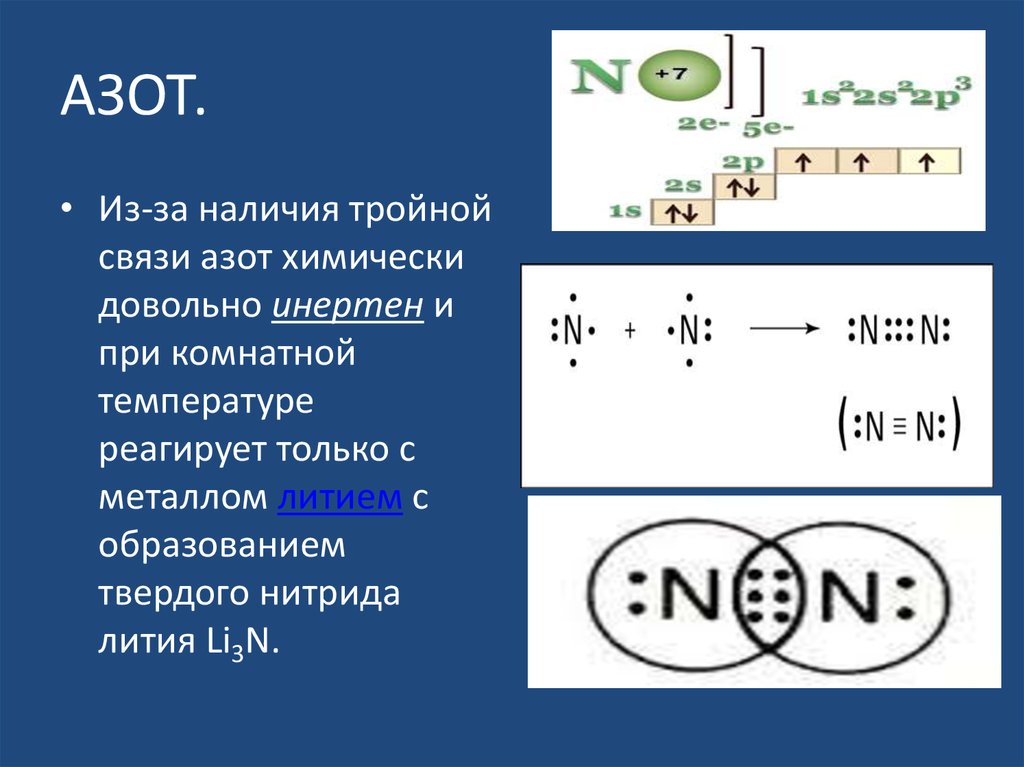
12. АЗОТ.
• Из-за наличия тройнойсвязи азот химически
довольно инертен и
при комнатной
температуре
реагирует только с
металлом литием с
образованием
твердого нитрида
лития Li3N.
13.
Если в мире что-то происходит само по себе, значит, природе этовыгодно. И образование химических связей подчиняется тому же
закону. Вот почему, если из отдельных атомов образуются
устойчивые молекулы, то всегда выделяется энергия.
Эту энергию химики называют энергией связи, и она может большой
или маленькой. Чем больше эта энергия, тем прочнее химическая
связь.
Тройная связь азота образует самую стабильную из всех известных
двухатомных молекул. Нужно приложить колоссальные усилия, чтобы
разрушить эту связь.
Тройная связь в молекуле азота очень прочна, при ее образовании
выделяется много энергии. Атомы азота в молекуле N2
трехвалентны, они связаны друг с другом тремя электронными
парами.
14.
15.
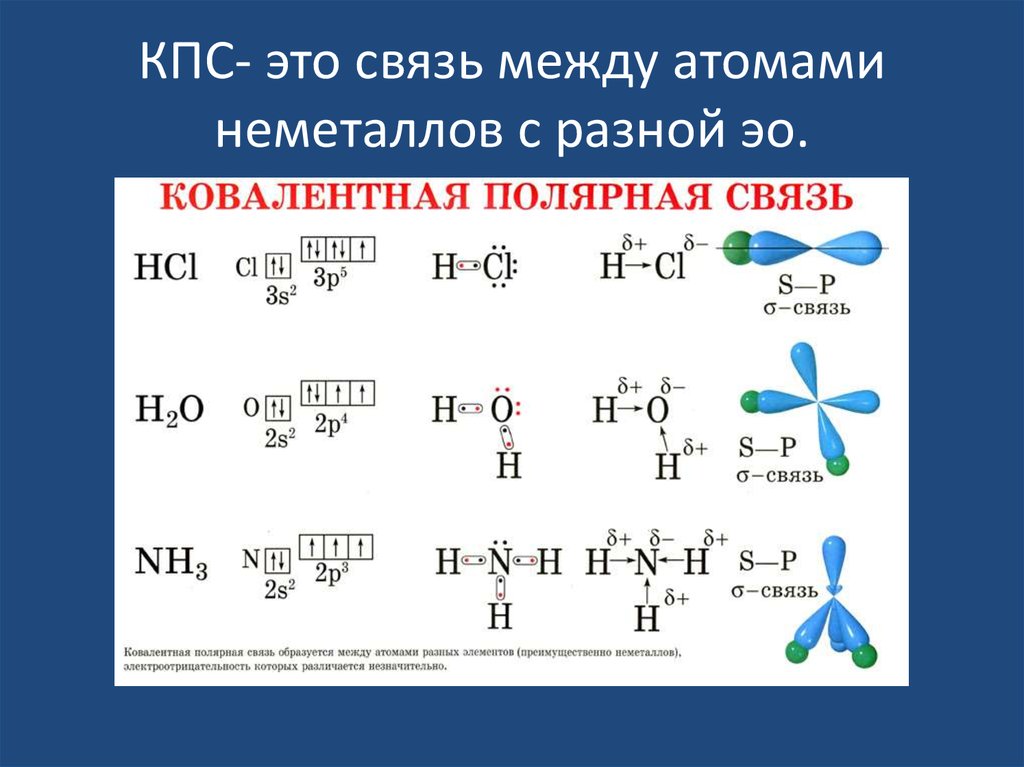
16. КПС- это связь между атомами неметаллов с разной эо.
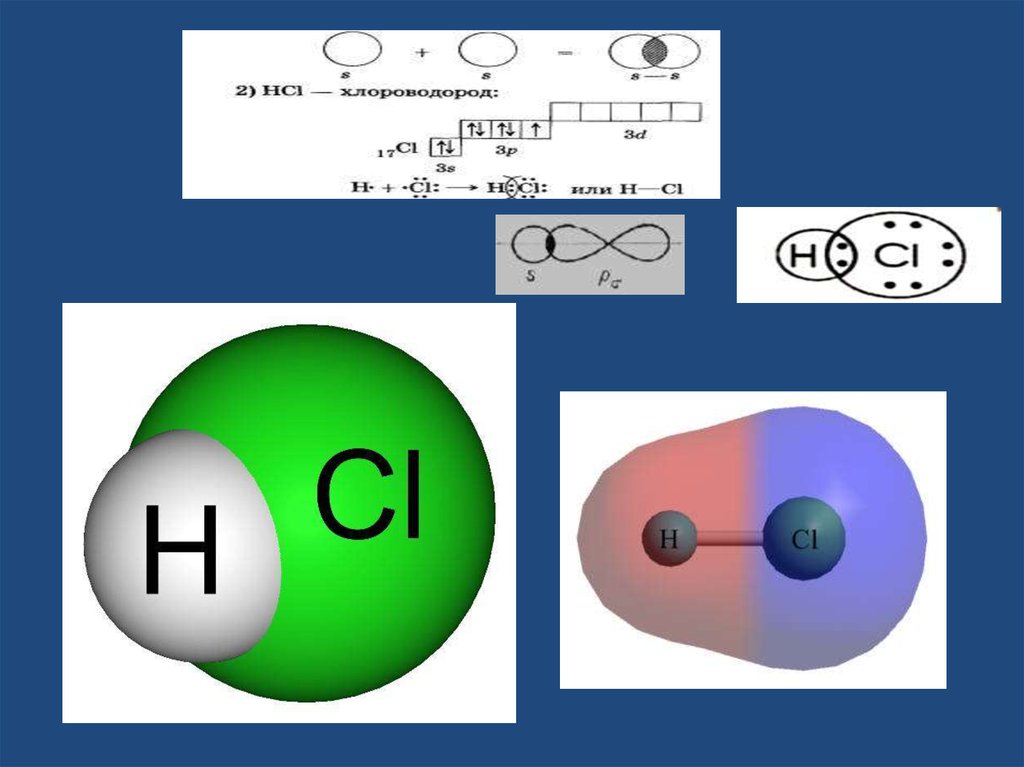
17. хлороводорода
18.
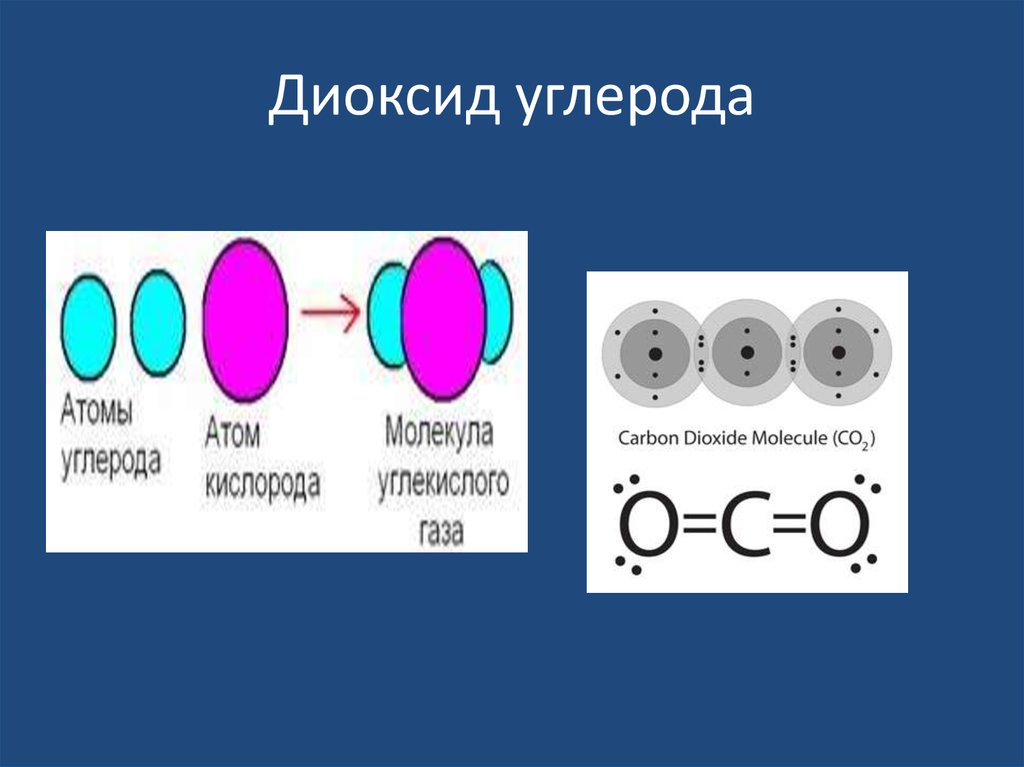
19. Диоксид углерода
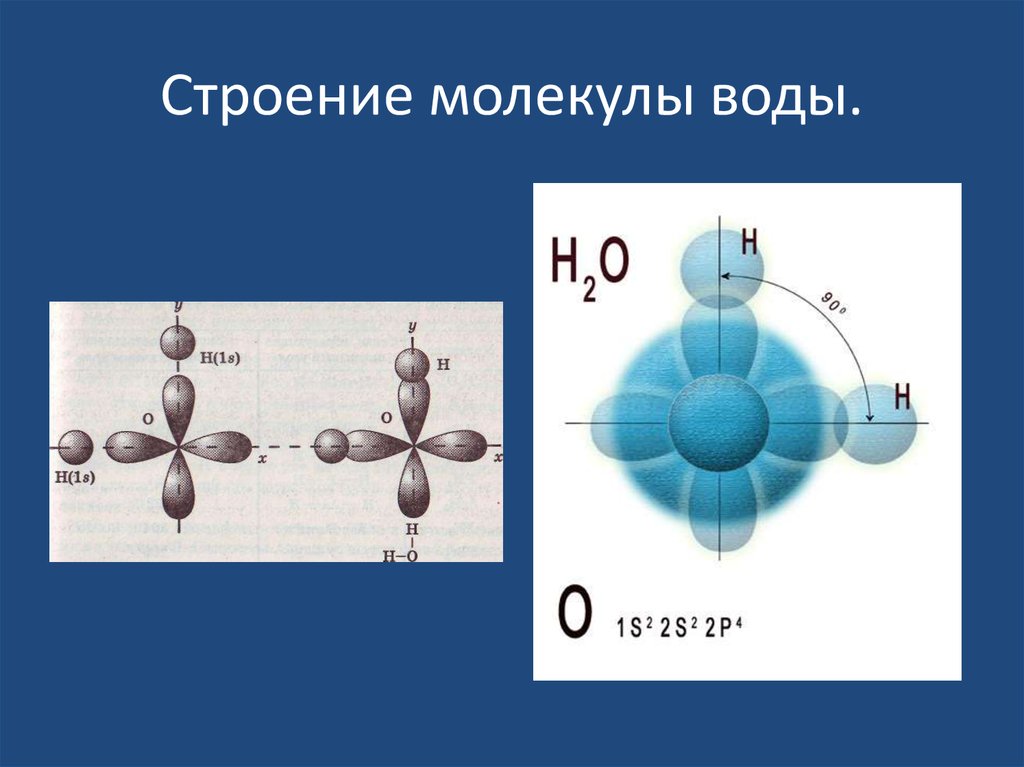
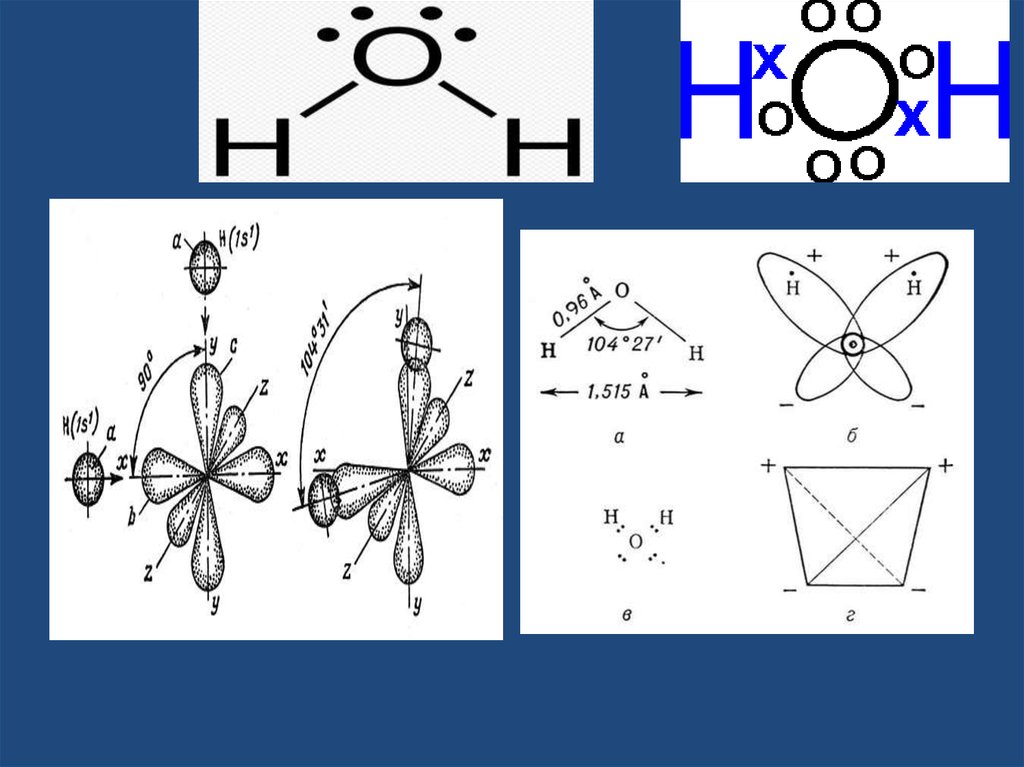
20. Строение молекулы воды.
21.
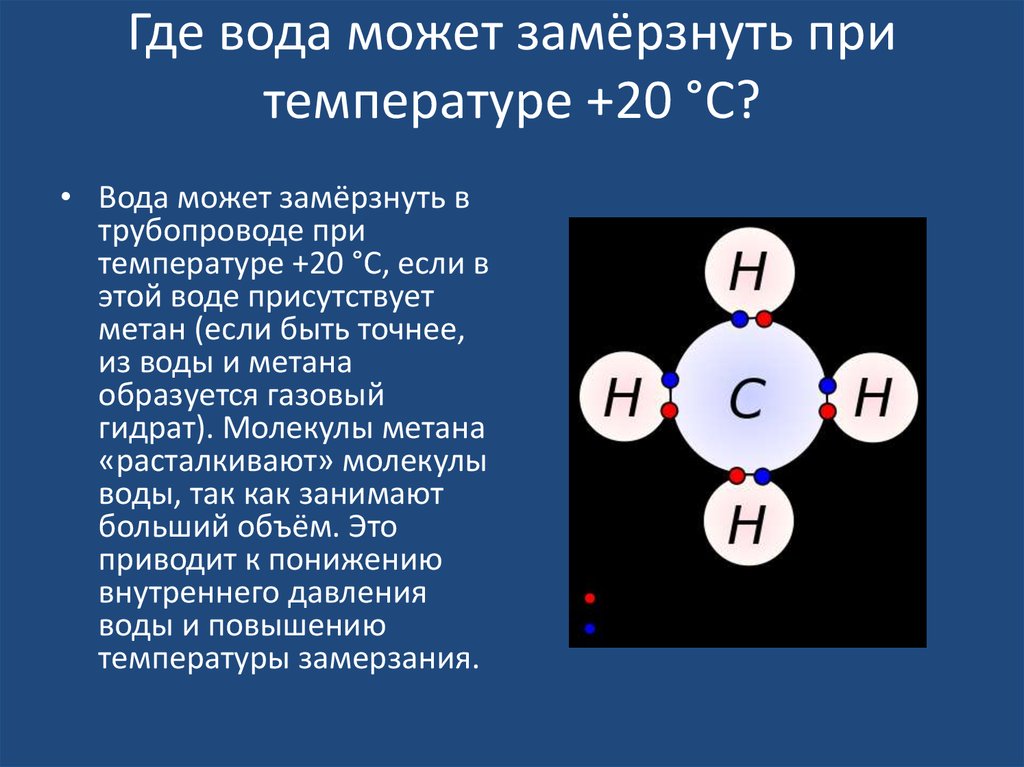
22. Где вода может замёрзнуть при температуре +20 °C?
• Вода может замёрзнуть втрубопроводе при
температуре +20 °C, если в
этой воде присутствует
метан (если быть точнее,
из воды и метана
образуется газовый
гидрат). Молекулы метана
«расталкивают» молекулы
воды, так как занимают
больший объём. Это
приводит к понижению
внутреннего давления
воды и повышению
температуры замерзания.
23.
24.
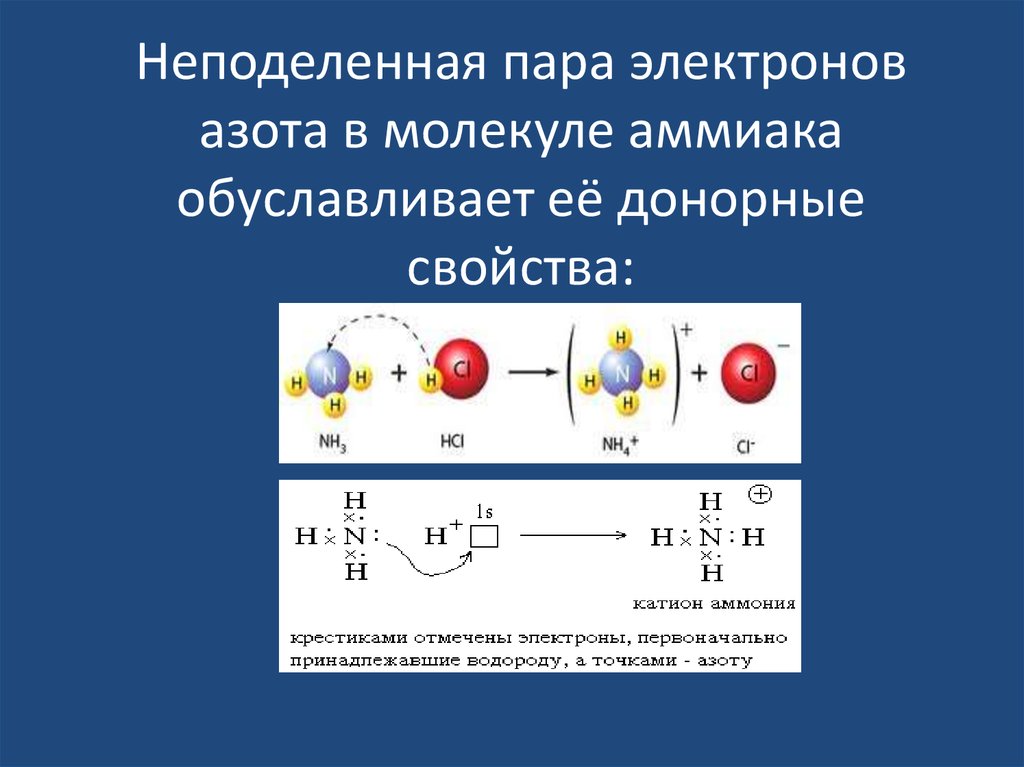
25. Неподеленная пара электронов азота в молекуле аммиака обуславливает её донорные свойства:
26. Аммиак NH3 —
• бесцветный газ с резкимхарактерным запахом,
почти в два раза легче
воздуха, легко сжижается
(т. кип. —33,4° C). Аммиак
очень хорошо растворим в
воде (при 20° C в 1 объеме
H2O растворяется 700
объемов NH3). Раствор
Аммиака в воде называют
аммиачной водой или
нашатырным спиртом.
27. Ион гидроксония.
• Говоря об ионах H+делается упрощение,
так как в воде их нет.
Протон "потерянный"
молекулой кислоты при
диссоциации
присоединяется к
молекуле воды, образуя
ион гидроксония H3O+, и
реакция диссоциации
кислоты записывается
так:
• НХ + H2O ↔ H3O+ + Х-
28. Схема образования молекулы азотной кислоты.
• 1. Атом водорода связывается с атомомкислорода ковалентной связью:
2. За счет неспаренного электрона атом
кислорода образует ковалентную связь с
атомом азота:
29.
• 3. Два неспаренных электрона атома азотаобразуют ковалентную связь со вторым
атомом кислорода:
30.
• 4. Третий атом кислорода, возбуждаясь,образует свободную 2р-орбиталь путем
спаривания неспаренных электронов (при
возбуждении такое спаривание возможно).
Взаимодействие неподеленной пары азота
со свободной орбиталью третьего атома
кислорода приходит к образованию
молекулы азотной кислоты:
31.
32.
• Доказано, что вмолекуле азотной
кислоты нет двойной
связи- электронная
плотность равномерно
распределена
(делокализована)
между двумя атомами
кислорода. Степень
окисления не
совпадает с
валентностью: ст.о.
равна +5, а
валентность равна IV.
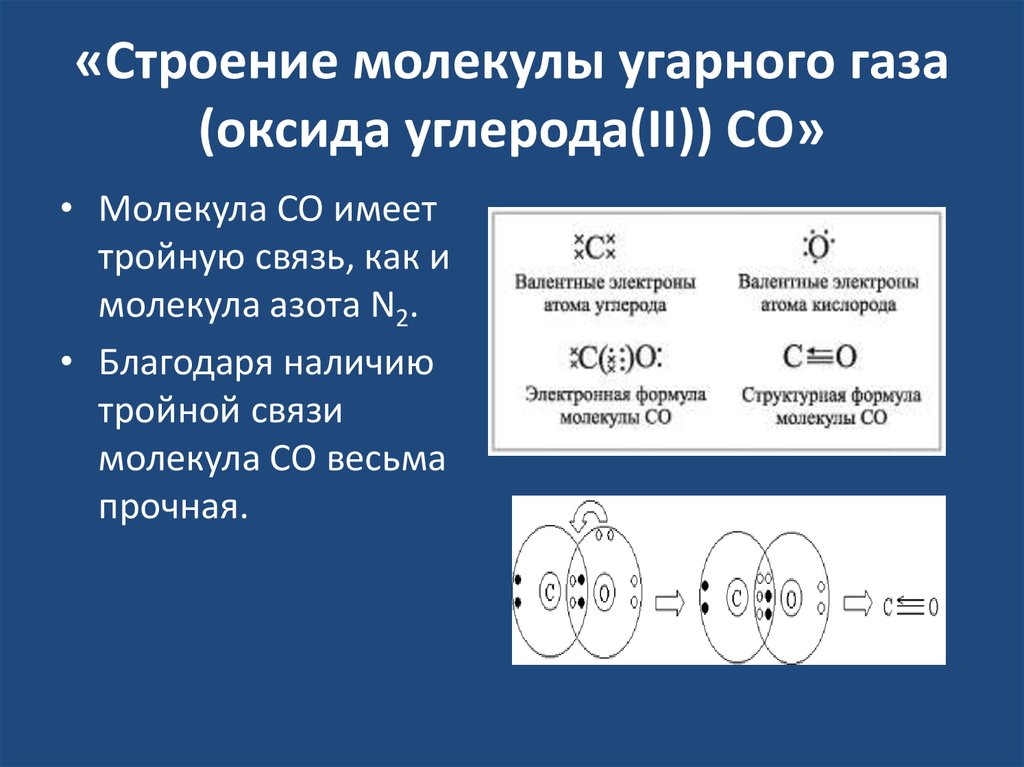
33. «Строение молекулы угарного газа (оксида углерода(II)) СО»
• Молекула CO имееттройную связь, как и
молекула азота N2.
• Благодаря наличию
тройной связи
молекула CO весьма
прочная.

















 chemistry
chemistry








