Similar presentations:
Механизмы образования ковалентной связи
1. Основы органической химии
E-mail: irkrav66@gmail.comОсновы
органической
химии
Семинар-5. Механизмы
образования ковалентной
связи
лектор:
проф. Рохин Александр
Валерьевич
2. Механизмы образования связи
Cвязь между атомами возникает приперекрывании их атомных орбиталей с
образованием молекулярных орбиталей
(МО).
Различают два механизма образования
ковалентной связи:
обменный;
донорно-акцепторный
2
27.07.2017
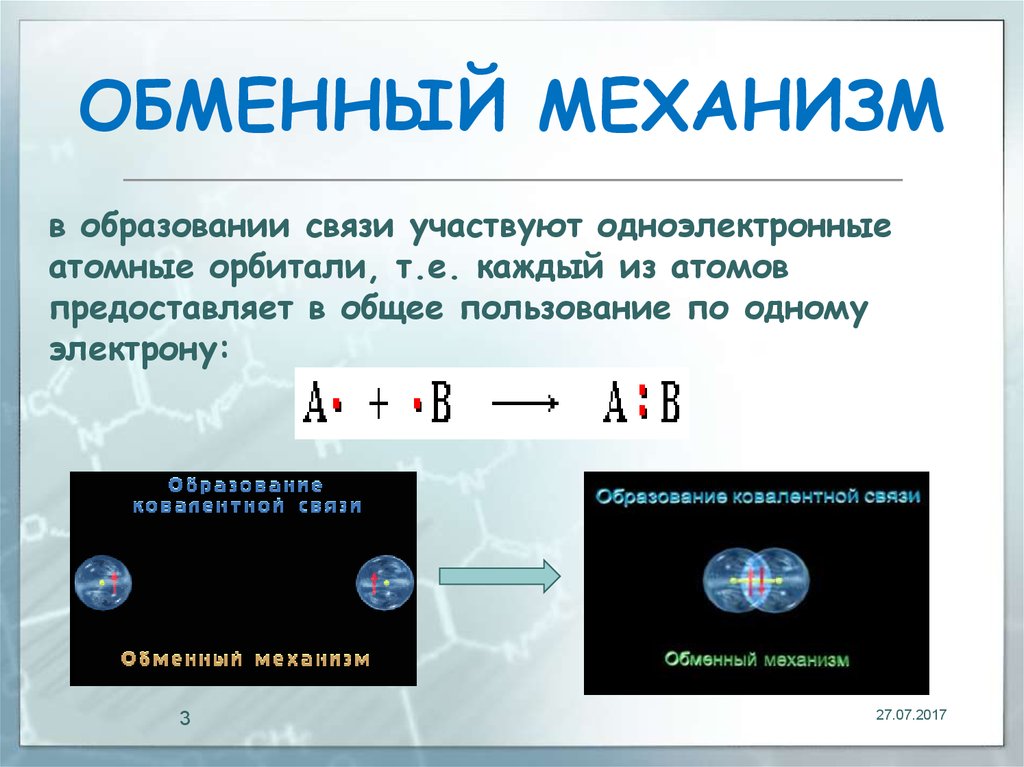
3. ОБМЕННЫЙ МЕХАНИЗМ
в образовании связи участвуют одноэлектронныеатомные орбитали, т.е. каждый из атомов
предоставляет в общее пользование по одному
электрону:
3
27.07.2017
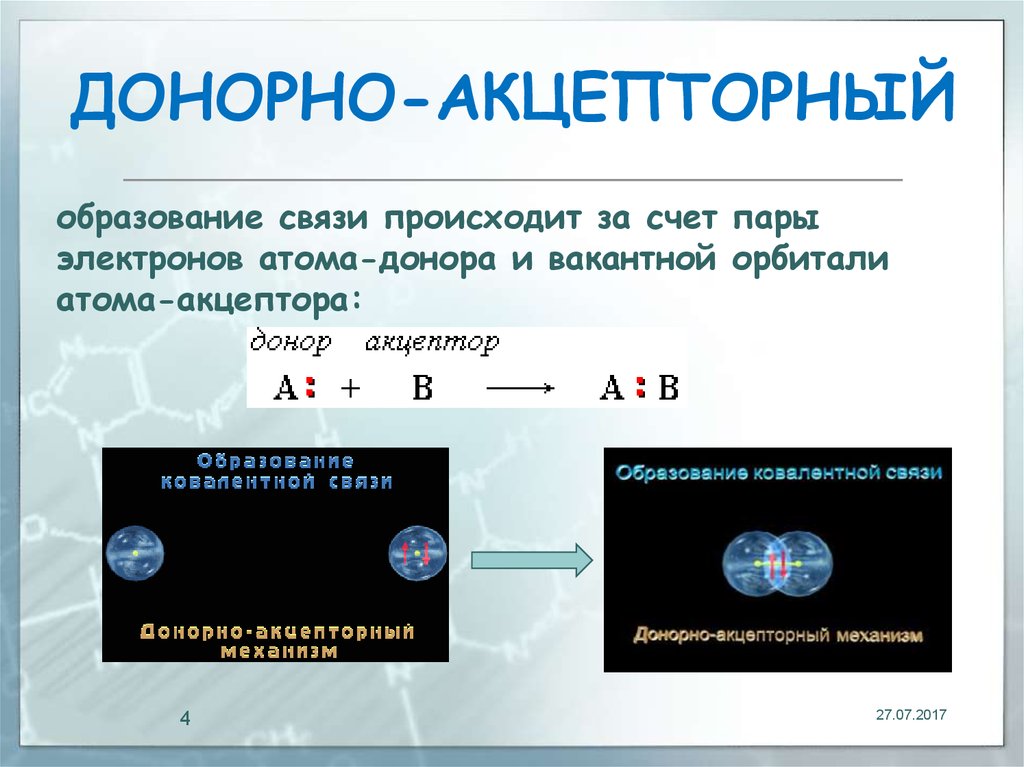
4. ДOНОРНО-АКЦЕПТОРНЫЙ
образование связи происходит за счет парыэлектронов атома-донора и вакантной орбитали
атома-акцептора:
4
27.07.2017
5. Донорно-акцепторные связи
Ковалентная связь, образующаяся засчет пары электронов одного из
атомов, т.е. по донорно-акцепторному
механизму, называется дoнорноакцeпторной
5
27.07.2017
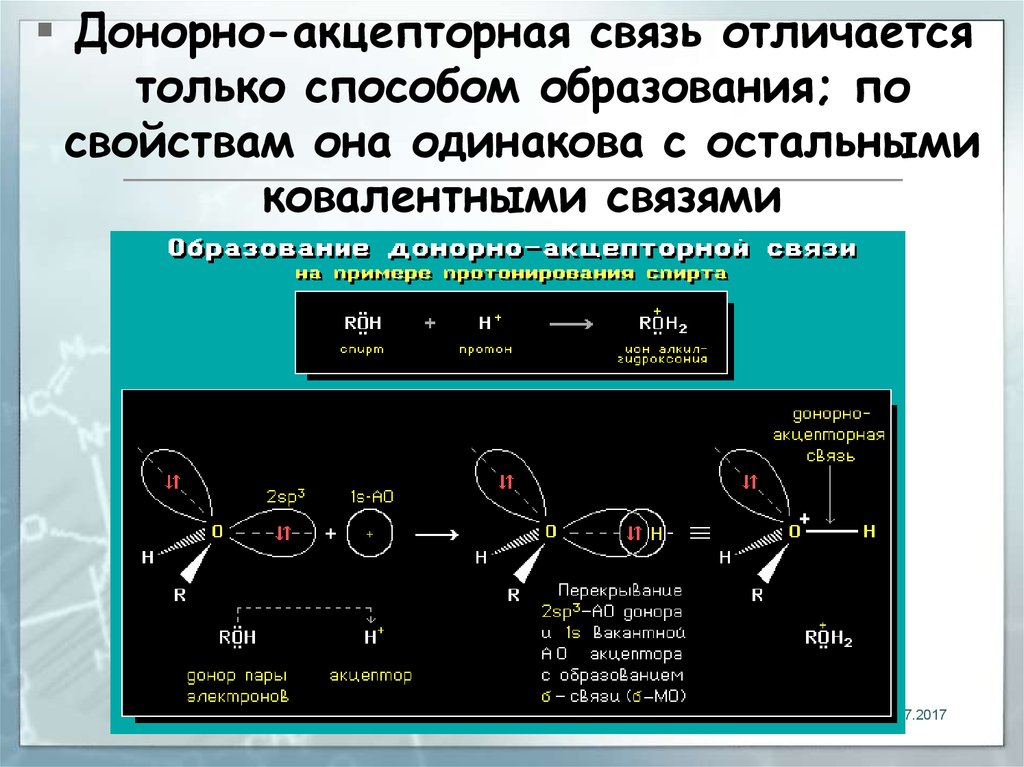
6.
Донорно-акцeпторная связь отличаетсятолько способом образования; по
свойствам она одинакова с остальными
ковалентными связями
6
27.07.2017
7. Сeмипoлярная связь
разновидность донорно-акцепторной.Образование происходит при
взаимодействии атома-донора пары
электронов и атома-акцептора, не
имеющих формальных зарядов
7
27.07.2017
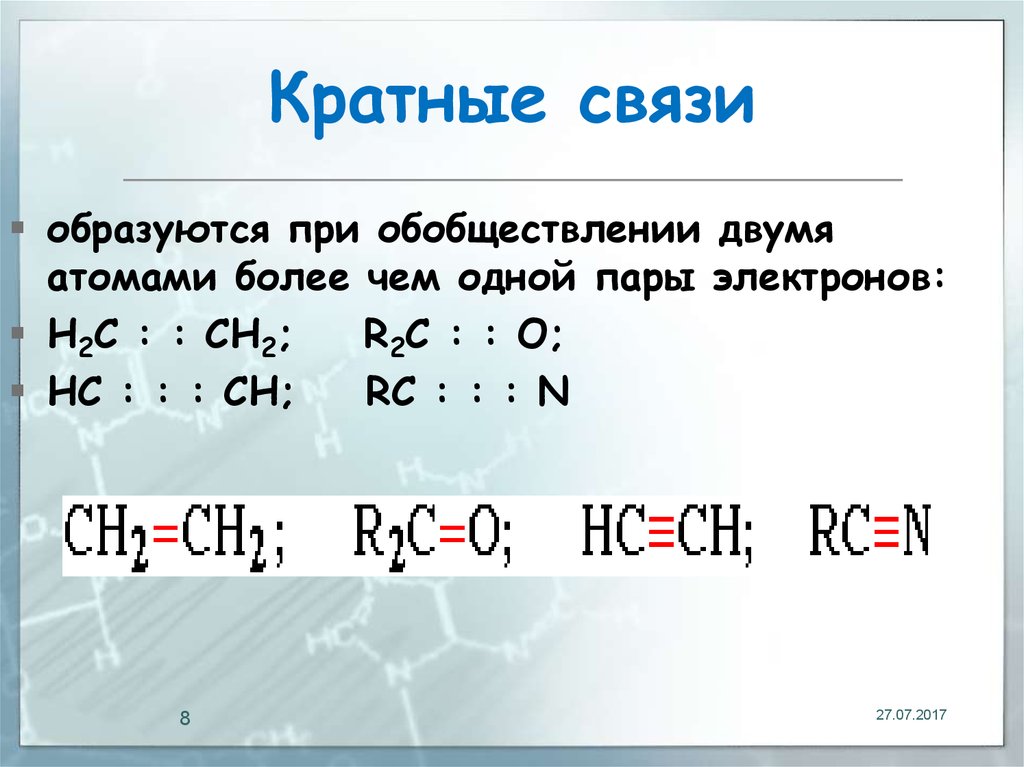
8. Кратные связи
образуются при обобществлении двумяатомами более чем одной пары электронов:
Н2С : : СН2;
R2С : : О;
HС : : : CH;
RС : : : N
8
27.07.2017
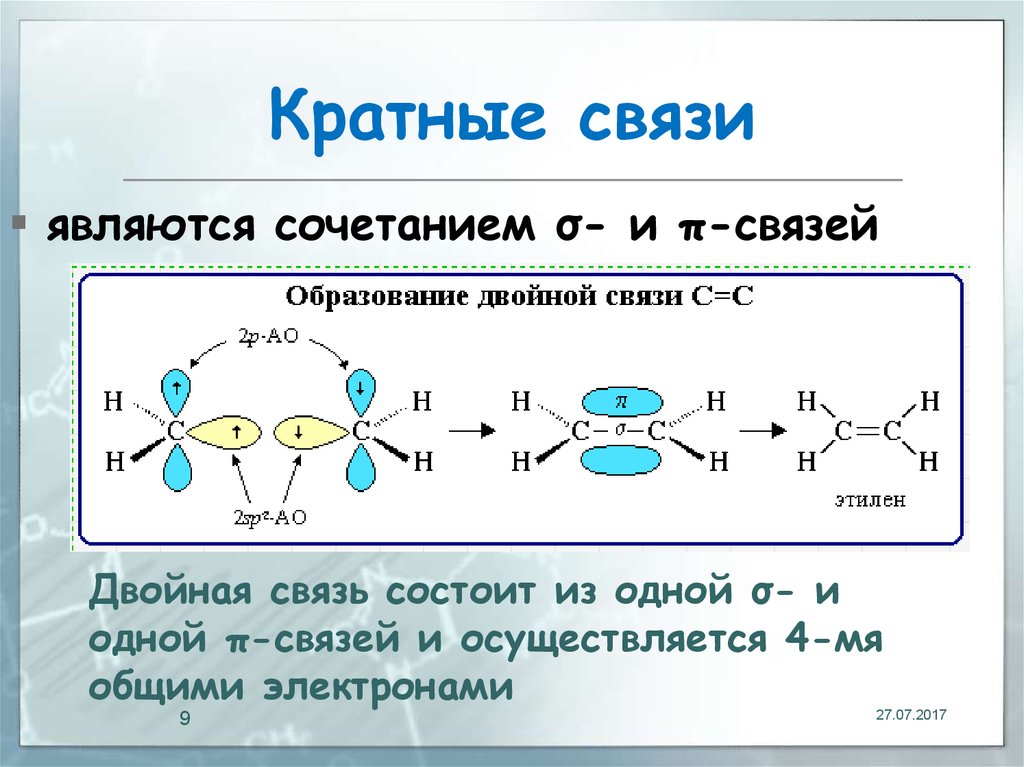
9. Кратные связи
являются сочетанием σ- и π-связейДвойная связь состоит из одной σ- и
одной π-связей и осуществляется 4-мя
общими электронами
9
27.07.2017
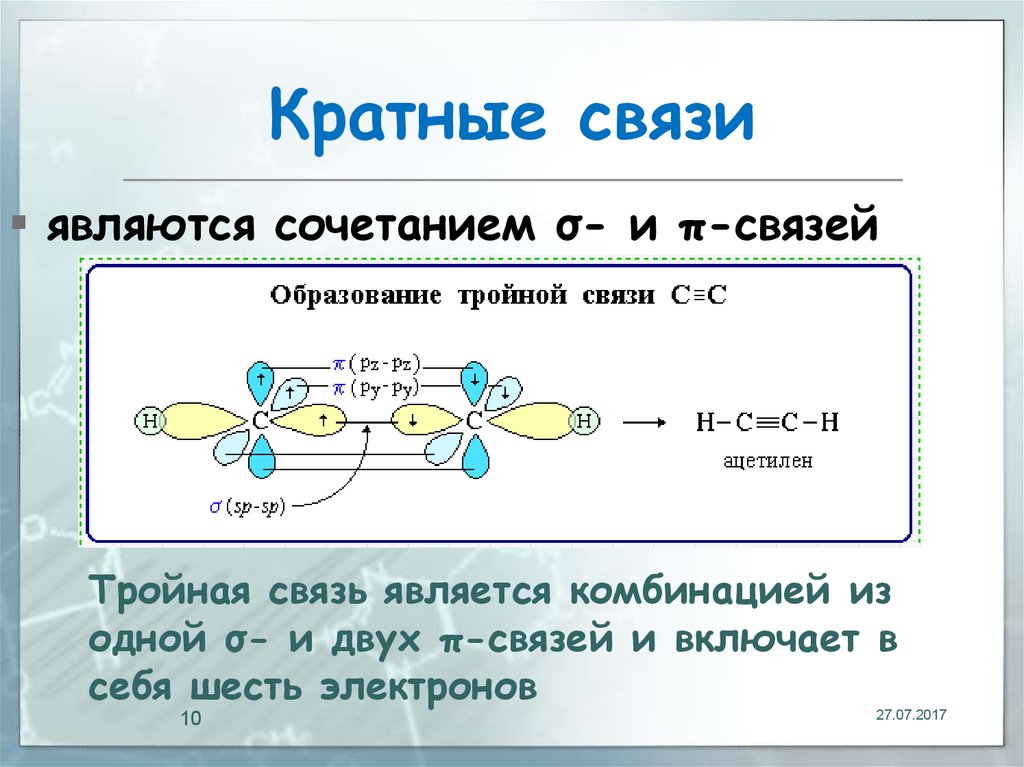
10. Кратные связи
являются сочетанием σ- и π-связейТройная связь является комбинацией из
одной σ- и двух π-связей и включает в
себя шесть электронов
10
27.07.2017
11. Кратные связи
Число электронных пар, участвующих вобразовании ковалентной связи
называется порядком связи.
порядок простой связи равен 1,
двойной - 2,
тройной - 3
11
27.07.2017
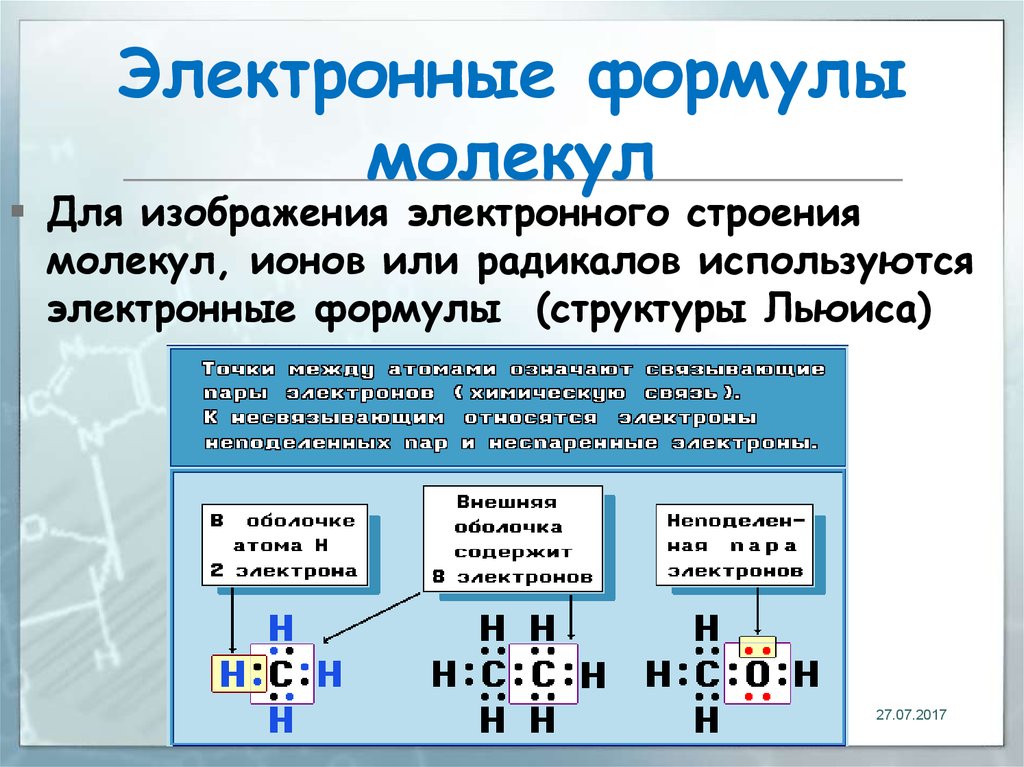
12. Электронные формулы молекул
Для изображения электронного строениямолекул, ионов или радикалов используются
электронные формулы (структуры Льюиса)
12
27.07.2017
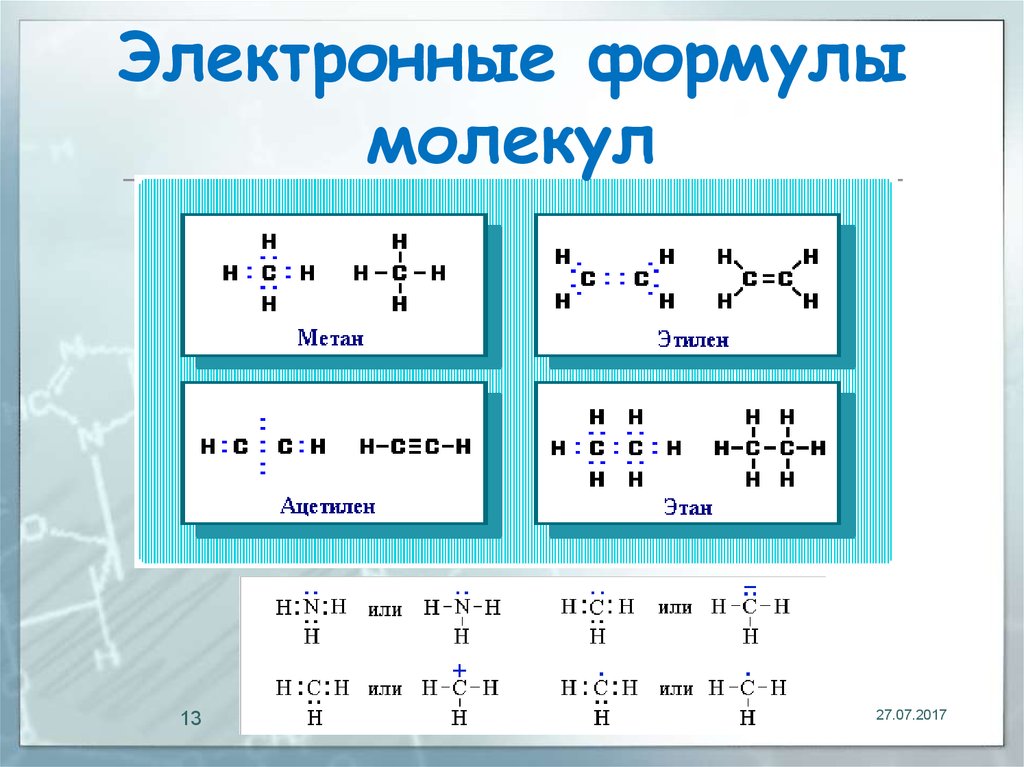
13.
Электронные формулымолекул
13
27.07.2017
14. Атомно-орбитальные модели
взаимное расположение атомныхорбиталей разного типа:
участвующих в образовании
ковалентных связей;
с неспаренным электроном;
с неподеленной электронной парой;
вакантных (например, в
карбокатионах).
14
27.07.2017
15.
Для построения АО-моделей сначала следуетопределить тип гибридизации каждого атома
и затем последовательно в порядке
химического связывания атомов изобразить их
атомные орбитали с учетом образуемых углов
15
27.07.2017
16. Примеры АО-моделей
1627.07.2017
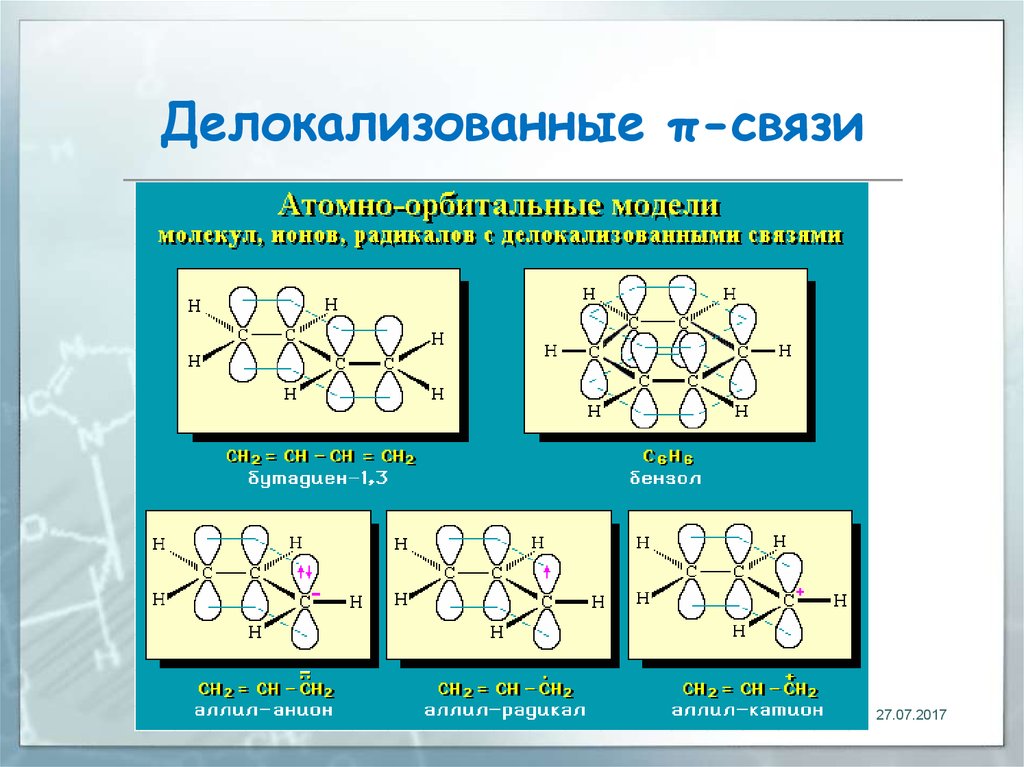
17. Делокализованные π-связи. Сопряжение
связь, электронная пара которойрассредоточена между несколькими
(более 2) ядрами атомов
17
27.07.2017
18. Делокализованные π-связи
Рассредоточение электронов энергетически выгодный процесс, т.к.приводит к снижению энергии молекулы
18
27.07.2017
19. Делокализованные π-связи
1927.07.2017
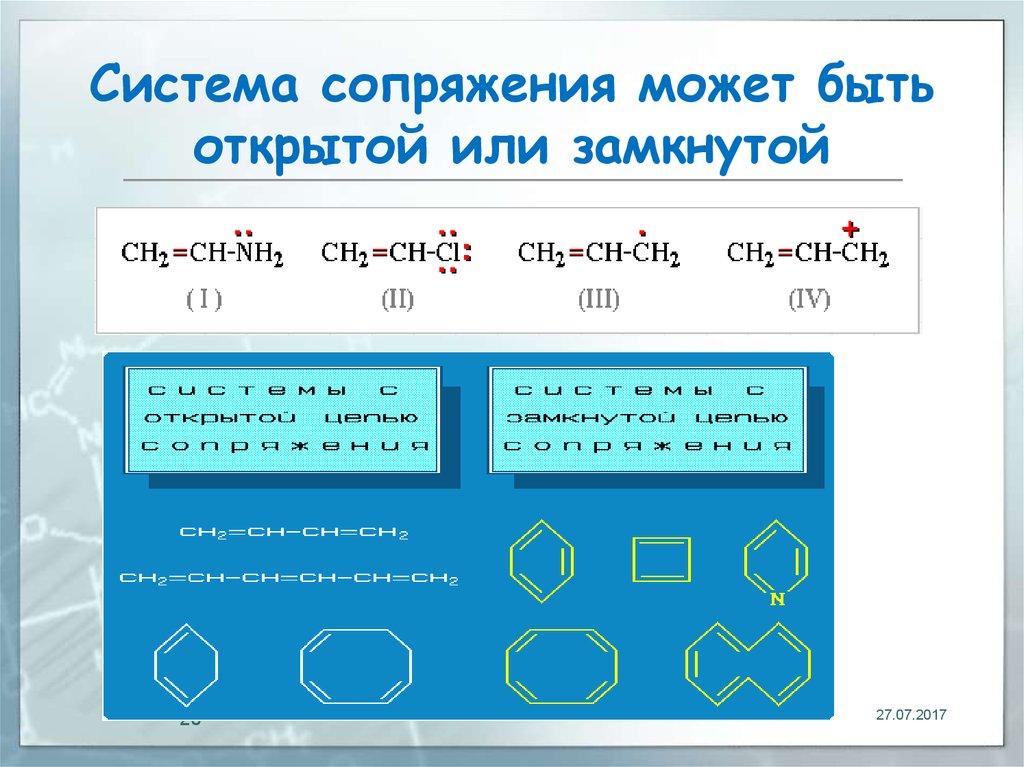
20. Система сопряжeния может быть открытой или замкнутой
2027.07.2017
21. Бензол
2127.07.2017
22. Водородные связи (Н-связи)
Атом водорода, связанный с электроотрицательным элементом (азотом,кислородом, фтором и др.), испытывает
недостаток электронов и способен
взаимодействовать с неподелённой парой
электронов другого электроотрицательного
атома.
В результате возникает водородная связь,
которая графически обозначается тремя
точками:
22
27.07.2017
23. Водородные связи (Н-связи)
Эта связь значительно слабее другиххимических связей (энергия ее образования
10-40 кДж/моль) и в основном определяется
электростатическим и донорно-акцепторным
взаимодействиями:
23
27.07.2017
24. Образование водородных связей
В молекуле спирта R-O-H химическаясвязь между атомом водорода и более
электроотрицательным атомом
кислорода весьма полярна. Водород
имеет частичный положительный заряд
(δ+), а кислород - частичный
отрицательный (δ-):
24
27.07.2017
25. Образование водородных связей
Следовательно, возможно образованиеводородных связей между молекулами
спирта:
25
27.07.2017
26. Образование водородных связей
Это приводит к ассоциации молекул иобъясняет относительно высокую т.кип.
спиртов:
26
27.07.2017
27. Образование водородных связей
В присутствии воды возникаютводородные связи между молекулами
спирта и воды:
27
27.07.2017
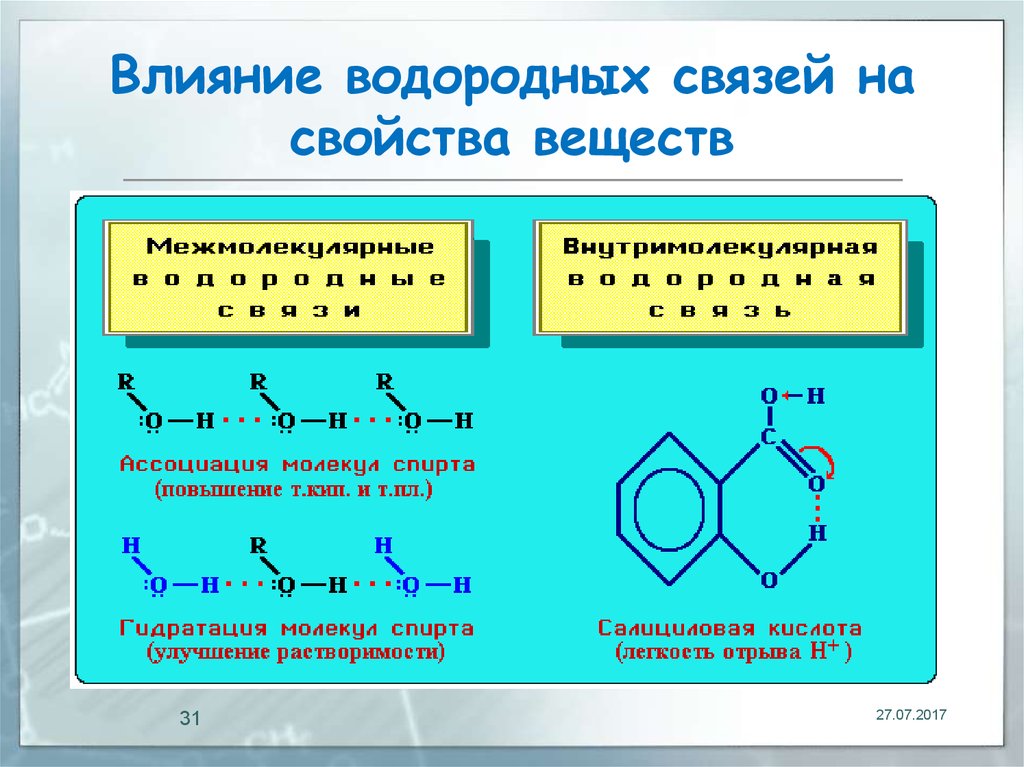
28. Влияние водородных связей на свойства веществ
Межмолекулярные водородные связиобусловливают ассоциацию молекул,
что приводит к повышению температур
кипения и плавления вещества.
Например, этиловый спирт C2H5OH,
способный к ассоциации, кипит при
+78,3°С, а диметиловый эфир
СН3ОСН3, не образующий водородных
связей, лишь при 24°С (молекулярная
28
формула
обоих веществ С2Н6О).
27.07.2017
29. Влияние водородных связей на свойства веществ
Образование Н-связей с молекуламирастворителя способствует улучшению
растворимости.
Так, метиловый и этиловый спирты
(CH3OH, С2Н5ОН), образуя Н-связи с
молекулами воды, неограниченно в ней
растворяются.
29
27.07.2017
30. Влияние водородных связей на свойства веществ
Внутримолекулярная водородная связьобразуется при благоприятном
пространственном расположении в
молекуле соответствующих групп
атомов и специфически влияет на
свойства.
Например, Н-связь внутри молекул
салициловой кислоты повышает ее
кислотность.
30
27.07.2017
31. Влияние водородных связей на свойства веществ
3127.07.2017
32. 1.Контрольная работа
3227.07.2017
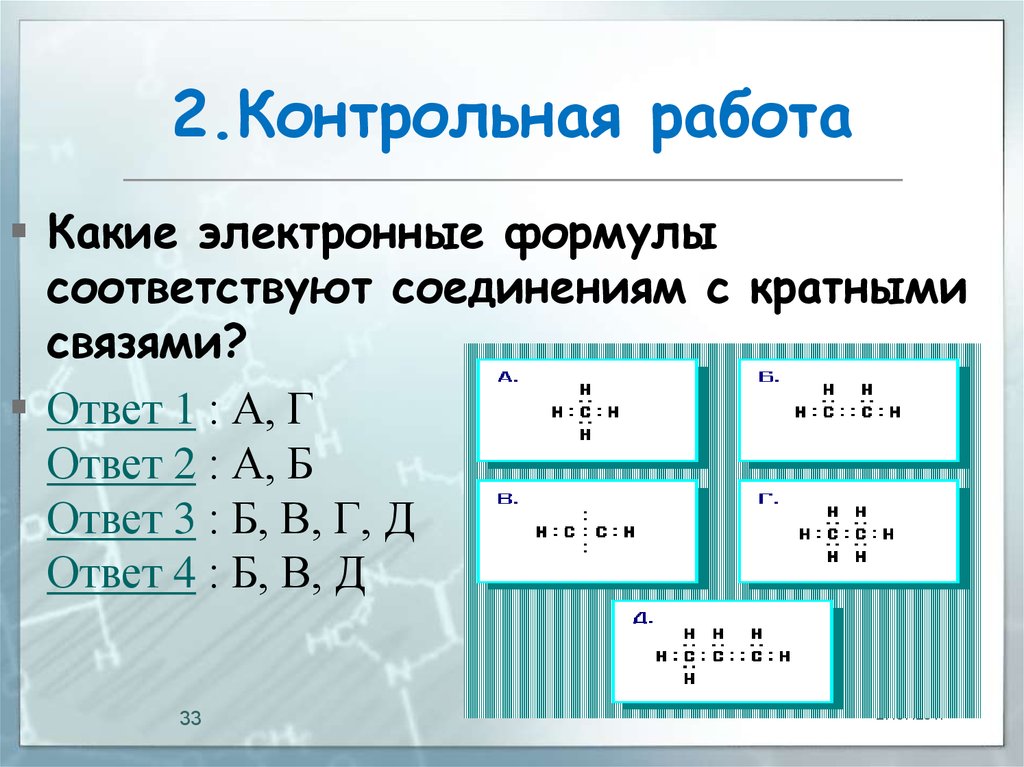
33. 2.Контрольная работа
Какие электронные формулысоответствуют соединениям с кратными
связями?
Ответ 1 : А, Г
Ответ 2 : А, Б
Ответ 3 : Б, В, Г, Д
Ответ 4 : Б, В, Д
33
27.07.2017
34. 3.Контрольная работа
В каких молекулах имеютсяделокализованные p-связи?
а) CH2=CH-CH2-CH=CH2
б) CH2=CH-CH=CH2
в) CH2=CH2
Ответ 1 : а, б
Ответ 2 : б, в
Ответ 3 : б
34 4 : а
Ответ
27.07.2017
35. 4.Контрольная работа
Укажите соединения, в которых естьатомы водорода, способные к
образованию водородной связи:
а) CH3-O-CH3
б) CH3-NH2
в) CH3-CH3
г) CH3-OH
Ответ 1 : а, г
Ответ 2 : б, г
Ответ
3 : а, б, г
Ответ 4 : б, в, г
35
27.07.2017
36. 5.Контрольная работа
3627.07.2017
37. 6.Контрольная работа
3727.07.2017
38. 7.Контрольная работа
3827.07.2017
39. 8.Контрольная работа
3927.07.2017
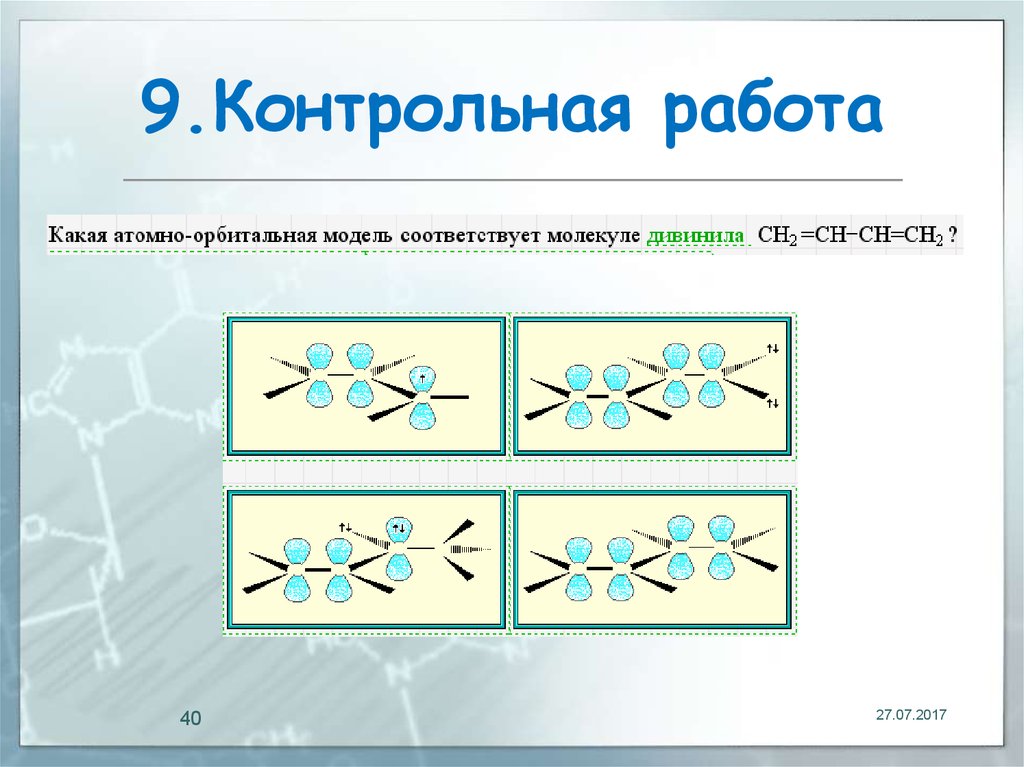
40. 9.Контрольная работа
4027.07.2017



























 chemistry
chemistry








