Similar presentations:
Ароматические гетероциклы. Синтез
1.
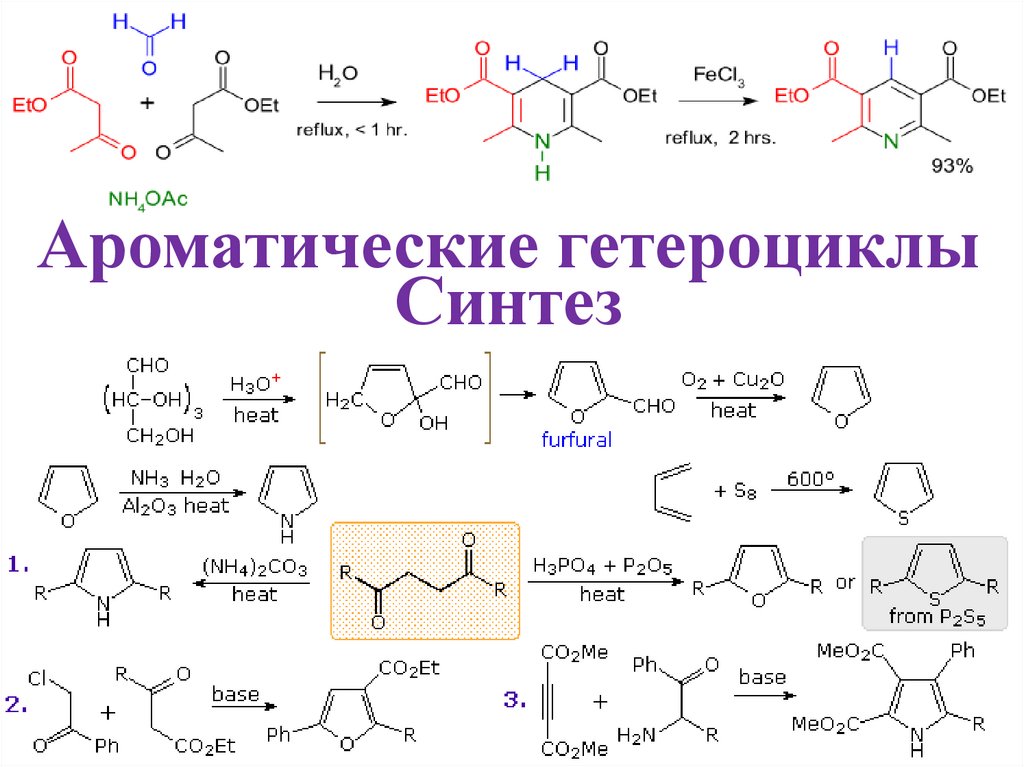
Ароматические гетероциклыСинтез
2.
Синтез ароматических гетероциклов• Получение гетероциклов – простое дело, и именно потому их так
много.
• Образование связей C–O, C–N и C–S происходит легко.
• Внутримолекулярные
реакции
предпочтительнее
бимолекулярных.
• Образование пяти- и шестичленных циклов происходит легко.
• Мы получаем ароматические, а следовательно, очень стабильные
молекулы.
• Обычно такие системы образуются в результате реакций
циклизации, в которых гетероатом (O, N, S) служит нуклеофилом,
а замещенный атом углерода – электрофилом. Во многих случаях
этот электрофил представляет собой карбонильную группу.
3.
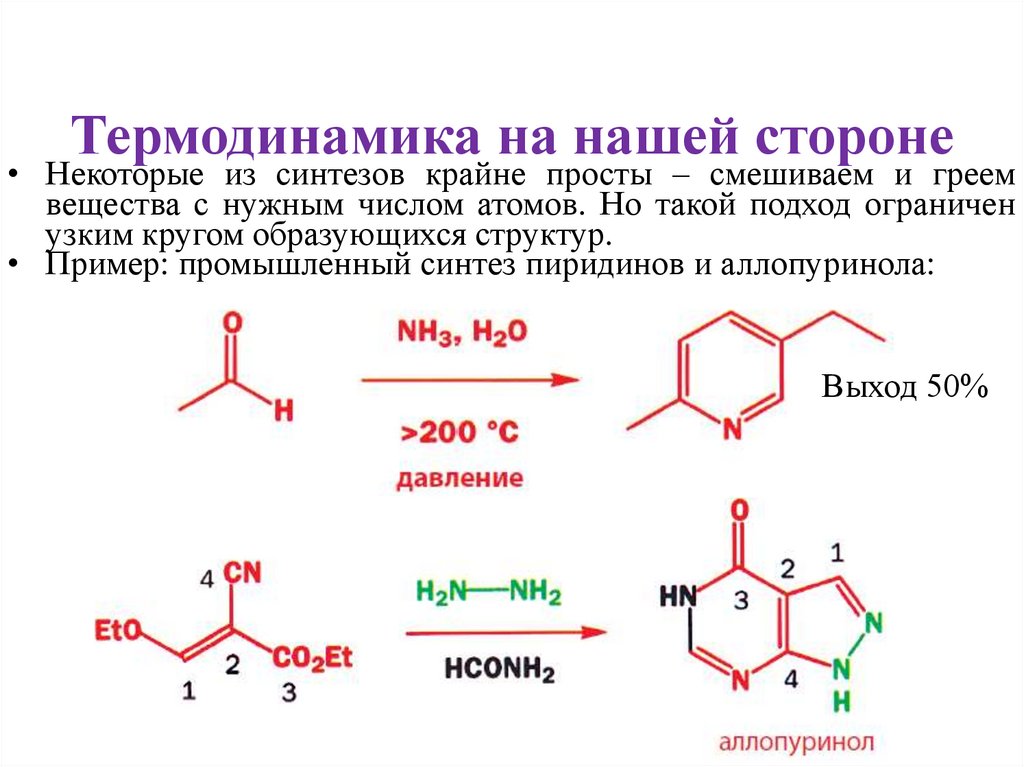
Термодинамика на нашей стороне• Некоторые из синтезов крайне просты – смешиваем и греем
вещества с нужным числом атомов. Но такой подход ограничен
узким кругом образующихся структур.
• Пример: промышленный синтез пиридинов и аллопуринола:
Выход 50%
4.
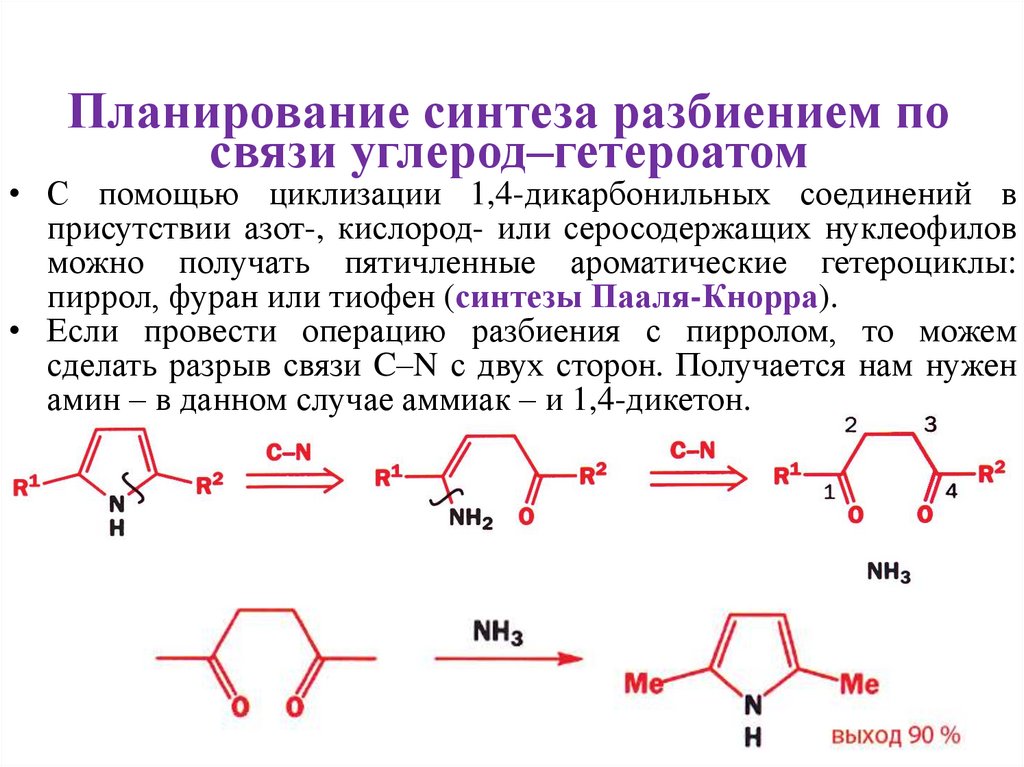
Планирование синтеза разбиением посвязи углерод–гетероатом
• С помощью циклизации 1,4-дикарбонильных соединений в
присутствии азот-, кислород- или серосодержащих нуклеофилов
можно получать пятичленные ароматические гетероциклы:
пиррол, фуран или тиофен (синтезы Пааля-Кнорра).
• Если провести операцию разбиения с пирролом, то можем
сделать разрыв связи C–N с двух сторон. Получается нам нужен
амин – в данном случае аммиак – и 1,4-дикетон.
5.
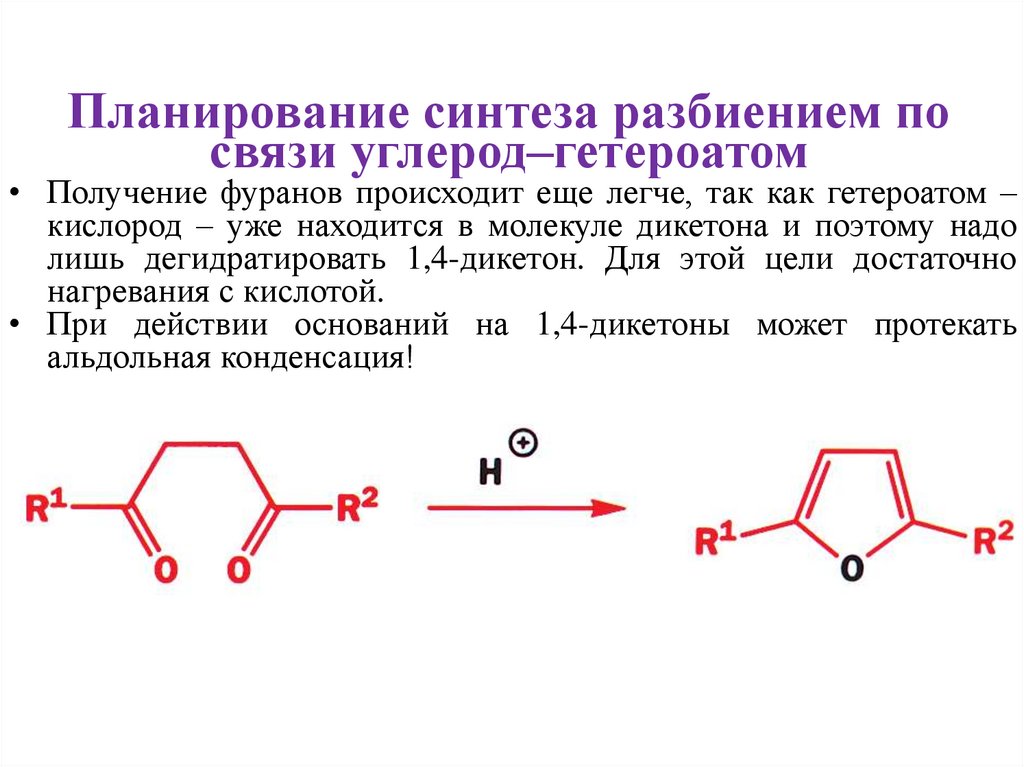
Планирование синтеза разбиением посвязи углерод–гетероатом
• Получение фуранов происходит еще легче, так как гетероатом –
кислород – уже находится в молекуле дикетона и поэтому надо
лишь дегидратировать 1,4-дикетон. Для этой цели достаточно
нагревания с кислотой.
• При действии оснований на 1,4-дикетоны может протекать
альдольная конденсация!
6.
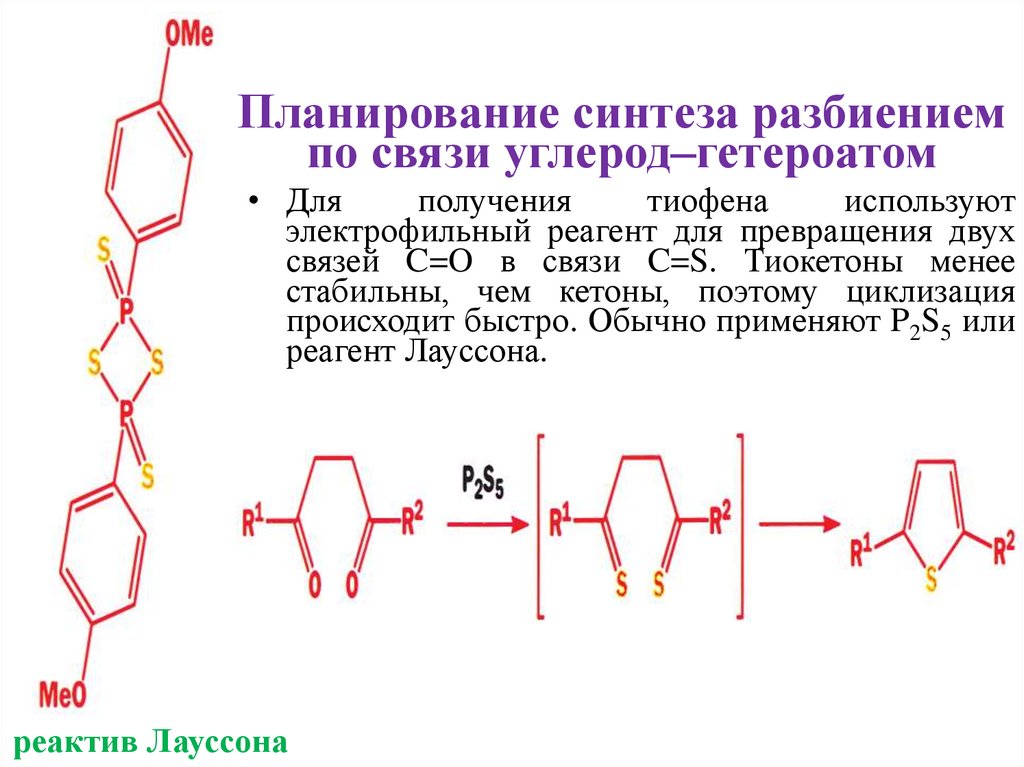
Планирование синтеза разбиениемпо связи углерод–гетероатом
• Для
получения
тиофена
используют
электрофильный реагент для превращения двух
связей C=O в связи C=S. Тиокетоны менее
стабильны, чем кетоны, поэтому циклизация
происходит быстро. Обычно применяют P2S5 или
реагент Лауссона.
реактив Лауссона
7.
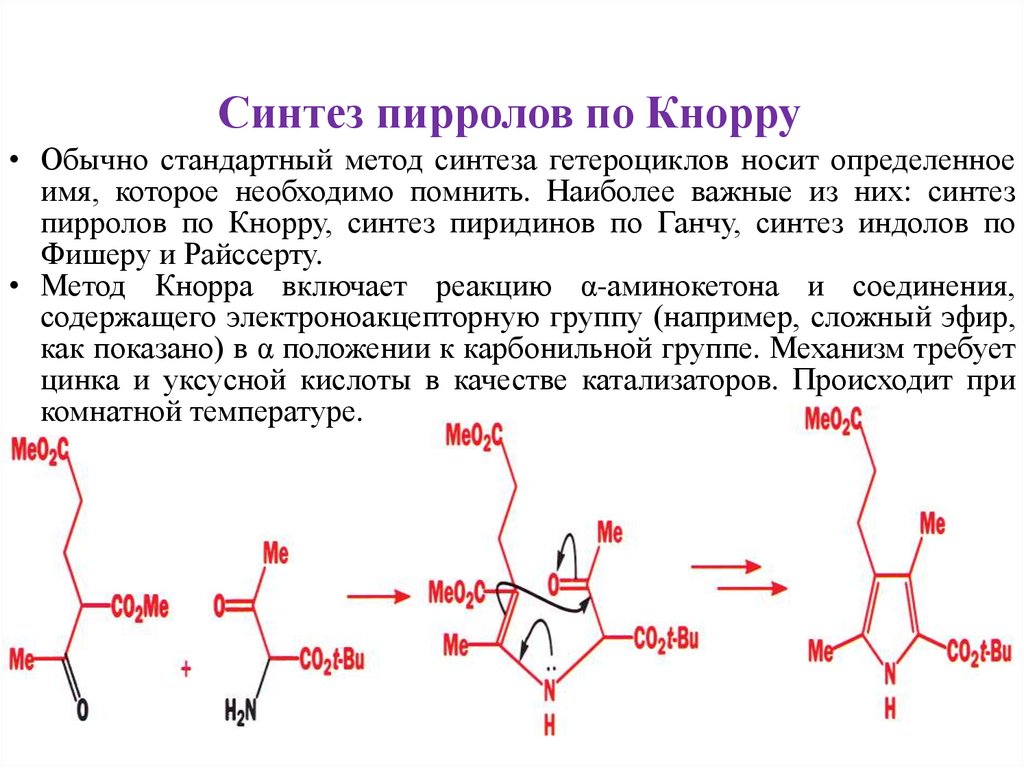
Синтез пирролов по Кнорру• Обычно стандартный метод синтеза гетероциклов носит определенное
имя, которое необходимо помнить. Наиболее важные из них: синтез
пирролов по Кнорру, синтез пиридинов по Ганчу, синтез индолов по
Фишеру и Райссерту.
• Метод Кнорра включает реакцию α-аминокетона и соединения,
содержащего электроноакцепторную группу (например, сложный эфир,
как показано) в α положении к карбонильной группе. Механизм требует
цинка и уксусной кислоты в качестве катализаторов. Происходит при
комнатной температуре.
8.
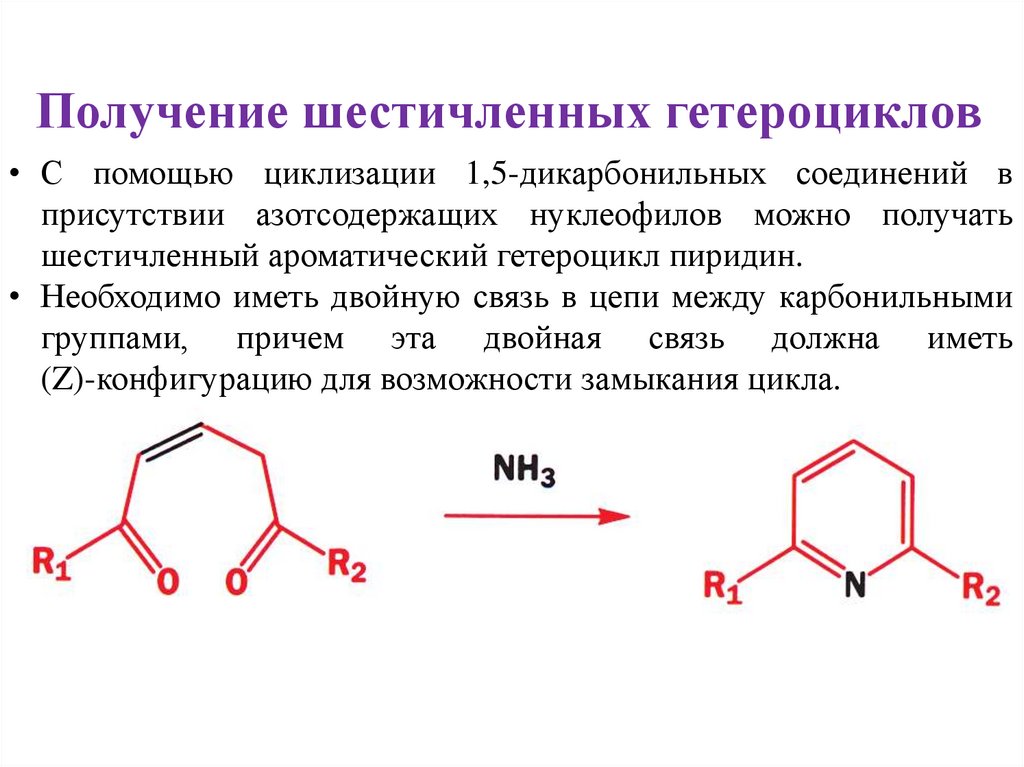
Получение шестичленных гетероциклов• С помощью циклизации 1,5-дикарбонильных соединений в
присутствии азотсодержащих нуклеофилов можно получать
шестичленный ароматический гетероцикл пиридин.
• Необходимо иметь двойную связь в цепи между карбонильными
группами, причем эта двойная связь должна иметь
(Z)-конфигурацию для возможности замыкания цикла.
9.
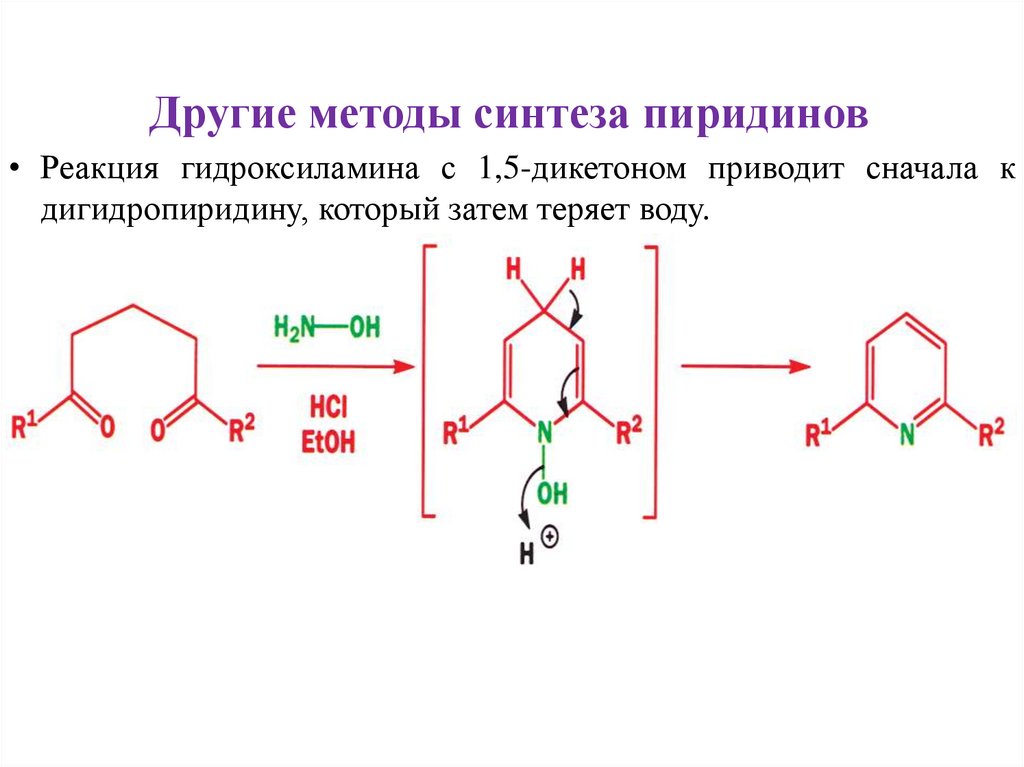
Другие методы синтеза пиридинов• Реакция гидроксиламина с 1,5-дикетоном приводит сначала к
дигидропиридину, который затем теряет воду.
10.
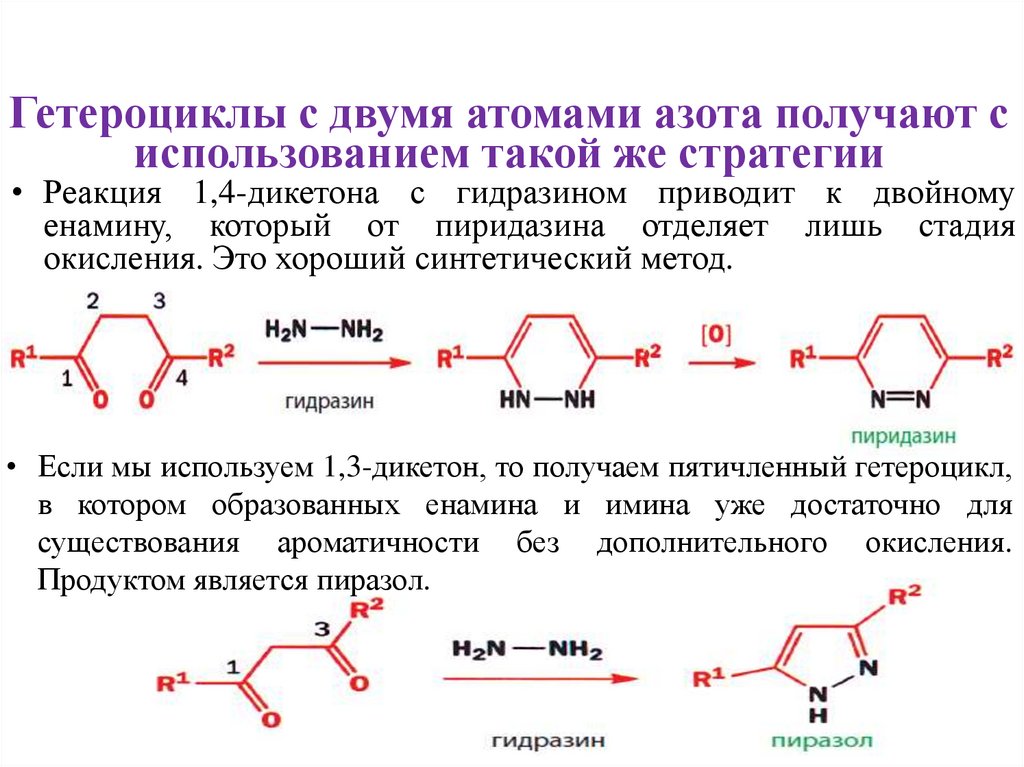
Гетероциклы с двумя атомами азота получают сиспользованием такой же стратегии
• Реакция 1,4-дикетона с гидразином приводит к двойному
енамину, который от пиридазина отделяет лишь стадия
окисления. Это хороший синтетический метод.
• Если мы используем 1,3-дикетон, то получаем пятичленный гетероцикл,
в котором образованных енамина и имина уже достаточно для
существования ароматичности без дополнительного окисления.
Продуктом является пиразол.
11.
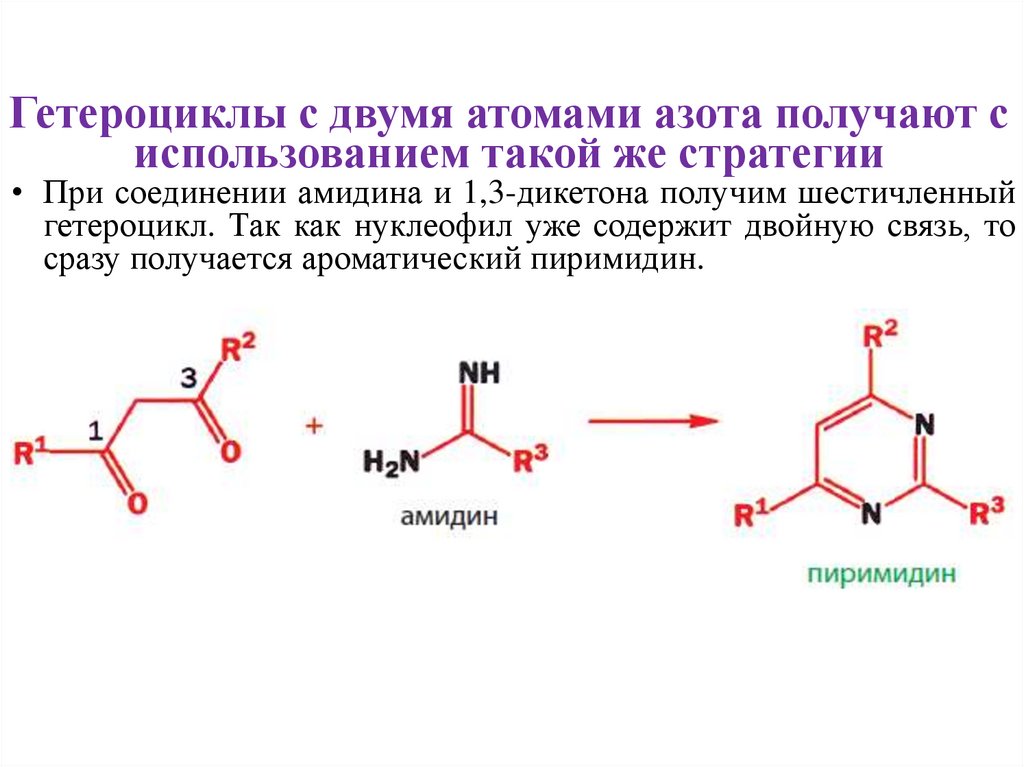
Гетероциклы с двумя атомами азота получают сиспользованием такой же стратегии
• При соединении амидина и 1,3-дикетона получим шестичленный
гетероцикл. Так как нуклеофил уже содержит двойную связь, то
сразу получается ароматический пиримидин.
12.
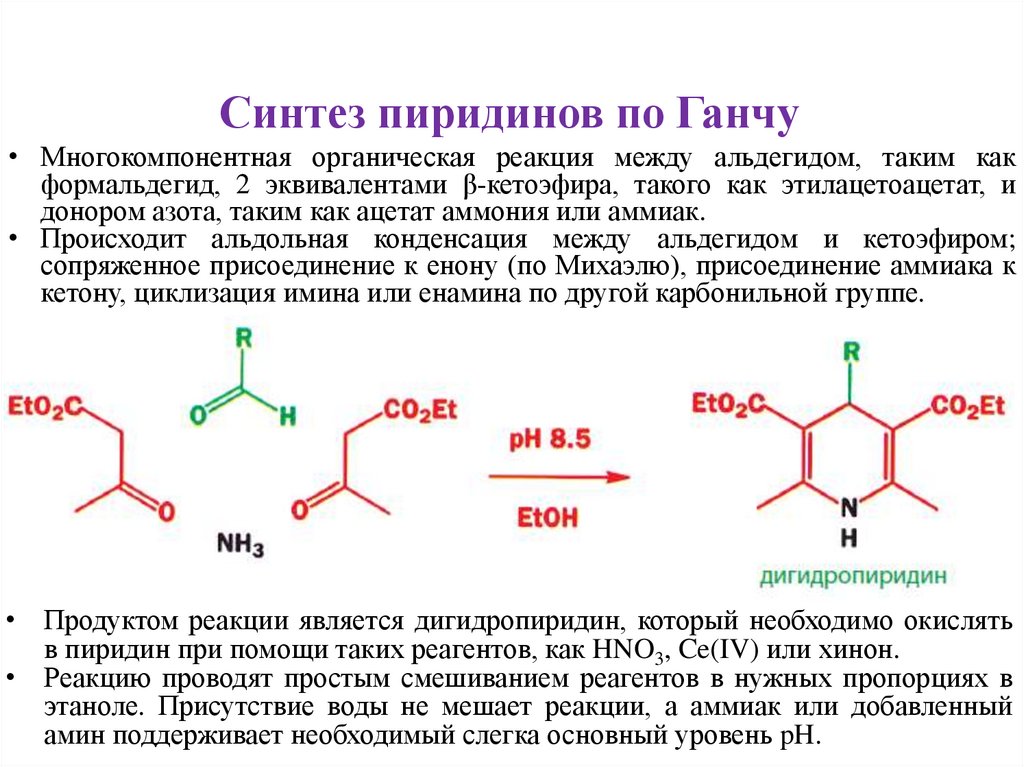
Синтез пиридинов по Ганчу• Многокомпонентная органическая реакция между альдегидом, таким как
формальдегид, 2 эквивалентами β-кетоэфира, такого как этилацетоацетат, и
донором азота, таким как ацетат аммония или аммиак.
• Происходит альдольная конденсация между альдегидом и кетоэфиром;
сопряженное присоединение к енону (по Михаэлю), присоединение аммиака к
кетону, циклизация имина или енамина по другой карбонильной группе.
• Продуктом реакции является дигидропиридин, который необходимо окислять
в пиридин при помощи таких реагентов, как HNO3, Ce(IV) или хинон.
• Реакцию проводят простым смешиванием реагентов в нужных пропорциях в
этаноле. Присутствие воды не мешает реакции, а аммиак или добавленный
амин поддерживает необходимый слегка основный уровень pH.
13.
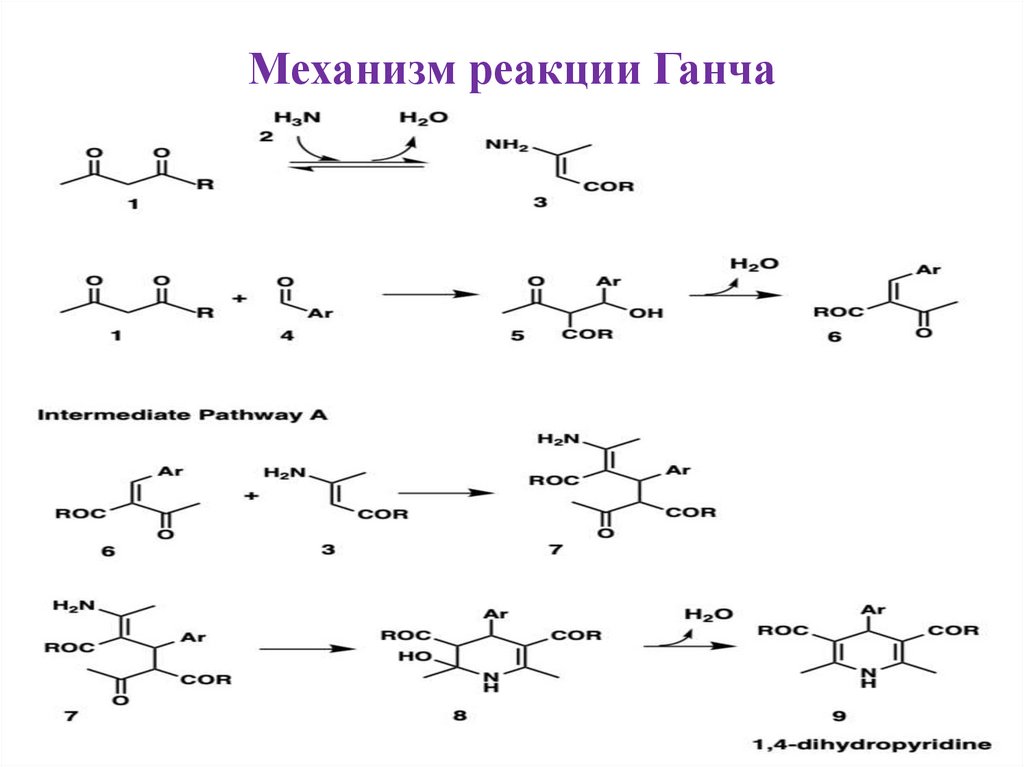
Механизм реакции Ганча14.
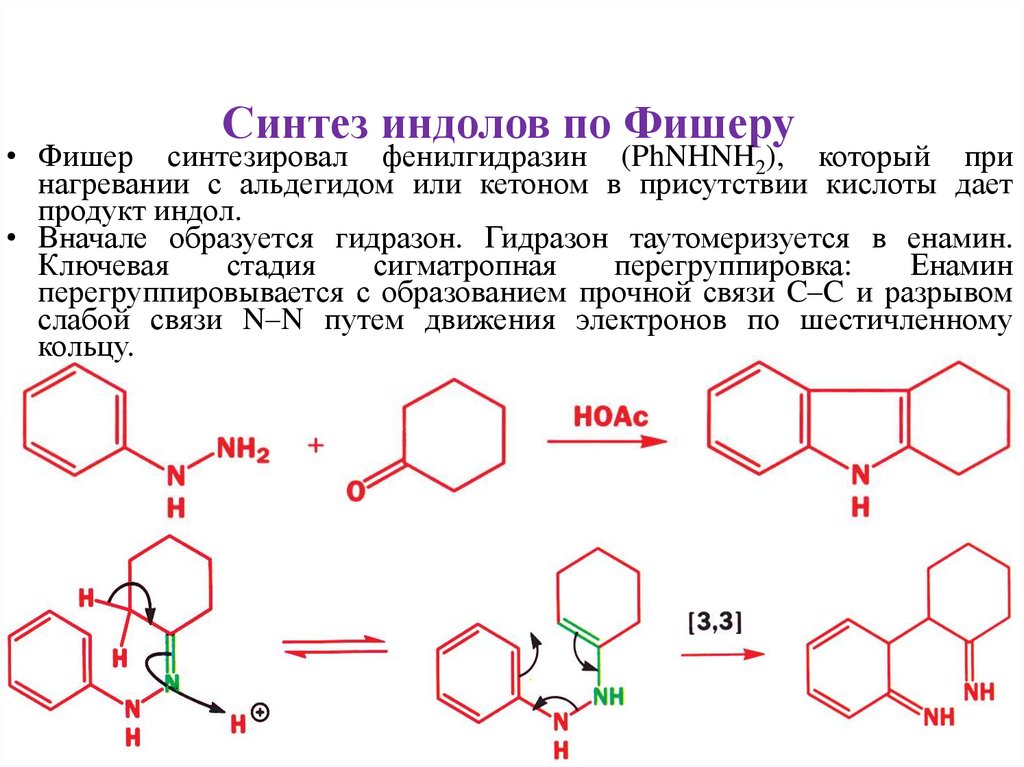
Синтез индолов по Фишеру• Фишер синтезировал фенилгидразин (PhNHNH2), который при
нагревании с альдегидом или кетоном в присутствии кислоты дает
продукт индол.
• Вначале образуется гидразон. Гидразон таутомеризуется в енамин.
Ключевая
стадия
сигматропная
перегруппировка:
Енамин
перегруппировывается с образованием прочной связи C–C и разрывом
слабой связи N–N путем движения электронов по шестичленному
кольцу.
15.
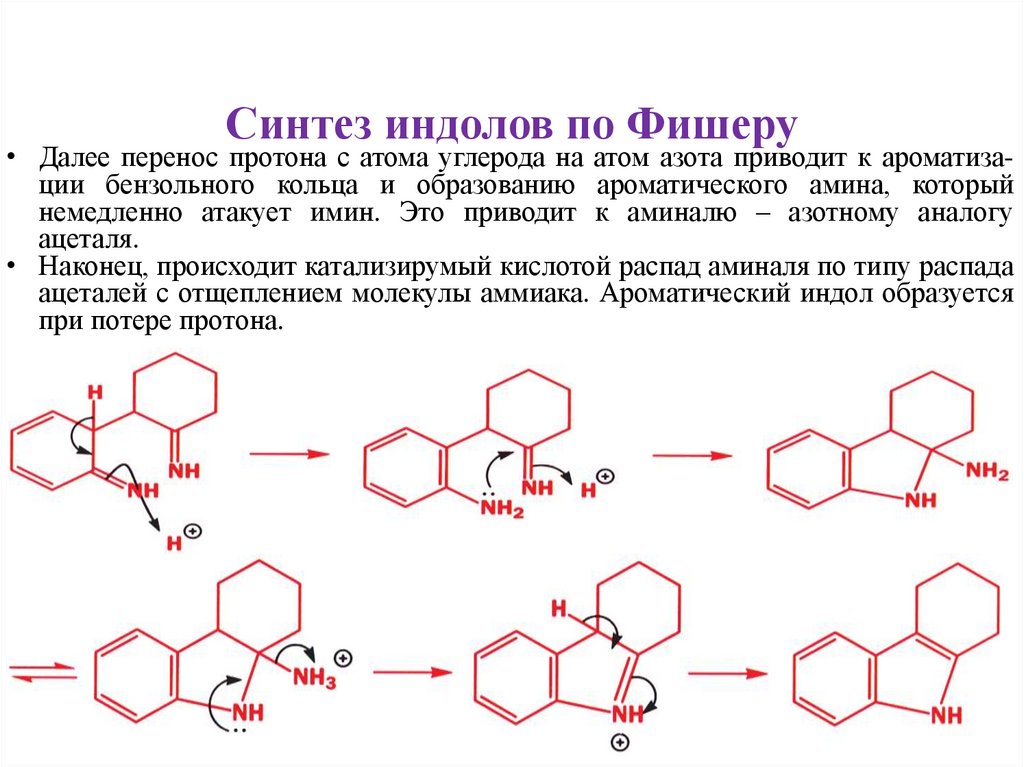
Синтез индолов по Фишеру• Далее перенос протона с атома углерода на атом азота приводит к ароматизации бензольного кольца и образованию ароматического амина, который
немедленно атакует имин. Это приводит к аминалю – азотному аналогу
ацеталя.
• Наконец, происходит катализирумый кислотой распад аминаля по типу распада
ацеталей с отщеплением молекулы аммиака. Ароматический индол образуется
при потере протона.
16.
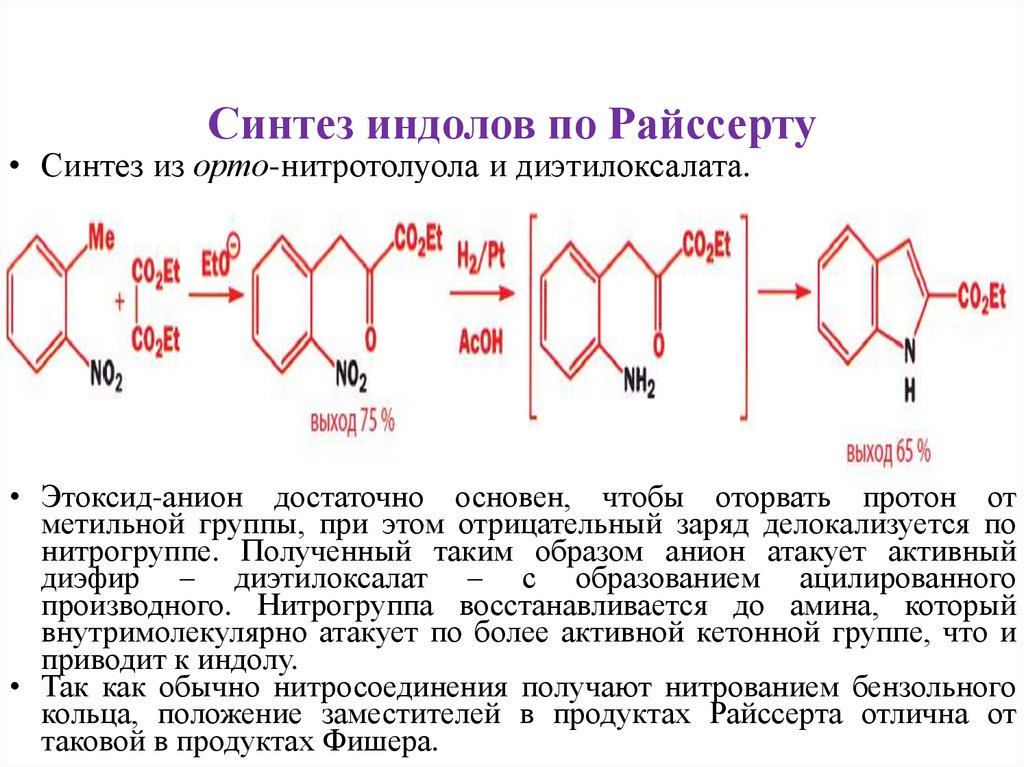
Синтез индолов по Райссерту• Синтез из орто-нитротолуола и диэтилоксалата.
• Этоксид-анион достаточно основен, чтобы оторвать протон от
метильной группы, при этом отрицательный заряд делокализуется по
нитрогруппе. Полученный таким образом анион атакует активный
диэфир – диэтилоксалат – с образованием ацилированного
производного. Нитрогруппа восстанавливается до амина, который
внутримолекулярно атакует по более активной кетонной группе, что и
приводит к индолу.
• Так как обычно нитросоединения получают нитрованием бензольного
кольца, положение заместителей в продуктах Райссерта отлична от
таковой в продуктах Фишера.
17.
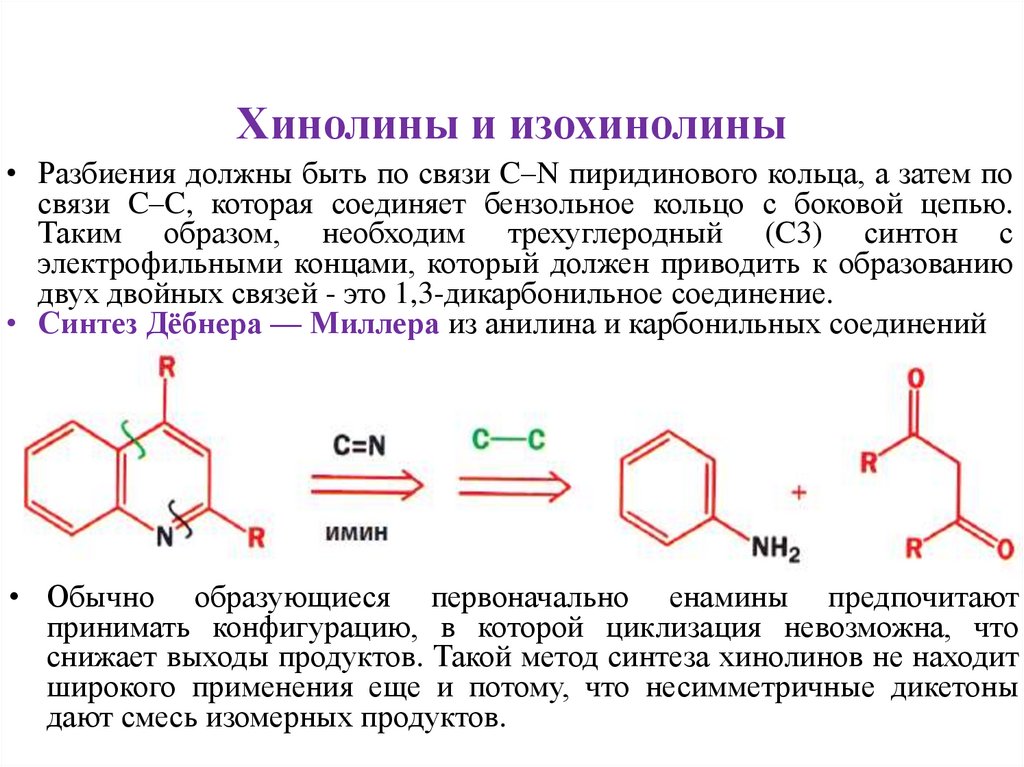
Хинолины и изохинолины• Разбиения должны быть по связи C–N пиридинового кольца, а затем по
связи C–C, которая соединяет бензольное кольцо с боковой цепью.
Таким образом, необходим трехуглеродный (C3) синтон с
электрофильными концами, который должен приводить к образованию
двух двойных связей - это 1,3-дикарбонильное соединение.
• Синтез Дёбнера — Миллера из анилина и карбонильных соединений
• Обычно образующиеся первоначально енамины предпочитают
принимать конфигурацию, в которой циклизация невозможна, что
снижает выходы продуктов. Такой метод синтеза хинолинов не находит
широкого применения еще и потому, что несимметричные дикетоны
дают смесь изомерных продуктов.
18.
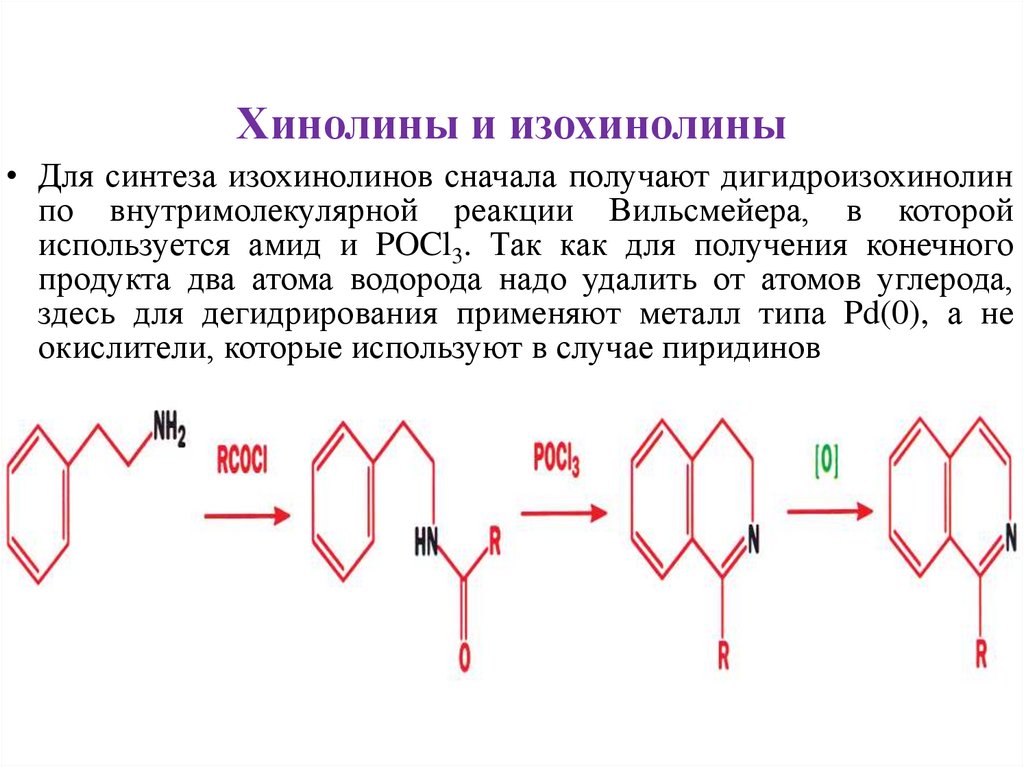
Хинолины и изохинолины• Для синтеза изохинолинов сначала получают дигидроизохинолин
по внутримолекулярной реакции Вильсмейера, в которой
используется амид и POCl3. Так как для получения конечного
продукта два атома водорода надо удалить от атомов углерода,
здесь для дегидрирования применяют металл типа Pd(0), а не
окислители, которые используют в случае пиридинов
19.
Построение цикла с помощью перициклическихреакций (реакции циклоприсоединения)
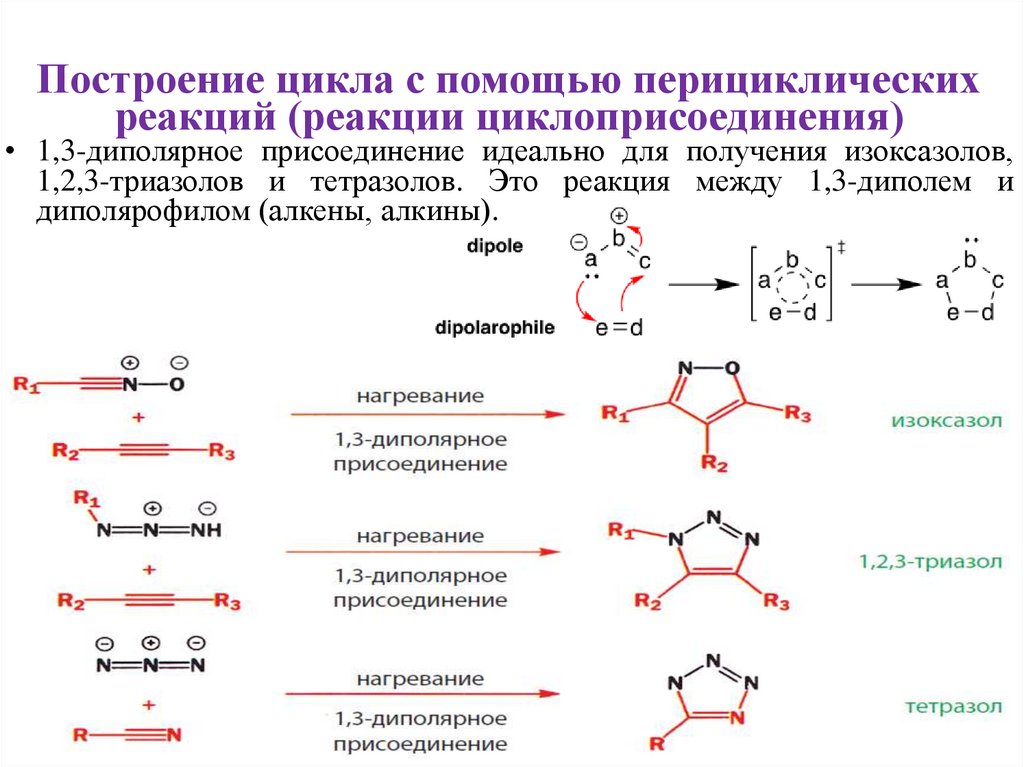
• 1,3-диполярное присоединение идеально для получения изоксазолов,
1,2,3-триазолов и тетразолов. Это реакция между 1,3-диполем и
диполярофилом (алкены, алкины).
20.
Построение цикла с помощью перициклическихреакций (реакции циклоприсоединения)
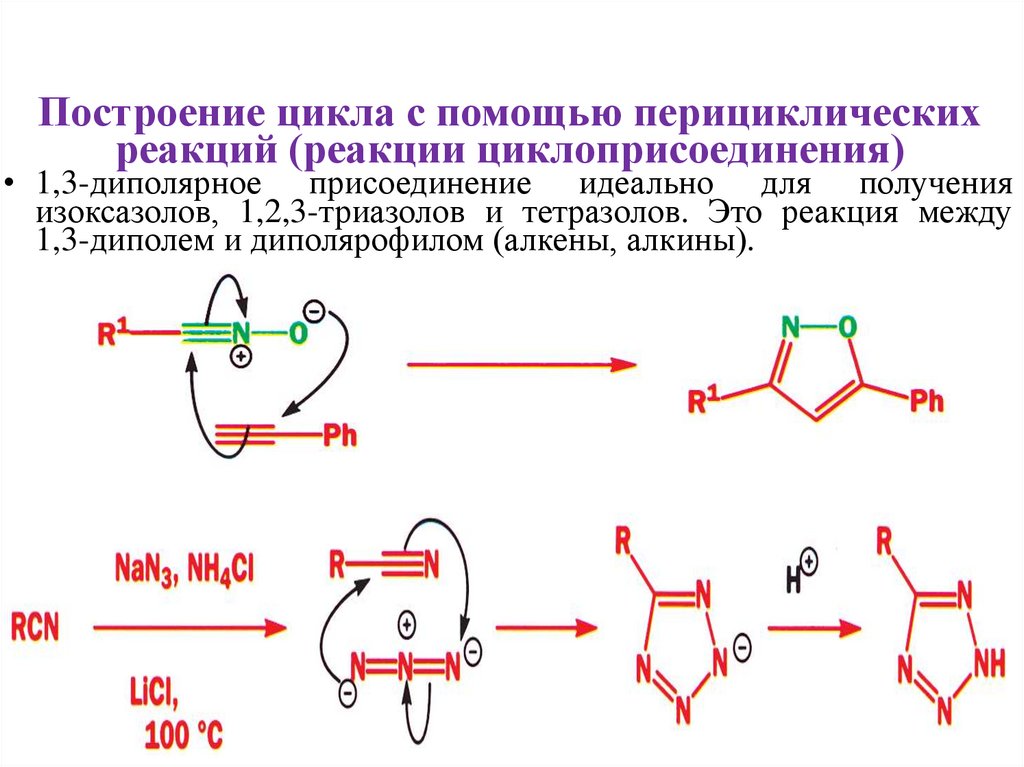
• 1,3-диполярное присоединение идеально для получения
изоксазолов, 1,2,3-триазолов и тетразолов. Это реакция между
1,3-диполем и диполярофилом (алкены, алкины).
21.
Три главных подходак синтезу ароматических гетероциклов
• Построение цикла с помощью гетеролитических реакций.
• Построение цикла с помощью перициклических реакций.
• Модифицирование
существующего
цикла
реакциями
электрофильного и нуклеофильного ароматического замещения
или с помощью последовательности литиирование – реакция с
электрофилом.
22.
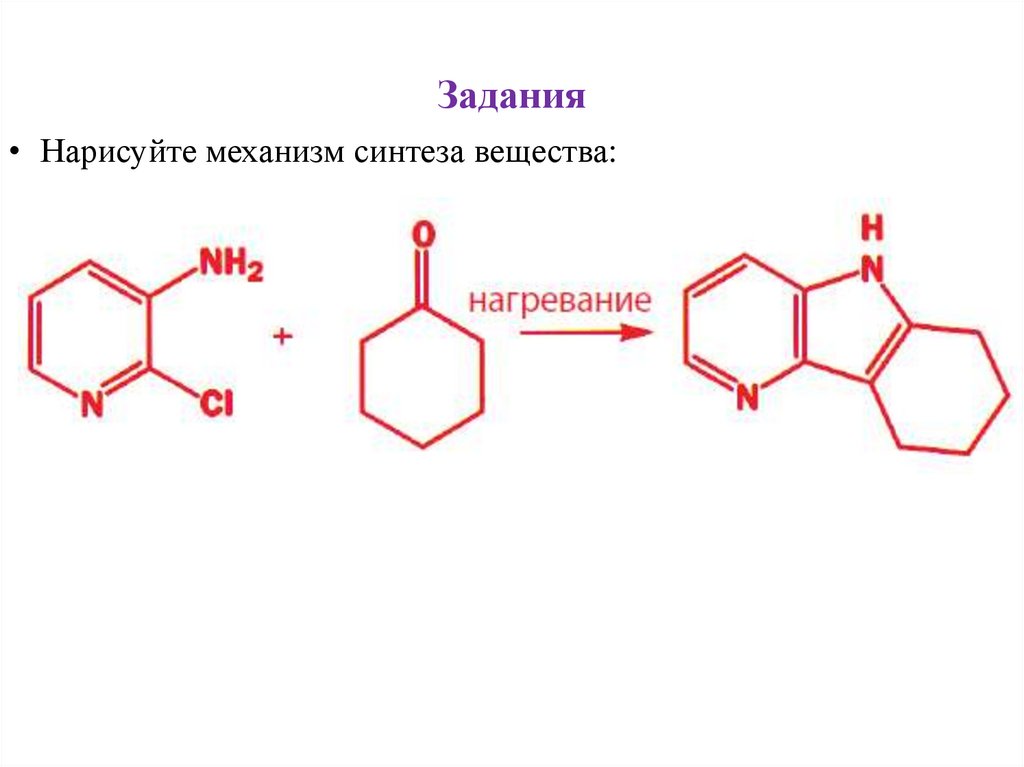
Задания• Нарисуйте механизм синтеза вещества:
23.
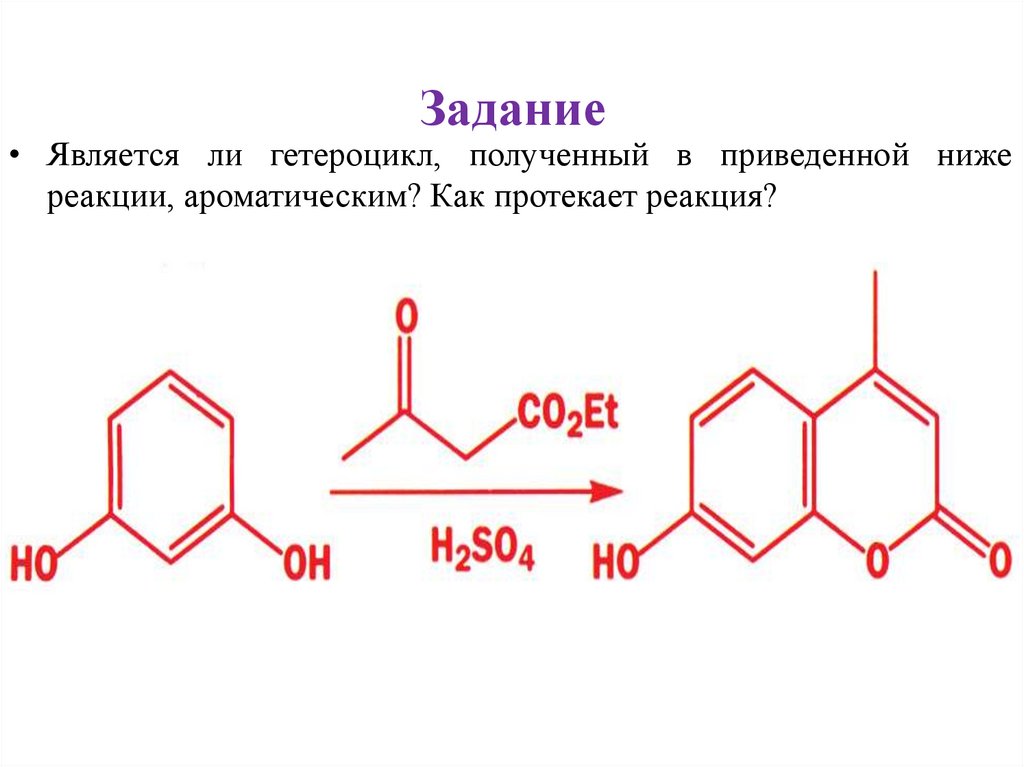
Задание• Является ли гетероцикл, полученный в приведенной ниже
реакции, ароматическим? Как протекает реакция?
24.
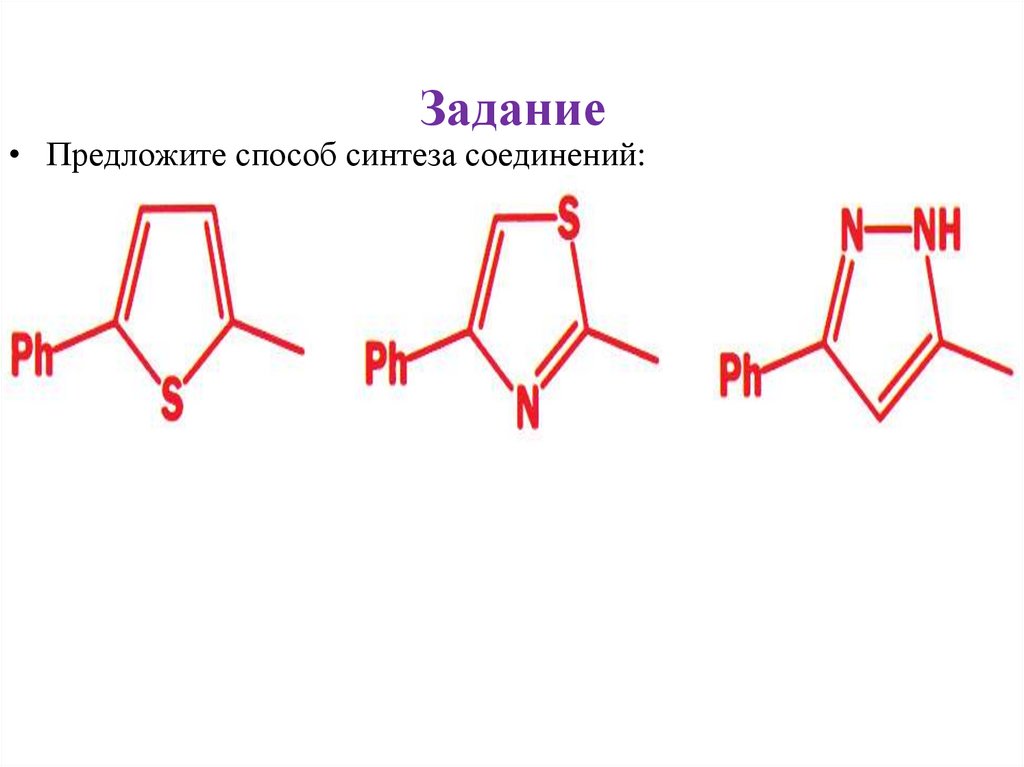
Задание• Предложите способ синтеза соединений:
25.
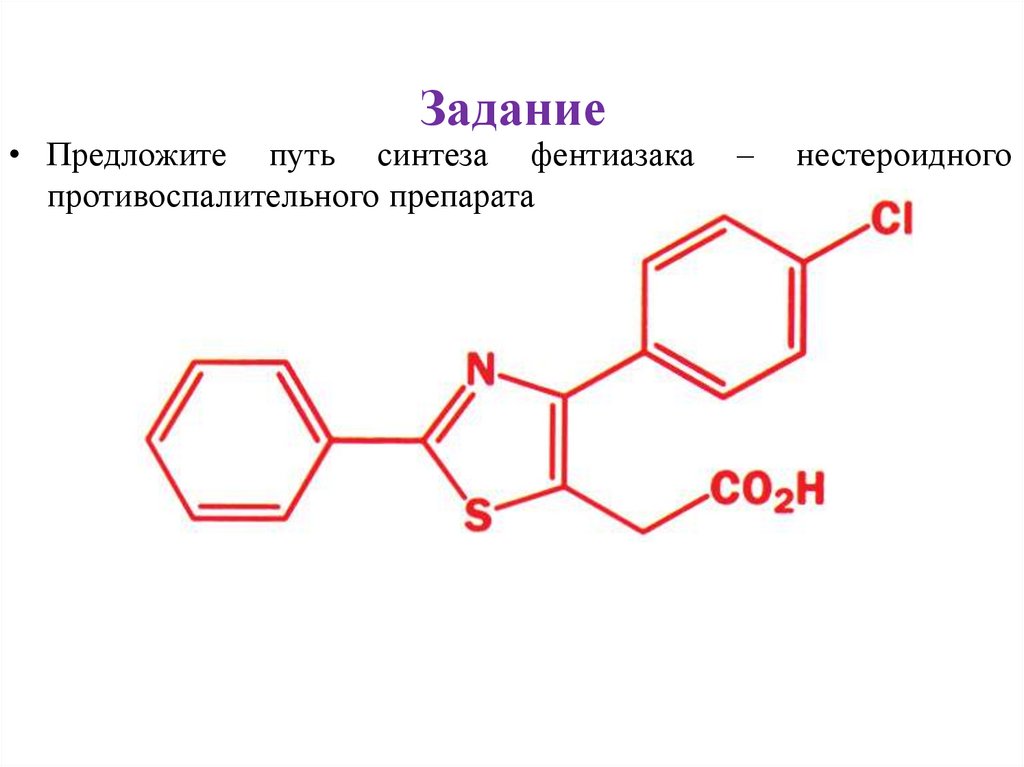
Задание• Предложите путь синтеза фентиазака
противоспалительного препарата
–
нестероидного
26.
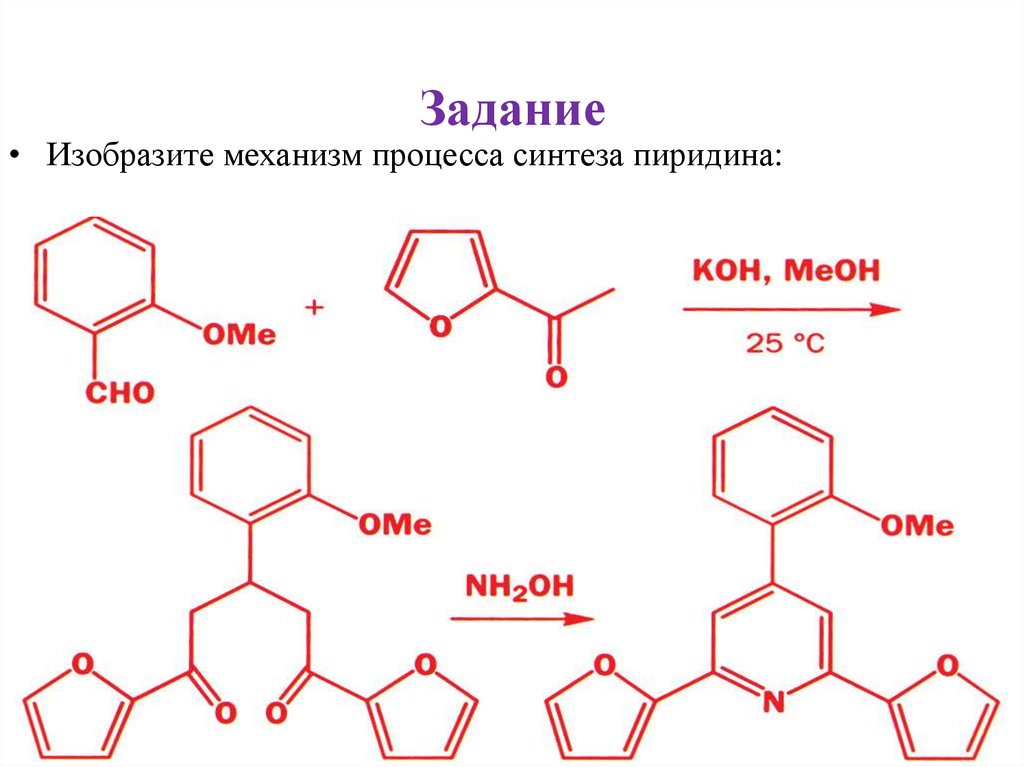
Задание• Изобразите механизм процесса синтеза пиридина:
27.
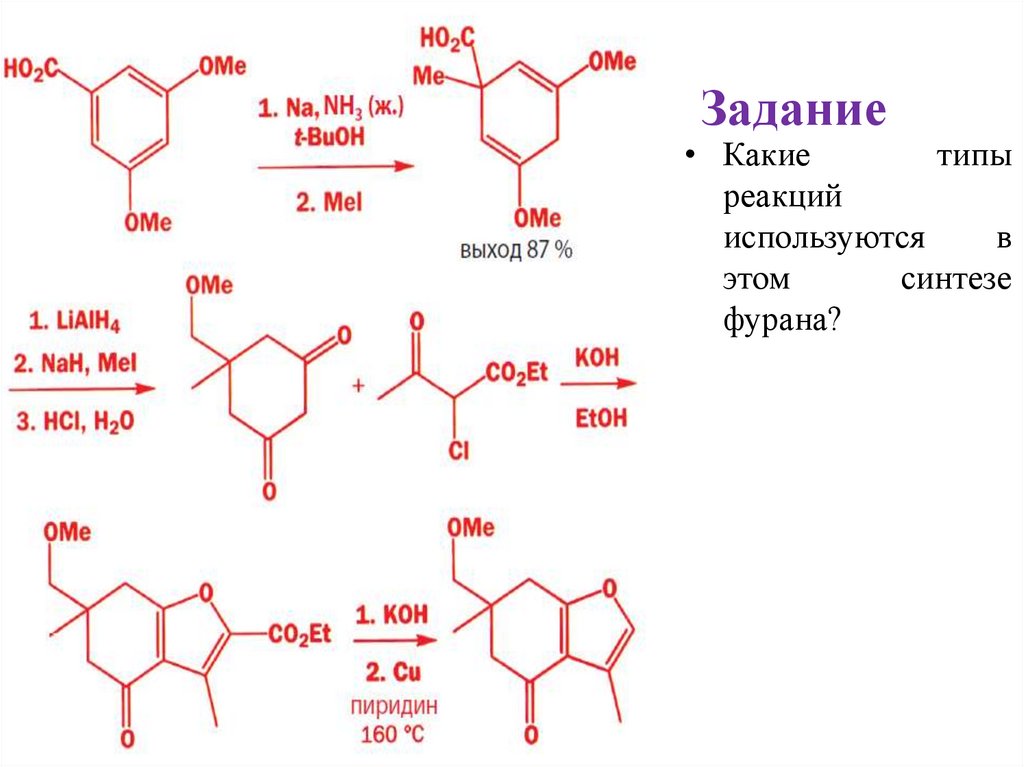
Задание• Какие
типы
реакций
используются
в
этом
синтезе
фурана?
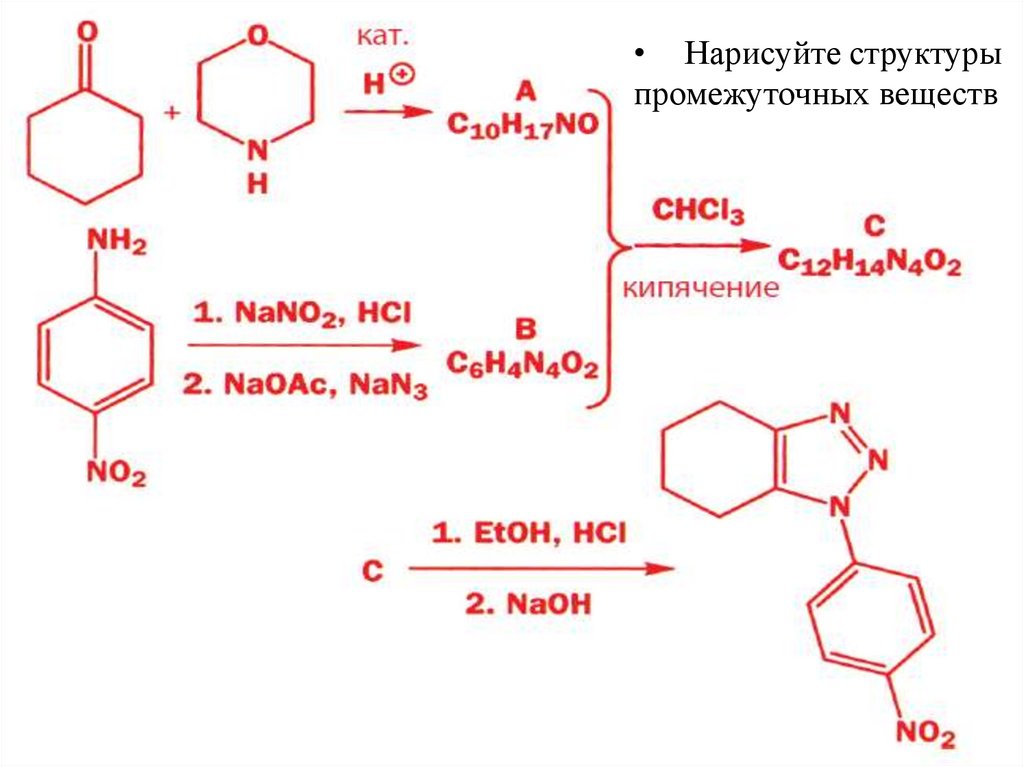
28.
• Нарисуйте структурыпромежуточных веществ
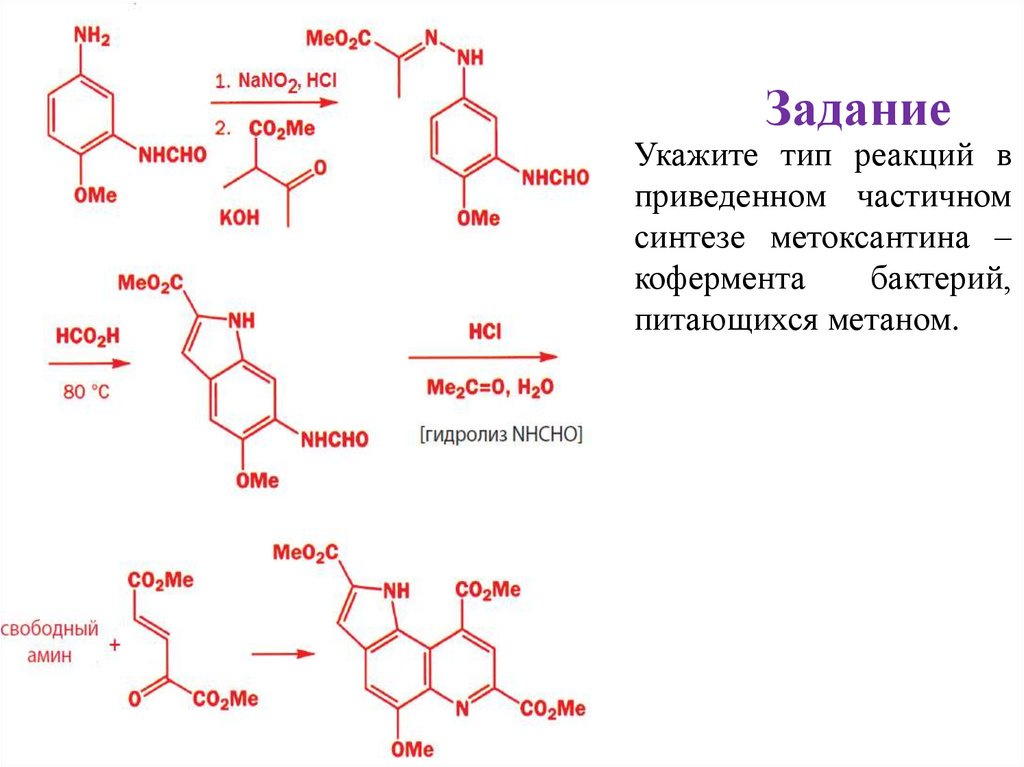
29.
Задание• Укажите тип реакций в
приведенном частичном
синтезе метоксантина –
кофермента
бактерий,
питающихся метаном.
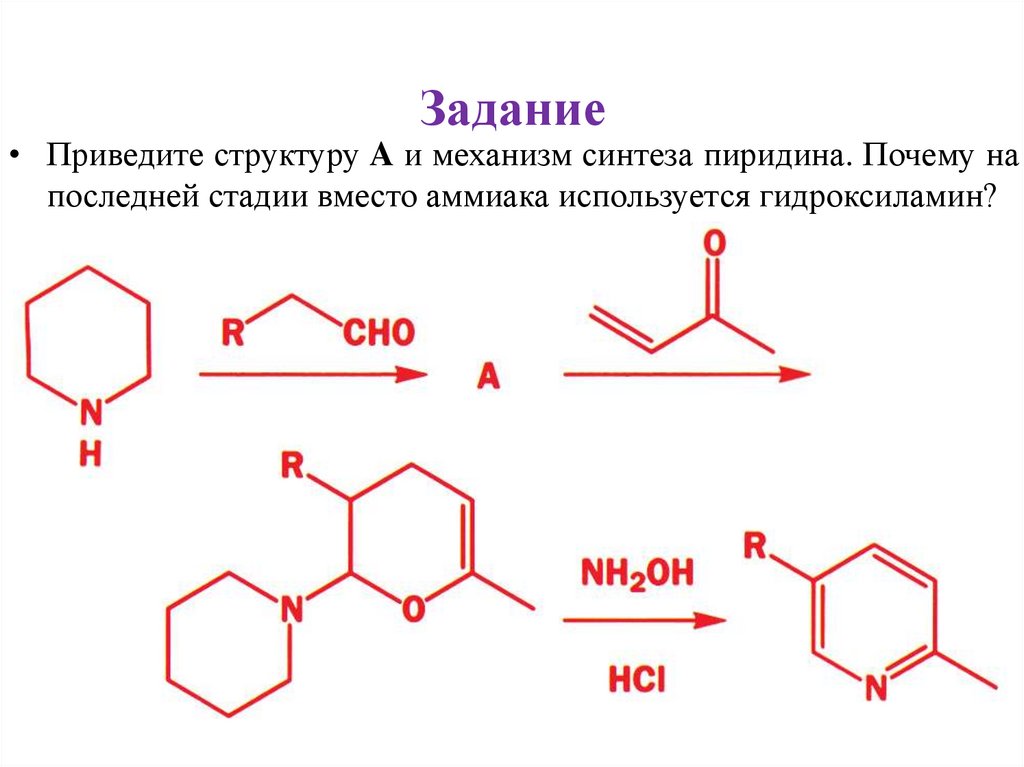
30.
Задание• Приведите структуру A и механизм синтеза пиридина. Почему на
последней стадии вместо аммиака используется гидроксиламин?


 chemistry
chemistry








