Similar presentations:
Аналитический подход к моделированию. Физико-химическое моделирование
1.
Аналитический подход кмоделированию. Физикохимическое моделирование
2.
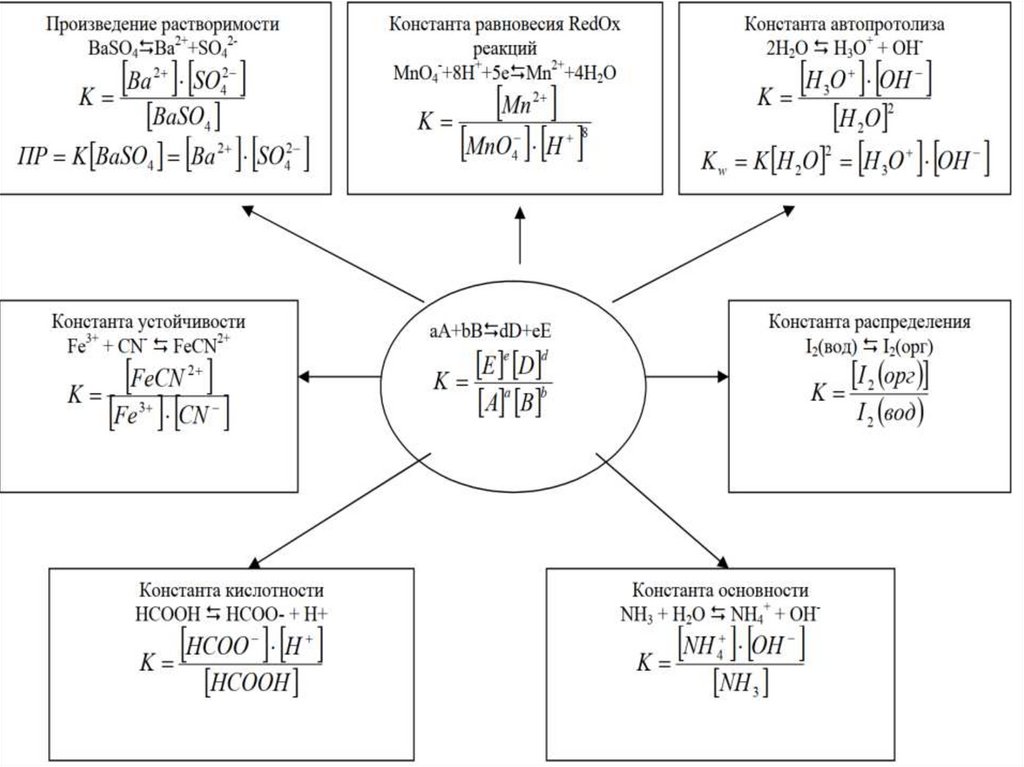
Термодинамический подход при моделированиигомогенных химических реакций, протекающих в
растворах по ионному механизму.
В химической кинетике реакции, протекающие
в растворах, в которых отсутствуют изменения
ковалентных связей, характеризуются как очень
быстрые реакции. Скорость протекания такого типа
реакций зависит главным образом от подвода
реагирующих веществ друг к другу – перемешивания,
конвекции, диффузии. Таким образом, для таких
реакций наиболее целесообразно использовать
термодинамический подход:
Примеры таких реакций:
3.
Ag Cl AgClH 3 O OH 2H 2 O
H OH H 2 O
Ba
2
SO 4
2
BaSO 4
Пример 1. Рассчитать ионно-молекулярный
состав системы в присутствии цианида калия
KCN, растворённого в количестве С0 = 10-5 моль/л
KCN K CN (1)
H 2O H OH (2)
4. Методика моделирования равновесного состава в растворе
1. Записать уравнения предполагаемыххимических реакций;
2. Записать константы равновесия для
протекающих химических реакций;
3. Записать
уравнения
материального
баланса для веществ, находящихся в
различных химических формах;
4. Записать
уравнение
электронейтральности;
5. Методика моделирования равновесного состава в растворе
5. Сопоставить количество неизвестных иуравнений (должно быть равное количество).
6. Привести систему нелинейных уравнений к
многочлену, например, от концентрации [H+];
/ (Решить численно систему нелинейных
уравнений);
7. Решить многочлен несколькими численными
методами;
8. Рассчитать
концентрации
ионов,
участвующих
в
термодинамическом
равновесии.
6.
7.
8.
Полное ионное уравнение:9. Пример 2. Рассчитать ионно-молекулярный состав раствора в присутствии растворённой углекислоты воздуха.
Сумма углеродсодержащих компонентов в воде, находящегося в контакте своздухом С0, за счёт растворения углекислого газа, равна 10-5 моль / л.
H2CO3 H HCO3 (1)
2
HCO 3 H CO3 (2)
[H ] *[HCO 3 ]
K1
(3)
[H 2 CO3 ]
2
[H ] * [CO3 ]
K2
(4)
[HCO 3 ]
2
C0 [H2CO3 ] [HCO3 ] [CO3 ](5)
10. Пример 3. Рассчитать концентрацию ионов СО32- в растворе, значение pH которого регулируется изменением концентрации соды.
Автопротолиз воды:H 2O H OH (1)
Диссоциация соды:
2
Na 2CO3 2Na CO3 (2)
Гидролиз:
2
CO3 H2O HCO3 OH (3)
HCO3 H2O H2CO3 OH (4)
11. Пример 3. Рассчитать концентрацию ионов СО32- в растворе, значение pH которого регулируется изменением концентрации соды.
Гидролиз:2
CO3 H2O HCO3 OH (3)
HCO3 H2O H2CO3 OH (4)
Уравнения (3) и (4), которые можно свести к уравнениям (1),
(2) из предыдущего примера:
H2CO3 H HCO3 (5)
2
HCO 3 H CO3 (6)
12. Пример 3. Рассчитать концентрацию ионов СО32- в растворе, значение pH которого регулируется изменением концентрации соды.
Материальный баланс:1
2
[ Na ] C0 [CO3 ] [HCO 3 ] [H 2 CO3 ](7)
2
Уравнение электронейтральности:
2
[ Na ] [H ] 2 *[CO3 ] [HCO 3 ] [OH ](8)
13. Пример 3. Рассчитать концентрацию ионов СО32- в растворе, значение pH которого регулируется изменением концентрации соды. С0 –
10-5моль/л[CO 3
2
] f ( K , K ,[ H ], C , K )
5
6
0
W












 chemistry
chemistry








