Similar presentations:
Закон Гесса. Лекция 4
1.
Лекция 4Закон Гесса.
Зависимость энтальпий химических реакций
от температуры. Уравнение Кирхгофа.
Второй закон термодинамики. Энтропия.
Аксиоматика первого и второго
законов термодинамики.
2.
Лекция 3.Теплота, работа и изменение внутренней энергии для
различных процессов в идеальном газе
Энтальпия. Вычисление изменений внутренней энергии
и энтальпии из опытных данных.
Теплоты реакций QV и Qp.
Стандартные энтальпии химических реакций.
3.
1 баллПервый закон термодинамики утверждает, что внутренняя энергия
постоянна
1. В любой системе. 2. В закрытой системе 3. В открытой системе
4. В изолированной системе 5. Систем с постоянной энергией не
существует.
Может быть несколько правильных ответов. Указать все!
4.
1 баллВыражение δQ+δW=dU
1) Это первый закон термодинамики для изолированных систем
2) В закрытой системе сумма δQ+δW совпадает с полным
дифференциалом.
2
3) Интеграл
4) Интеграл
Q
1
dU
всегда больше нуля
по любому замкнутому контуру равен нулю
Может быть несколько правильных ответов. Указать все!
5.
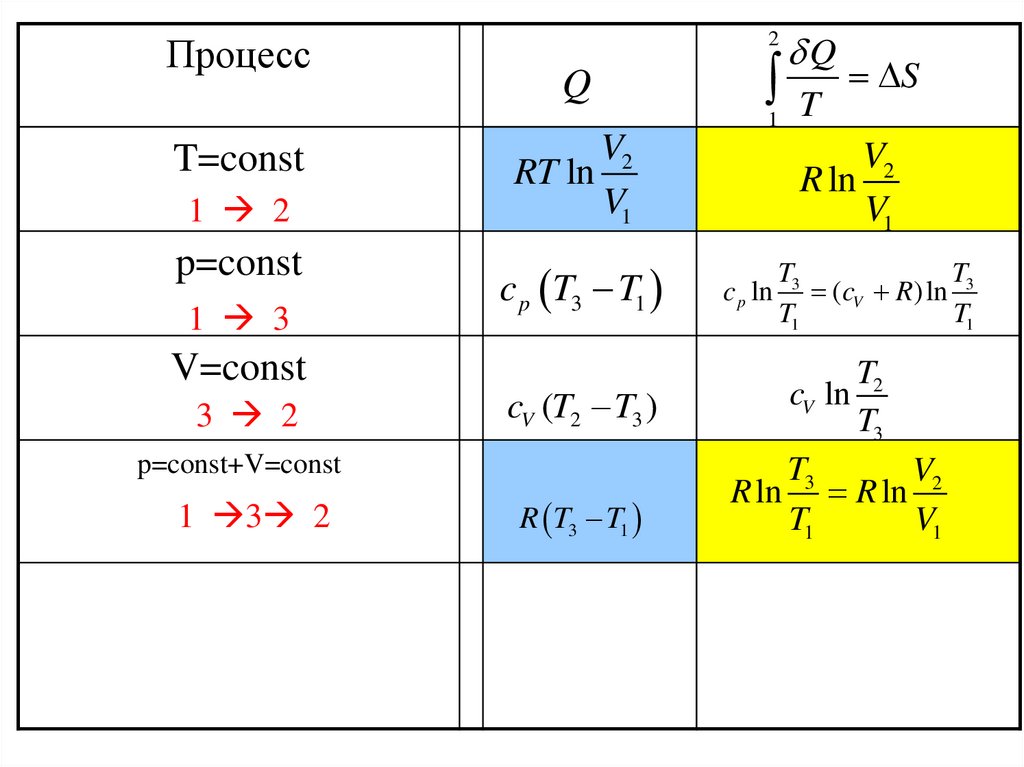
ПЕРВЫЙ ЗАКОН и ХИМИЧЕСКАЯ РЕАКЦИЯQ+W
«Состояние 1, Т1;р1»
U 2 1 U (2) U (1)
H 2 1 H (2) H (1)
«Состояние 1»
- реагенты реакции;
«Состояние 2»
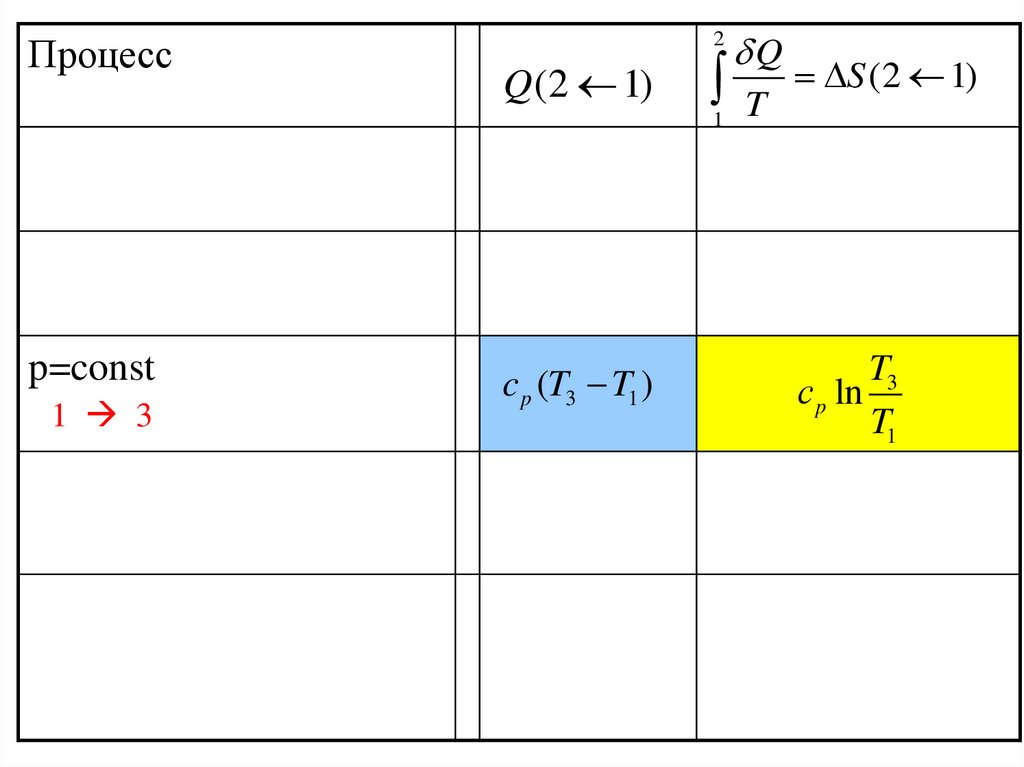
- продукты реакции.
«Состояние 2,Т1;р1»
6.
ЭНТАЛЬПИЯ.У любой системы существует функция состояния, называемая
энтальпией, H.
H U pV ;
dH dU pdV Vdp
H 2 1 U 2 1 ( pV ) 2 1
2
H 2 1 Q pвнеш dV p2V2 p1V1
1
7.
ТЕПЛОВЫЕ ЭФФЕКТЫ QV и Qр2
U 2 1 Q W Q pвнеш dV QV
1
V const
U 2 1 QV
2
H 2 1 Q pвнеш dV p2V2 p1V1
1
Q pвнеш V2 V1 p2V2 p1V1 Q p
рвнеш p2 p1 const ; H 2 1 Q p
8.
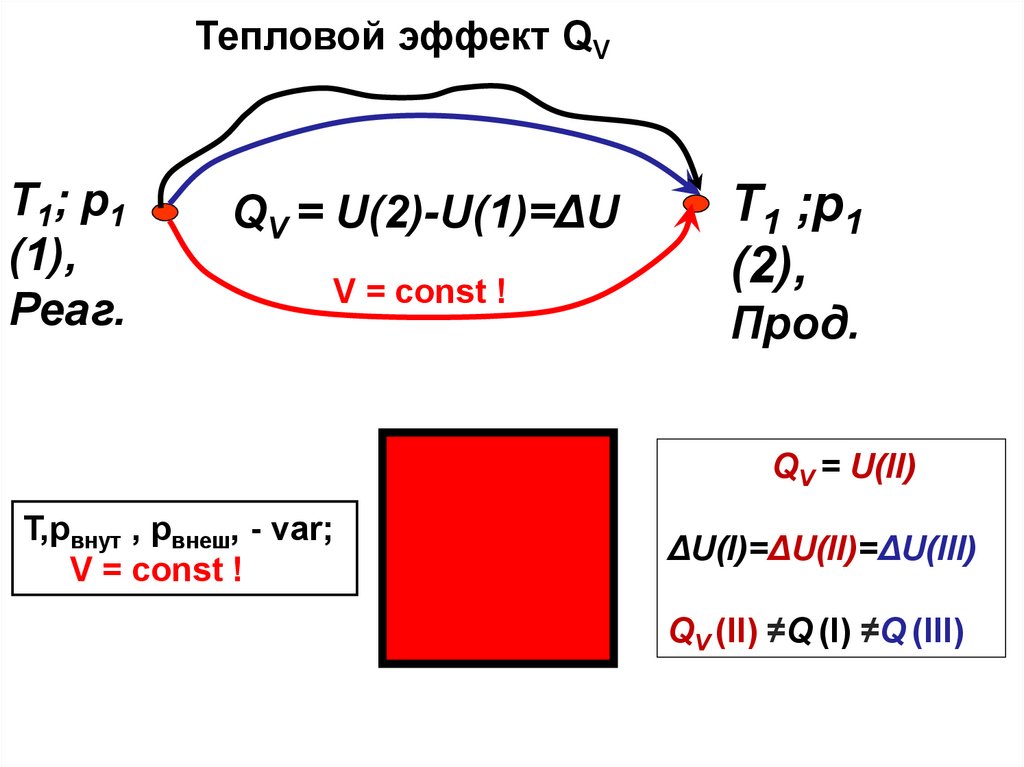
Тепловой эффект QVТ1; р1
(1),
Реаг.
QV = U(2)-U(1)=ΔU
V = const !
Т1 ;р1
(2),
Прод.
QV = U(II)
T,pвнут , pвнеш, - var;
V = const !
ΔU(I)=ΔU(II)=ΔU(III)
QV (II) ≠Q (I) ≠Q (III)
9.
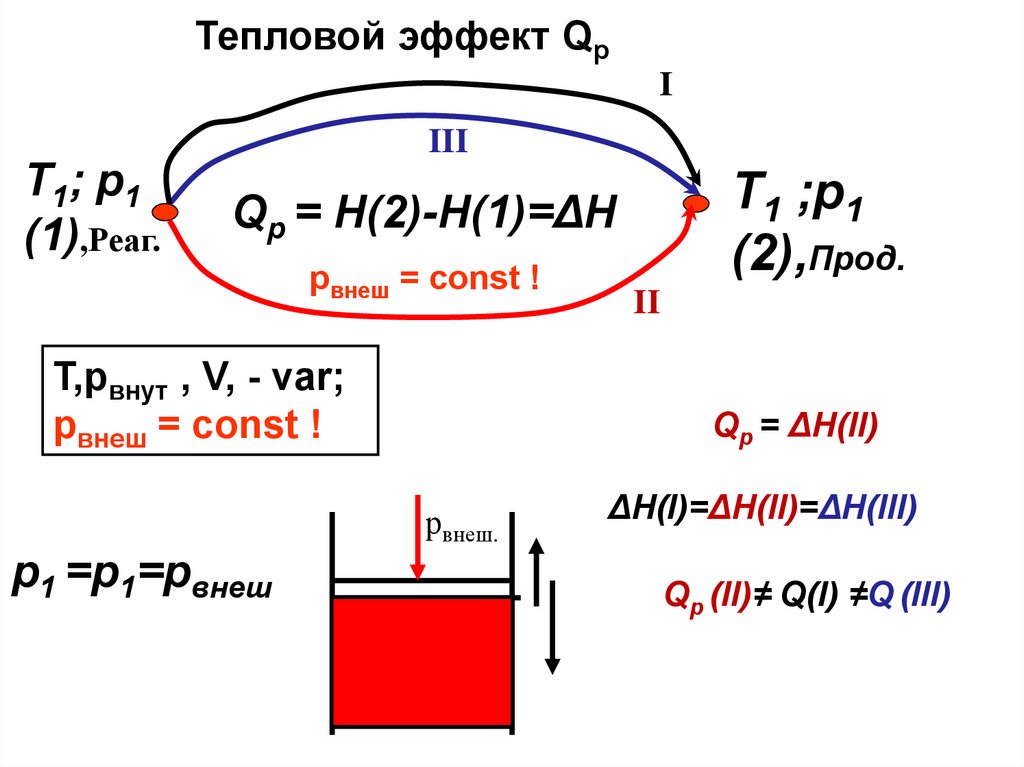
Тепловой эффект QpI
Т1; р1
(1),Реаг.
III
Т1 ;р1
(2),Прод.
Qp = H(2)-H(1)=ΔH
pвнеш = const !
T,pвнут , V, - var;
pвнеш = const !
р1 =р1=pвнеш
II
Qp = ΔH(II)
рвнеш.
ΔH(I)=ΔH(II)=ΔH(III)
Qp (II)≠ Q(I) ≠Q (III)
10.
Обычный «путь» в калориметрииQV U H H
0
T
11.
Связь ∆Н и ∆U химической реакции.H U pV U ( pV ) Прод. ( pV ) Реаг .
Для идеальных газов: pV = nRT
Для твердых и жидких: pV ≈0
H U pV U n RT
∆n = n (продукты, газы) - n (реагенты газы)
12.
Энтальпии реакций. Закон Гесса.13.
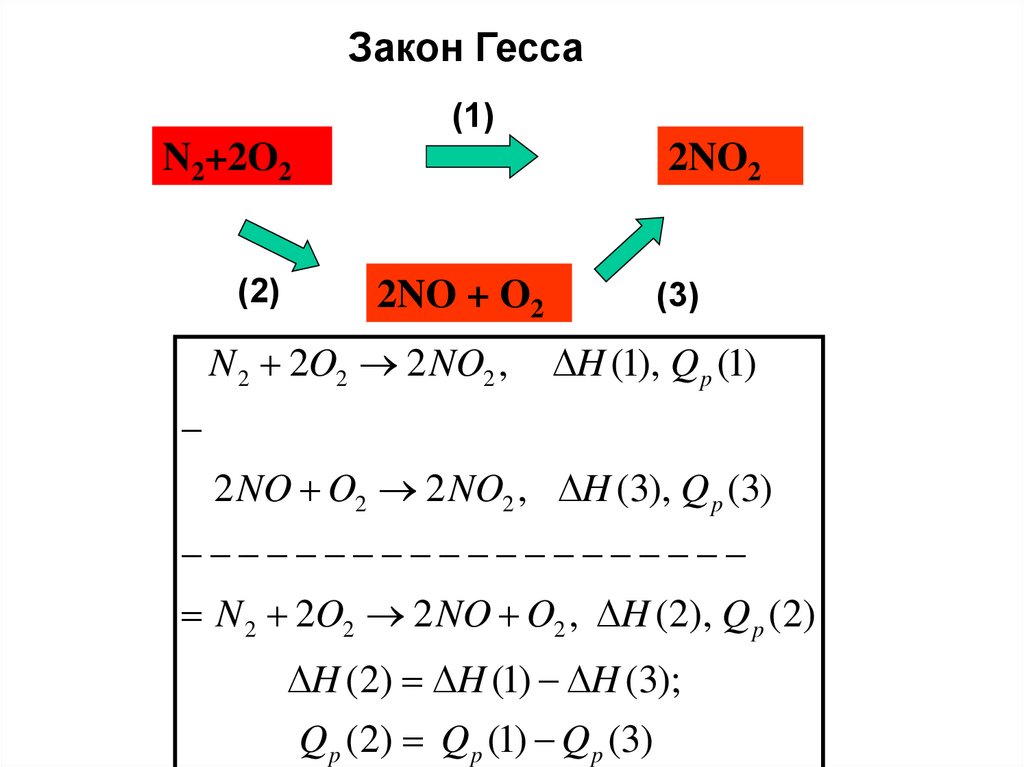
Закон Гесса(1)
N2+2O2
(2)
2NO2
2NO + O2
N 2 2O2 2 NO2 ,
(3)
H (1), Q p (1)
2 NO O2 2 NO2 , H (3), Q p (3)
N 2 2O2 2 NO O2 , H (2), Q p (2)
H (2) H (1) H (3);
Q p (2) Q p (1) Q p (3)
14.
Что такое закон Гесса ?3 балла
1. Энтальпия химической реакции не зависит от способа её
проведения.
2. Теплота химической реакции не зависит от способа её
проведения.
3. Тепловые эффекты химической реакции, QV и Qp ,
не зависят от способа ее проведения.
15.
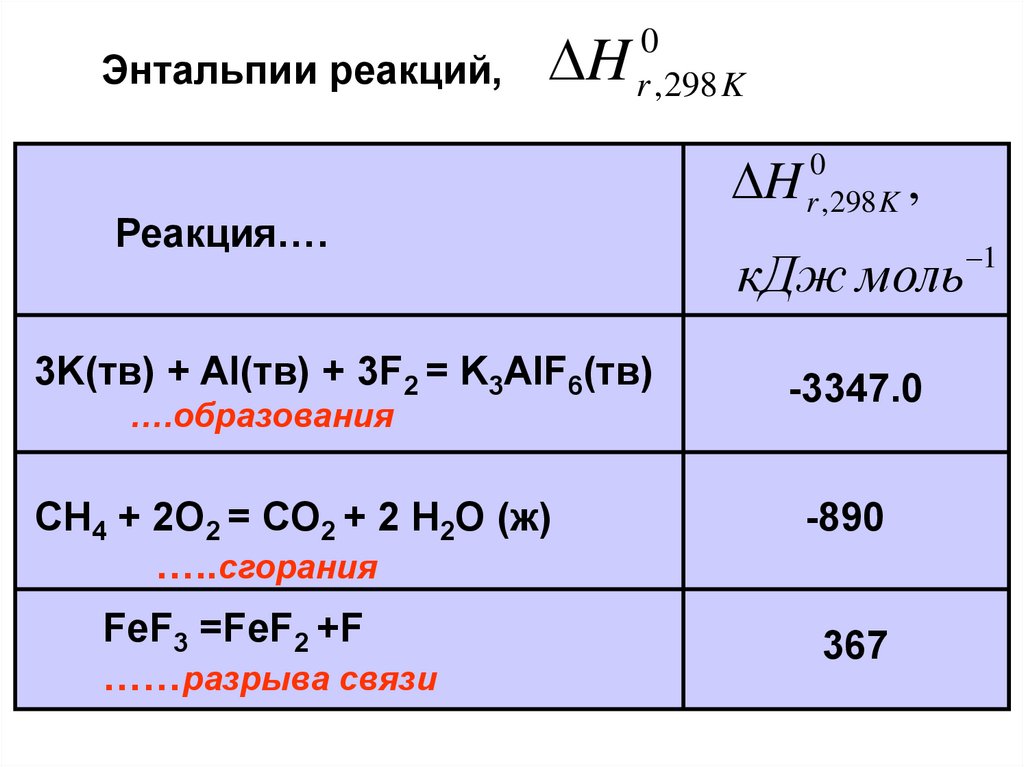
Энтальпии реакций,H
0
r ,298 K
H
Реакция….
3K(тв) + Al(тв) + 3F2 = K3AlF6(тв)
….образования
СH4 + 2О2 = СО2 + 2 Н2О (ж)
…..сгорания
FeF3 =FeF2 +F
……разрыва связи
0
r ,298 K
,
кДж моль
-3347.0
-890
367
1
16.
ЭНТАЛЬПИИ ОБРАЗОВАНИЯЭто энтальпии образования химических соединений из простых
веществ:
H 0f ,T
3Cтв , графит 4 H 2 0.5 О2 С3 H 7OH жид
Простые вещества (элементы в своем естественном состоянии!):
O2 ; Н 2 ; F2 ; Ств.графит ; Feтв ....; электрон
17.
Энтальпии образования простых веществ равны нулю:О2 ( газ ) О2 ( газ ), Н
0
f ,T
О2 (газ) 0
Энтальпия любой реакции равна разности энтальпий образования
продуктов и реагентов
2СH 3 C2 H 6 ; H T0 H 0f ,T C2 H 6 2 H 0f ,T CH 3
3
Ств.граф. Н 2 СН 3 Н 0f ,T СН 3
2
2Ств.граф. 3Н 2 С2 Н 6 Н 0f ,T С2 Н 6
18.
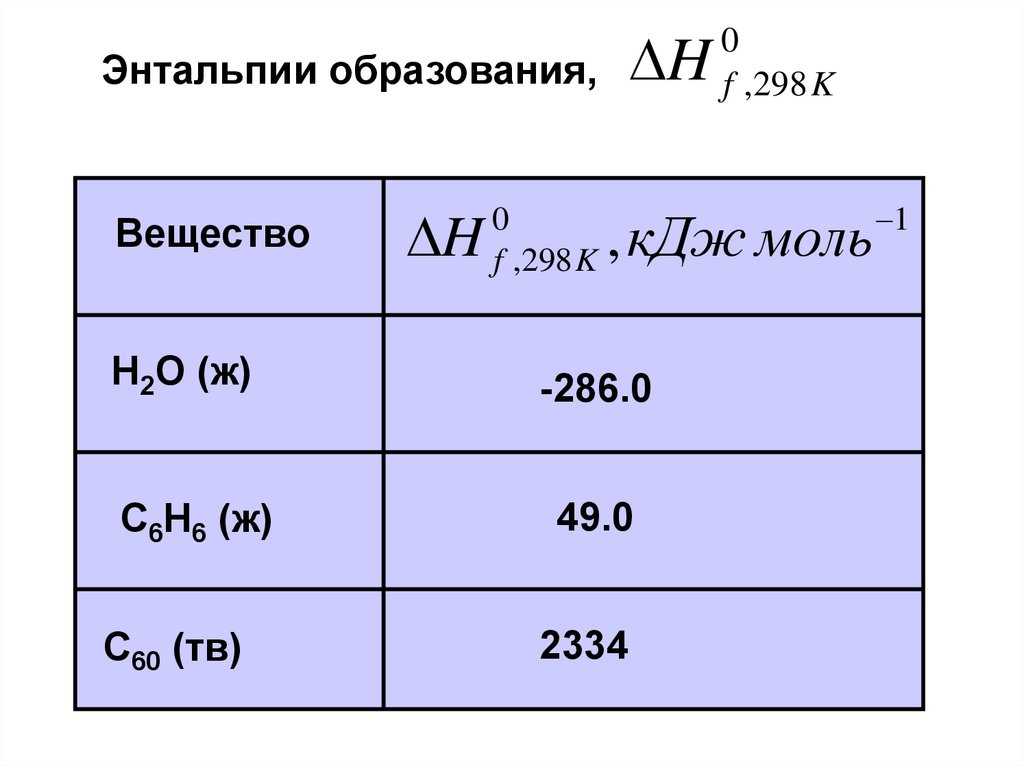
HЭнтальпии образования,
Вещество
H2O (ж)
С6H6 (ж)
C60 (тв)
H
0
f ,298 K
0
f ,298 K
, кДж моль
-286.0
49.0
2334
1
19.
Какой реакции соответствует энтальпия Н 0f ,298 K ( AlОF2 , газ )1) Al( тв ) F2 O e AlOF2 ( газ )
1 балл
2
2) Al( тв ) 2 F O e AlOF ( газ )
2
3) Al( газ ) F2 O e AlОF ( газ )
1
4) Al( газ ) F2 O2 e AlОF2 ( газ )
2
1
5) Al( тв ) F2 O2 e AlОF2 ( газ )
2
20.
С60С70
Научные основы
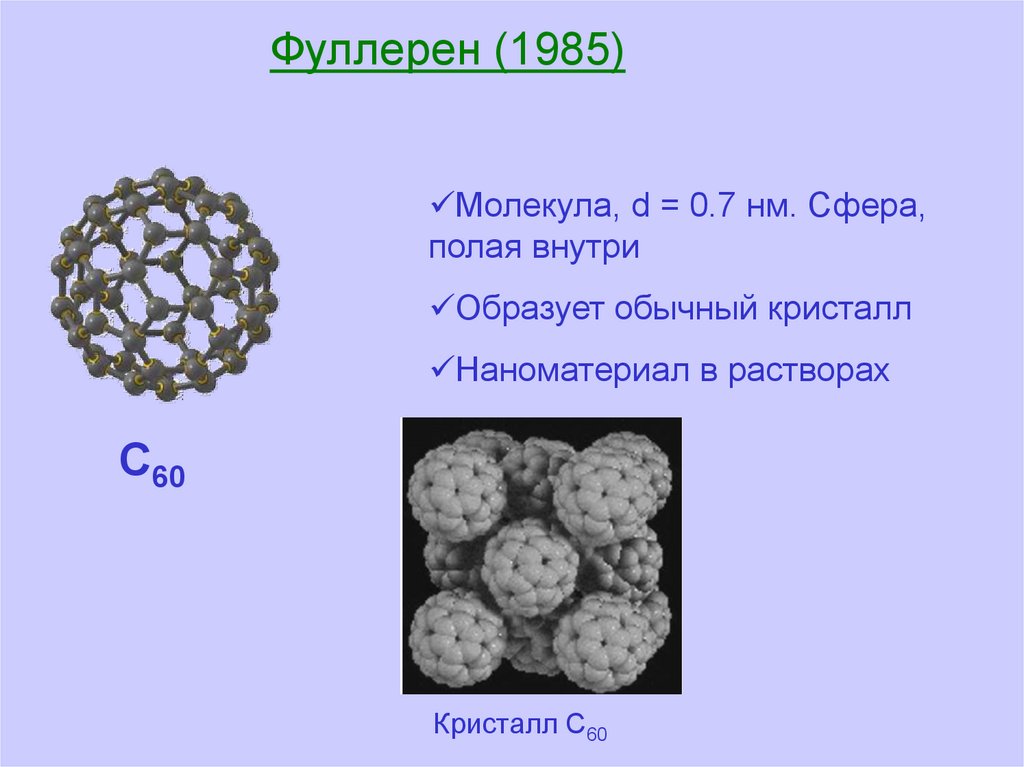
21.
Фуллерен (1985)Молекула, d = 0.7 нм. Сфера,
полая внутри
Образует обычный кристалл
Наноматериал в растворах
С60
Кристалл С60
22.
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ С6060 C( тв ) С60,( тв )
(I )
60 C( тв ) 60O2 60СO2 ( II ); Лит.
C60,( тв ) 60O2 60СO2
( III ); QV ( III ) U ( III )
H ( III ) U ( III ) (m n) RT ( pV )C60 ,тв U ( III )
H ( III ) U ( III ) QV ( III ) 25944 кДж / моль
H 298 K ( I ) H 298 K ( II ) H 298 K ( III )
H
0
f ,298 K
( I ) 2334 кДж / моль
( pV )C60, тв 122 Дж / моль
23.
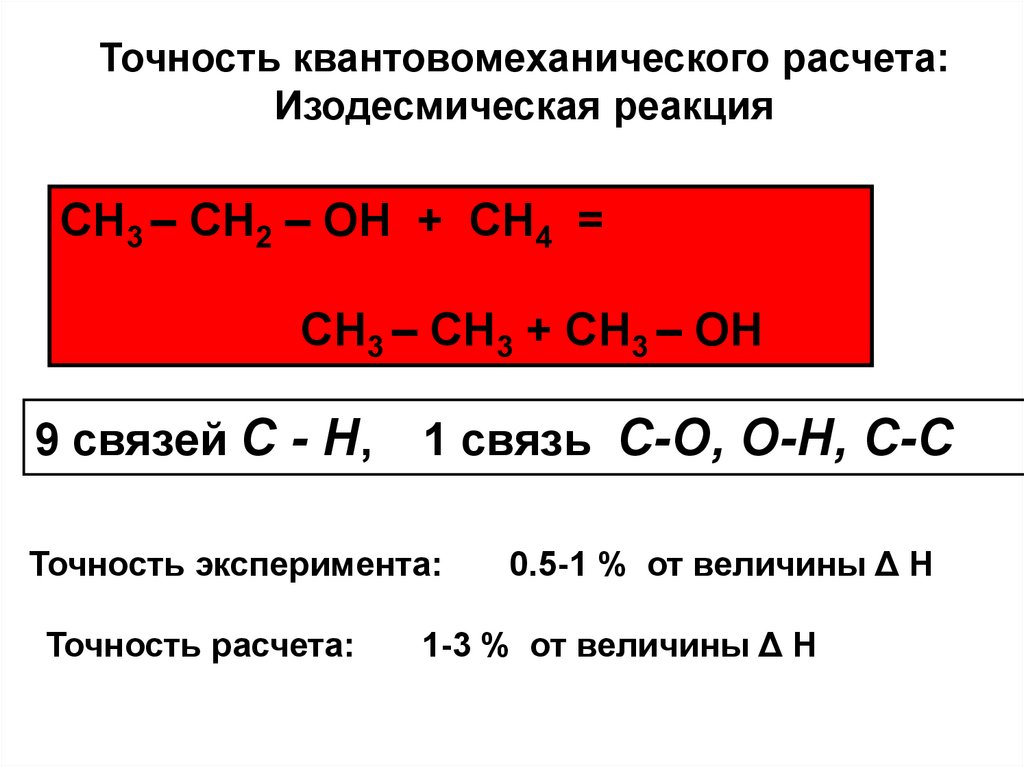
Точность квантовомеханического расчета:Изодесмическая реакция
СН3 – СН2 – ОН + СН4 =
СН3 – СН3 + СН3 – ОН
9 связей C - H,
1 связь C-O, O-H, C-C
Точность эксперимента:
Точность расчета:
0.5-1 % от величины Δ Н
1-3 % от величины Δ Н
24.
ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ ЭНТАЛЬПИЙХИМИЧЕСКИХ РЕАКЦИЙ
25.
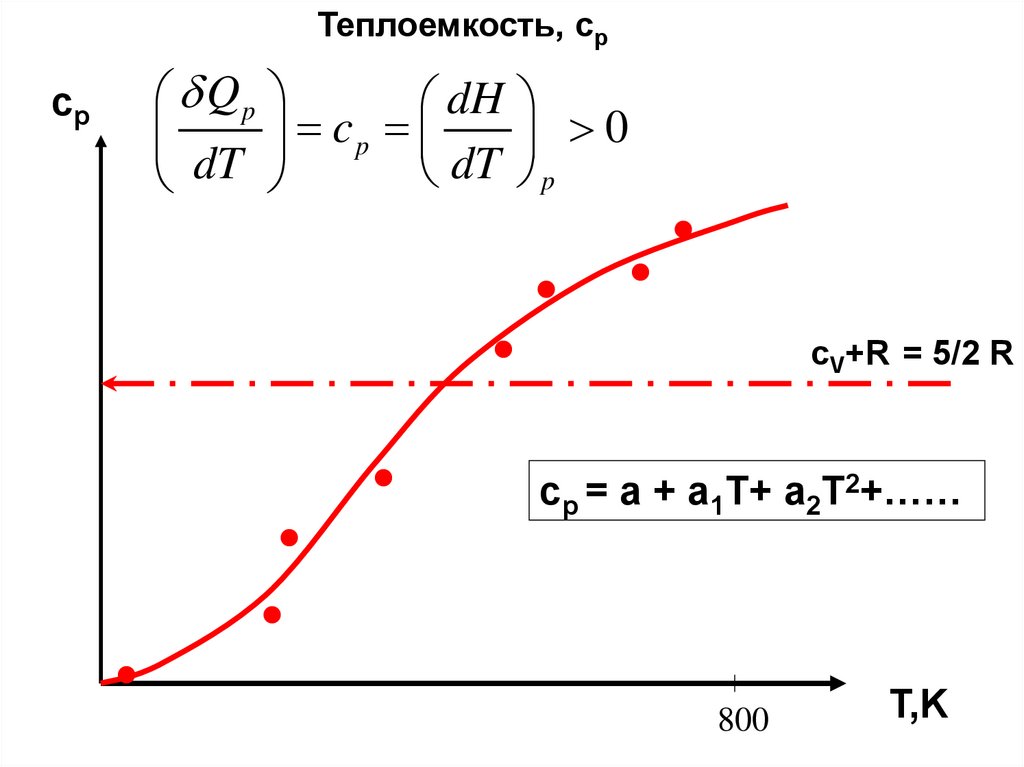
ЧТО ТАКОЕ ТЕПЛОЕМКОСТЬср?
H U pV ; dH dU pdV Vdp
Q dU pdV ; p const ; Q p dН
Qp
сp
dT
H
T
p
26.
Теплоемкость, срcp
Qp
dH
0
cp
dT p
dT
cV+R = 5/2 R
cp = a + a1T+ a2T2+……
800
T,K
27.
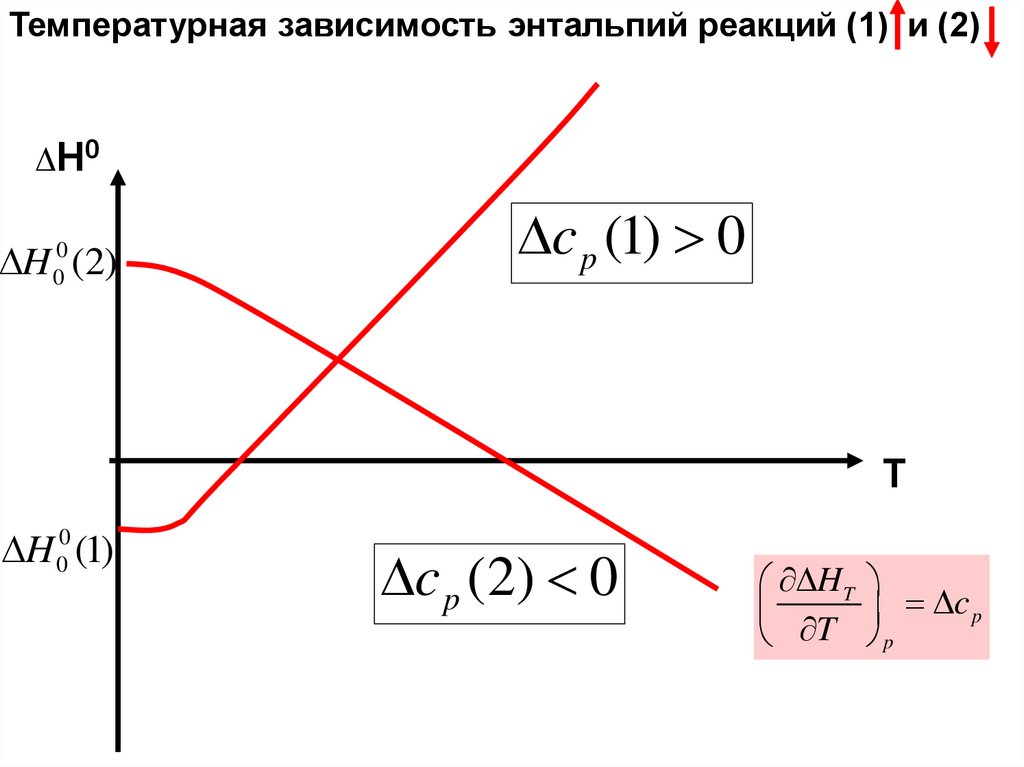
Температурная зависимость энтальпий реакций (1) и (2)Закон Кирхгофа.
A B
C D
H р ции H C H D H A H B ;
H р ции
T
( H C H D H A H B )
с р
T
p
p
c p c p (C ) c p ( D) c p ( A) c p ( B )
c p f T , p
28.
Температурная зависимость энтальпий реакций (1) и (2)ΔН0
H (2)
0
0
c p (1) 0
Т
H 00 (1)
c p (2) 0
H T
c p
T p
29.
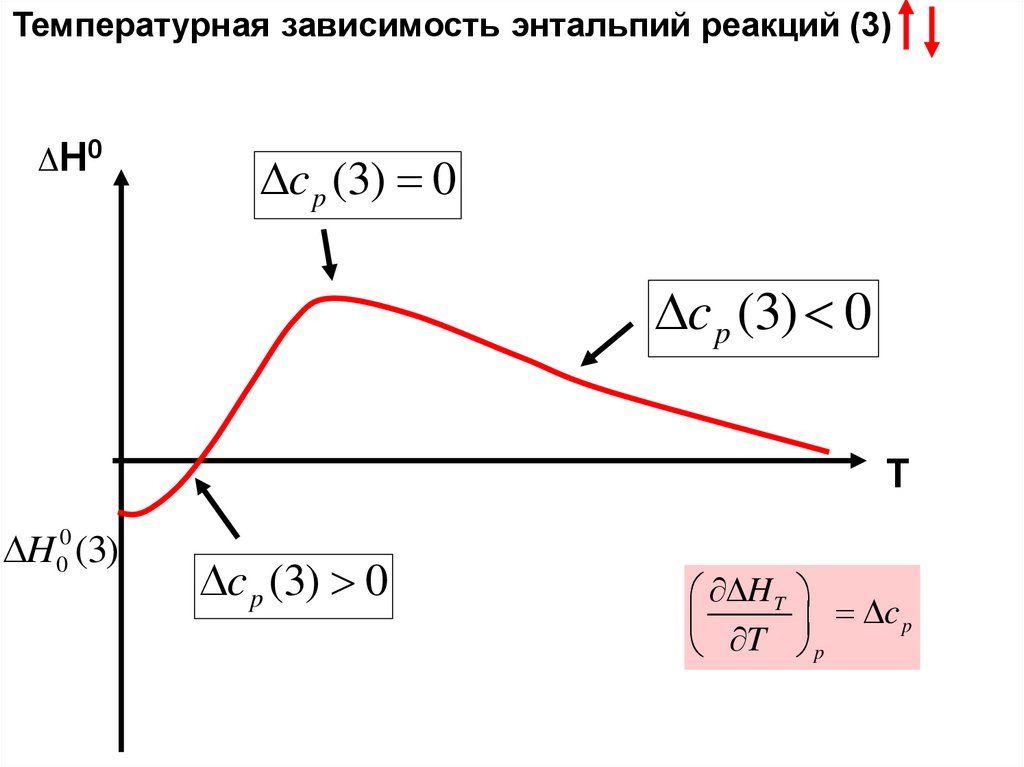
Температурная зависимость энтальпий реакций (3)ΔН0
c p (3) 0
c p (3) 0
Т
H 00 (3)
c p (3) 0
H T
c p
T p
30.
Энтальпия химической реакции , Н T02 балл
1) Соответствует реакции, протекающей при постоянной
температуре T;
2) Растет с увеличением температуры Т;
3) Если реакция проходит при постоянном внешнем давлении равна теплоте реакции;
4) Только при постоянном внешнем давлении не зависит от
способа проведения реакции.
5) Равна ∆U + ∆nRT, где ∆n – разница числа молей
продуктов и реагентов.
Какие из этих утверждений – правильные ?
31.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ32.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ∆U1
«Состояние 1»
?
∆U2
∆U1 =- ∆U2
«Состояние 2»
33.
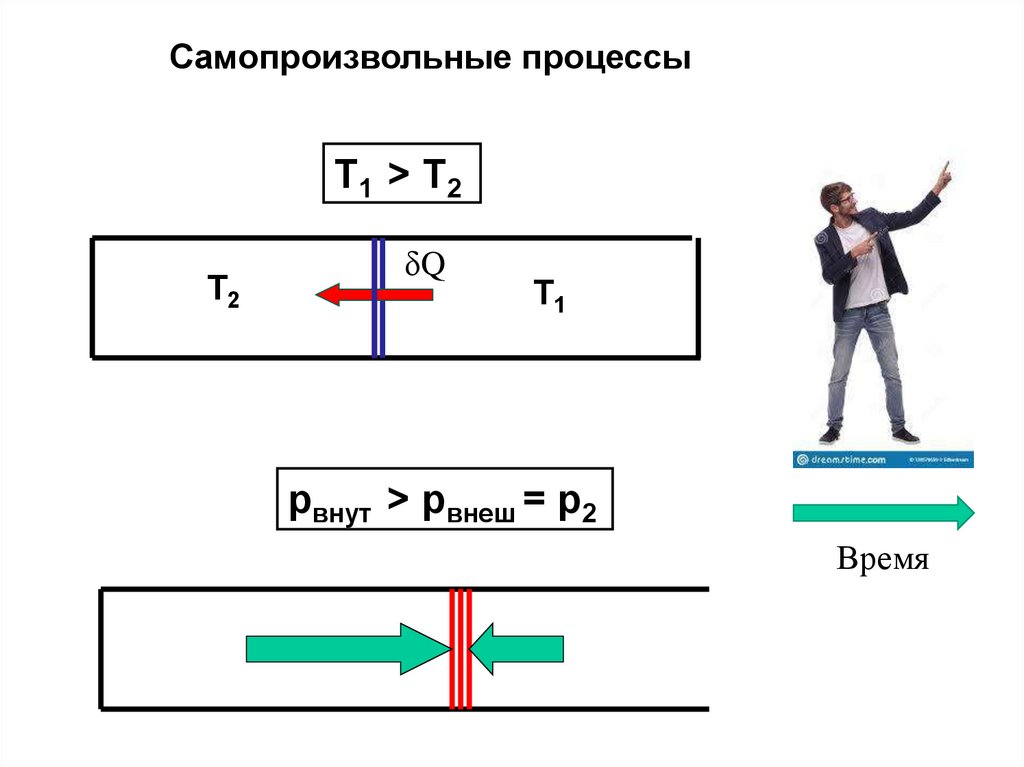
Самопроизвольные процессыТ1 > T2
T2
δQ
Т1
pвнут > pвнеш = p2
Время
34.
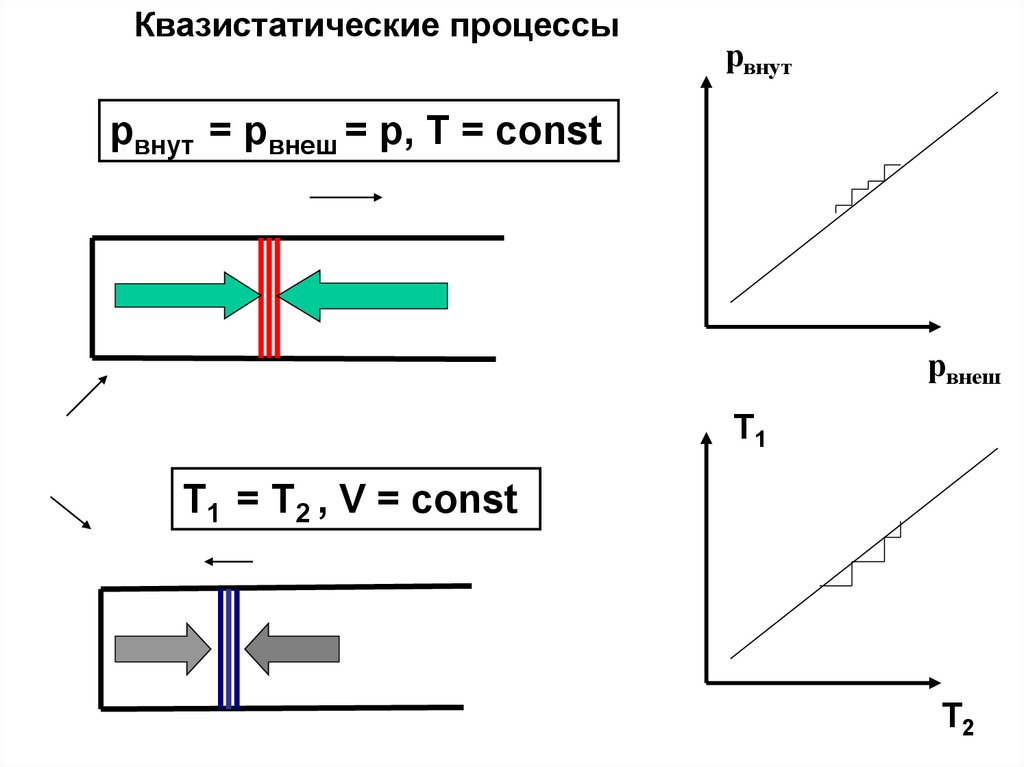
Квазистатические процессырвнут
pвнут = pвнеш = p, T = const
рвнеш
Т1
Т1 = Т2 , V = const
Т2
35.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИQ1
«Состояние 1»
«Состояние 2»
Q2
2
2
1
1
Q2 Q2 Q1 Q1
S S
Q
T
2
??
S 2 1
1
Q1
T
2
1
Q2
T
???
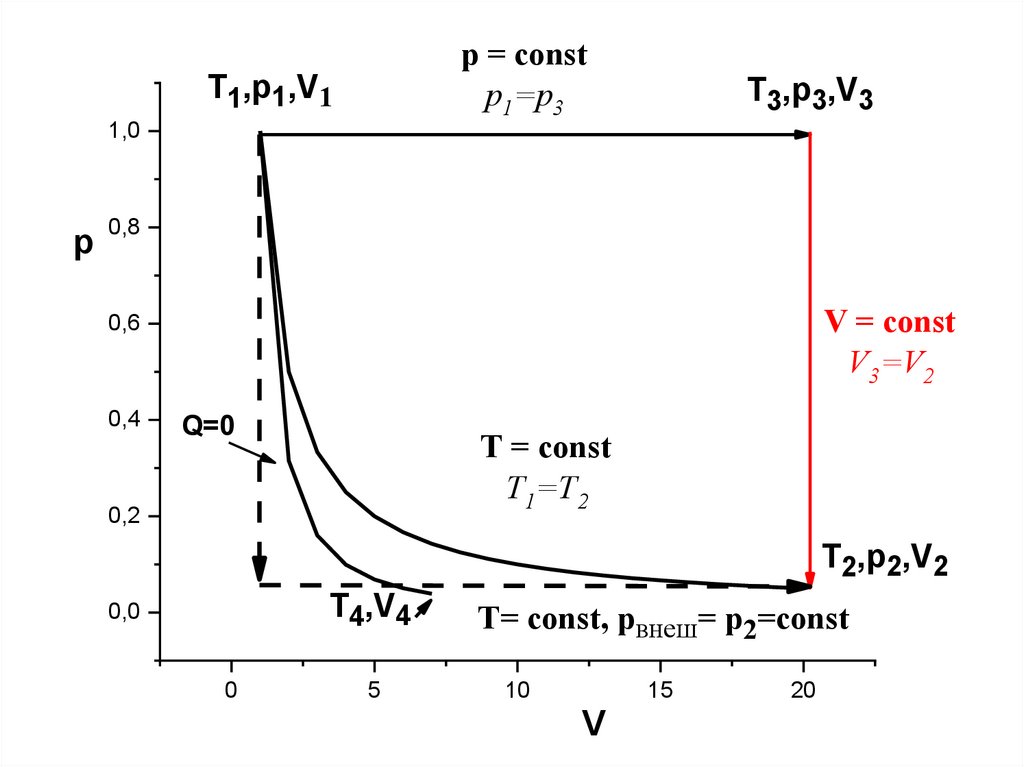
36.
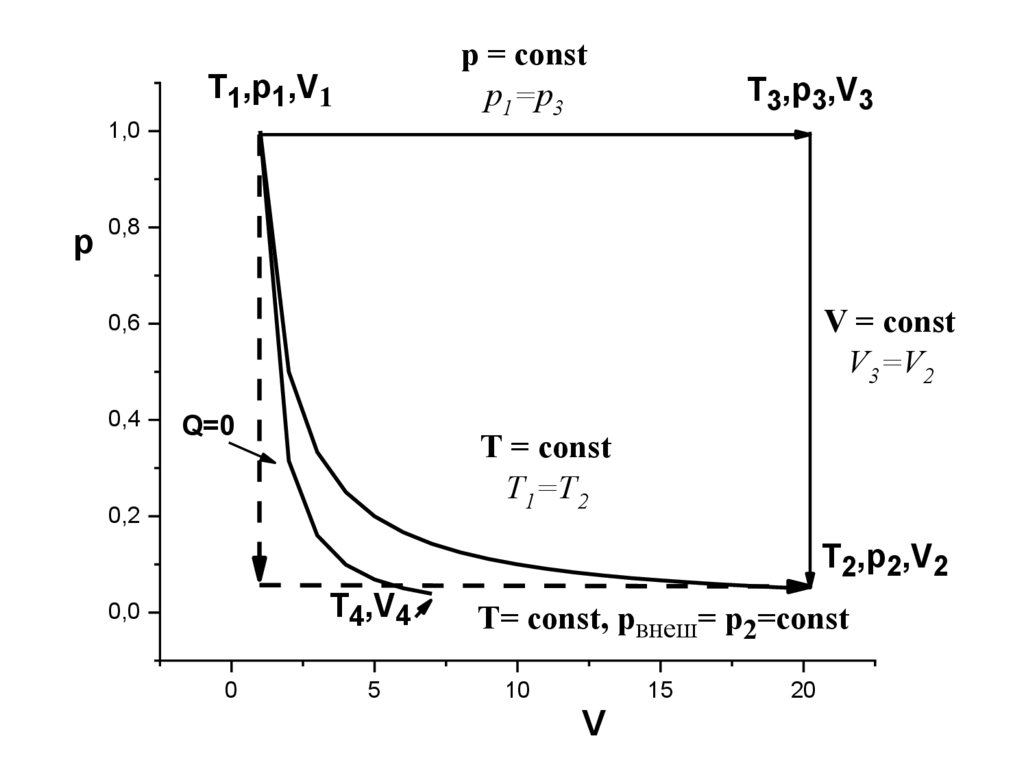
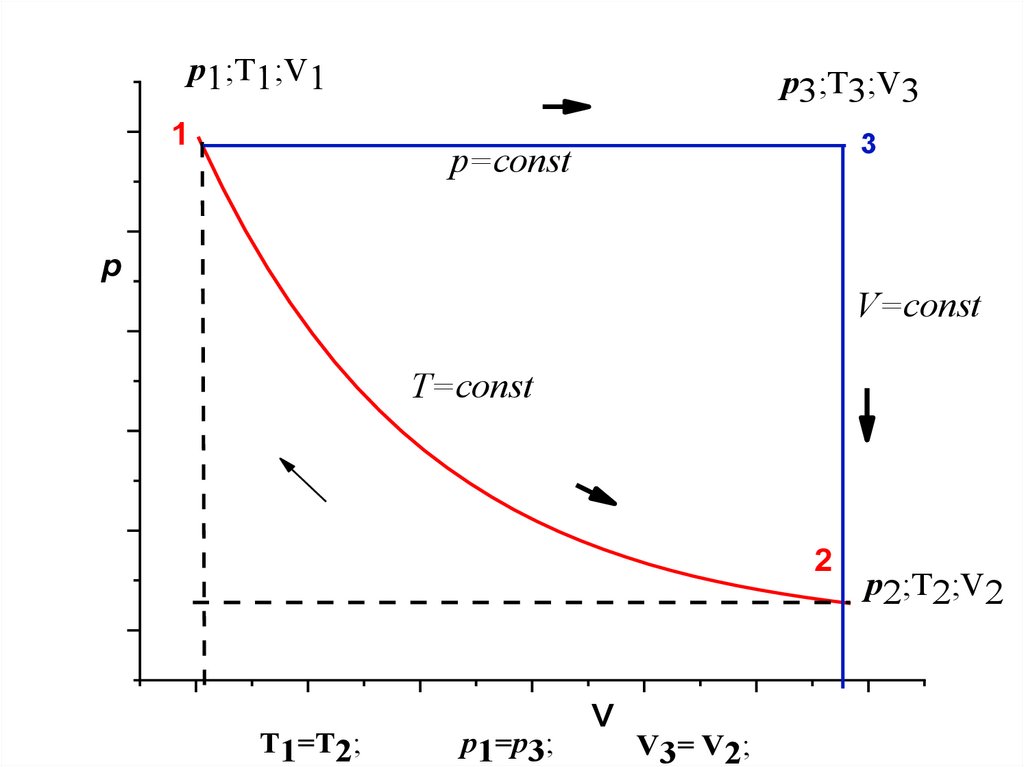
p = constp1=p3
T1,p1,V1
T3,p3,V3
1,0
p
0,8
V = const
V3=V2
0,6
0,4
Q=0
T = const
T1=T2
0,2
T2,p2,V2
T4,V4
0,0
0
5
T= const, pвнеш= p2=const
10
15
V
20
37.
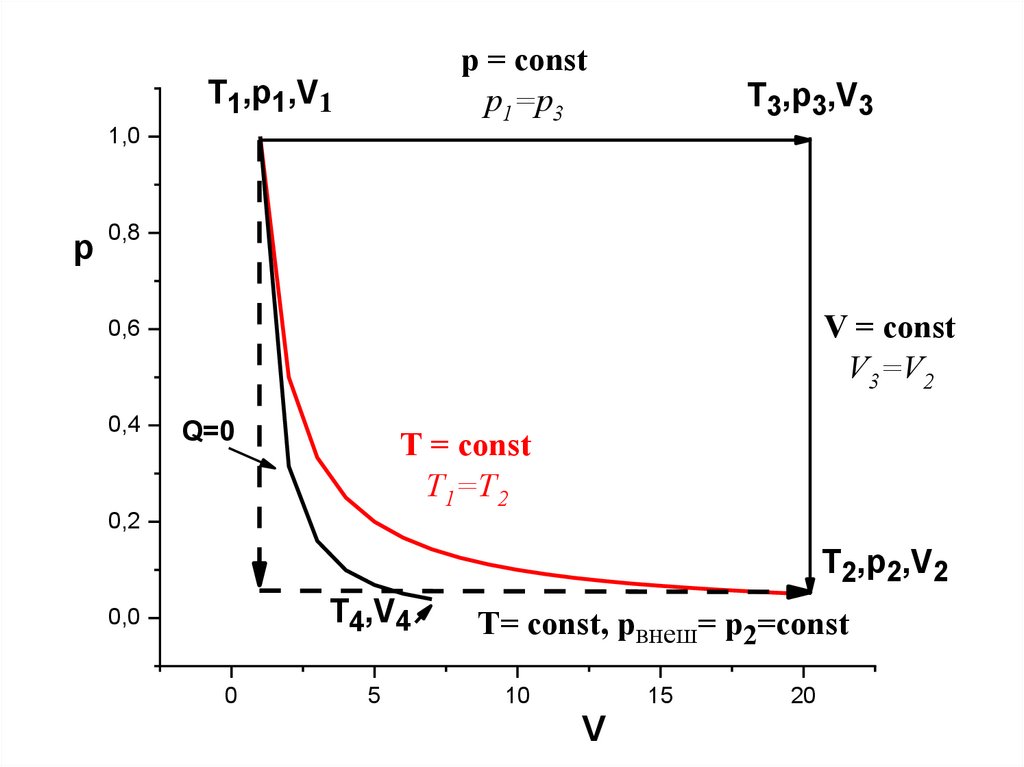
p = constp1=p3
T1,p1,V1
T3,p3,V3
1,0
p
0,8
V = const
V3=V2
0,6
0,4
Q=0
T = const
T1=T2
0,2
T2,p2,V2
T4,V4
0,0
0
5
T= const, pвнеш= p2=const
10
15
V
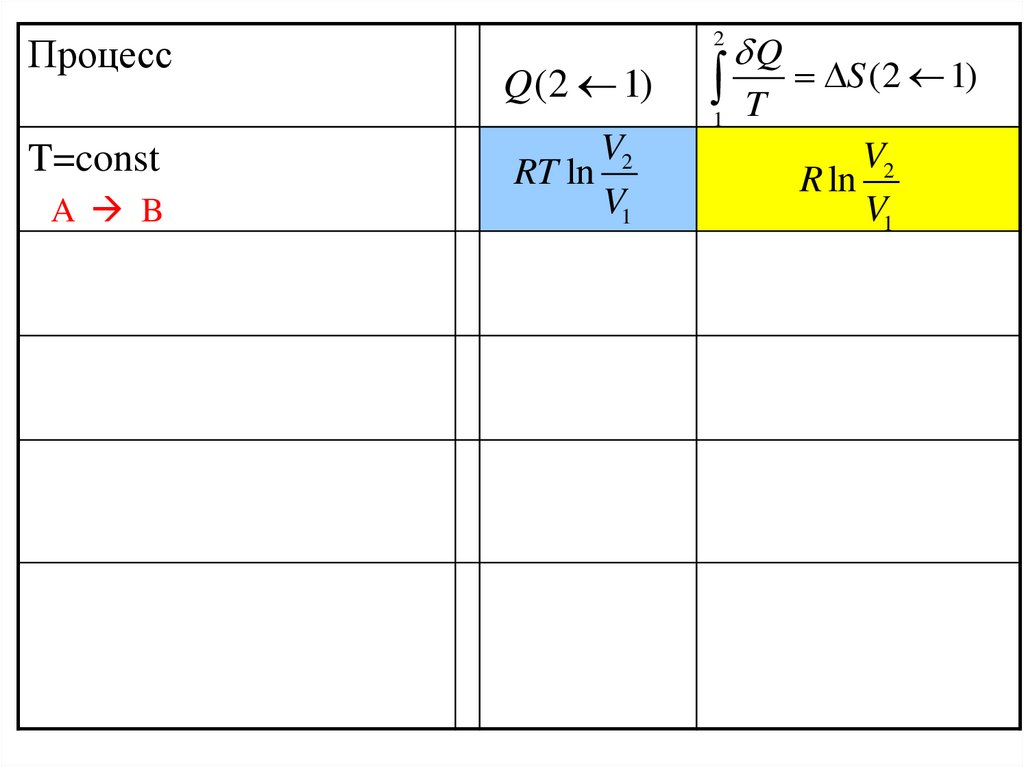
20
38.
ИДЕАЛЬНЫЙ ГАЗКВАЗИСТАТИЧЕСКИЙ, ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС.
∆U = 0 ; dU = δQ + δW ; δW =- δQ
δW = -pdV
V2
V2
RT
W
dV RT ln
V
V1
V1
V2
W RT ln ;
V1
V2
V2
Q RT ln ; S R ln
V1
V1
39.
Процесс2
Q (2 1)
1
T=const
A B
V2
RT ln
V1
Q
T
S (2 1)
V2
R ln
V1
40.
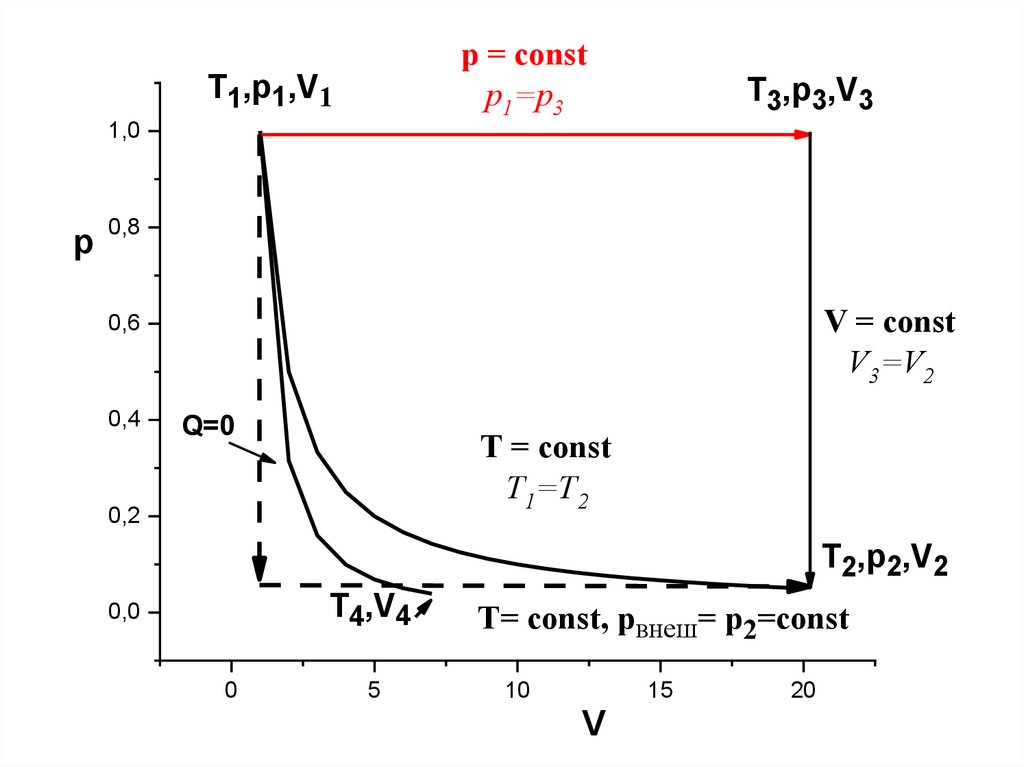
p = constp1=p3
T1,p1,V1
T3,p3,V3
1,0
p
0,8
V = const
V3=V2
0,6
0,4
Q=0
T = const
T1=T2
0,2
T2,p2,V2
T4,V4
0,0
0
5
T= const, pвнеш= p2=const
10
15
V
20
41.
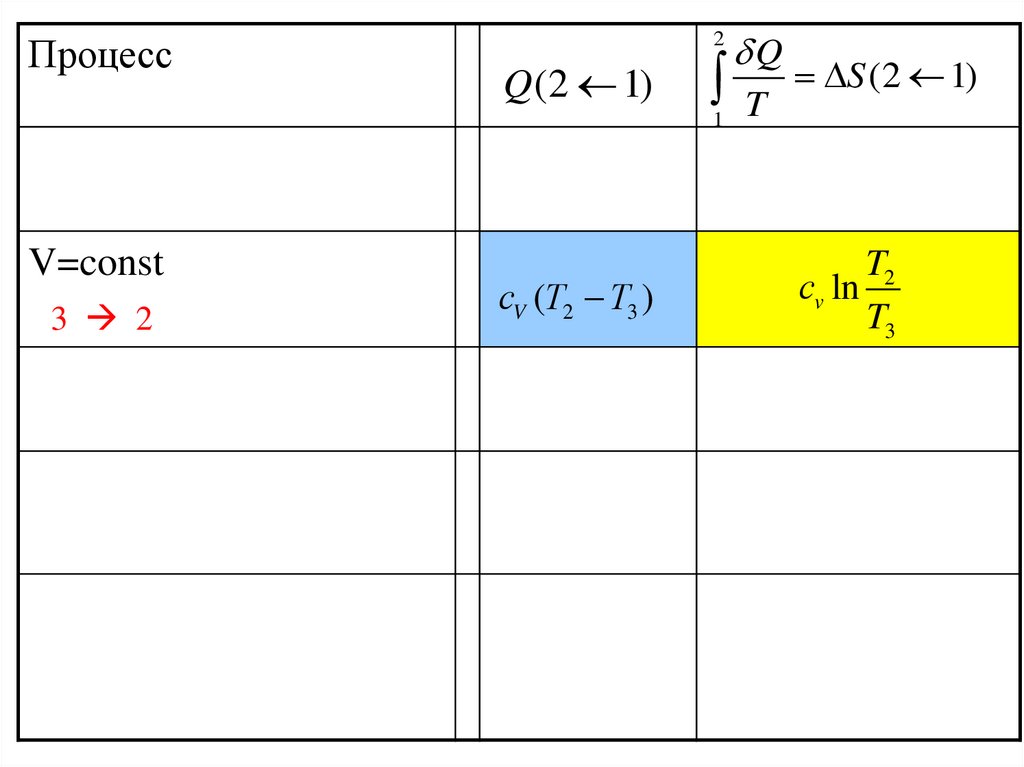
ИДЕАЛЬНЫЙ ГАЗКВАЗИСТАТИЧЕСКИЙ, ИЗОХОРИЧЕСКИЙ ПРОЦЕСС.
dU = δQ + δW ; δQ = cVdT
T2
Q cV dT cV T2 T3
T3
T2
S
T3
Q
T2
cv
dT cV
T T3 T
T2
T2
dT
T T dT cV ln T3 ;
3
42.
Процесс2
Q (2 1)
1
V=const
3 2
сV (T2 T3 )
Q
T
S (2 1)
T2
сv ln
T3
43.
p = constp1=p3
T1,p1,V1
T3,p3,V3
1,0
p
0,8
V = const
V3=V2
0,6
0,4
Q=0
T = const
T1=T2
0,2
T2,p2,V2
T4,V4
0,0
0
5
T= const, pвнеш= p2=const
10
15
V
20
44.
ИДЕАЛЬНЫЙ ГАЗКВАЗИСТАТИЧЕСКИЙ, ИЗОБАРИЧЕСКИЙ ПРОЦЕСС.
dU = δQ + δW ; δQ = cрdT
T3
Q c p dT c p T3 T1
T1
T3
S
T1
Q
T3
cp
T3
T3
dT
dT c p
dT c p ln ;
T T1 T
T
T1
T1
45.
Процесс2
Q (2 1)
1
p=const
1 3
c p (T3 T1 )
Q
T
S (2 1)
T3
с p ln
T1
46.
Процесс2
Q
1
T=const
1 2
p=const
1 3
V=const
3 2
V2
RT ln
V1
c p T3 T1
cV (T2 T3 )
p=const+V=const
1 3 2
R T3 T1
Q
T
S
V2
R ln
V1
c p ln
T3
T
(cV R )ln 3
T1
T1
T2
cV ln
T3
T3
V2
R ln R ln
T1
V1
47.
p1;T1;V11
p3;T3;V3
3
p=const
p
V=const
T=const
2
T1=T2;
p1=p3;
V
V3= V2;
p2;T2;V2
























 physics
physics








