Similar presentations:
Внутренняя энергия. Работа расширения. Теплота. Аналитическое выражение первого закона термодинамики. (Занятие 2)
1. Часть 1
Техническаятермодинамика
Занятие 2
Внутренняя энергия. Работа расширения. Теплота.
Аналитическое выражение первого закона
термодинамики. Теплоемкость газов. Энтальпия.
2. Внутренняя энергия (U)
Фильм 213. Внутренняя энергия (U)
U = Uк + Uп + Uо + UяUк=f(T)
Uп=f(V)
Uо=0
Фильм 22
Uя=0
4. Внутренняя энергия (U)
Фильм 235. Свойства внутренней энергии
1. U=f(состояния тела) => U=f(V,P,T)2. свойство аддитивности. U=U1+ U2+…
3. u=U/М [Дж/кг]
4. ИГ U2=0
Uиг=f(T)
5. для задач u=u2-u1
6. Работа расширения (L)
- форма передачи энергии в ТДФильм 24
7. Работа расширения (L), Дж
v2l pdv
v1
8. Работа расширения (L)
Свойства :1. L=f(процесса)
2. Макрофизическая форма передачи энергии в ТД
процессе
3. l=L/М [Дж/кг]
4. При расширении - «+», при сжатии – «-»
5. Зависит от свойств ТРД
9. Теплота (Q), Дж (q, дж/кг)
- форма передачи энергии на микроФильм 25
10. Теплоемкость газов (С)
- количество теплоты, которое необходимоподвести или отвести от единицы рабочего тела
для изменения его температуры на 1
Q
C
T
Дж
К
Теплоемкость зависит от:
температуры,
давления,
структуры молекул,
процесса,
единицы рабочего тела
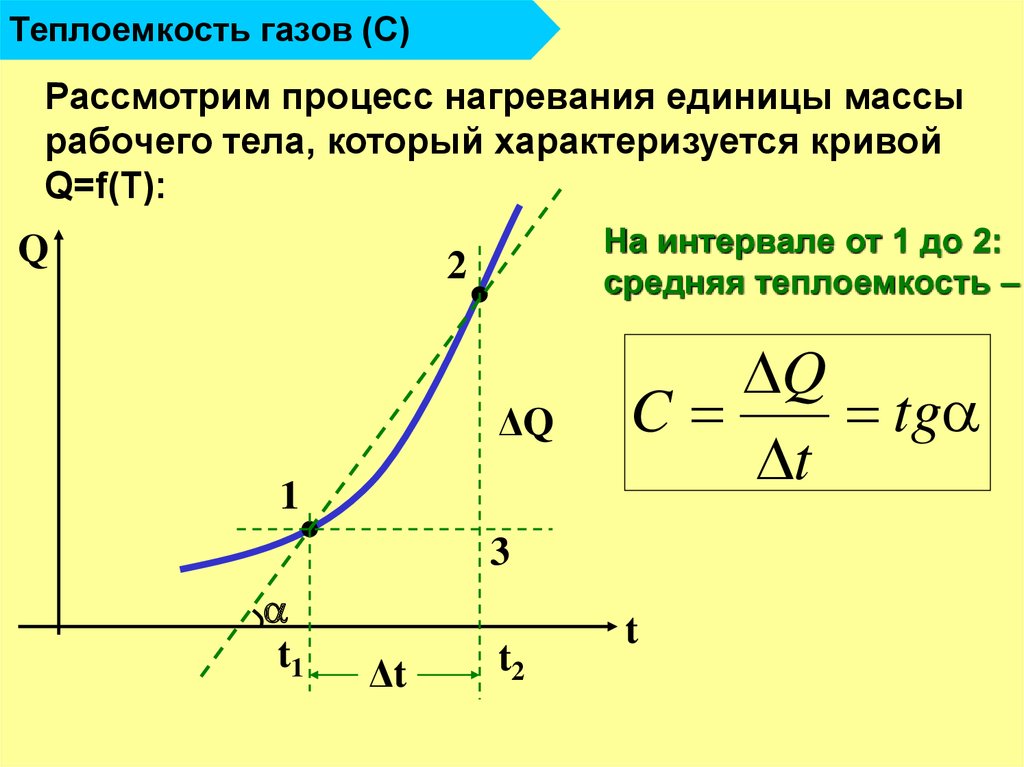
11. Теплоемкость газов (С)
Рассмотрим процесс нагревания единицы массырабочего тела, который характеризуется кривой
Q=f(T):
Q
На интервале от 1 до 2:
средняя теплоемкость –
2
ΔQ
1
Q
C
tg
t
3
t1
Δt
t2
t
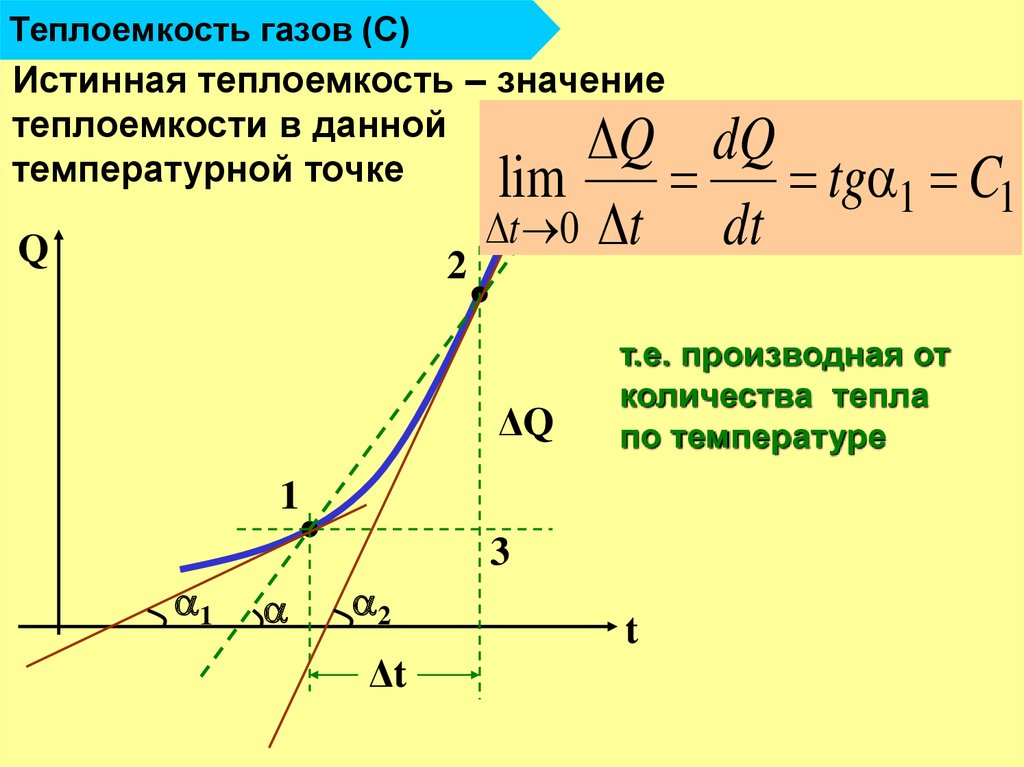
12. Теплоемкость газов (С)
Истинная теплоемкость – значениетеплоемкости в данной
температурной точке
Q
2
Q dQ
lim
tg 1 C1
t 0 t
dt
ΔQ
т.е. производная от
количества тепла
по температуре
1
3
1
2
Δt
t
13. Теплоемкость газов (С)
Расход тепла в процессе:1. Через среднюю
теплоемкость:
Q Сср t
2. Через истинную
теплоемкость:
dQ Cdt
t2
Q Cdt
t1
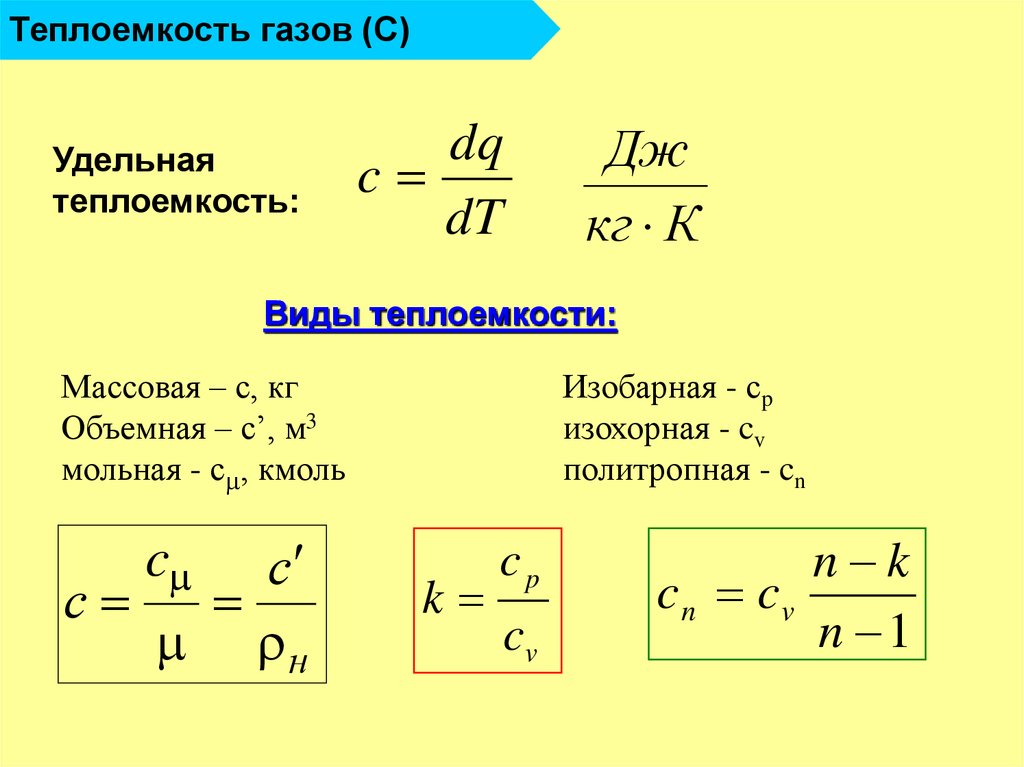
14. Теплоемкость газов (С)
Удельнаятеплоемкость:
dq
c
dT
Дж
кг К
Виды теплоемкости:
Массовая – с, кг
Объемная – с’, м3
мольная - с , кмоль
с
с
н
c
Изобарная - сp
изохорная - cv
политропная - cn
k
cp
cv
n k
cn cv
n 1
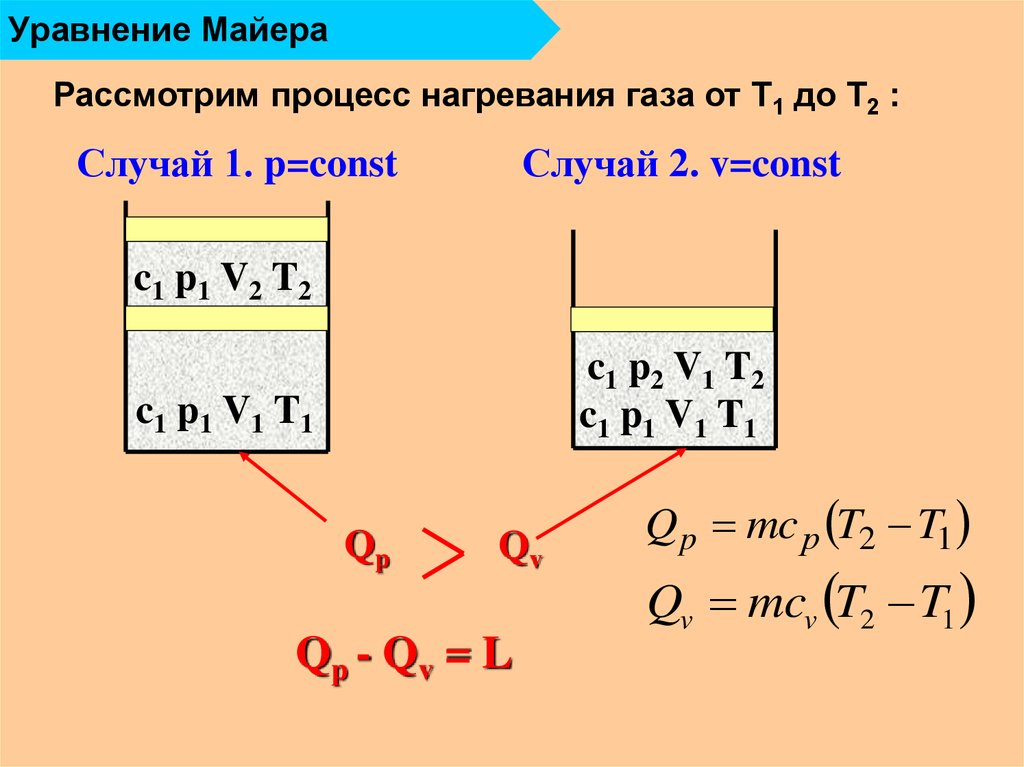
15. Уравнение Майера
Рассмотрим процесс нагревания газа от Т1 до Т2 :Случай 1. p=const
Случай 2. v=const
c1 p1 V2 T2
c1 p2 V1 T2
c1 p1 V1 T1
c1 p1 V1 T1
Qp
Qv
Qp - Qv = L
Q p mc р T2 T1
Qv mcv T2 T1
16. Уравнение Майера
Работа газа:pV = mRT
p
L = p1V2 - p1V1 =
= p1 (V2 - V1) =
2
L
Qv
= mR(T2 - T1)
1
C другой стороны:
2
Qp
v
L = Qp - Qv = mcp(T2 - T1) - mcv(T2 - T1)
Тогда:
mR(T2 - T1) = mcp(T2 - T1) - mcv(T2 - T1)
R c p cv
1842 г.
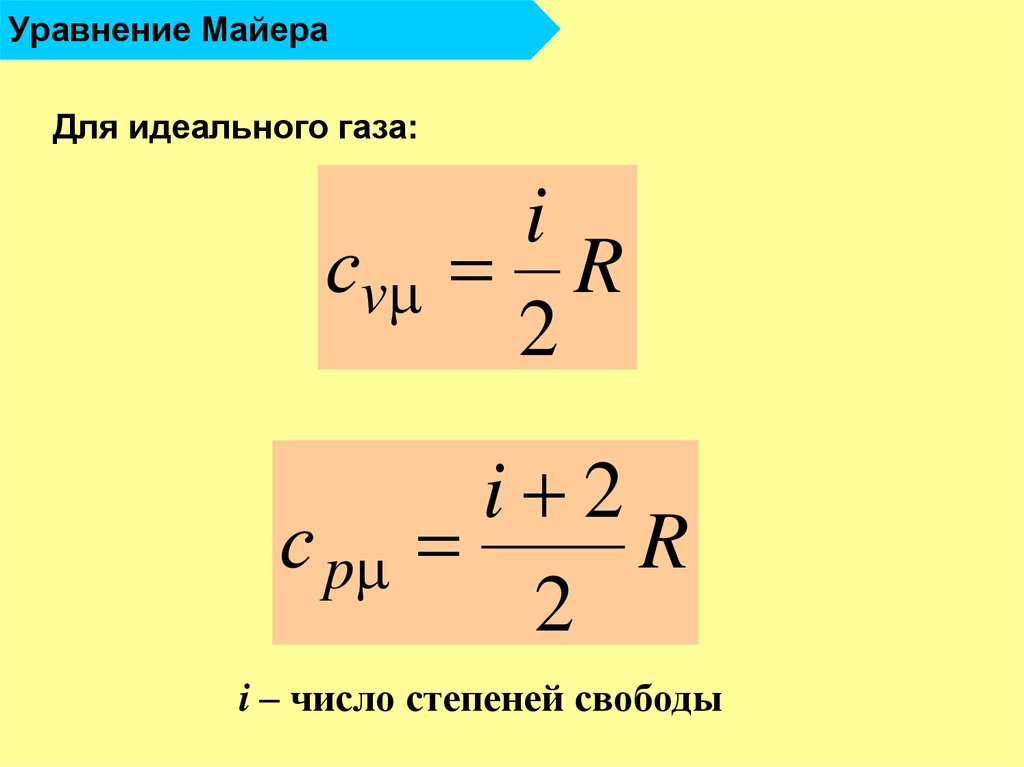
17. Уравнение Майера
Для идеального газа:сv
с p
i
R
2
i 2
R
2
i – число степеней свободы
18. Уравнение Майера
Коэффициент Пуассона:k
cp
Газ
k
cv
одноатомный
1,67
двухатомный
1,40
многоатомный
1,28
19. Энтальпия (i)
I = U + pV [Дж]Функция состояния
u + pv = i [Дж/кг]
Энтальпия ИГ является функцией только Т
i = U(T) + RT
di = cpdT
i = cdT + RT
Δi = cp(T2-T1)
20. Первый закон термодинамики
Е=constПолная энергия изолированной
термодинамической системы при любых
происходящих в системе процессах остается
неизменной
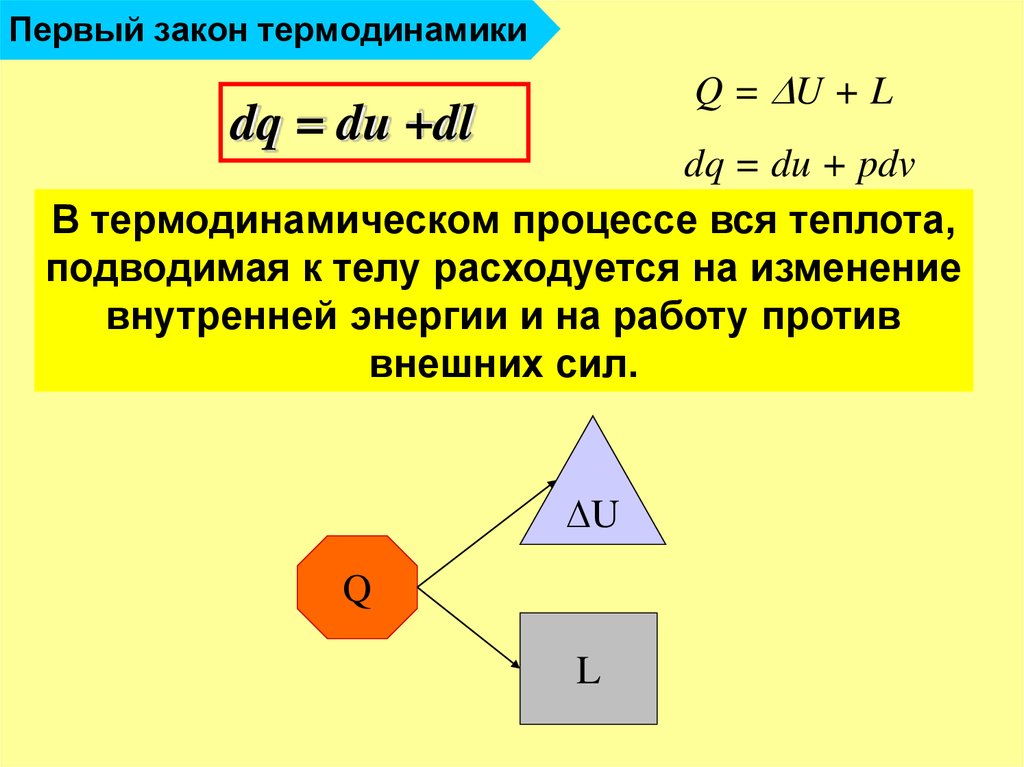
21. Первый закон термодинамики
Q = U + Ldq = du +dl
dq = du + pdv
В термодинамическом процессе вся теплота,
подводимая к телу расходуется на изменение
внутренней энергии и на работу против
внешних сил.
U
Q
L
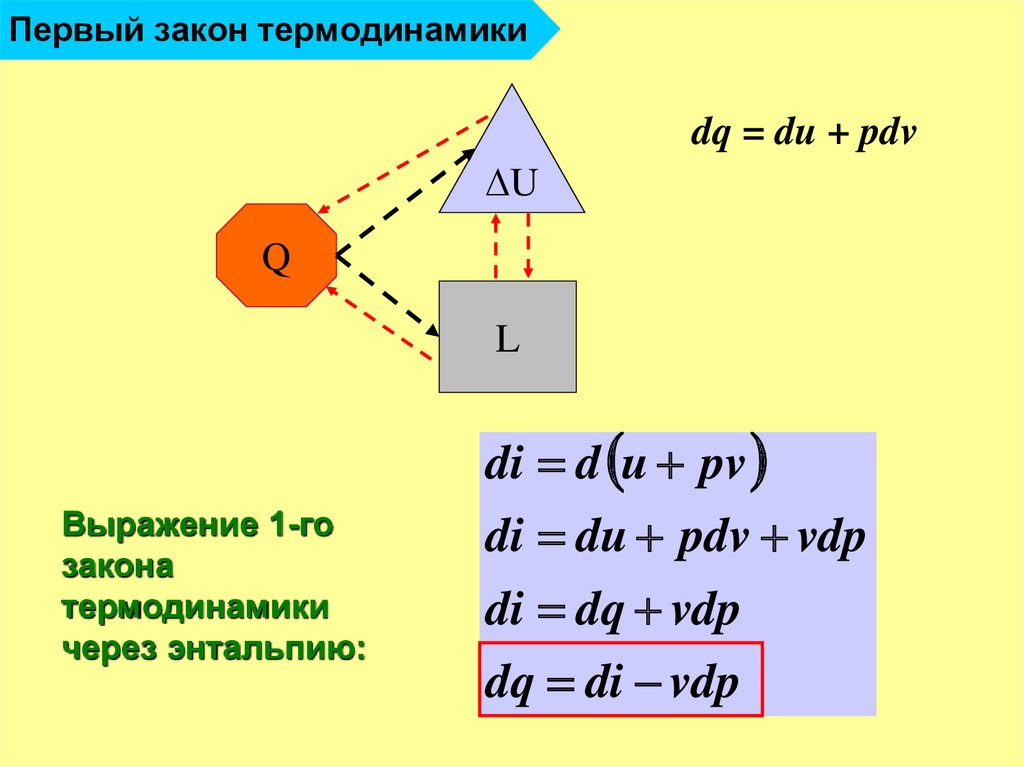
22. Первый закон термодинамики
dq = du + pdvU
Q
L
di d u pv
Выражение 1-го
закона
термодинамики
через энтальпию:
di du pdv vdp
di dq vdp
dq di vdp















 physics
physics








