Similar presentations:
Применение первого начала термодинамики к изо-процессам. Лекция 4
1.
Казахский агротехнический университет им. С.СейфуллинаЛекция 4
Применение первого начала
термодинамики к изопроцессам
И.о. профессора Абельдина Жайдары Калтаевна
2.
Энтальпия газаЭнтальпия газа h, (Дж/кг) равна
сумме внутренней энергии газа и
произведения давления на объем.
h U PV
Физический смысл величины PV
понятен – это потенциальная энергия
сжатого газа.
3.
Энтальпия, как и внутренняя энергия,является функцией состояния; ее изменение (ΔН)
определяется только начальными и конечными
состояниями системы и не зависит от пути
перехода.
Нетрудно видеть, что теплота реакции в
изохорно - изотермическом процессе (V=const;
T=const), при котором ΔV = 0, равна изменению
внутренней энергии системы:
QV = ΔU
4.
Энтропия газаНе всегда количество подведенной
энергии можно определить через изменение
температуры тела. Например, вода кипит, а ее
температура остается постоянной. В
выражении первого закона термодинамики:
Q dU PdV
выражение ∂Q не является полным
дифференциалом, поскольку неизвестна
зависимость изменения P от температуры Т.
5.
Энтропия газаdQ
Обозначив dS
после сокращения на
T
Т получим:
cV dT
dV
dS
R
T
V
Энтропия – есть теплота, отнесенная к
температуре Т тела. Изменение энтропии ΔS
будет равно: ΔS = S2 – S1, отсюда подведенная
теплота равна:
Q S T
6.
Закон сохранения энергииЭнергия в природе не
возникает из ничего и не
исчезает: количество энергии
неизменно, она только
переходит из одной формы в
другую.
7.
Закон сохранения и превращенияэнергии, распространяемый на тепловые
явления, носит название первого закона
термодинамики.
Изменение внутренней энергии системы
при переходе ее из одного состояния в другое
равно сумме работы внешних сил и
количества теплоты, переданного системе:
ΔU=A+Q
8.
Применение первого начала термодинамикик изохорическому процессу
Q dU ,
A 0,
V const
В изохорном процессе (V = const) газ работы
не совершает, A = 0. Следовательно,
Q = ΔU = U2– U1
Здесь U1 и U2 – внутренние энергии газа в
начальном и конечном состояниях. Внутренняя
энергия идеального газа зависит только от
температуры (закон Джоуля).
9.
При изохорномнагревании тепло
поглощается газом (Q >
0), и его внутренняя
энергия увеличивается.
При охлаждении
тепло отдается внешним
телам (Q < 0).
10.
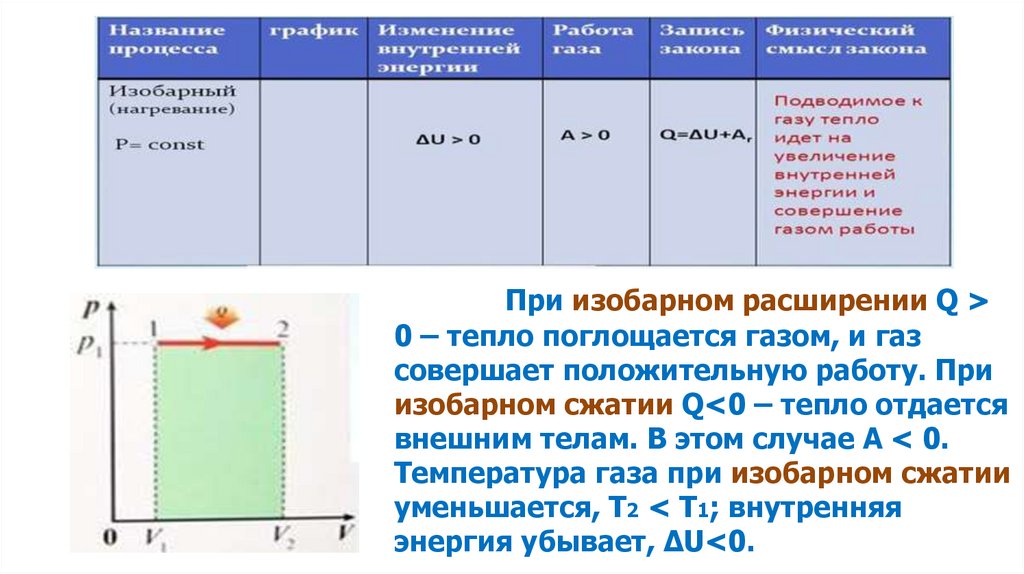
Применение первого началатермодинамики к изобарному процессу
Q dU A,
P const
В изобарном процессе (P=const) работа,
совершаемая газом, выражается соотношением
A = P (V2 – V1) = P ΔV.
Первый закон термодинамики для изобарного
процесса дает:
Q = U2 – U1+P(V2 – V1) = ΔU+PΔV.
11.
При изобарном расширении Q >0 – тепло поглощается газом, и газ
совершает положительную работу. При
изобарном сжатии Q<0 – тепло отдается
внешним телам. В этом случае A < 0.
Температура газа при изобарном сжатии
уменьшается, T2 < T1; внутренняя
энергия убывает, ΔU<0.
12.
Применение первого начала термодинамики кизотермическому процессу
Q A,
dU 0,
T const
В изотермическом процессе температура газа не
изменяется, следовательно, не изменяется и
внутренняя энергия газа, ΔU=0.
Первый закон термодинамики для
изотермического процесса выражается
соотношением
Q = A.
13.
Количество теплоты Q,полученное газом в процессе
изотермического расширения,
превращается в работу над внешними
телами. При изотермическом сжатии
работа внешних сил, произведенная над
газом, превращается в тепло, которое
передается окружающим телам.
14.
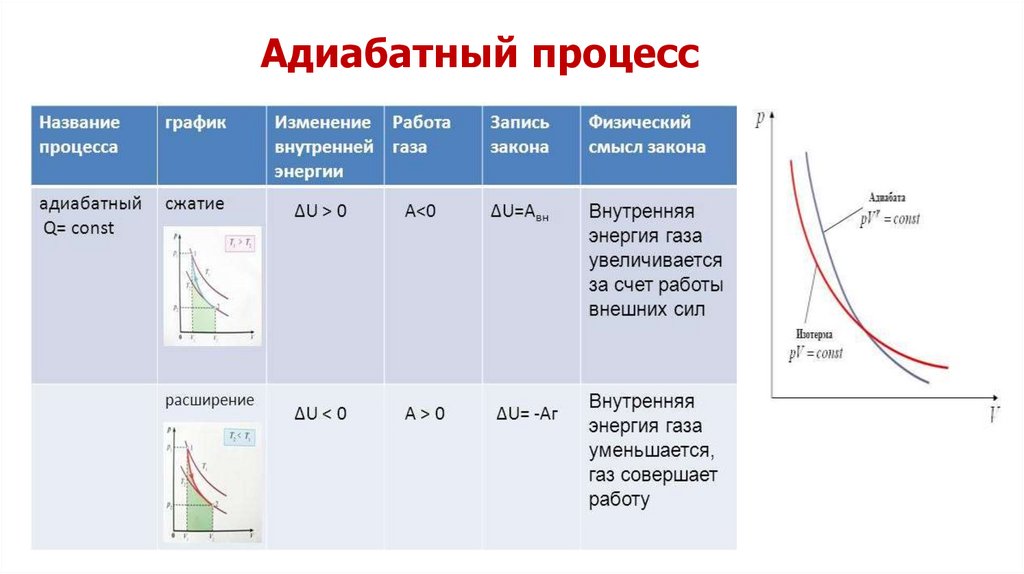
Применение первого начала термодинамикик адиабатному процессу
Q 0,
dU A 0
В адиабатическом процессе Q = 0; поэтому первый
закон термодинамики принимает вид A = –ΔU, т. е. газ
совершает работу за счет убыли его внутренней
энергии.
В термодинамике выводится уравнение адиабатного
процесса для идеального газа. В координатах (p, V) это
уравнение имеет вид
PV const
Это соотношение называют уравнением Пуассона.
15.
При адиабатическом расширении газ совершаетположительную работу (A>0); поэтому его внутренняя
энергия уменьшается (ΔU<0). Это приводит к
понижению температуры газа.
Вследствие этого давление газа при
адиабатическом расширении убывает быстрее, чем
при изотермическом.
Работа газа в адиабатическом процессе просто
выражается через температуры T1 и T2 начального и
конечного состояний:
A = CV (T2 – T1).
Поскольку на любом участке адиабатического
процесса ΔQ = 0, энтропия в этом процессе остается
неизменной.
16.
Адиабатный процесс17.
КалориметрияКалориметрия (лат. calor тепло и metro измеряю )
совокупность методов измерения количества теплоты,
выделяющейся или поглощаемой при протекании различных
физических, химических или биологических процессов.
Методы калориметрии применяют при определении
теплоемкости, тепловых эффектов химических реакций,
процессов растворения, теплотворной способности топлива, а
также тепловых эффектов, сопровождающих процессы
жизнедеятельности
Прибор, используемый для калориметрических измерений,
называется калориметром.
Прибор для определения теплотворной способности
(теплоты сгорания) топлива называется калориметрической
бомбой
18.
19.
20.
При изотермическом расширенииидеальным газом совершена работа 15
кДж.
Какое количество теплоты
сообщено газу?
21.
При изотермическом расширенииидеальным газом совершена работа 15
кДж.
Какое количество теплоты
сообщено газу?
Ответ: Q = A =15 кДж.
22.
В закрытом баллоне находитсягаз. При охлаждении его внутренняя
энергия уменьшилась на 500 Дж.
Какое количество теплоты отдал
газ? Совершил ли он работу?
23.
В закрытом баллоне находитсягаз. При охлаждении его внутренняя
энергия уменьшилась на 500 Дж.
Какое количество теплоты отдал
газ? Совершил ли он работу?
Ответ: Q = ΔU =500 Дж, А=0





















 physics
physics








