Similar presentations:
Второй закон термодинамики. Условия термодинамического равновесия
1.
Лекция 5Второй закон термодинамики.
Условия термодинамического равновесия.
Фундаментальное уравнение
Уравнения Гиббса-Дюгема.
2.
Лекция 4Закон Кирхгоффа. Использование теплоемкостей
для расчетов изменения энергии и энтальпии реакций.
Возможности расчёта энтальпий химических реакций
методами квантовой химии.
Второй закон термодинамики.
3.
Ответы в чате:Ответ в чате должен содержать НОМЕР группы!
Должен выглядеть так:
«Фамилия» (пробел) Номер группы (пробел) Цифра (ответ)
Например:
Иванов 400 3
4.
Какой реакции соответствует энтальпия Н 0f ,298 K ( AlОF2 , газ )1) Al( тв ) F2 O e AlOF2 ( газ )
1 балл
2
2) Al( тв ) 2 F O e AlOF ( газ )
2
3) Al( газ ) F2 O e AlОF ( газ )
1
4) Al( газ ) F2 O2 e AlОF2 ( газ )
2
1
5) Al( тв ) F2 O2 e AlОF2 ( газ )
2
5.
Какой реакции соответствует энтальпия Н 0f ,932 K ( AlОF2 , газ )и Н 0f ,935 K ( AlОF2 , газ )
1
T 932 K : Al (тв.) F2 ( газ ) O2 ( газ ) e ( газ ) AlOF2 ( газ )
2
1
T 935 K : Al ( жид.) F2 ( газ ) O2 ( газ ) e ( газ ) AlOF2 ( газ )
2
6.
Энтальпия химической реакции , Н T02 балл
1) Соответствует реакции, протекающей при постоянной
температуре T;
2) Растет с увеличением температуры Т;
3) Если реакция проходит при постоянном внешнем давлении равна теплоте реакции;
4) Только при постоянном внешнем давлении не зависит от
способа проведения реакции.
5) Равна ∆U + ∆nRT, где ∆n – разница числа молей
продуктов и реагентов.
Какие из этих утверждений – правильные ?
7.
Связь ∆Н и ∆U химической реакции.H U pV U ( pV ) Прод. ( pV ) Реаг .
Для идеальных газов: pV = nRT
Для твердых и жидких: pV ≈0
H U pV U n RT
∆n = n (продукты, газы) - n (реагенты газы)
8.
ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ С6060 C( тв ) С60,( тв )
(I )
60 C( тв ) 60O2 60СO2 ( II ); Лит.
C60,( тв ) 60O2 60СO2
( III ); QV ( III ) U ( III )
H ( III ) U ( III ) (m n) RT ( pV )C60 ,тв U ( III )
H ( III ) U ( III ) QV ( III ) 25944 кДж / моль
H 298 K ( I ) H 298 K ( II ) H 298 K ( III )
H
0
f ,298 K
( I ) 2334 кДж / моль
( pV )C60, тв 122 Дж / моль
9.
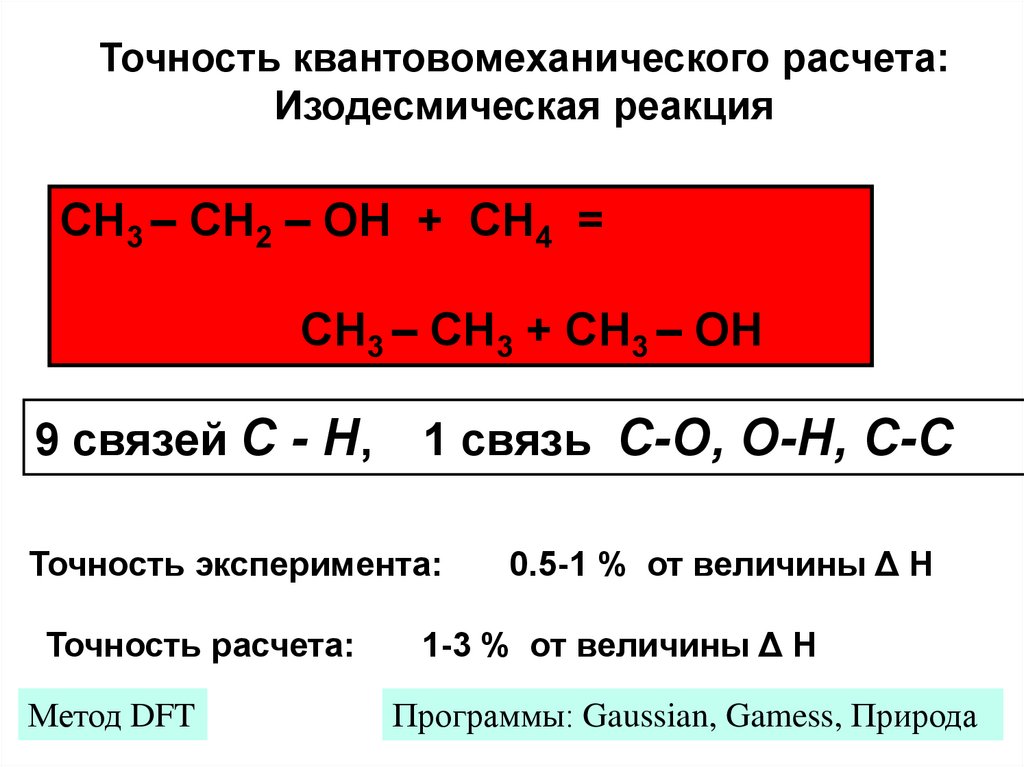
Точность квантовомеханического расчета:Изодесмическая реакция
СН3 – СН2 – ОН + СН4 =
СН3 – СН3 + СН3 – ОН
9 связей C - H,
1 связь C-O, O-H, C-C
Точность эксперимента:
Точность расчета:
Метод DFT
0.5-1 % от величины Δ Н
1-3 % от величины Δ Н
Программы: Gaussian, Gamess, Природа
10.
1 баллДля реакции
3KF(тв.) +AlF3(тв) = K3AlF6(тв)
измерили тепловой эффект QV при температуре T.
Нужно посчитать энтальпию реакции ∆HT . Какую формулу
нужно использовать для самого точного расчета?
H T QV (m n) RT
H T QV
(1)
(2)
H T QV ( pV ) (3)
11.
1 баллПростым веществом для элемента Pt служит Pt(тв). Какое из
следующих утверждений верно?
1. Энтальпия образования твердой платины при Т 298К
H f ,298 K ( Pt (тв )) 0
2. Величина С р для реакции образования твердой платины
равна нулю
3. При очень высокой температуре энтальпия образования
твердой платины H f ,Т ( Pt (тв )) отличается от нуля.
4. Величина С р для твердой платины равна нулю.
12.
1 баллМы знаем, что для реакции
3K(тв.) +Al (тв.) + 3F2(газ) = K3AlF6(тв)
величина ∆ср положительна.
Как меняется с температурой тепловой эффект реакции, Qp ?
Растет
(1)
Остается постоянной (2)
Трудно сказать (3)
Уменьшается (4)
13.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ14.
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИQ1
«Состояние 1»
«Состояние 2»
Q2
2
2
1
1
Q2 Q2 Q1 Q1
S S
Q
T
2
??
S 2 1
1
Q1
T
2
1
Q2
T
???
15.
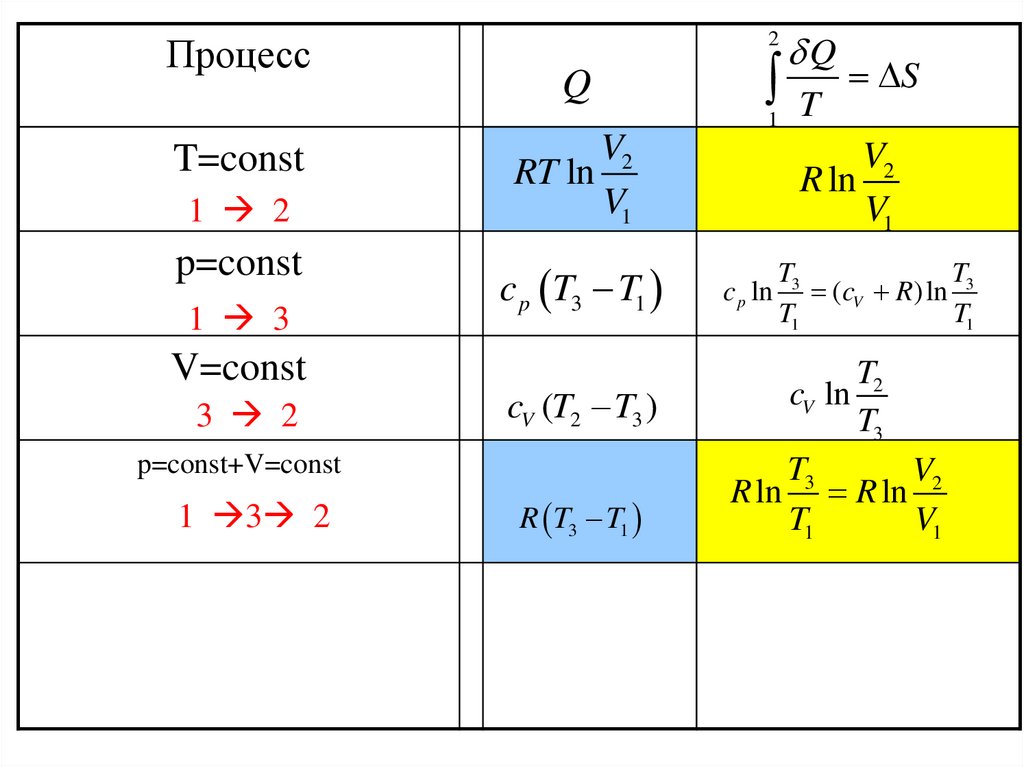
Процесс2
Q
1
T=const
1 2
p=const
1 3
V=const
3 2
V2
RT ln
V1
c p T3 T1
cV (T2 T3 )
p=const+V=const
1 3 2
R T3 T1
Q
T
S
V2
R ln
V1
c p ln
T3
T
(cV R )ln 3
T1
T1
T2
cV ln
T3
T3
V2
R ln R ln
T1
V1
16.
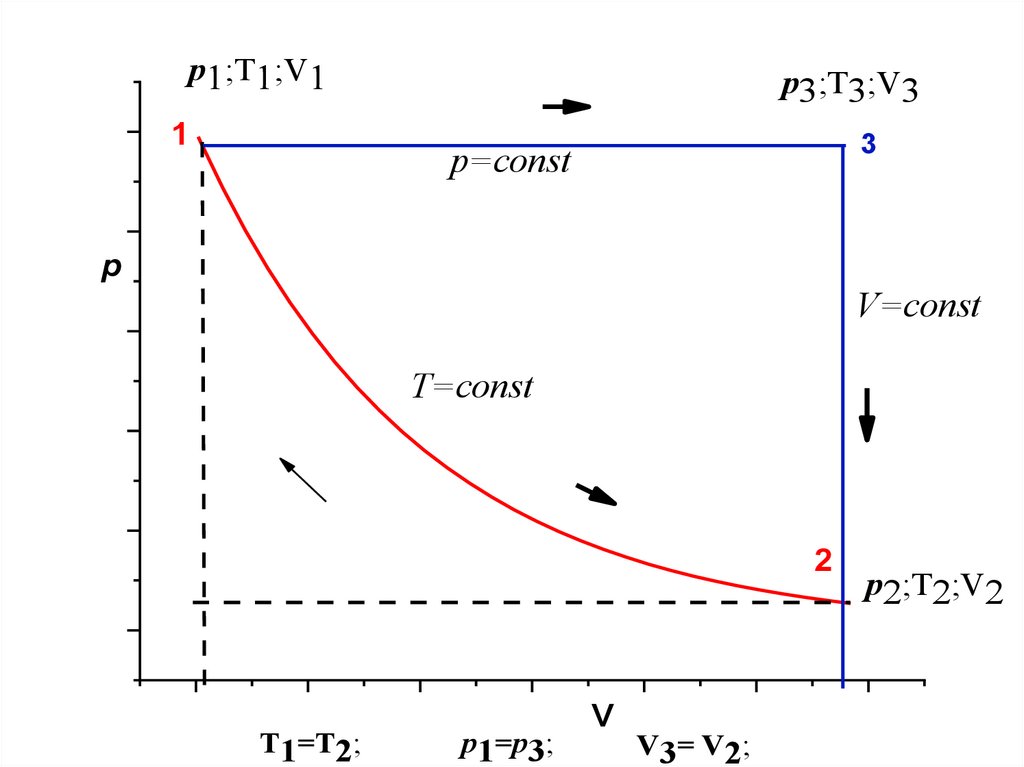
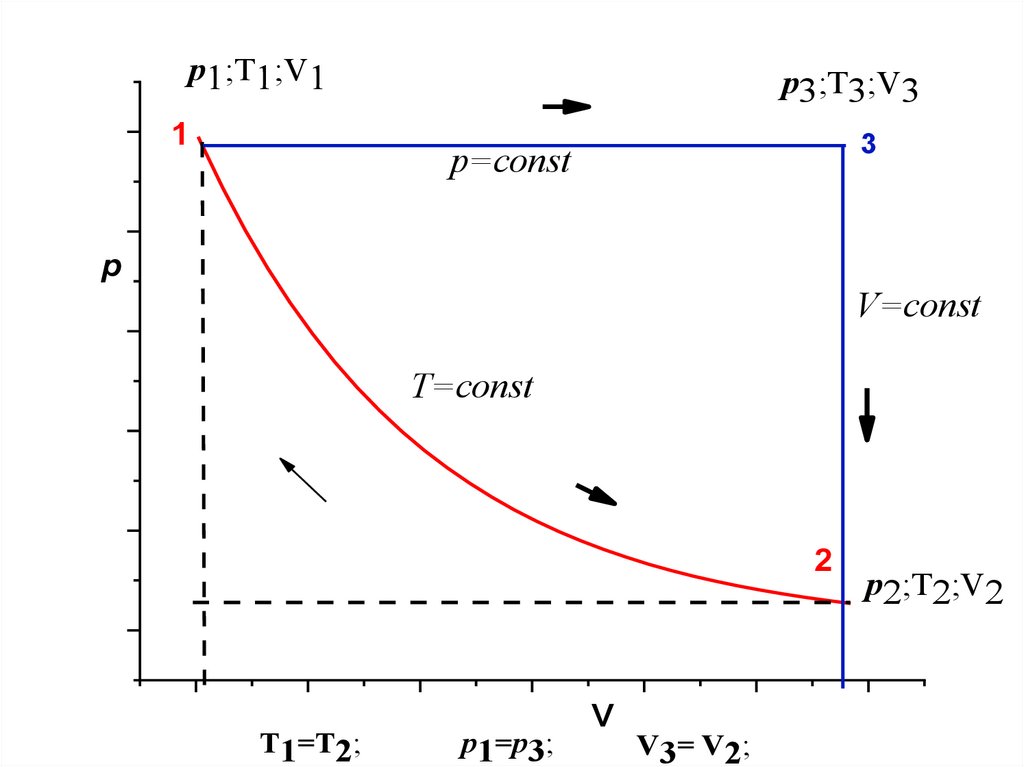
p1;T1;V11
p3;T3;V3
3
p=const
p
V=const
T=const
2
T1=T2;
p1=p3;
V
V3= V2;
p2;T2;V2
17.
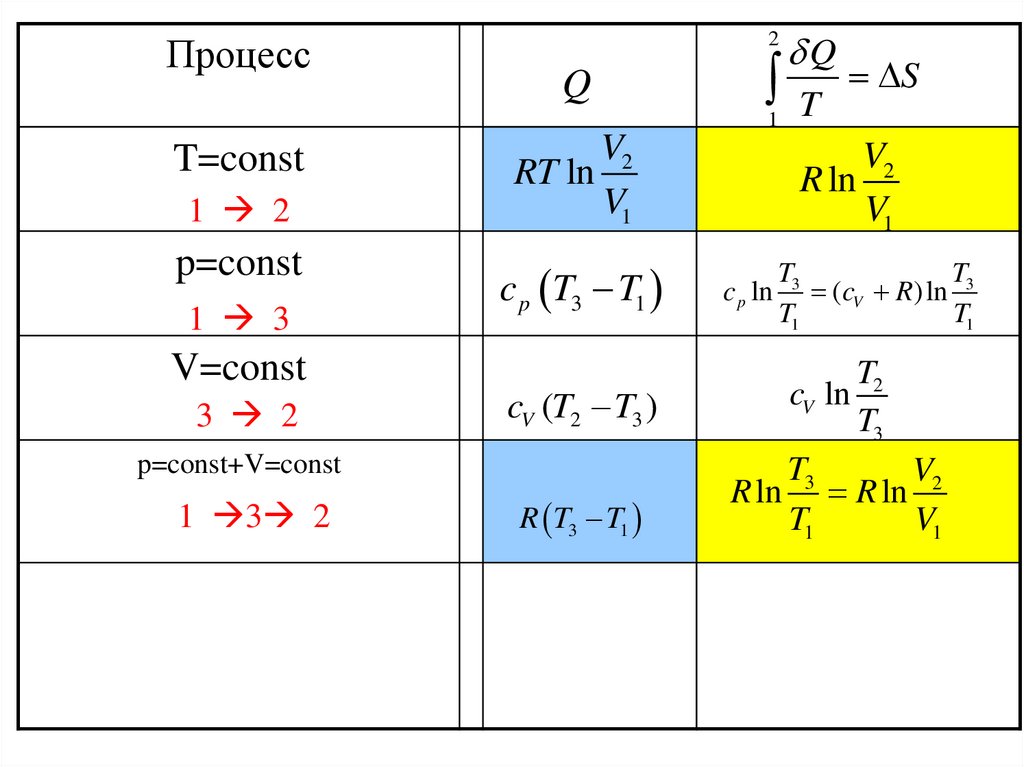
Процесс2
Q
1
T=const
1 2
p=const
1 3
V=const
3 2
V2
RT ln
V1
c p T3 T1
cV (T2 T3 )
p=const+V=const
1 3 2
R T3 T1
Q
T
S
V2
R ln
V1
c p ln
T3
T
(cV R )ln 3
T1
T1
T2
cV ln
T3
T3
V2
R ln R ln
T1
V1
18.
p1;T1;V11
p3;T3;V3
3
p=const
p
V=const
T=const
2
T1=T2;
p1=p3;
V
V3= V2;
p2;T2;V2
19.
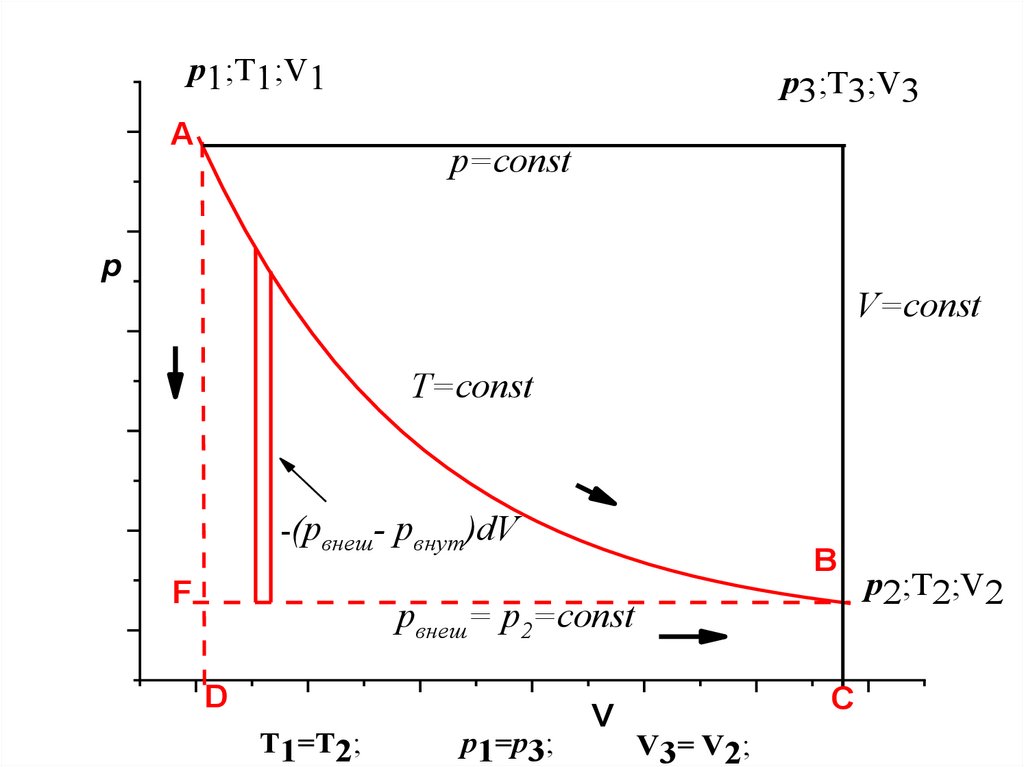
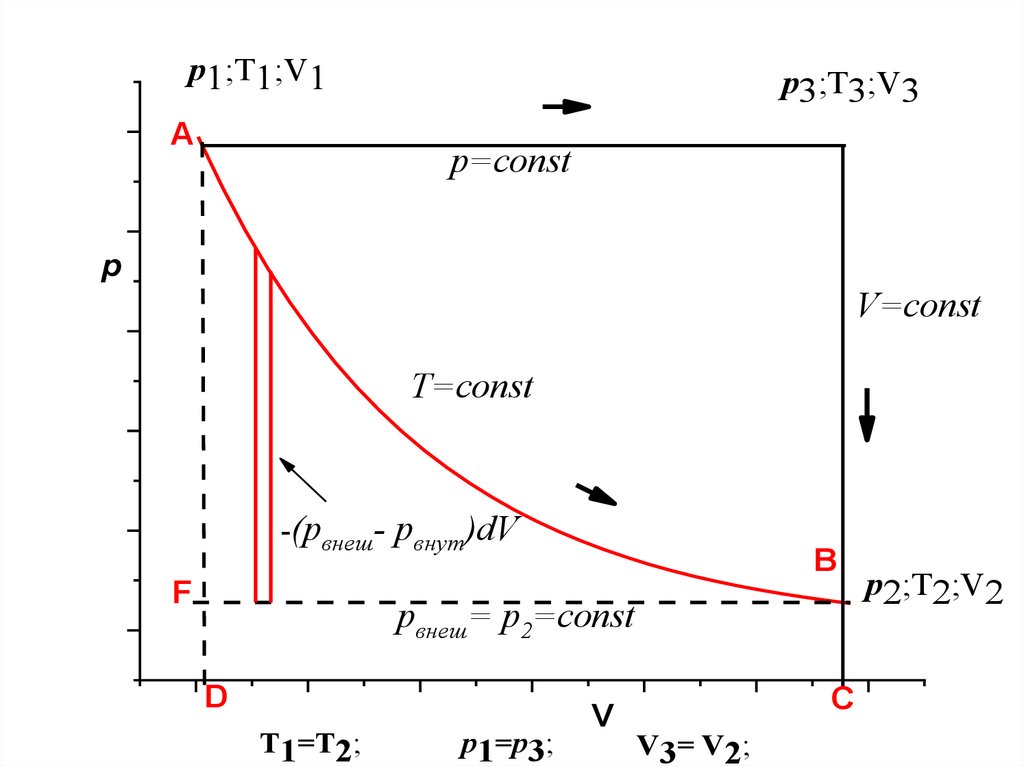
p1;T1;V1A
p3;T3;V3
p=const
p
V=const
T=const
-(pвнеш- рвнут)dV
F
B
pвнеш= p2=const
D
T1=T2;
p1=p3;
V
C
V3= V2;
p2;T2;V2
20.
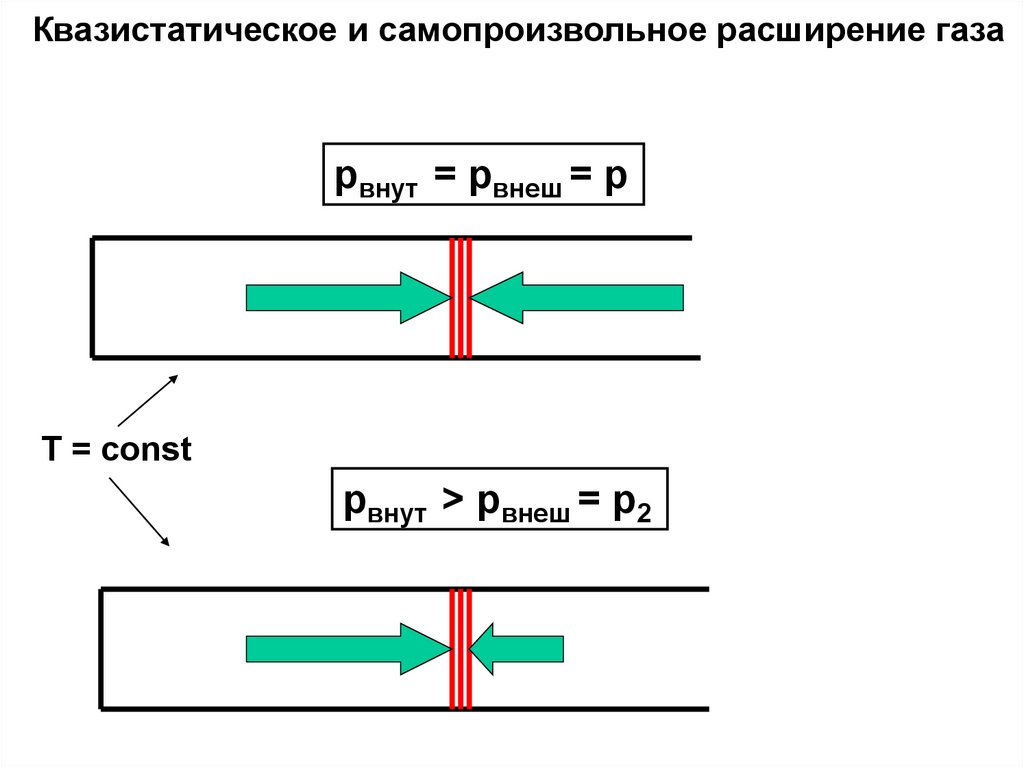
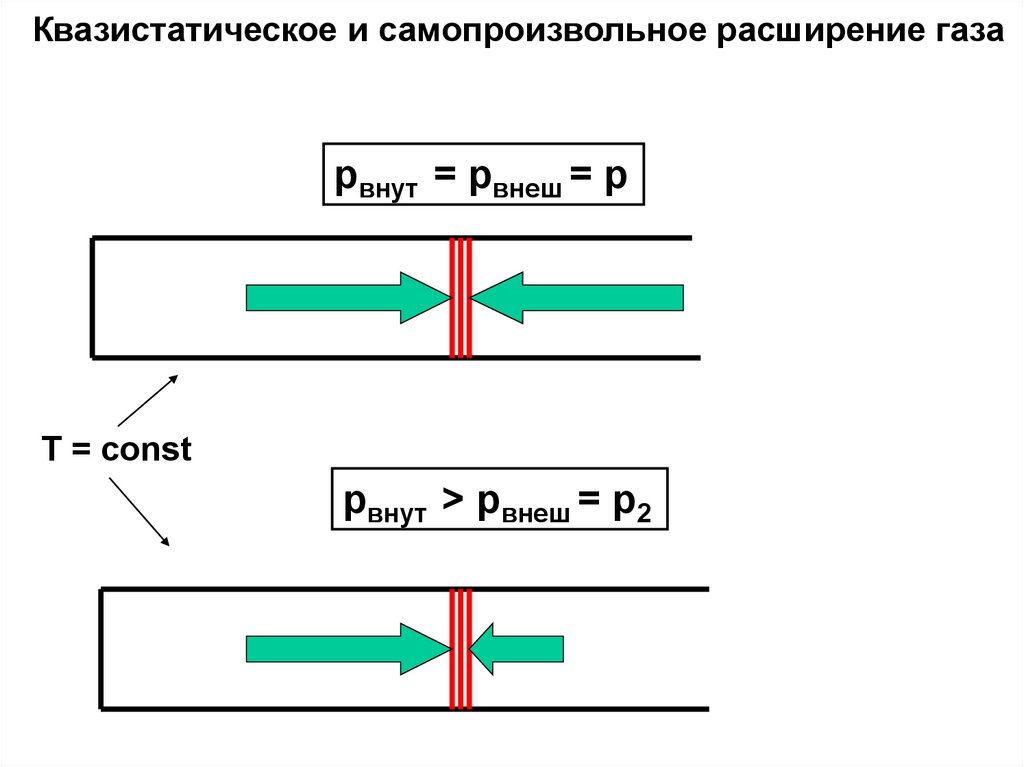
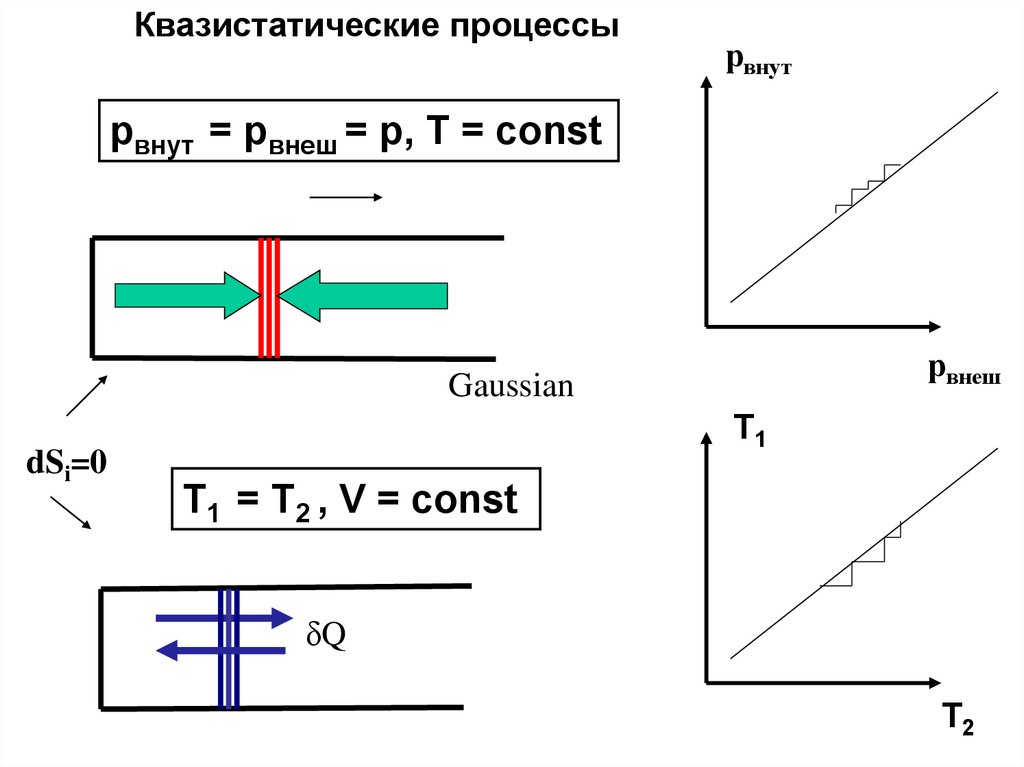
Квазистатическое и самопроизвольное расширение газаpвнут = pвнеш = p
T = const
pвнут > pвнеш = p2
21.
ИДЕАЛЬНЫЙ ГАЗНЕКВАЗИСТАТИЧЕСКИЙ, ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС.
∆U = 0 ; dU = δQ + δW ; δW =- δQ
2
V2
1
V1
δW = -pвнеш dV
W W pвнеш dV pвнеш V2 V1
W рвнеш V2 V1 ; Q рвнеш V2 V1 ; U 0
22.
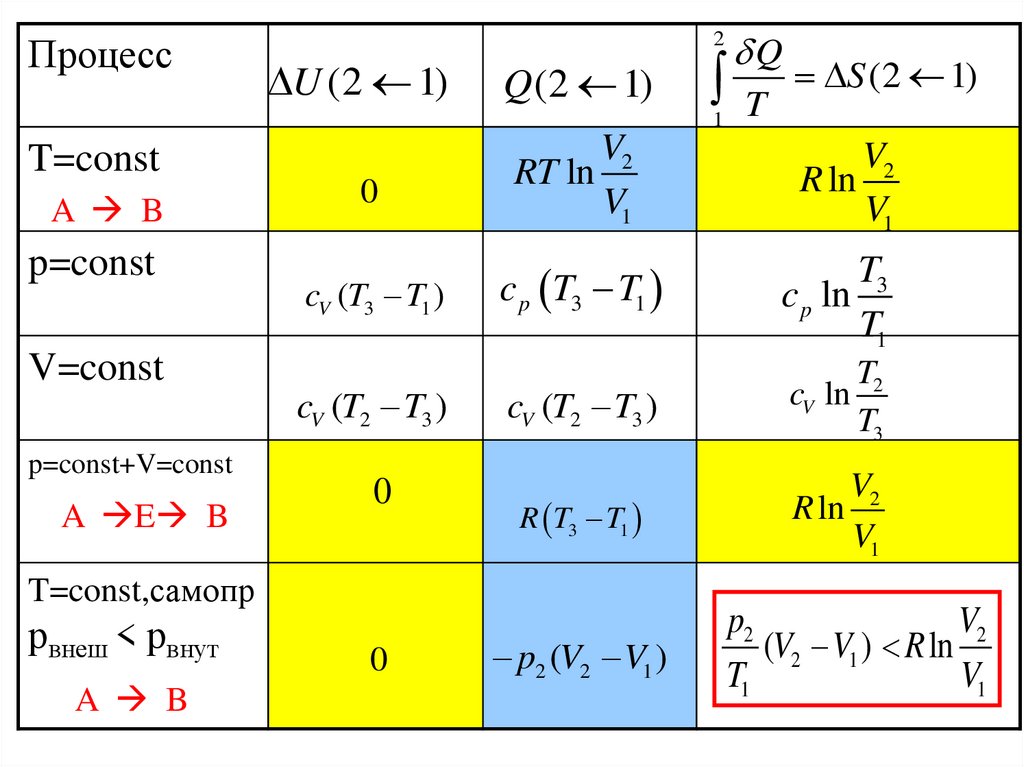
Процесс2
U (2 1)
Q (2 1)
1
T=const
A B
p=const
V=const
p=const+V=const
A E B
0
V2
RT ln
V1
cV (T3 T1 )
c p T3 T1
cV (T2 T3 )
0
A B
0
T
S (2 1)
V2
R ln
V1
T3
c p ln
T1
cV (T2 T3 )
T2
cV ln
T3
R T3 T1
V2
R ln
V1
T=const,самопр
рвнеш < рвнут
Q
p2 (V2 V1 )
p2
V2
(V2 V1 ) R ln
T1
V1
23.
p1;T1;V1A
p3;T3;V3
p=const
p
V=const
T=const
-(pвнеш- рвнут)dV
F
B
pвнеш= p2=const
D
T1=T2;
p1=p3;
V
C
V3= V2;
p2;T2;V2
24.
Квазистатическое и самопроизвольное расширение газаpвнут = pвнеш = p
T = const
pвнут > pвнеш = p2
25.
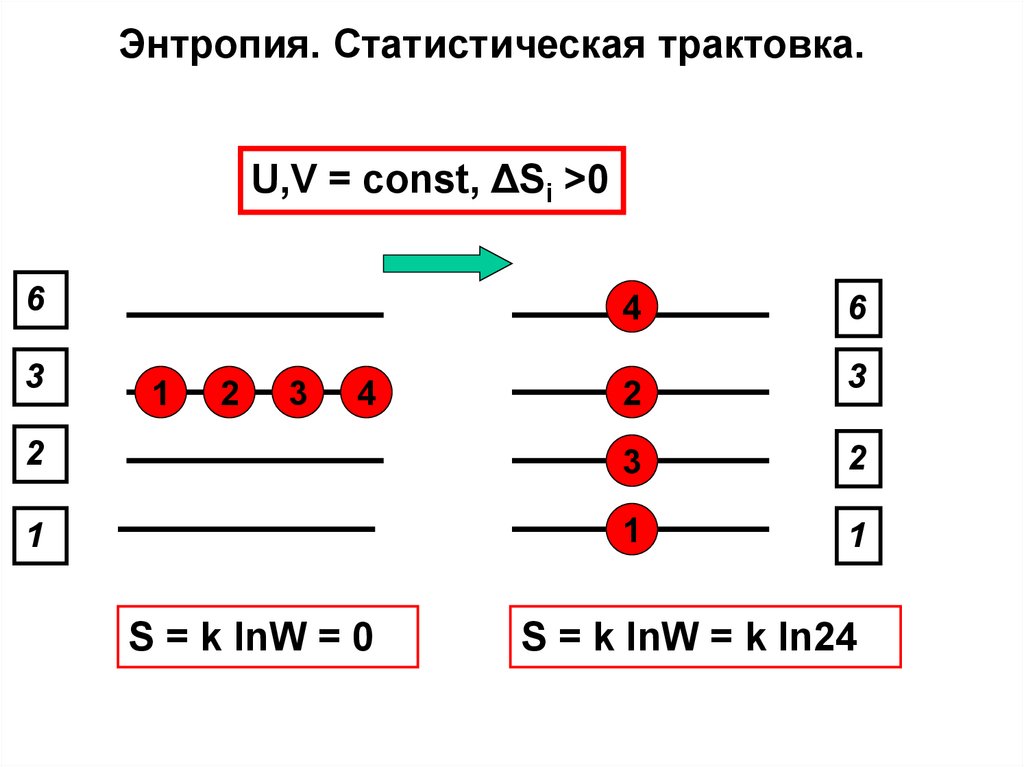
Квазистатический и самопроизвольный процесс2
1
Qквази
T
2
1
Qсамоп
T
;





















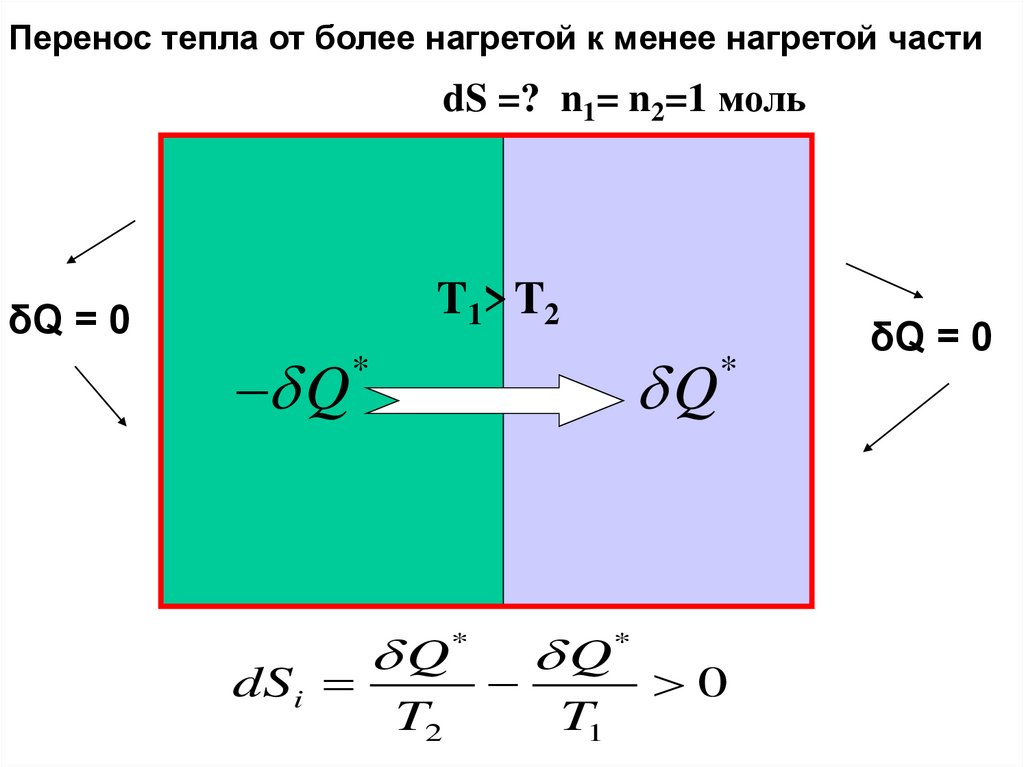

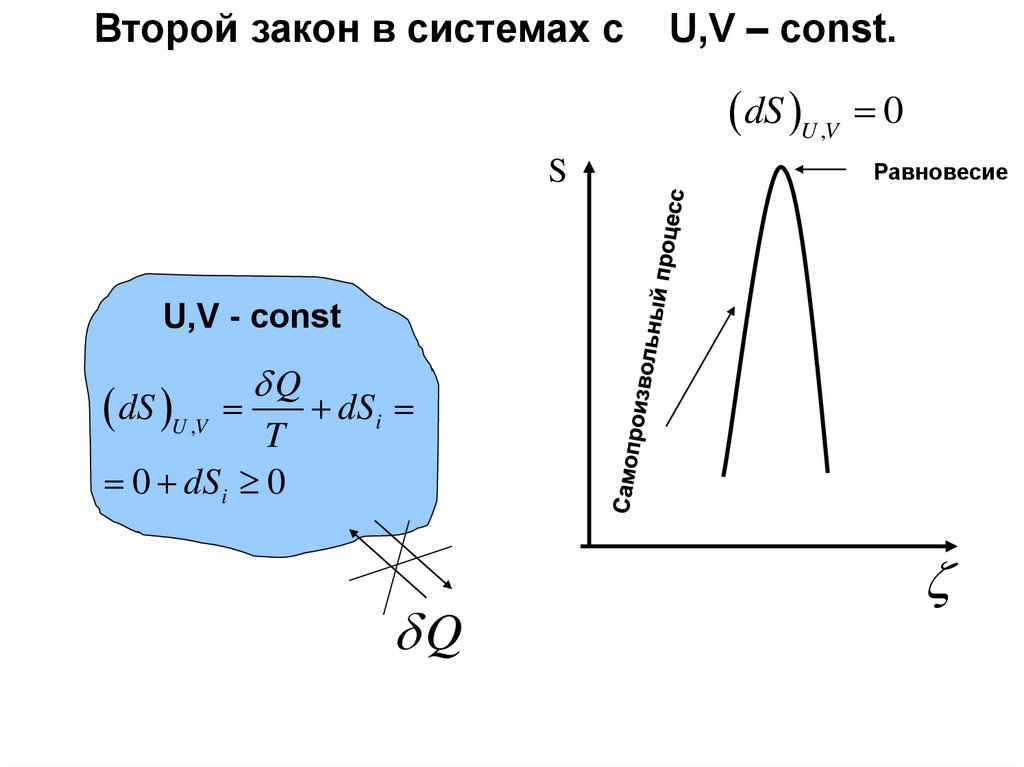
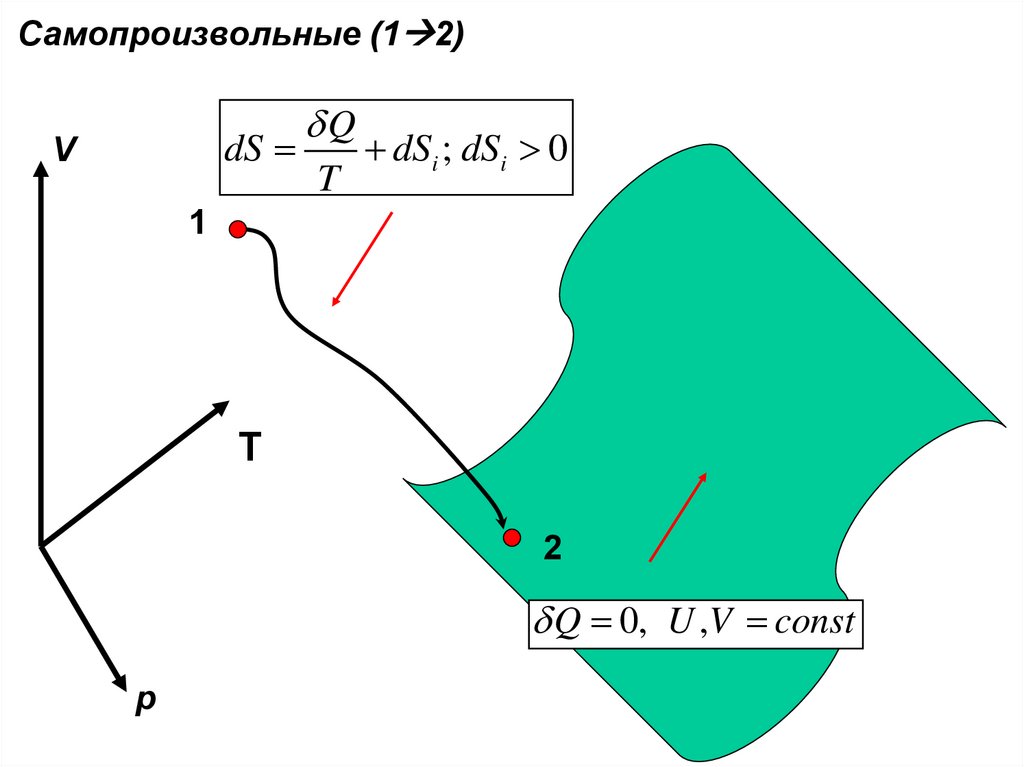

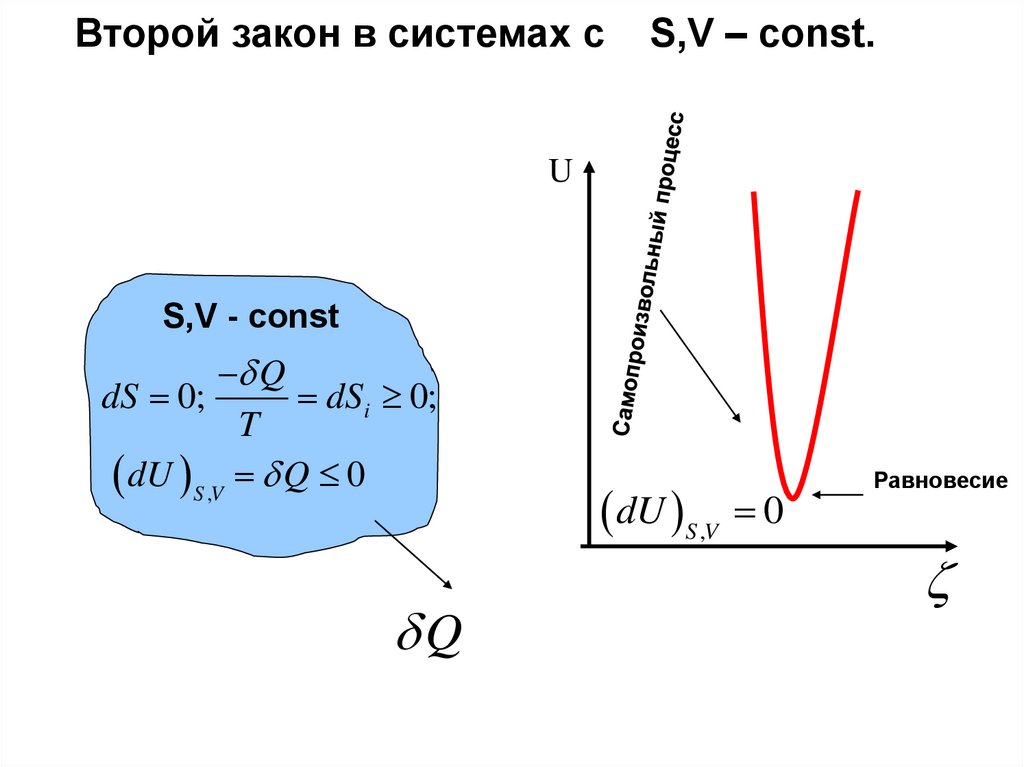
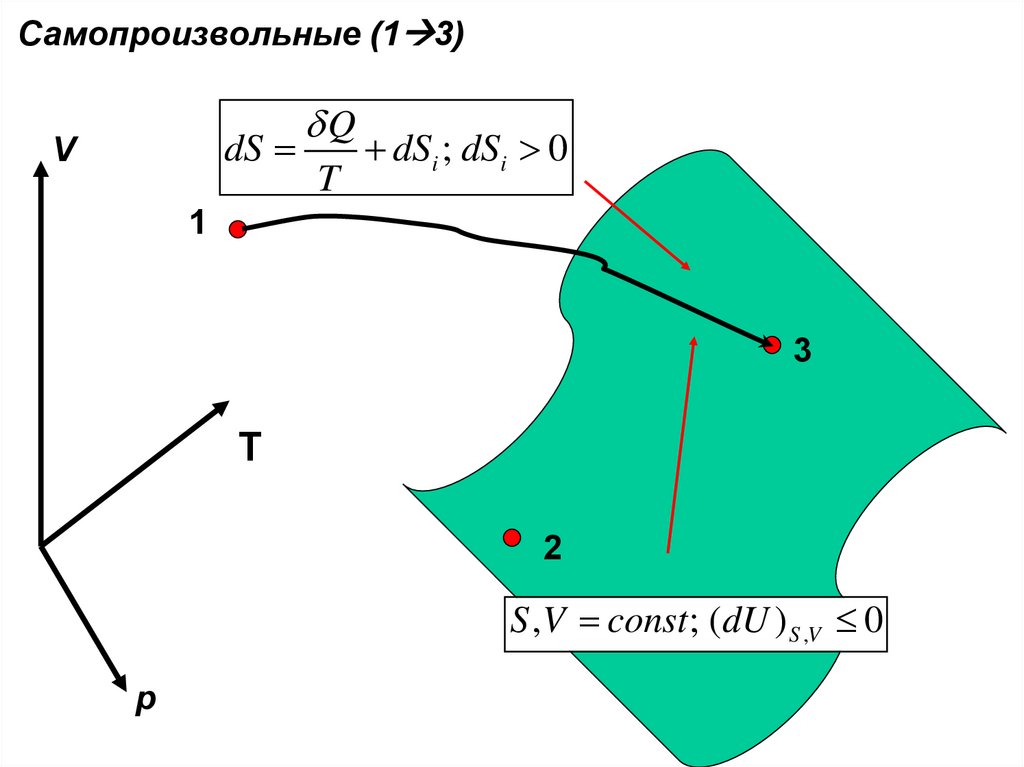
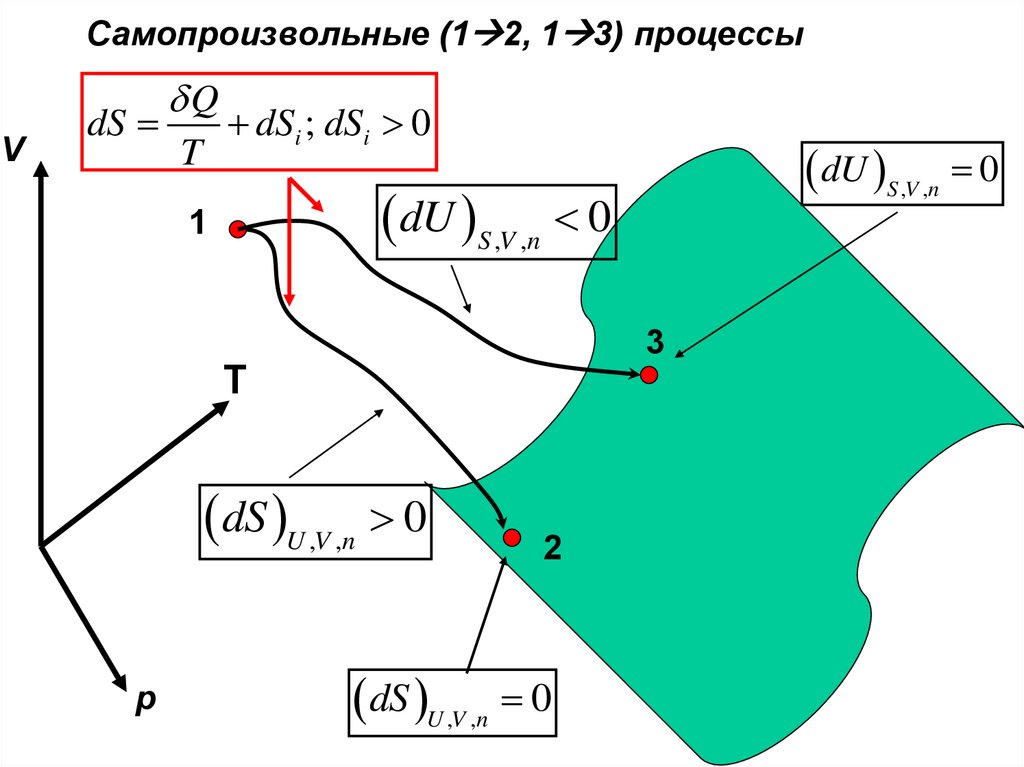


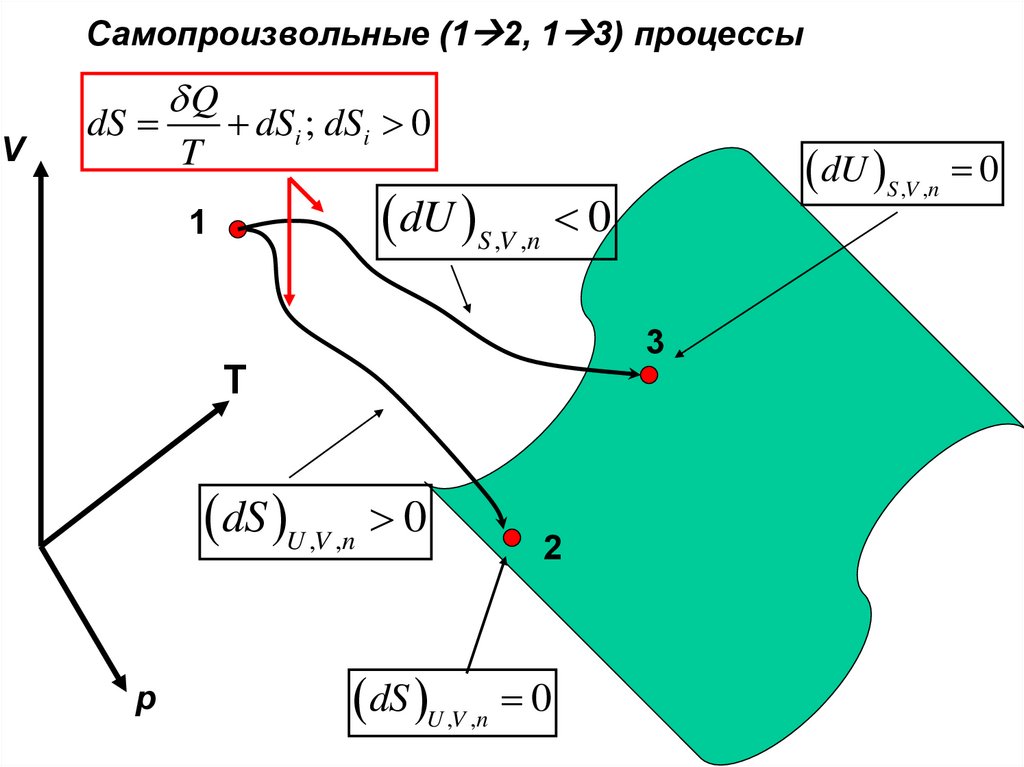
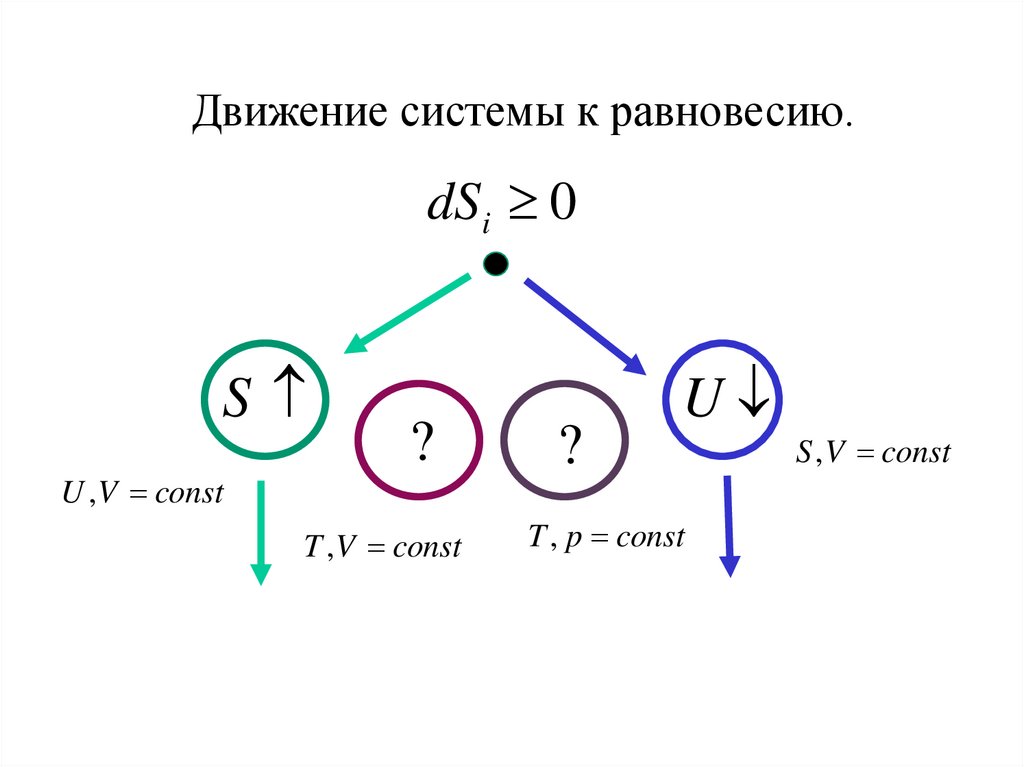
 physics
physics








