Similar presentations:
Вывод уравнения Менделеева-Клайперона. Изопроцессы
1.
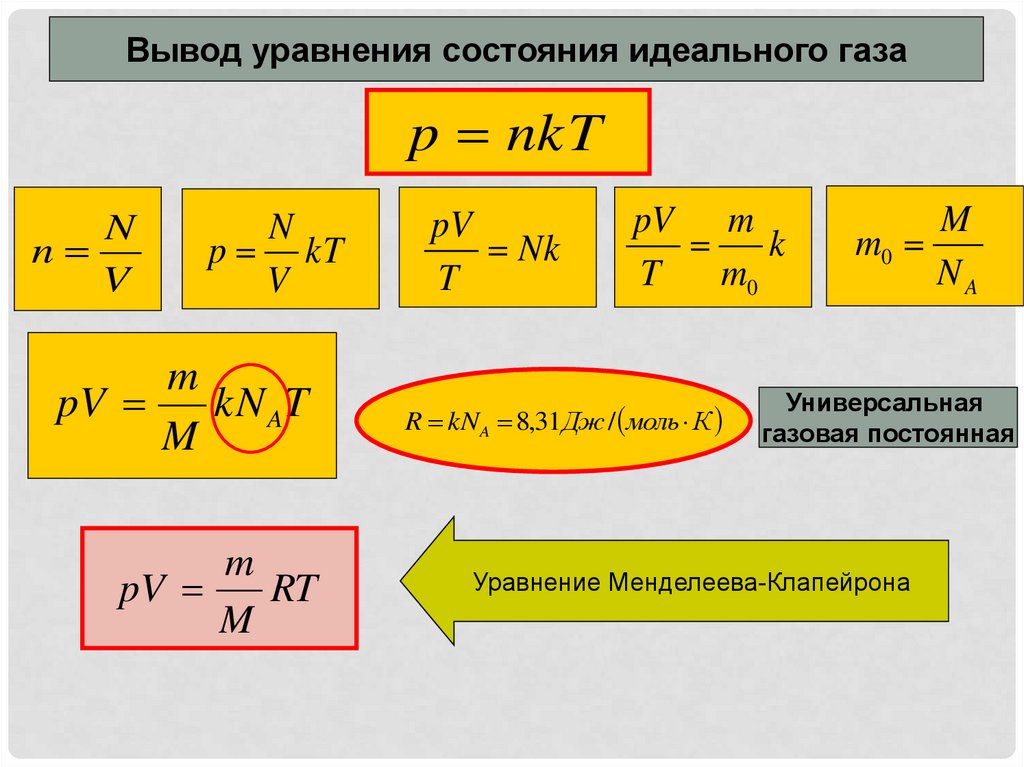
Вывод уравнения состояния идеального газаp nkT
N
n
V
N
p kT
V
m
pV
kN AT
M
m
pV
RT
M
pV
Nk
T
pV m
k
T
m0
R kNA 8,31Дж / моль К
M
m0
NA
Универсальная
газовая постоянная
Уравнение Менделеева-Клапейрона
2.
если m=const иM=const, то …
m
pV
RT
M
Если
pV
const
T
p1V1 p2V2
const
T1
T2
= const, то
Уравнение
Клапейрона
Газовый закон –
количественная
зависимость между двумя
параметрами газа при
фиксированном значении
третьего
Изопроцесс – процесс, при котором
один из макроскопических параметров
состояния данной массы газа остается
постоянным
3.
p1V1 p2V2const
T1
T2
pV const
Если T=const (не
изменяется)
Закон Бойля-Мариотта: для данной
массы газа при постоянной
Изотермический процесс
температуре произведение давления
газа на его объем есть величина
постоянная
При изотермическом процессе
плотность газа изменяется
прямо пропорционально
давлению
4.
Дыхание можно объяснить так:межреберные мышцы и
диафрагма изменяют объем
грудной клетки. При ее
расширении давление воздуха
в легких уменьшается и за счет
перепада давления происходит
вдох
Увеличение объема пузырьков
воздуха, когда они
поднимаются в воде
объясняется так: на глубине
давление жидкости больше,
чем у поверхности воды
5.
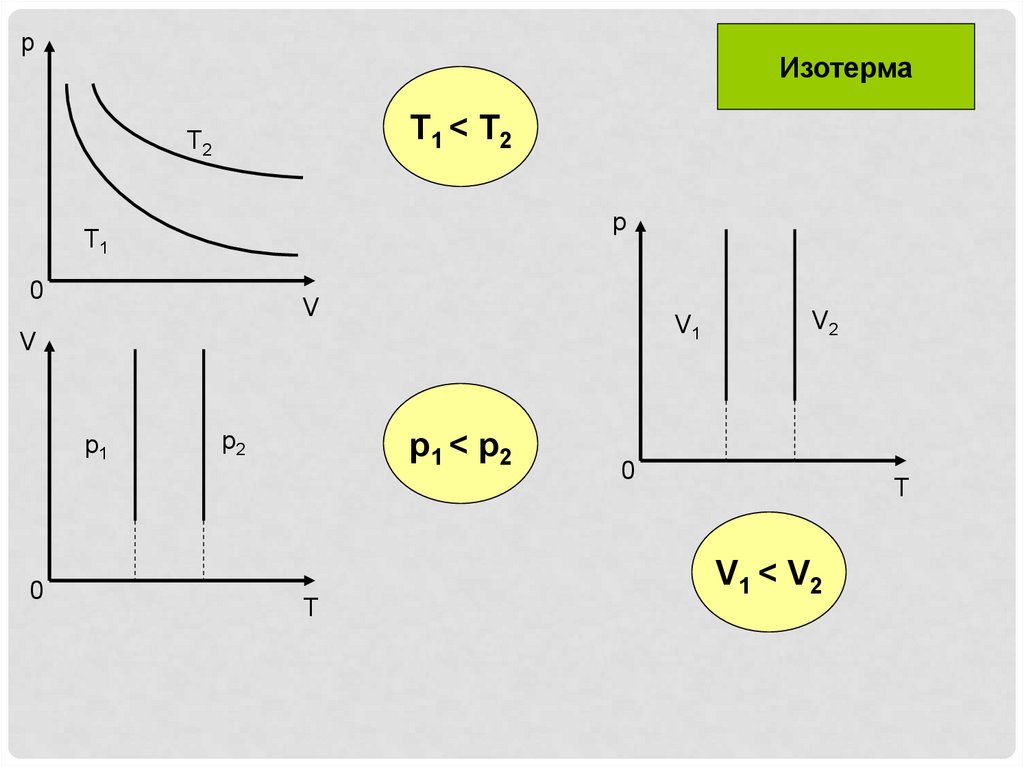
pИзотерма
T1 < T2
T2
p
T1
0
V
V1
V
p1
0
p2
p1 < p2
T
V2
0
T
V1 < V2
6.
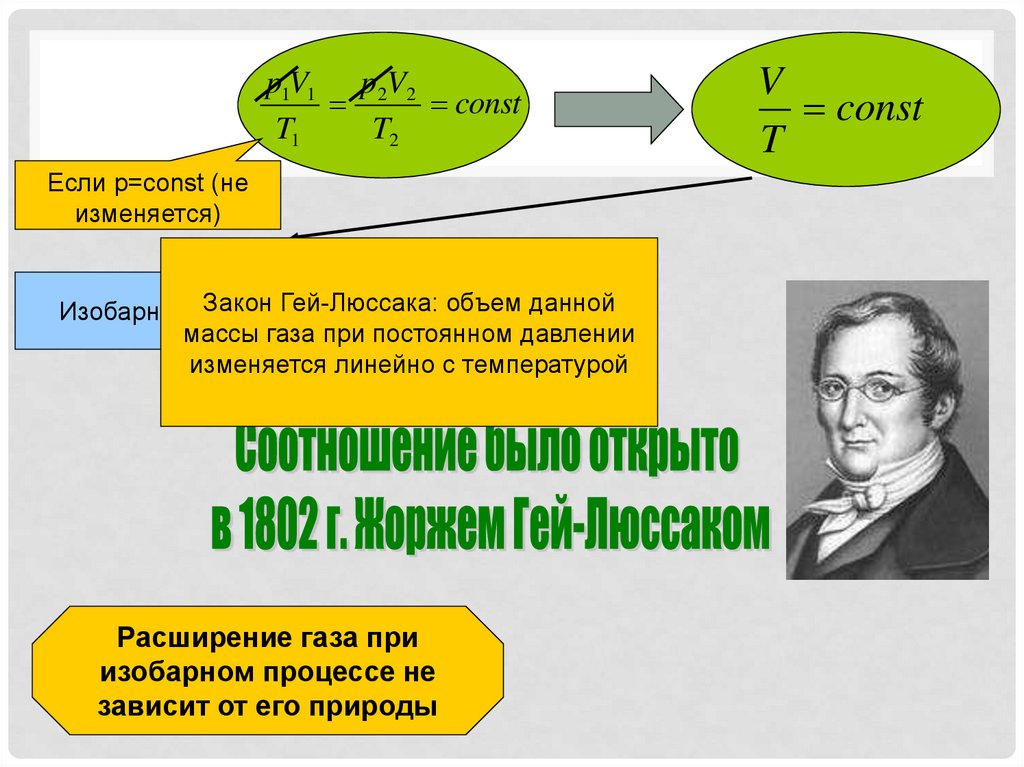
p1V1 p2V2const
T1
T2
Если p=const (не
изменяется)
Закон Гей-Люссака: объем данной
Изобарный процесс
массы газа при постоянном давлении
изменяется линейно с температурой
Расширение газа при
изобарном процессе не
зависит от его природы
V
const
T
7.
VИзобара
p1
p1 < p2
p2
p
V1
0
p
T
•В области низких температур
все изобары идеального газа
сходятся в точке Т = 0
V2
0
T
T1
T1 < T2
T2
0
V
V1 < V2
8.
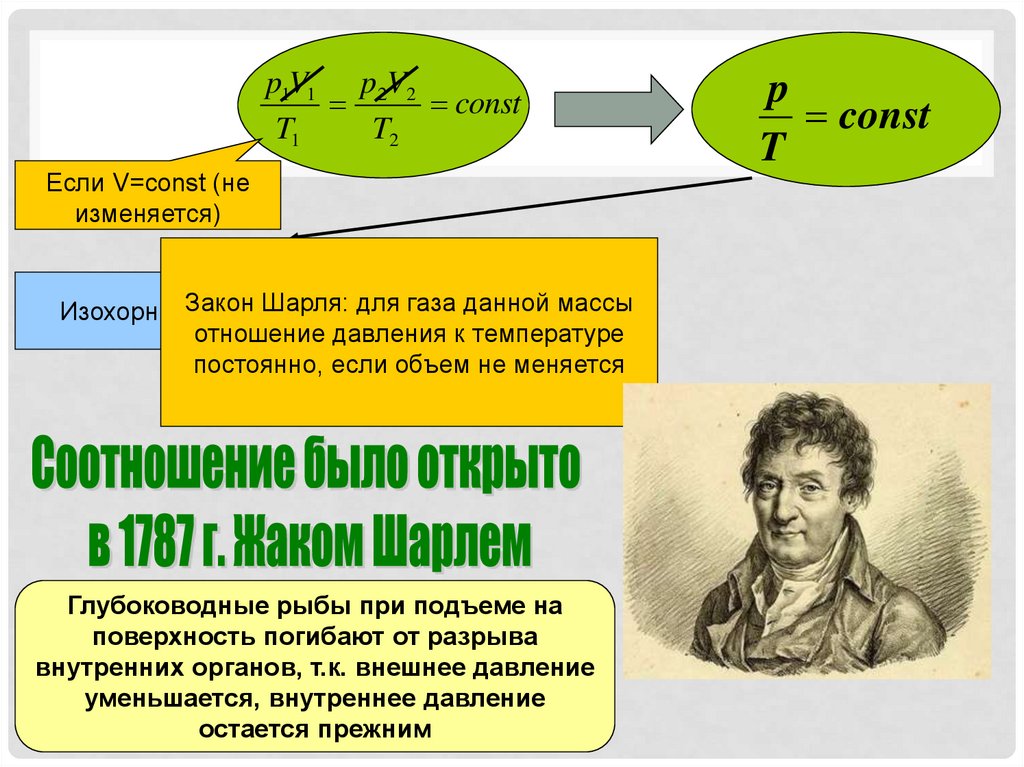
p1V1 p2V2const
T1
T2
Если V=const (не
изменяется)
Шарля: для газа данной массы
ИзохорныйЗакон
процесс
отношение давления к температуре
постоянно, если объем не меняется
Глубоководные рыбы при подъеме на
поверхность погибают от разрыва
внутренних органов, т.к. внешнее давление
уменьшается, внутреннее давление
остается прежним
p
const
T
9.
pИзохора
V1
V1 < V2
V2
V
p1
0
T
•Давление идеального газа
при абсолютном нуле равно 0
p
T1
0
T2
T1 < T2
V
p2
0
T
p1 < p2
10. Закон Дальтона
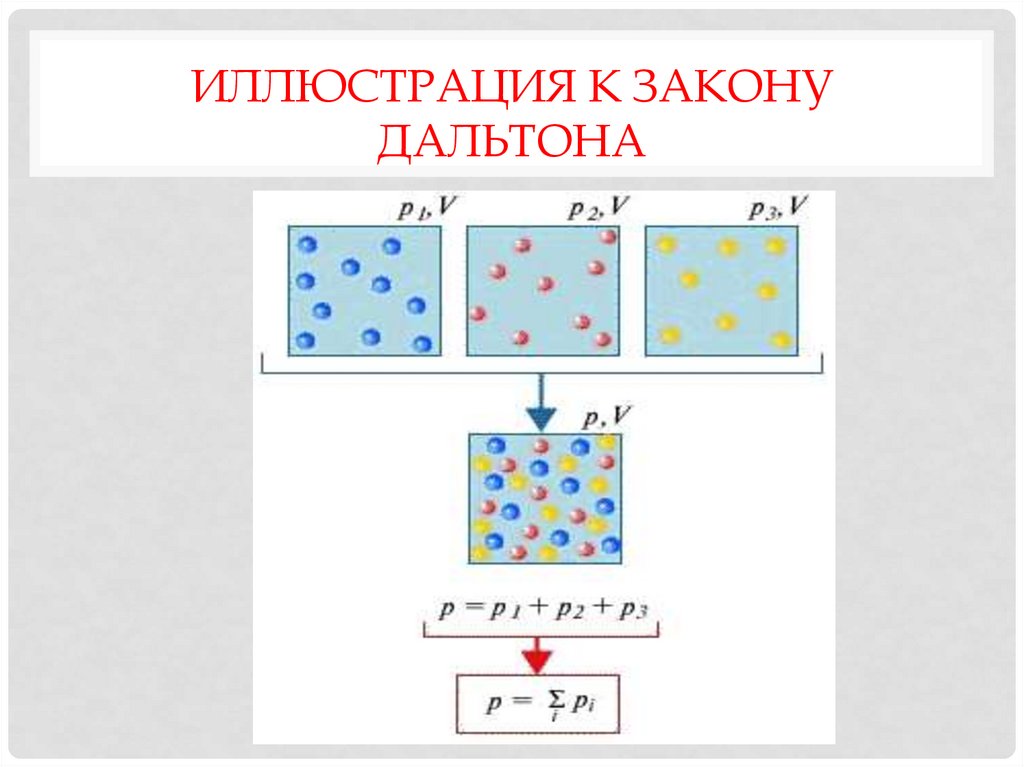
ЗАКОН ДАЛЬТОНАЕсли идеальный газ является смесью
нескольких газов, давление смеси
идеальных газов равно сумме парциальных
давлений входящих в нее газов.
Парциальное давление - это такое
давление, которое производил бы газ,
если бы он один занимал весь объем,
равный объему смеси.
11. Иллюстрация к закону Дальтона
ИЛЛЮСТРАЦИЯ К ЗАКОНУДАЛЬТОНА
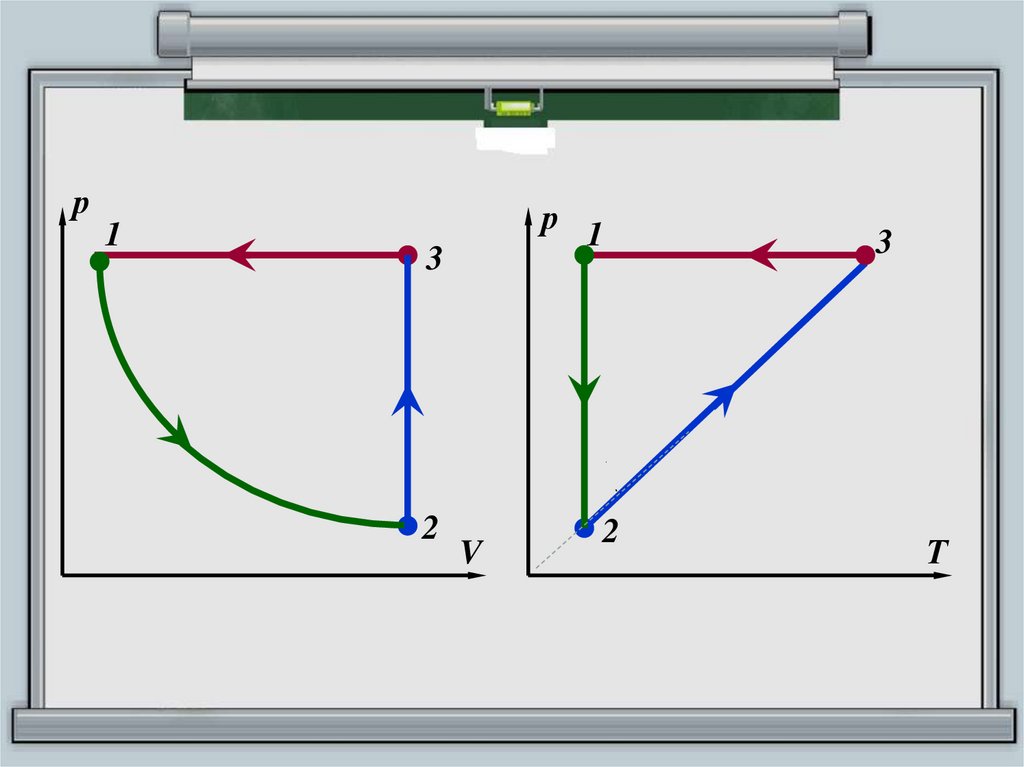
12. Построить замкнутый цикл в координатных осях рТ, TV
рПОСТРОИТЬ ЗАМКНУТЫЙ ЦИКЛ В
КООРДИНАТНЫХ ОСЯХ РТ, TV
1
3
2
V
13. Алгоритм построения
АЛГОРИТМ ПОСТРОЕНИЯ1. Определите процесс, соответствующий данному участку графика, по
виду этого участка (изотерма, изобара, изохора).
2. Запишите формулу закона.
3. Назовите процесс (например, изотермическое сжатие, изохорное
охлаждение, изобарное расширение и т. д.).
4. Укажите, какой закон выполним на данном участке графика.
5. Постройте указанный цикл в других координатных осях. (Помните, если
на исходном графике изменения состояния идеального газа цикл был
замкнут, то при построении его в других координатных осях должен тоже
получиться замкнутый цикл.)
14. Построить замкнутый цикл в координатных осях рТ, VT
ПОСТРОИТЬ ЗАМКНУТЫЙ ЦИКЛ ВКООРДИНАТНЫХ ОСЯХ РТ, VT
р
1
Участок 1 – 2: pV = const, T = const, p↓, V↑ –
изотермичекое расширение,
закон
Бойля-Мариотта
3
p
Участок 2 – 3: T = const, V = const, p↑, Т ↑–
изохорное нагревание,
закон Шарля
V
Участок 3 – 1: T = const, р = const, p↑, V↓ –
2
изобарное
охлаждение (сжатие),
V
закон Гей-Люссака
15.
р1
р 1
3
2
V
2
3
Т
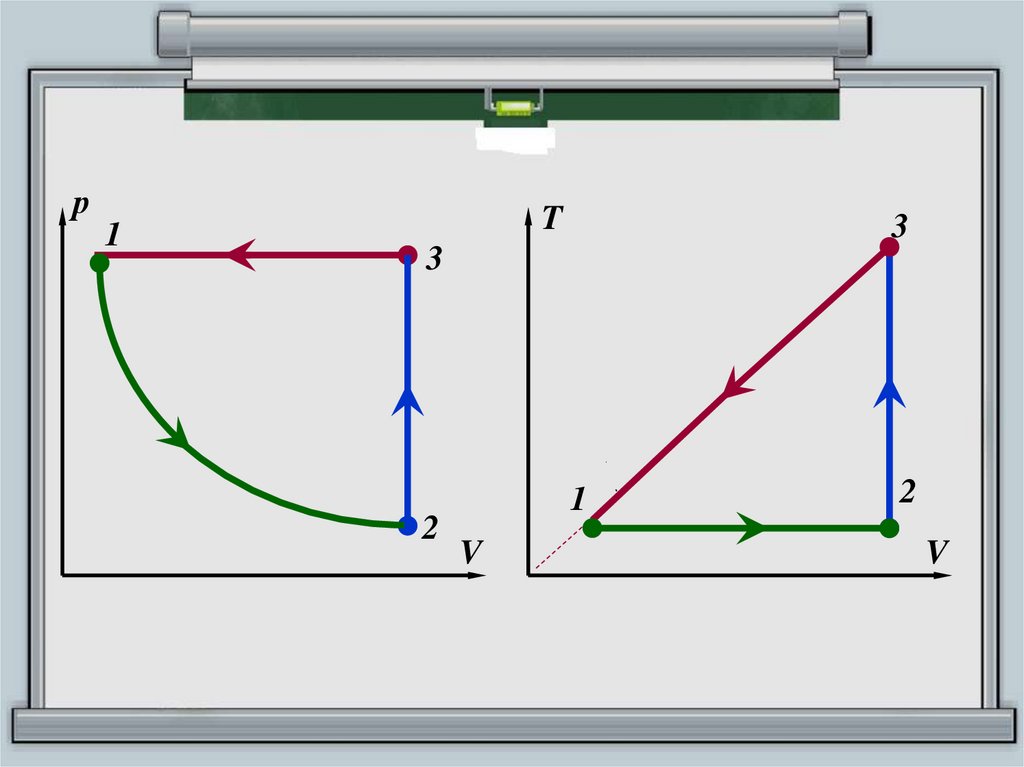
16.
р1
T
3
3
2
1
V
2
V
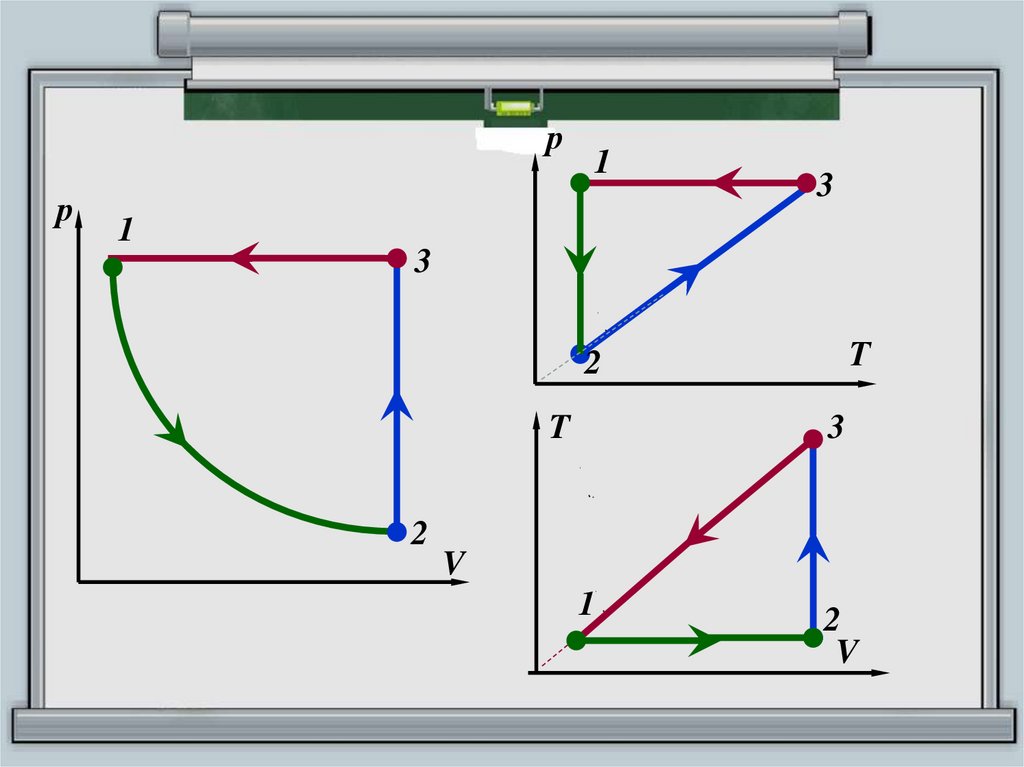
17.
рр
1
3
1
3
Т
2
T
2
3
V
1
2
V
18.
Построить замкнутый цикл вкоординатных осях рТ, VТ









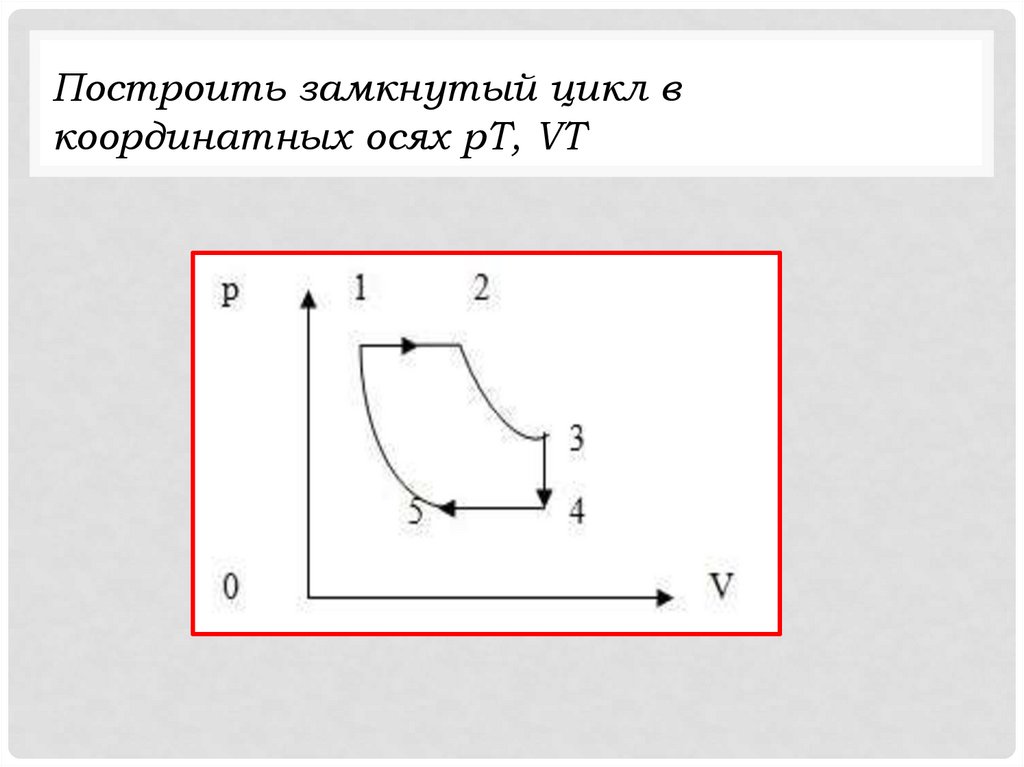
 physics
physics








