Similar presentations:
Применение дидактических игр на уроках химии
1. Методическая разработка: «Применение дидактических игр на уроках химии» (на примере урока: «Соединения углерода»)
Автор: КНЯЗЕВАЕкатерина Александровна
учитель химии
ГБОУ школа № 507
Санкт-Петербург
2.
Данный урок служит для формированияпредметных и метапредметных знаний, умений
и навыков у учащихся 9 класса в процессе игры
Участниками урока являются учащиеся 9 класса
Целью урока является усвоение учащимися
материала курса химии по теме: «Соединения
углерода»на уровне компетенции посредством
активного изучения теоретического материала,
через участие учащихся в дидактической игре
Применяемые приемы, методы и технологии:
проблемный подход в обучении, игровые
технологии.
Оснащение урока: мультимедийная презентация,
лабораторное оборудование (пробирки, вещества,
приборы для получения газообразных веществ)
раздаточный материал(опорные конспекты, памятки
для учащихся), игровое поле, игровые кубики.
3. Результат урока: сформировать у учащихся знания по теме «Соединения углерода» через активное изучение материала (в форме игры),
умнее сравнивать анализировать и делатьсоответствующие выводы, применяя в дальнейшем свои
знания на практике и в других предметных областях
Суть игры: участники каждой команды кидают
кубик с цифрами и в соответствии с этим делают
определенное количество шагов на игровом поле.
Попадая на ту или иную «станцию» учащиеся
выполняют определенное задание и только после
этого двигаются по полю дальше. За каждый
правильный, быстрый и подробный ответ
команды получают баллы.
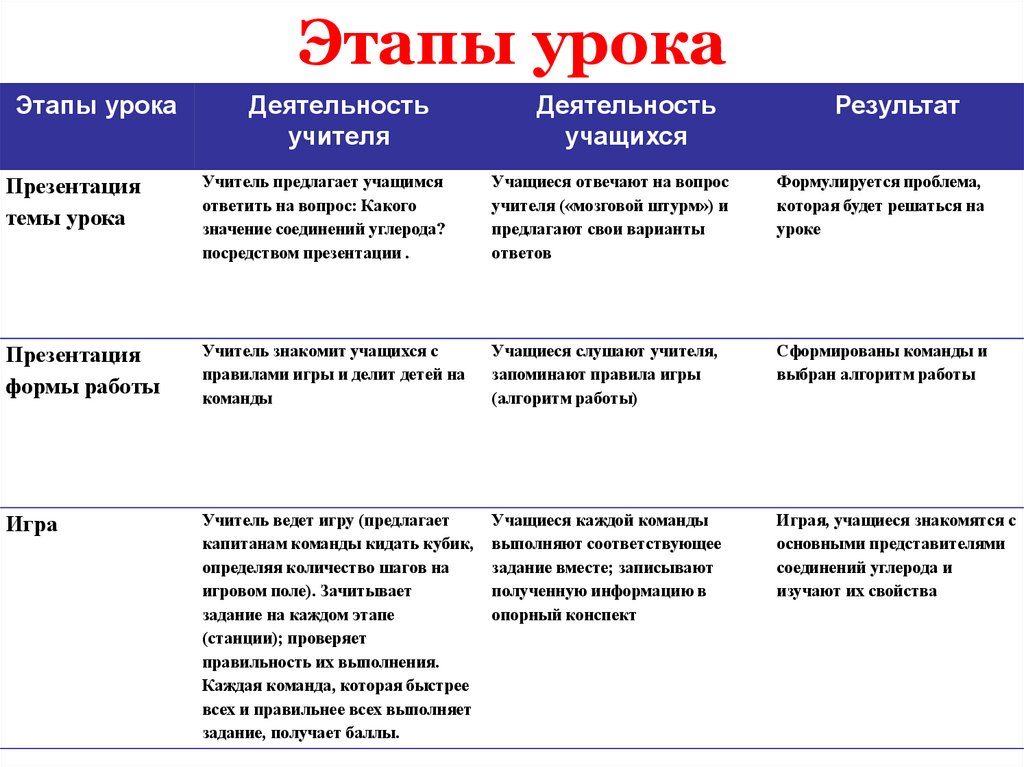
4. Этапы урока
Этапы урокаДеятельность
учителя
Деятельность
учащихся
Результат
Презентация
темы урока
Учитель предлагает учащимся
ответить на вопрос: Какого
значение соединений углерода?
посредством презентации .
Учащиеся отвечают на вопрос
учителя («мозговой штурм») и
предлагают свои варианты
ответов
Формулируется проблема,
которая будет решаться на
уроке
Презентация
формы работы
Учитель знакомит учащихся с
правилами игры и делит детей на
команды
Учащиеся слушают учителя,
запоминают правила игры
(алгоритм работы)
Сформированы команды и
выбран алгоритм работы
Игра
Учитель ведет игру (предлагает
капитанам команды кидать кубик,
определяя количество шагов на
игровом поле). Зачитывает
задание на каждом этапе
(станции); проверяет
правильность их выполнения.
Каждая команда, которая быстрее
всех и правильнее всех выполняет
задание, получает баллы.
Учащиеся каждой команды
выполняют соответствующее
задание вместе; записывают
полученную информацию в
опорный конспект
Играя, учащиеся знакомятся с
основными представителями
соединений углерода и
изучают их свойства
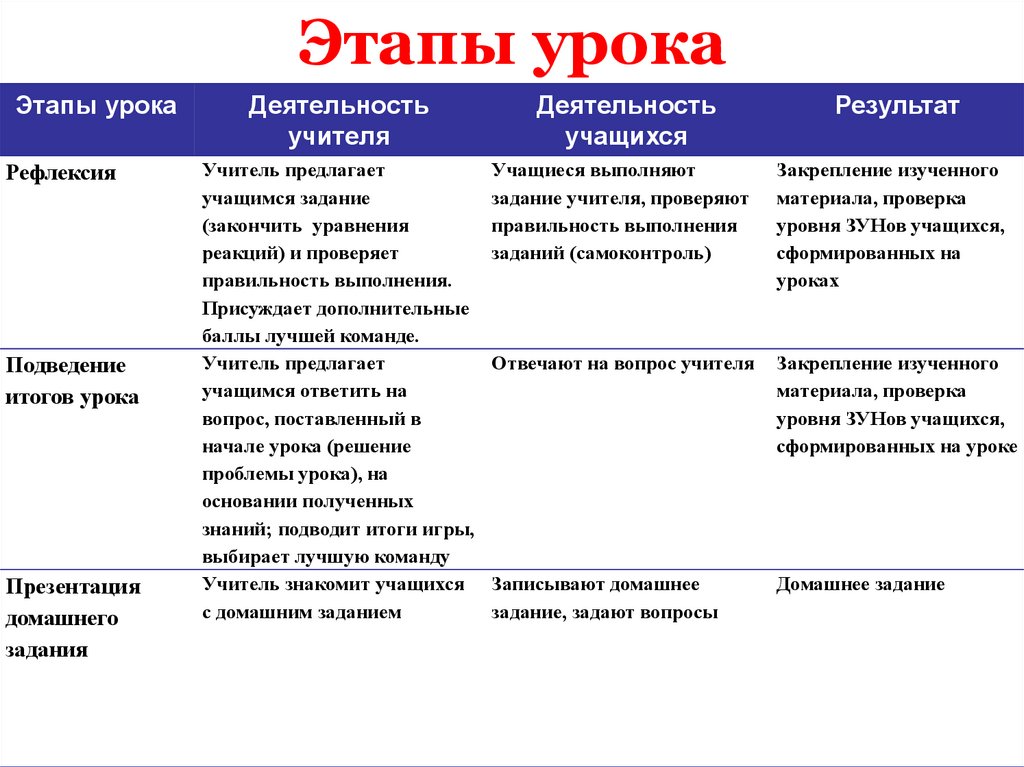
5. Этапы урока
Этапы урокаРефлексия
Подведение
итогов урока
Презентация
домашнего
задания
Деятельность
учителя
Деятельность
учащихся
Результат
Учитель предлагает
учащимся задание
(закончить уравнения
реакций) и проверяет
правильность выполнения.
Присуждает дополнительные
баллы лучшей команде.
Учитель предлагает
учащимся ответить на
вопрос, поставленный в
начале урока (решение
проблемы урока), на
основании полученных
знаний; подводит итоги игры,
выбирает лучшую команду
Учитель знакомит учащихся
с домашним заданием
Учащиеся выполняют
задание учителя, проверяют
правильность выполнения
заданий (самоконтроль)
Закрепление изученного
материала, проверка
уровня ЗУНов учащихся,
сформированных на
уроках
Отвечают на вопрос учителя
Закрепление изученного
материала, проверка
уровня ЗУНов учащихся,
сформированных на уроке
Записывают домашнее
задание, задают вопросы
Домашнее задание
6. СОЕДИНЕНИЯ УГЛЕРОДА: ДРУЗЬЯ или ВРАГИ?
учитель химииКНЯЗЕВА
Екатерина Александровна
школа № 507
Санкт-Петербург
7.
Na2CO3техническая сода
8. CaCO3 известняк
9. CaCO3 мрамор
10.
(Cu(OH)2)CO3малахит
11.
каменный уголь12.
нефть13.
природный газ14.
15.
16.
17.
18.
19.
20.
СОЕДИНЕНИЯУГЛЕРОДА:
ДРУЗЬЯ или ВРАГИ?
21.
?Известно, что оксид серы (IV) прирастворении в воде образует
неустойчивую сернистую кислоту
и как типичный кислотный оксид,
вступает в реакцию с основанием
с образованием соответствующей
кислоты.
Составьте уравнения реакций,
характеризующие свойства оксида
углерода (IV).
22.
SO2 +H2OSO2 +Ca(OH)2
H2SO3
Ca SO3+2H2O
CO2 +H2O
CO2 +Ca(OH)2
23.
CO2 +H2OCO2 +Ca(OH)2
CO2
H2CO3
CaCO3 + 2H2O
CaCO3
24.
CO2CaCO3
25.
Что произойдет, еслипропустить углекислый газ
через раствор гидроксида
кальция?
Составьте соответствующие
уравнения реакций.
26.
CO2 + Ca(OH)2CaCO3 + H2O
CaCO3 + CO2 + H2O
+
Ca(НCO3)2
27. Соли угольной кислоты
КарбонатыCaCO3
Гидрокарбонаты
NaHCO3
мрамор
питьевая сода
28.
Страшнаятайна
29.
Соли угольной кислоты, как и все прочиеобладают рядом особых свойств. Одно из
них сокрыто в этом ларце. Однако, чтобы
открыть его нужно выполнить задание.
Предложите два способа получения
карбоната кальция из оксида углерода (IV).
Напишите соответствующие уравнения
реакций.
Если вы правильно выполните задание, то
ларец откроется.
30.
Все нерастворимые карбонаты, атакже гидрокарбонаты разлагаются
при нагревании с образованием
углекислого газа:
CaCO3
t
t
CO2+ CaO
(NH4)2CO3 CO2+2NH3+H2O
31. (NH4)2CO3 CO2 +2NH3+H2O
t(NH4)2CO3 CO2 +2NH3+H2O
32. Ca(HCO3)2 t CO2+ CaCO3+ H2O
t33.
В лабораториипроизошло ЧП: от
нескольких склянок
с реактивами
оторвались
этикетки. Известно,
что в нескольких
из них склянках
были карбонаты.
С помощью какой
реакции можно
определить, где
были карбонаты?
34. Карбонаты взаимодействуют с кислотами (качественная реакция на карбонат-ион):
СaCO3 +2HClCaCl2 + H2O+CO2
35. NaHCO3 +CH3COOH CH3COONa+CO2+H2O
36. СaCO3 +2HCl CaCl2 + H2O+CO2
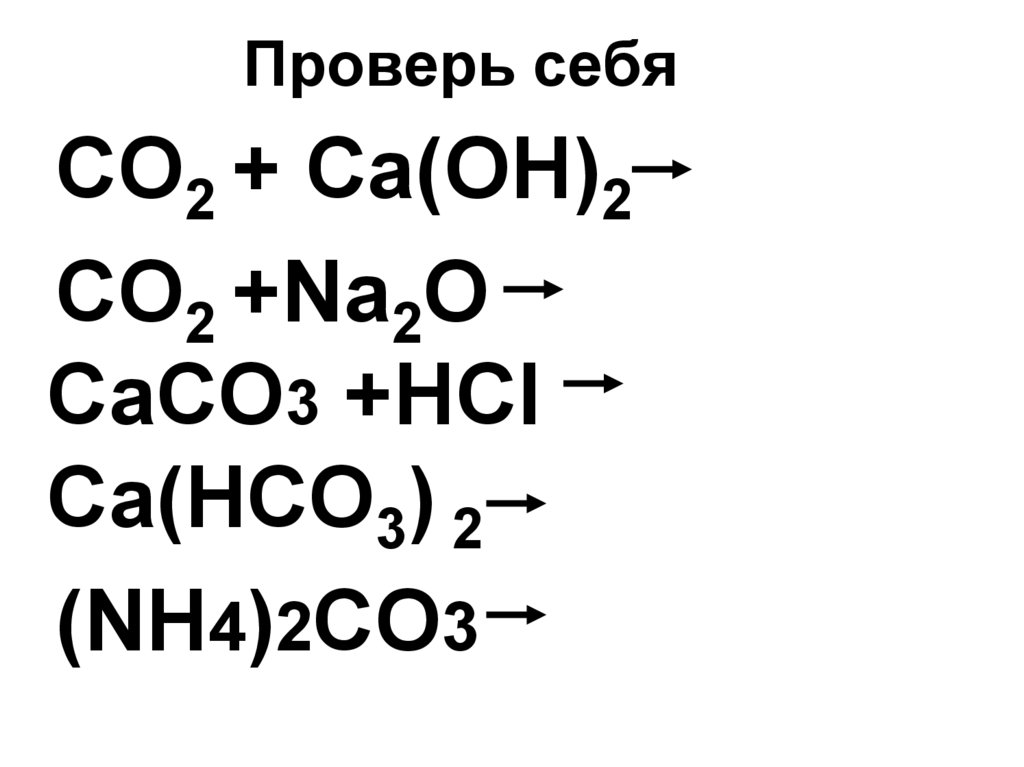
37. Проверь себя
CO2 + Ca(OH)2CO2 +Na2O
СaCO3 +HCl
Ca(HCO3) 2
(NH4)2CO3
38.
CO2 + Ca(OH)2 СaCO3 + H2OCO2 +Na2O
Na2CO3
СaCO3 +2HCL CaCl2+H2O+CO2
t
Ca(HCO3)2 CO2+ CaCO3 +H2O
t
(NH4)2CO3 CO2 +2NH3+H2O
39.
СОЕДИНЕНИЯУГЛЕРОДА:
ДРУЗЬЯ или ВРАГИ?


















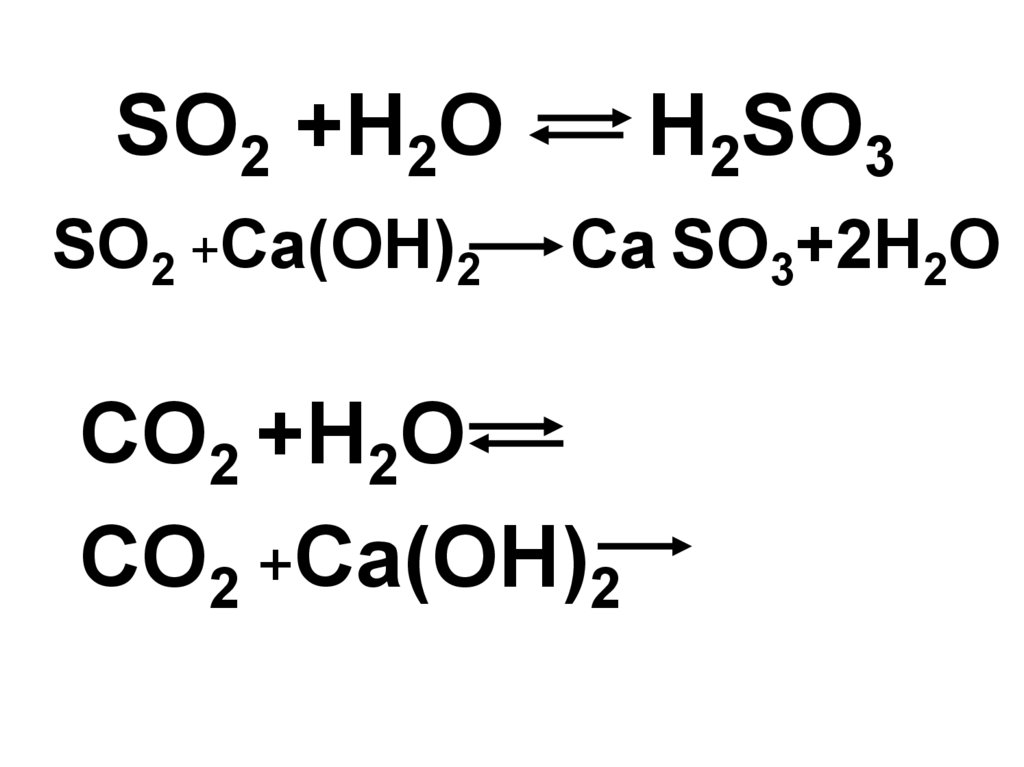
















 chemistry
chemistry