Similar presentations:
Мультимедийная презентация «Углерод». Характеристика химического элемента
1.
Мультимедийная презентация «Углерод»Программа О.С. Габрильян 9 класс
Выполнила: Полякова Татьяна Андреевна
учитель химии БОУ г. Омска «Гимназия
№ 159»
2.
3.
4. Характеристика химического элемента
С6
Углерод
12,011
2s2p2
4
2
5. Положение углерода в ПСХЭ Д.И Менделеева
2 малый периодIV группа главная
подгруппа
Ar = 12,011
6. Состав атома углерода
12с
+
р 0
n -
6
6
e- 6
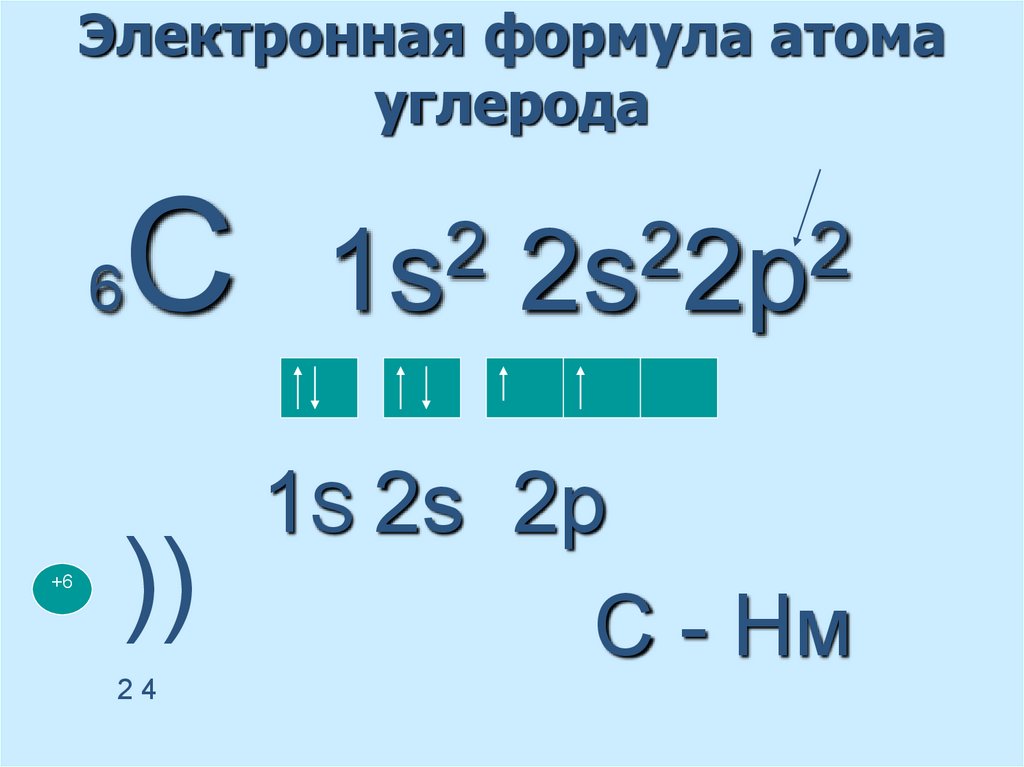
7. Электронная формула атома углерода
6+6
С
))
24
2
1s
2
2
2s 2p
1S 2s 2p
С - Нм
8. Степени окисления
-4; -1; 0; +2; +4CH4 СаС2 C СO
CO2
9. Важнейшие соединения
А. Летучее водородное соединениеCH4-метан
Б. Высший оксид
СО2-Оксид углерода (IV)
В. Высший гидроксид
H2CO3-угольная кислота
10. Распространение в природе
Содержание углерода в земнойкоре составляет 4,8*10-2%, в
составе карбонатных минералов,известняке СаСО3 и доломите
CaMg(CО3)2,каменного угля, нефти, в виде графита и реже алмаза.
Является главной составной
частью органических веществ.
11.
Кристаллические алмазыанабара
тиликита
12. Графит
13.
Алмаз 600 каратЗнаменитый
окрашенный алмаз
"Хоуп" весит 44,4
метрического карата
Алмаз 67 карат
АЛМАЗ "ШАХ" 88,70
карата
Найденный в южно- африканском
королевстве Лесото самый крупный
алмаз
14. Происхождение названия
Международное название происходит отлатинского «carbo»—уголь,свя-занного с
древним корнем «kar»— огонь.
Этот же корень в латинском «cremare» —
гореть, а возможно, и
в русском «гарь», «жар», «угореть» (в
древнерусском «угорати» — обжигать,
опалять). Отсюда — и название «уголь».
15. Историческая справка
Углерод известен с глубокой древности.Древесный уголь служил для восстановления металлов из руд, алмаз - как
драгоценный камень. Значительно позднее
стали применять графит для изготовления
тиглей и карандашей.
Углерод был
признан химическим элементом в 1789
Лавуазье. Латинское название «Carboneum» углерод получил от carbo - уголь.
16. Лавуазье Антуан Лоран (26.VIII.1743–8.V.1794)
Французскийхимик.
Один
из
основоположников
классической
химии. Ввел в химию строгие коли чественные методы исследования.
Положил начало опровержению (1774)
теории флогистона. Получил (1774)
кислород.
Доказал
(1775–1777)
сложный
состав
атмосферного
воздуха, содержащего кислород и
«удушливый воздух» (азот). Доказал
сложный состав воды, установив, что
она состоит из кислорода и водорода.
Разработал
принципы
новой
химической номенклатуры. Заложил
основы
органического
анализа.
Доказал, что процесс дыхания подобен
горению
и
что
образование
углекислого газа при дыхании является
главным источником теплоты в живом
организме.
17. Характеристика аллотропных модификаций
СС алмаз
С графит
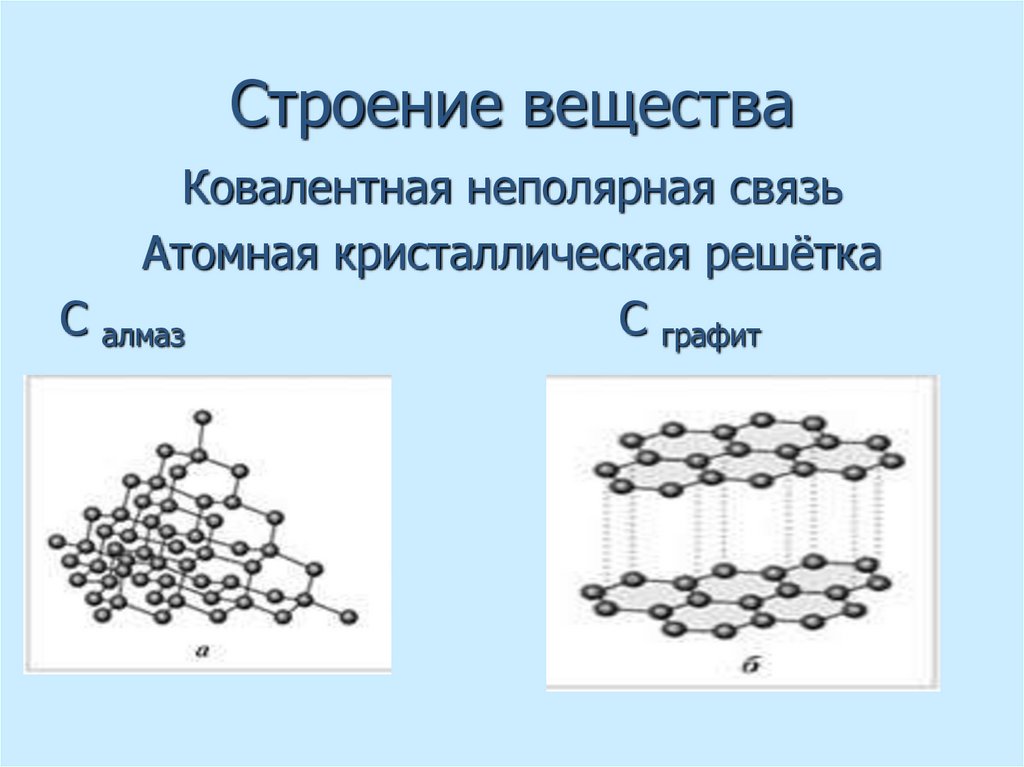
18. Строение вещества
Ковалентная неполярная связьАтомная кристаллическая решётка
С алмаз
С графит
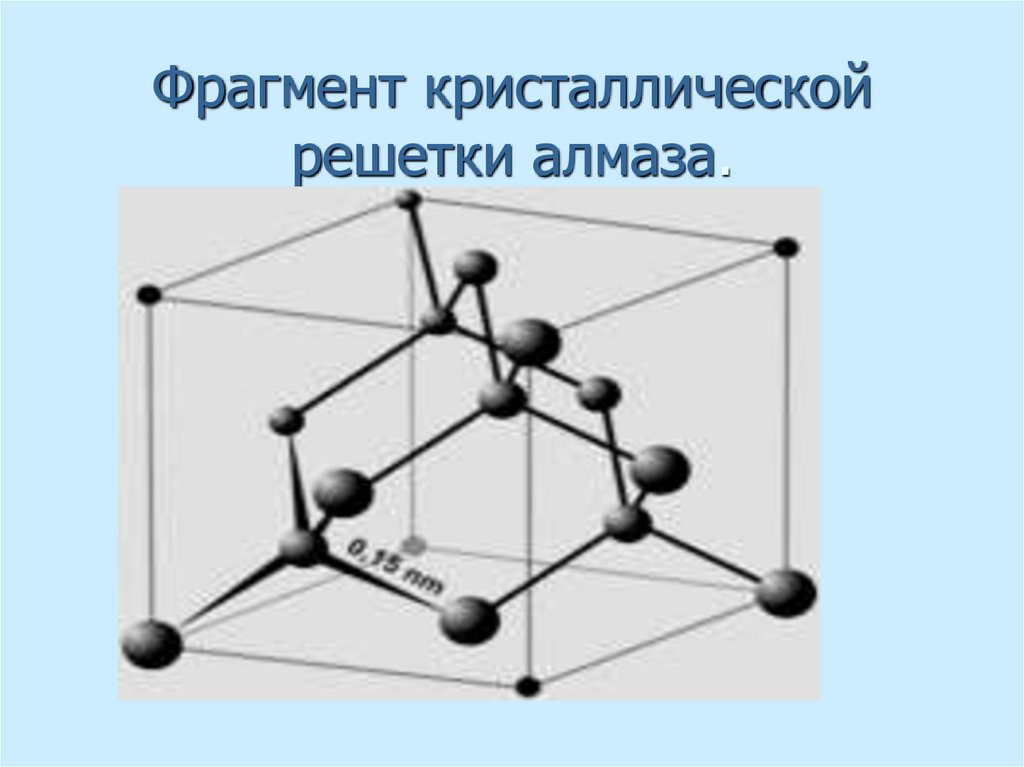
19. Фрагмент кристаллической решетки алмаза.
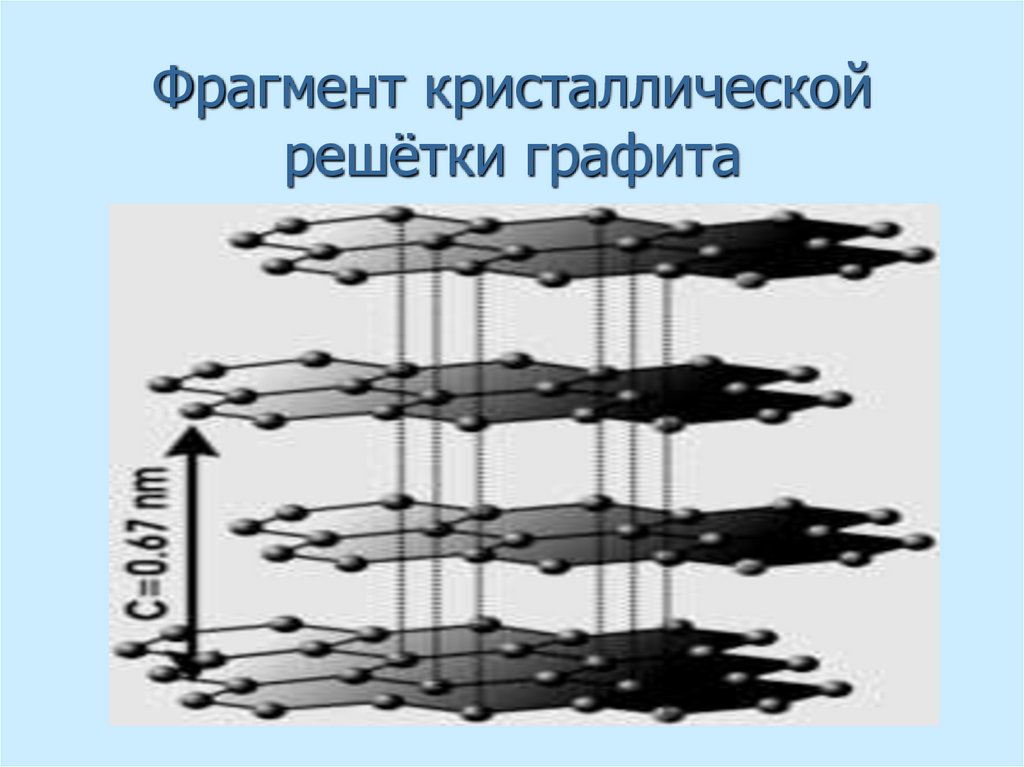
20. Фрагмент кристаллической решётки графита
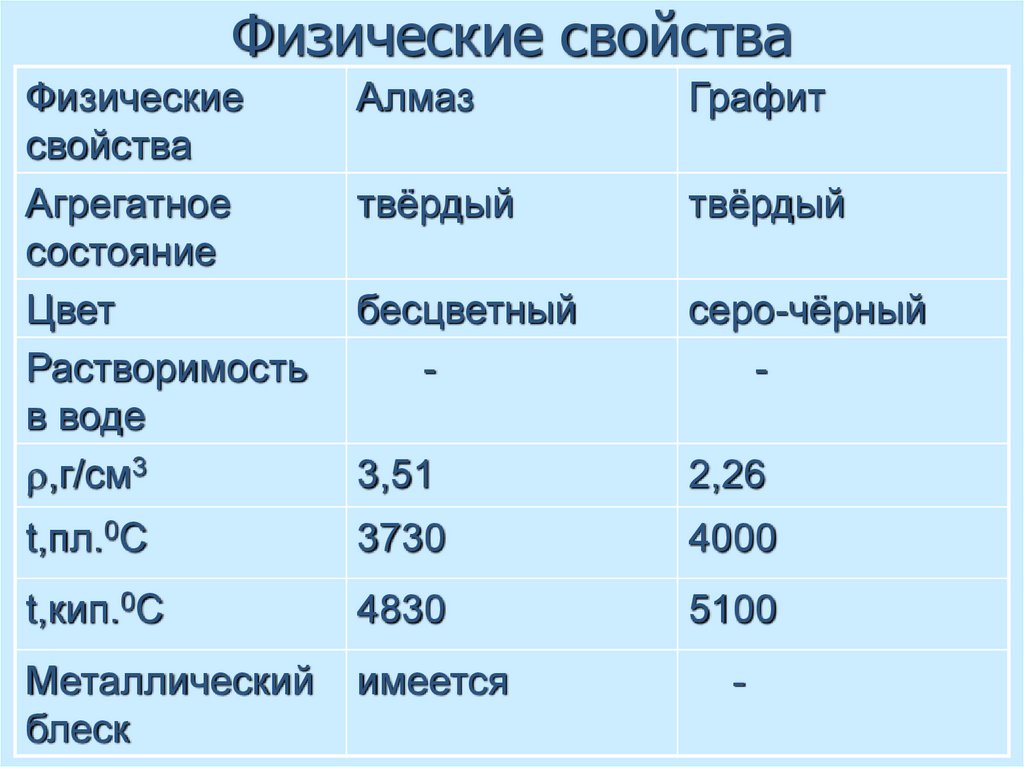
21. Физические свойства
Физическиесвойства
Агрегатное
состояние
Цвет
Растворимость
в воде
,г/см3
Алмаз
Графит
твёрдый
твёрдый
бесцветный
-
серо-чёрный
-
3,51
2,26
t,пл.0С
3730
4000
t,кип.0С
4830
5100
Металлический
блеск
имеется
-
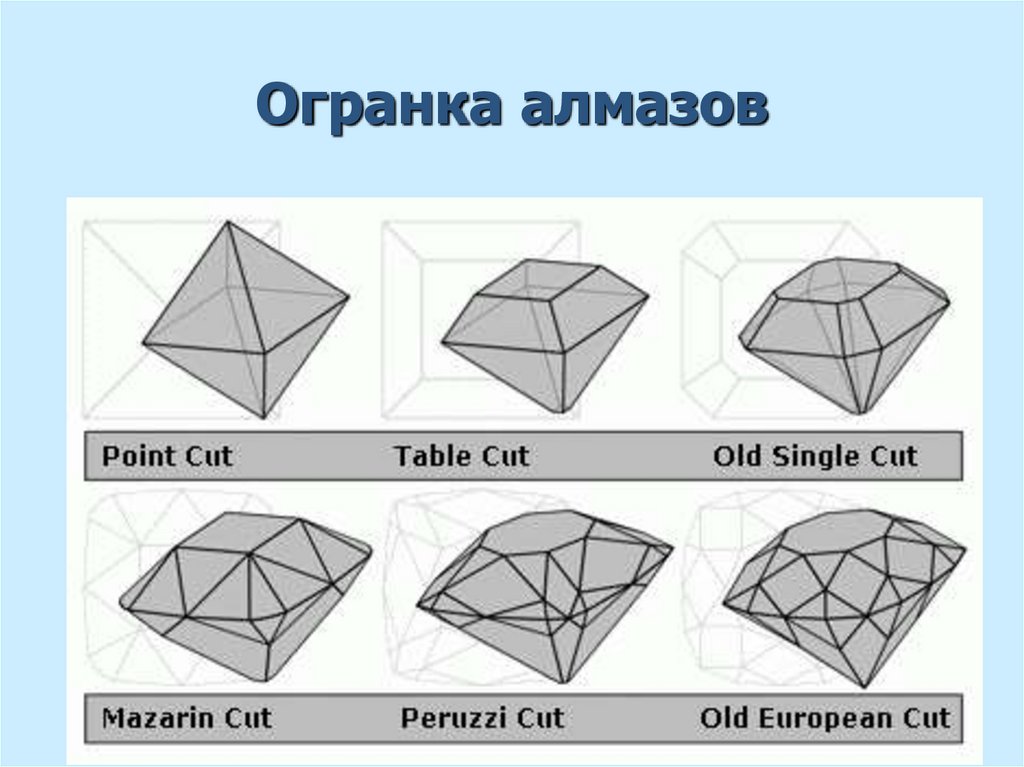
22. Огранка алмазов
23. Древесный уголь
Древесный уголь - адсорбентАдсорбция
способность
поглощать газы и растворенные вещества.
24. Зелинский Николай Дмитриевич (6.II.1861–31.VII.1953)
Зелинский Николай Дмитриевич (6.II.1861–31.VII.1953)
Советский химик-органик, академик (с 1929).
Исследования относятся к нескольким
областям органической химии – химии
алициклических
соединений,
химии
гетероциклов,
органическому
катализу,
химии белка и аминокислот. Совместно с
инженером
А.
Кумантом
разработал
конструкцию
(1916)
противогаза.
Осуществил процессы каталитической и
пирогенетической ароматизации нефтей.
Впервые в СССР начал работы по
получению
хлоропренового
каучука.
Является одним из основоположников
учения об органическом катализе. Проводил
также исследования в области химии
аминокислот и белка. Создал крупную школу
химиков-органиков.
25. Зелинский Н. Д. изобрёл первый противогаз
Противогаз –устройство для
защиты от вредных
примесей,
имеющихся в
воздухе.
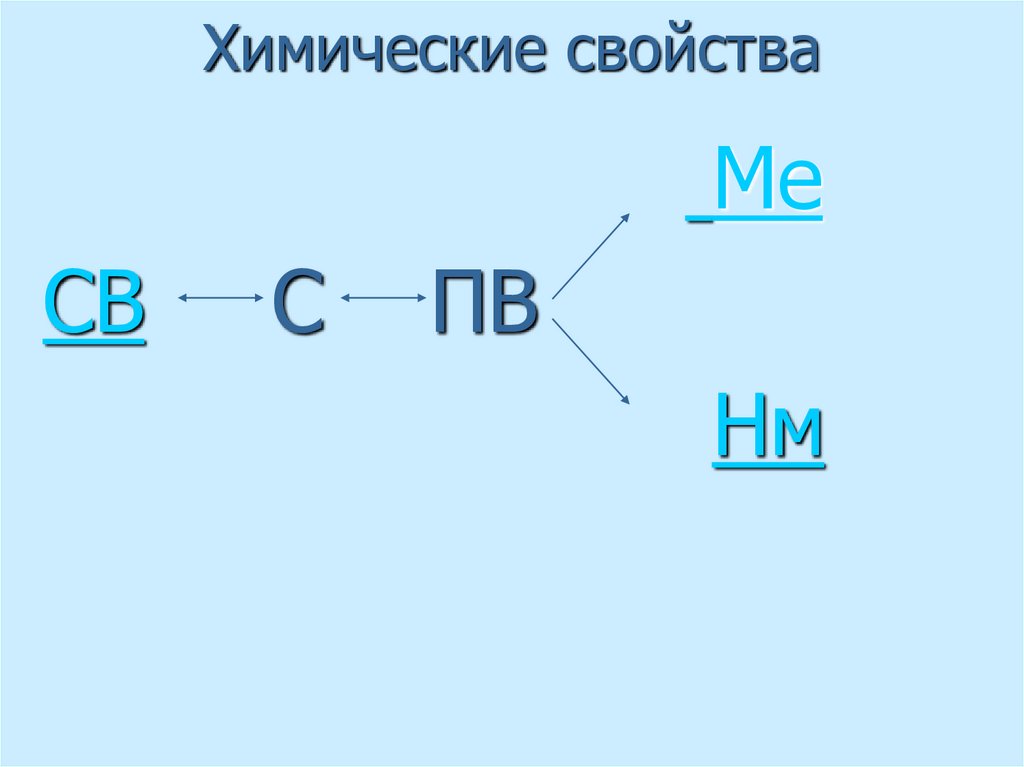
26. Химические свойства
МеСВ
С
ПВ
Нм
27. Взаимодействие с металлами
а) С + Саб) С+ Аl
СаС2
Al4C3
28. Взаимодействие с металлами
а) 2С0 + Са0 = Са+2С2-1б) 3С0 + 4Аl0 = Al4+3C3-4
29. Взаимодействие с металлами
а) 2С0 + Са0 = Са+2С2-1 карбид кальцияок-ль
б) 3С0 + 4Аl0 = Al4+3C3-4 карбид алюминия
ок-ль
30. Взаимодействие с неметаллами
а) С + О2СО2
изб.
б) С + О2
СО
нед.
в) С+ F2
CF4
31. Взаимодействие с неметаллами
а) С0 + О20 = С+4О2-2изб.
б) 2С0 + О20 = 2С+2О-2
нед.
в) С0 + 2F20 = C+4F4-1
32. Взаимодействие с неметаллами
а) С0 + О20 = С+4О2-2 оксид углерода(IV)в-ль изб.
б) 2С0 + О20 = 2С+2О-2 оксид углерода (II)
в-ль нед.
в) С0 + 4F20 = C+4F4-1 фторид углерода (IV)
в-ль
33. Взаимодействие со сложными веществами
tа) C+ СuO
б) С+H2SO4к.
Cu+ CO2
CO2 + SO2+H2O
34. Взаимодействие со сложными веществами
tа) C0 + 2Сu+2O = 2Cu0+ C+4O2
б) С0+H2S+6O4к. = C+4O2+2S+4O2+2H2O
35. Взаимодействие со сложными веществами
tа) C0 + 2Сu+2O-2=2Cu0+ C+4O2-2
в-ль
б) С0+H-12S+6O-24к. = C+4O2-2
+2S+4O2+2H2O
в-ль
36. Применение
37. Получение
В промышленности:а) сухая перегонка древесины, каменного угля
древесного угля, кокса, активированного угля;
б) неполное сжигание метана:
CH4 = C + 2H2
метан
38.
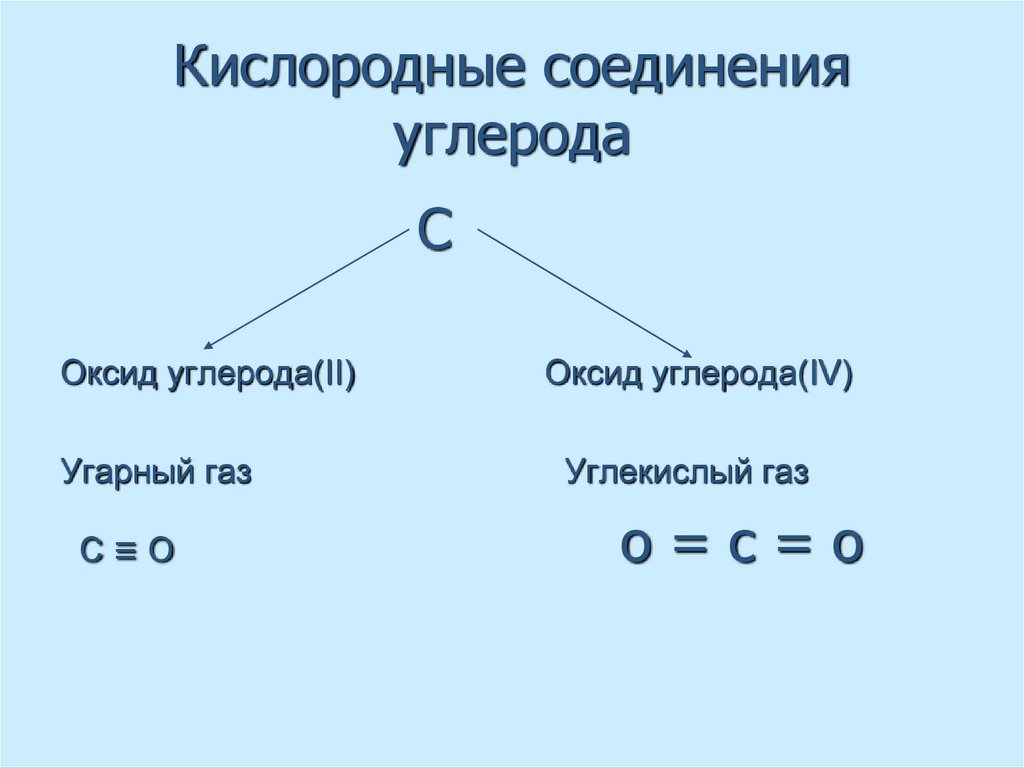
39. Кислородные соединения углерода
СОксид углерода(II)
Угарный газ
С≡О
Оксид углерода(IV)
Углекислый газ
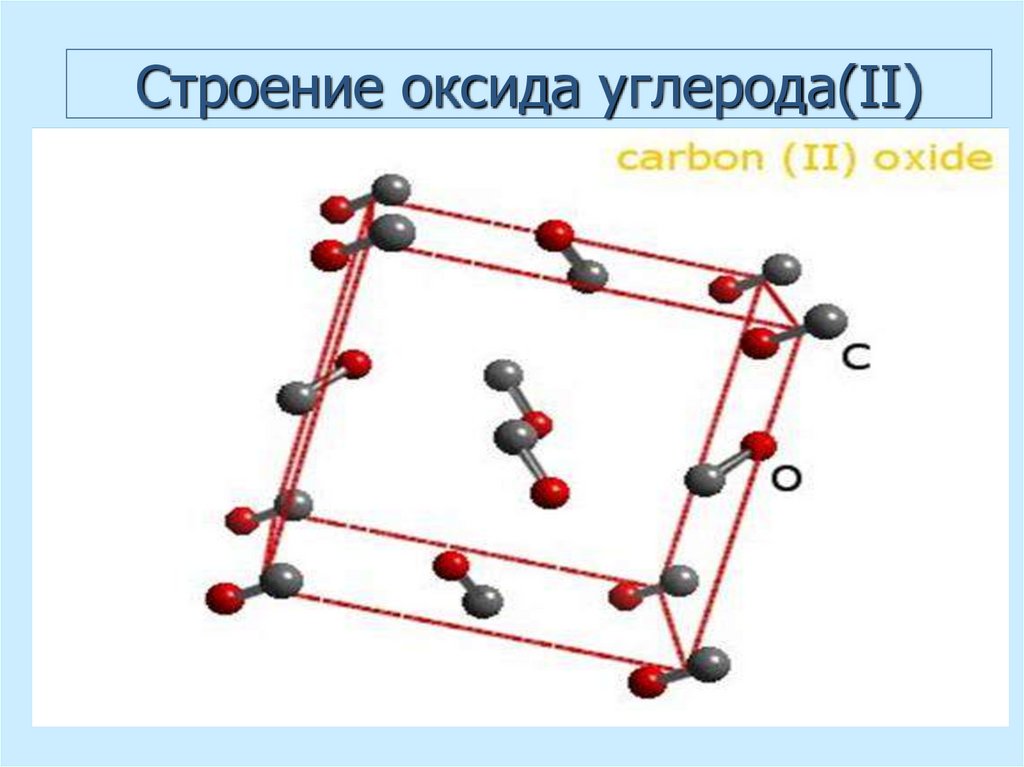
о=с=о
40. Cтроение оксида углерода(II)
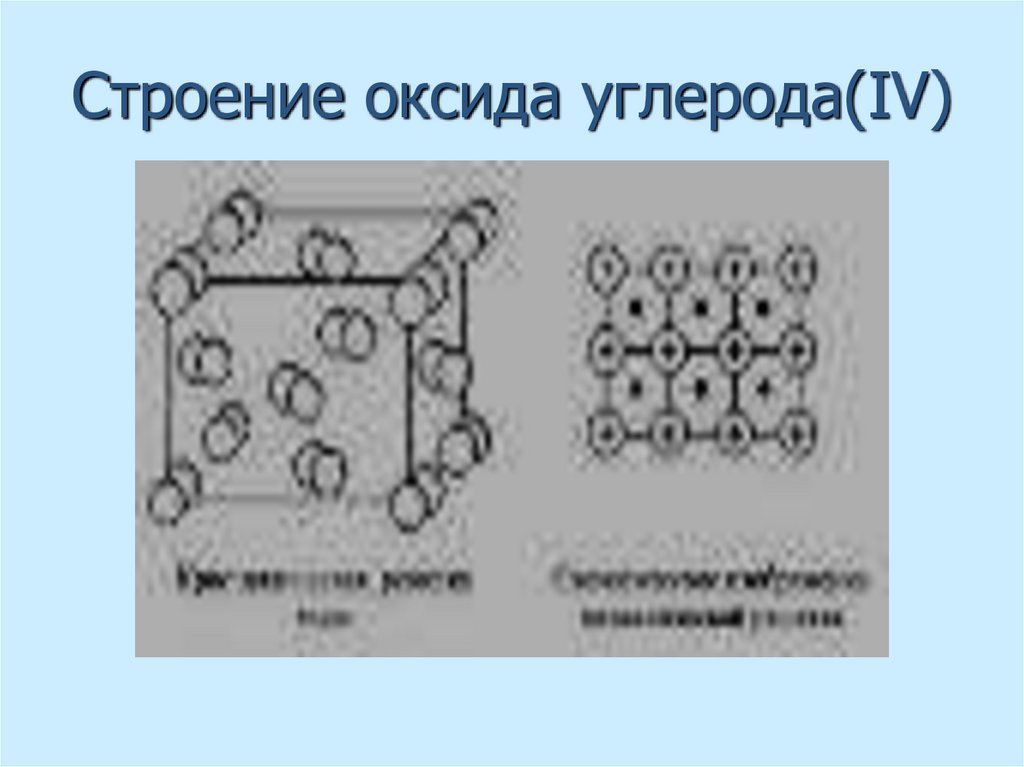
41. Строение оксида углерода(IV)
42. Физические свойства оксидов углерода
Оксиды углеродаАгрегатное состояние
СО
СО2
Газ, без цвета и
запаха
Газ, без
цвета и
запаха
Молекулярная масса
Температура плавления, 0С
28,010
-205
44,010
57
Температура кипения, °С
–192
–56,6
Температура замерзания, °С –199
–78,5
Плотность, г/л (при 0° С)
1,250
1,977
Растворимость,
объем/объем воды (при 0°
С)
0,03 , плохо
растворим в
воде
1,3,
раствор
им в
воде
43. Химические свойства Кислотно – основные
СО-несолеобразующий CO2- солеобразующий,оксид
кислотный
СО2+основной оксид = соль
СО2+основание = соль+вода
СО2+ вода = кислота
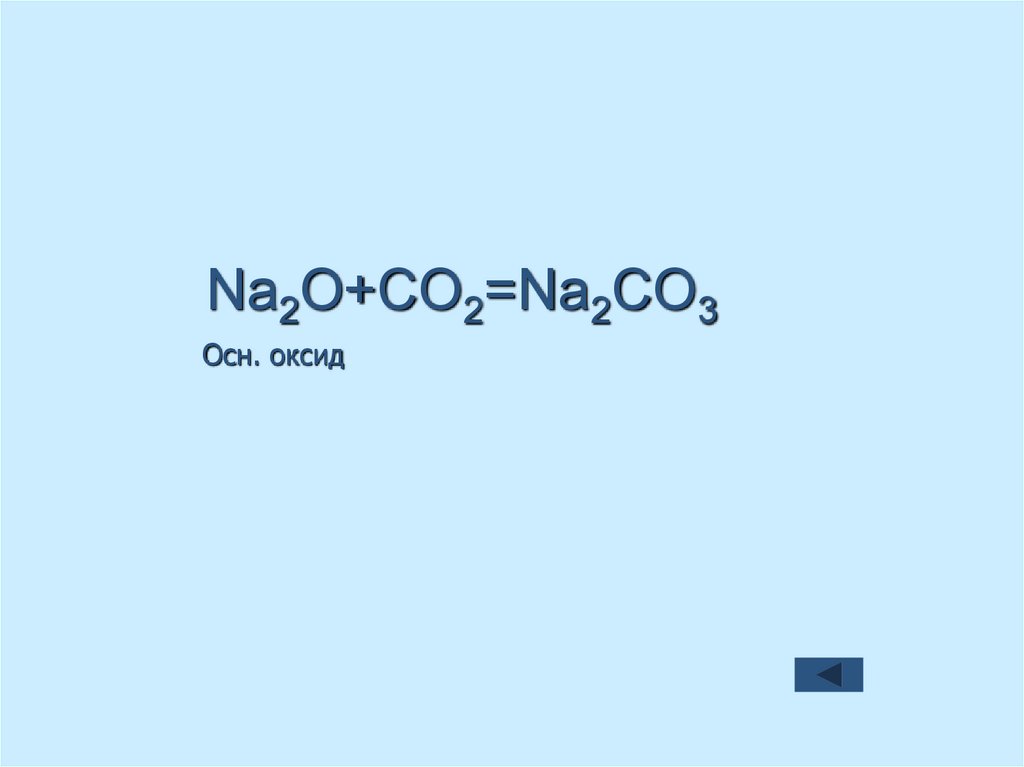
44. Осн. оксид
Na2O+CO2=Na2CO3Осн. оксид
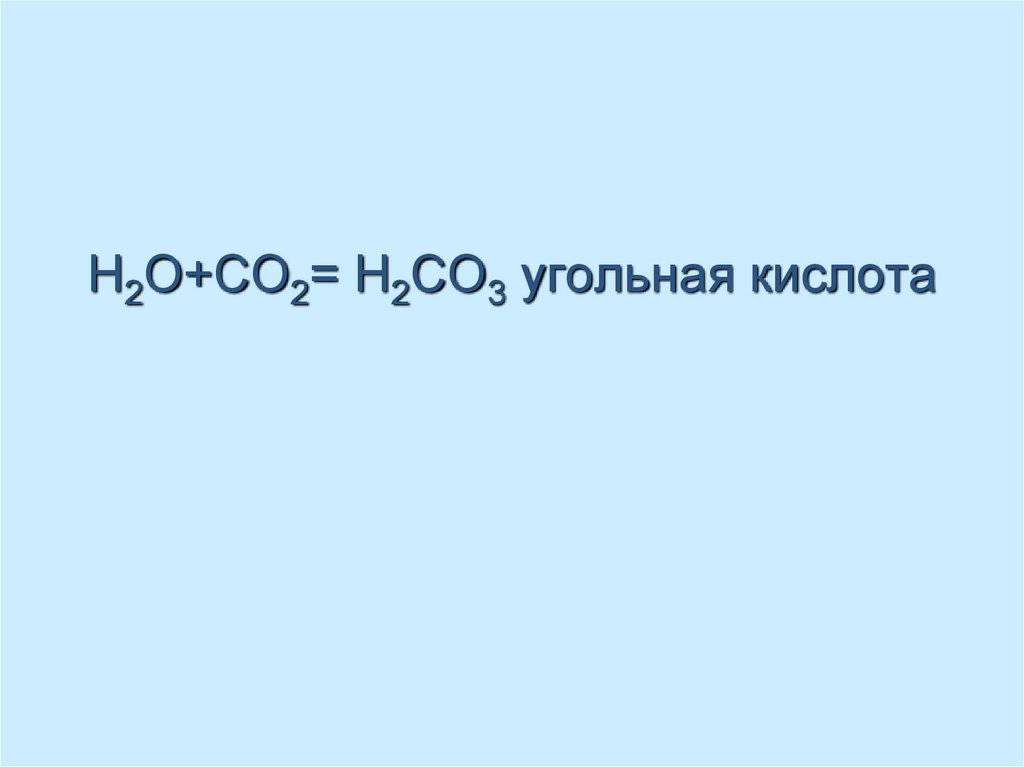
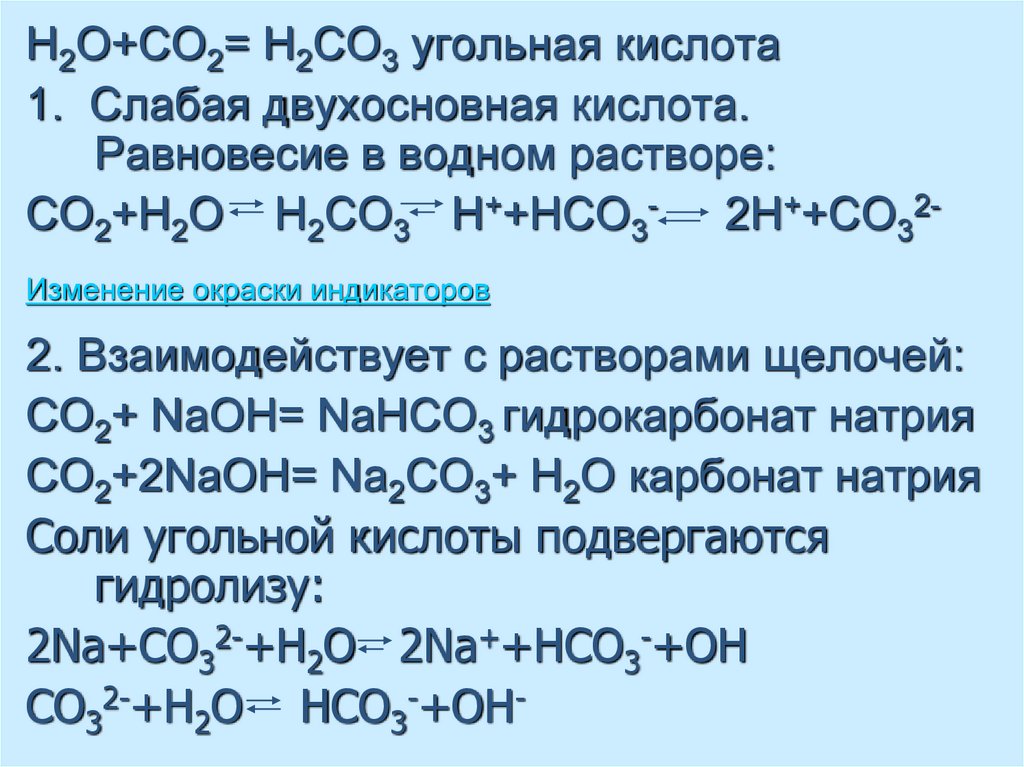
45. H2О+CO2= Н2CO3 угольная кислота
46. Качественная реакция на углекислый газ
Сa(OH)2+CO2= CaCO3 + H2OCO2+Ca2++2OH-= CaCO3 + H2O
Аппарат Киппа
47.
H2О+CO2= Н2CO3 угольная кислота1. Слабая двухосновная кислота.
Равновесие в водном растворе:
CO2+H2O H2CO3 H++HCO3- 2H++CO32Изменение окраски индикаторов
2. Взаимодействует с растворами щелочей:
CO2+ NaOH= NaHCO3 гидрокарбонат натрия
CO2+2NaOH= Na2CO3+ H2O карбонат натрия
Соли угольной кислоты подвергаются
гидролизу:
2Na+CO32-+H2O 2Na++HCO3-+OH
CO32-+H2O HCO3-+OH-
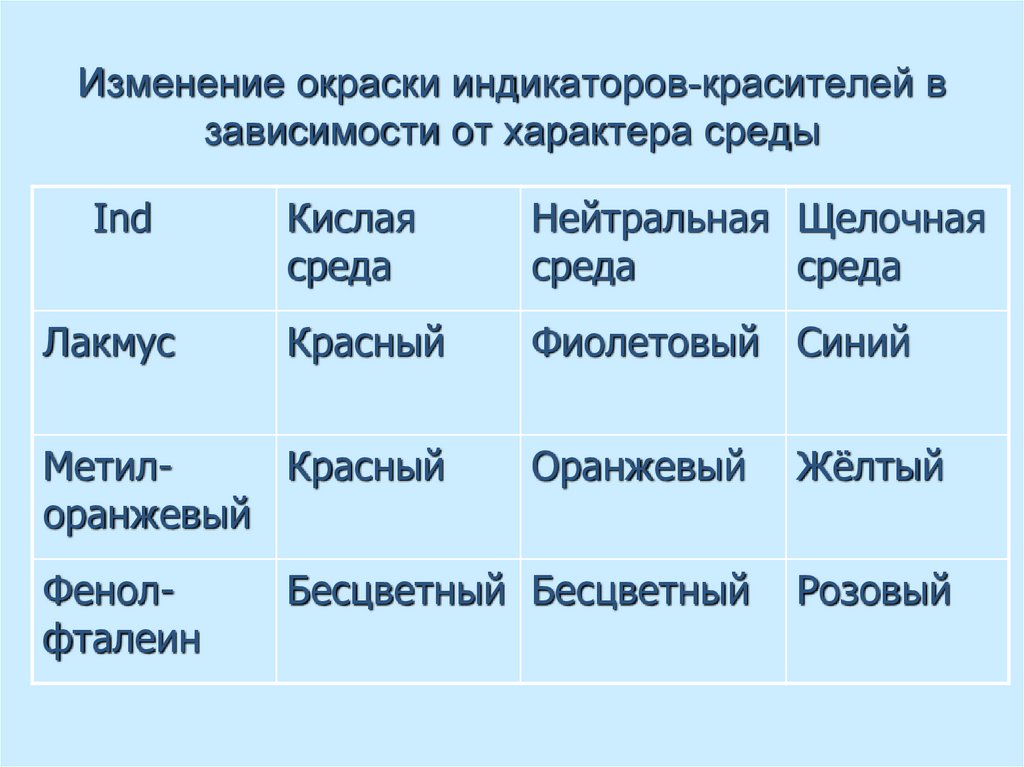
48. Изменение окраски индикаторов-красителей в зависимости от характера среды
IndЛакмус
Кислая
среда
Нейтральная Щелочная
среда
среда
Красный
Фиолетовый Синий
МетилКрасный
оранжевый
Фенолфталеин
Оранжевый
Жёлтый
Бесцветный Бесцветный
Розовый
49.
3. Вытесняется из солей более сильнымикислотами:
CaCO3+2HCl=CaCl2+CO2 +H2O
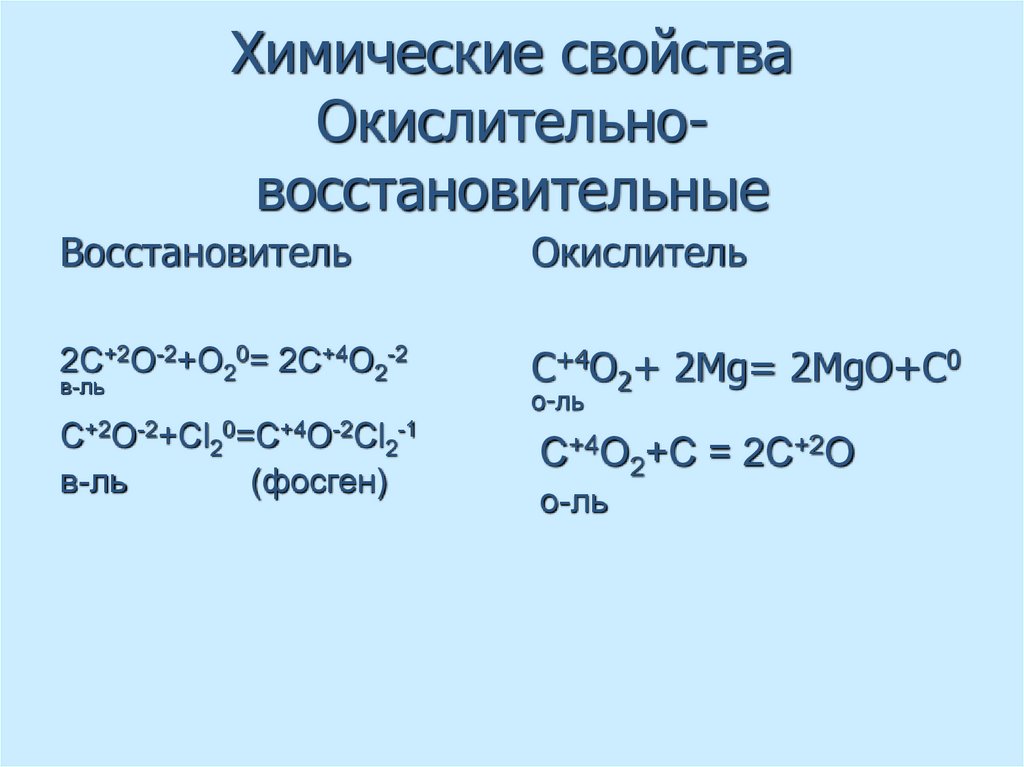
50. Химические свойства Окислительно-восстановительные
Химические свойстваОкислительновосстановительные
Восстановитель
Окислитель
2С+2О-2+О20= 2С+4О2-2
C+4O2+ 2Mg= 2MgO+C0
С+2О-2+Сl20=C+4O-2Cl2-1
в-ль
(фосген)
C+4O2+C = 2C+2O
в-ль
о-ль
о-ль
51. Получение оксидов углерода
Оксид углерода(II)Оксид углерода(IV)
Промышленный способ получения:
CO2+C=2CO
обжиг известняка
t
CaCO3 = CaO+CO2
Лабораторный способ:
Обезвоживание муравьиной кислоты
Действие сильных кислот на
соли угольной кислот
H2SO4
HCOOH = CO+H2O
CaCО3+2HCl=CaCl2+H2O+CO2
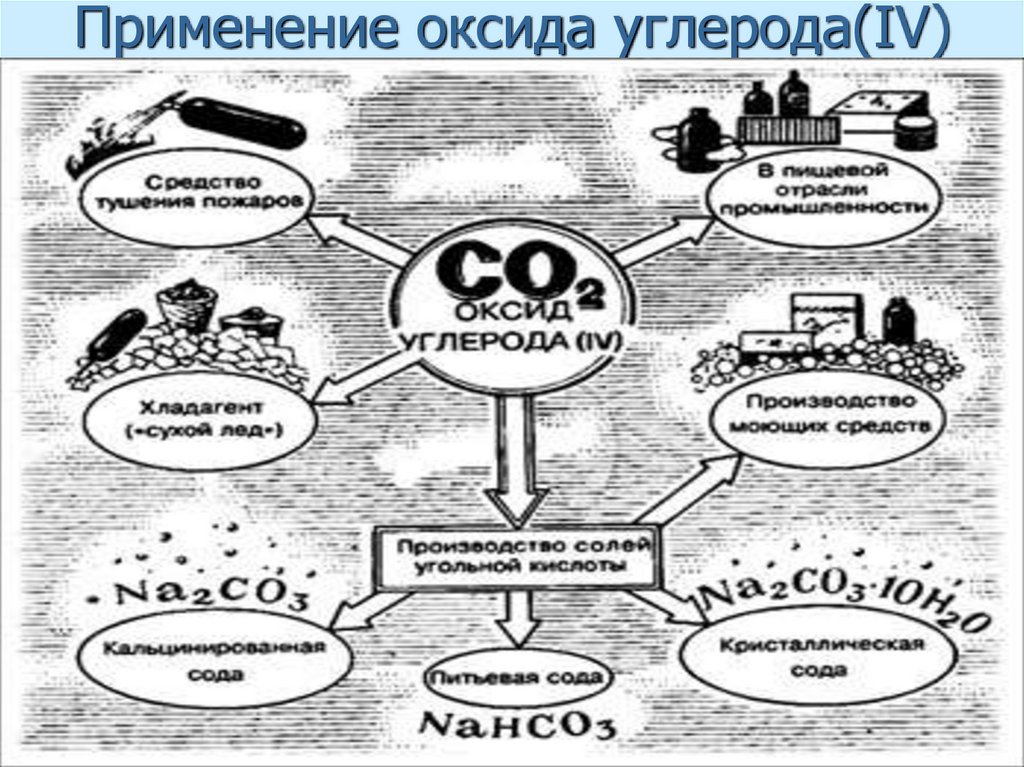
52. Применение оксида углерода(IV)
53. Применение оксида углерода(II)
В металлургии при выплавке чугуна,производство метилового спирта
54. Качественная реакция на карбонат-ион
Качественной реакцией на карбонатион - выделение СО2 при действиисильных кислот на карбонаты и
гидрокарбонаты.
CO32- + 2H+=H2O+CO2
HCO3- + H+= H2O+CO2
55. Важнейшие карбонаты
NaHCO3- питьевая содаNa2CO3 – кальцинированная сода
Na2CO3*10H2O-кристаллическая сода
CaCO3 – мел, известняк, мрамор
56.
Формула,химическое
название
Техническое
название
Применение
Na2CO3
Кристаллическа Производство
карбонат натрия я сода
стекла,
бумаги,мыла
NaHCO3
гидрокарбонат
натрия
Пищевая
или Пищевая
питьевая сода
промышленност
ь, медицина
57.
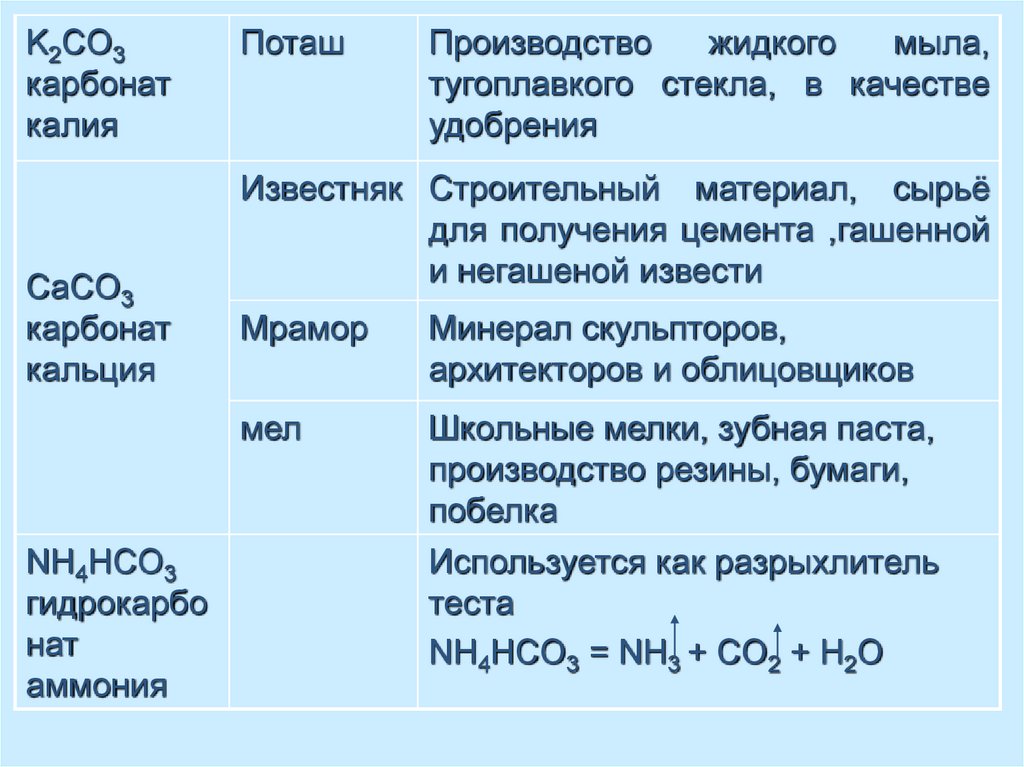
K2CO3карбонат
калия
CaCO3
карбонат
кальция
NH4HCO3
гидрокарбо
нат
аммония
Поташ
Производство
жидкого
мыла,
тугоплавкого стекла, в качестве
удобрения
Известняк Строительный материал, сырьё
для получения цемента ,гашенной
и негашеной извести
Мрамор
Минерал скульпторов,
архитекторов и облицовщиков
мел
Школьные мелки, зубная паста,
производство резины, бумаги,
побелка
Используется как разрыхлитель
теста
NH4HCO3 = NH3 + CO2 + H2O
58. Биологическая роль
Входит в состав ДНКСодержание в человеческом организме:
Мышечная ткань:67%
Костная ткань:36%
Ежедневный приём с пищей:300г.
Токсическая доза: обычно не токсичен, но
может быть токсичен в форме СО или
цианидов(CN-)
Содержание в организме среднего
человека ( масса тела 70кг): 16кг.
59. Литература:
1. Габриелян О.С. Химия. 9 класс: Учебн. дляобщеобразоват. учеб. заведений. –М.: Дрофа,
2001
2. Еремин В.В. Справочник школьника по химии: 811 кл./В.В. Ерёмин, Н.Е. Кузьменко, Е.А.
Еремина.- М.: Дрофа,1996. – 208с.
3. Энциклопедический словарь юного химика /Сост.
В.А. Крицман, В.В. Стацо.- М.:
Педагогика,1982.-368с.
4. http://image.websib.ru104/edu/plau.html
5. www. alchimik. ru










































 chemistry
chemistry








