Similar presentations:
Химические элементы IV группы главной подгруппы
1.
Химическиеэлементы IV
группы главной
подгруппы
2.
Элементы главнойподгруппы IV группы:
углерод С,
кремний Si,
германий Ge,
олово Sn,
свинец Pb
недавно открытый
искусственный
радиоактивный элемент
флеровий Fl.
3. Общая характеристика элементов IV группы главной подгруппы
ЭлементыС
Si
Ge
Sn
Pb
Строение внешней
электронной оболочки:
2S22P2 3S23P2 4S24P2 5S25P2
6S26P2
Энергия ионизации,
эВ
11,26 8,15
7,90
7,34
7,42
+4
+4,+2
+2
Характерная
степень окисления
+4
+4
немет немет полупр мет
мет
4.
5. Аллотропные модификации углерода
алмазграфит
карбин
6.
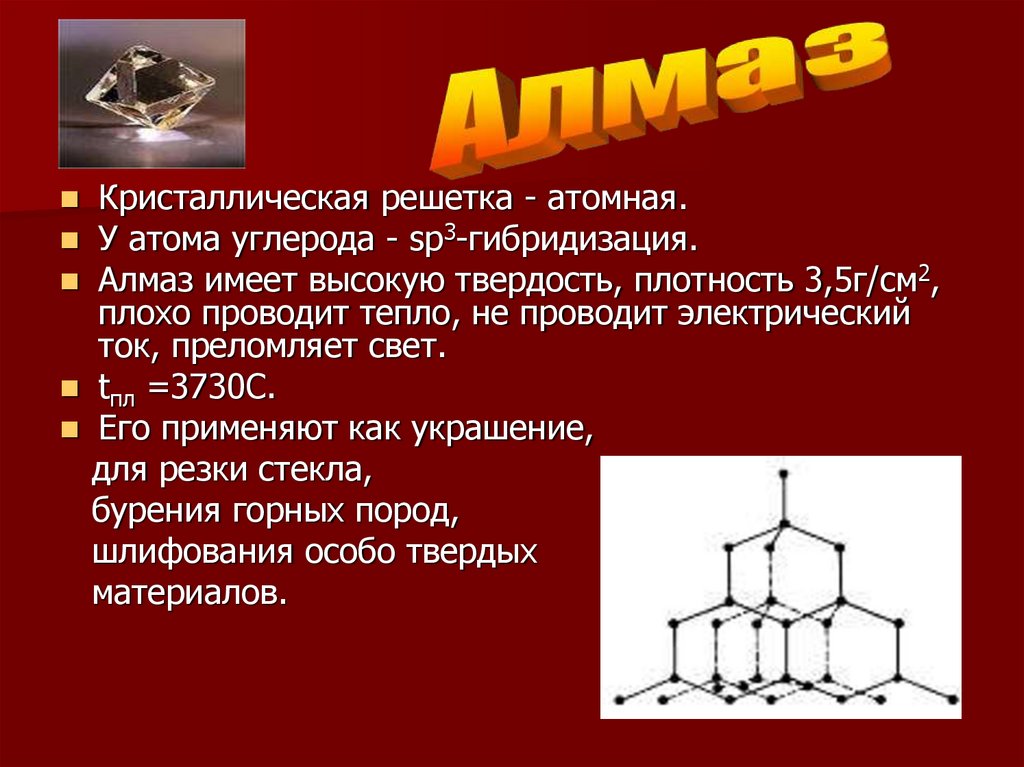
Кристаллическая решетка - атомная.У атома углерода - sp3-гибридизация.
Алмаз имеет высокую твердость, плотность 3,5г/см2,
плохо проводит тепло, не проводит электрический
ток, преломляет свет.
tпл =3730С.
Его применяют как украшение,
для резки стекла,
бурения горных пород,
шлифования особо твердых
материалов.
7.
Видоизменения графита - кокс, сажа, древесныйуголь.
Углерод в графите находится в состоянии sp2–
гибридизации.
Графит - жирное на ощупь вещество с металлическим
блеском, тугоплавок, полупроводник, мягок, легко
расслаивается.
Из графита изготавливают огнестойкие, химически
устойчивые изделия, карандаши, краски, смазки.
Графит применяется в электротехнике, в атомной
технике как замедлитель нейтронов, изоляционный
материал.
8.
Представляет собой черный порошок.Углерод находится в состоянии sp–
гибридизации.
ΞС–СΞС–СΞ
Карбин является полупроводником.
Впервые карбин получен в 1963 году при
каталитическом окислении ацетилена
(учеными В. В. Коршак, А. М. Сладковым, В.
Ш. Касаточкиным). Позднее карбин
обнаружили в природе.
9.
Химические свойства углеродаПри нагревании до 800 – 900оС
1. С кислородом
2. С азотом
3. С серой
4. С водородом
С+O2=СO2 (оксид)
2С+N2=С2N2 (циан)
С+2S=СS2(сероуглерод
С+2H2=СH4 (метан)
5. С кремнием
С+Si=SiC (карборунд)
6. С металлами
3C + 4Al = Al4C3
(карбид алюминия)
7. С оксидами
металлов
CuO + C = CO2 +Cu
10.
Адсорбция - свойство угля и другихтвёрдых веществ удерживать на
своей поверхности пары, газы и
растворённые вещества.
Адсорбент - вещество, на
поверхности которого происходит
адсорбция.
11. Нахождение в природе
Свободный углерод находится в природе ввиде алмаза и графита.
Основная масса углерода в виде природных и
горючих ископаемых
В атмосфере и гидросфере находится в виде
диоксида углерода СО2, (в воздухе 0,046 %
СО2 по массе).
Углерод входит в состав растений и животных
(~18 %). Общее содержание углерода в
организме человека достигает 21 %/.
12. Природные карбонаты кальция и магния
мелмрамор
доломит
известняк
13. Горючие ископаемые
антрацитприродный газ
каменный уголь
нефть
битумторф
14. ШУНГИТ
ШунгитШУНГИТ
(содержит углерод
и оксид кремния)
15. Домашнее задание
создайте интеллект карту по теме«Углерод»
16. Оксид углерода (II)
CΞOC
O
Газ без цвета и запаха, ядовит.
Получается при сгорании угля в
недостатке кислорода.
Получение в лабораторных условиях
СООН H2SO4→ СО + Н2О
Получение в промышленности
С+ Н2О t→ СО+Н2
водяной газ
17. Химические свойства оксида углерода (II)
1. ВосстановительCuO + CO = Cu + CO2
2. Вступает в реакции присоединения:
CO + Cl2 = COCl2 (фосген)
CO + S = COS (тиооксид углерода)
3. Выступает в роли лигандов:
Ni + 4CO = [Ni(CO)4]
Карбонильные комплексы –
ядовитые жидкости;
широко используются для
получения чистых металлов.
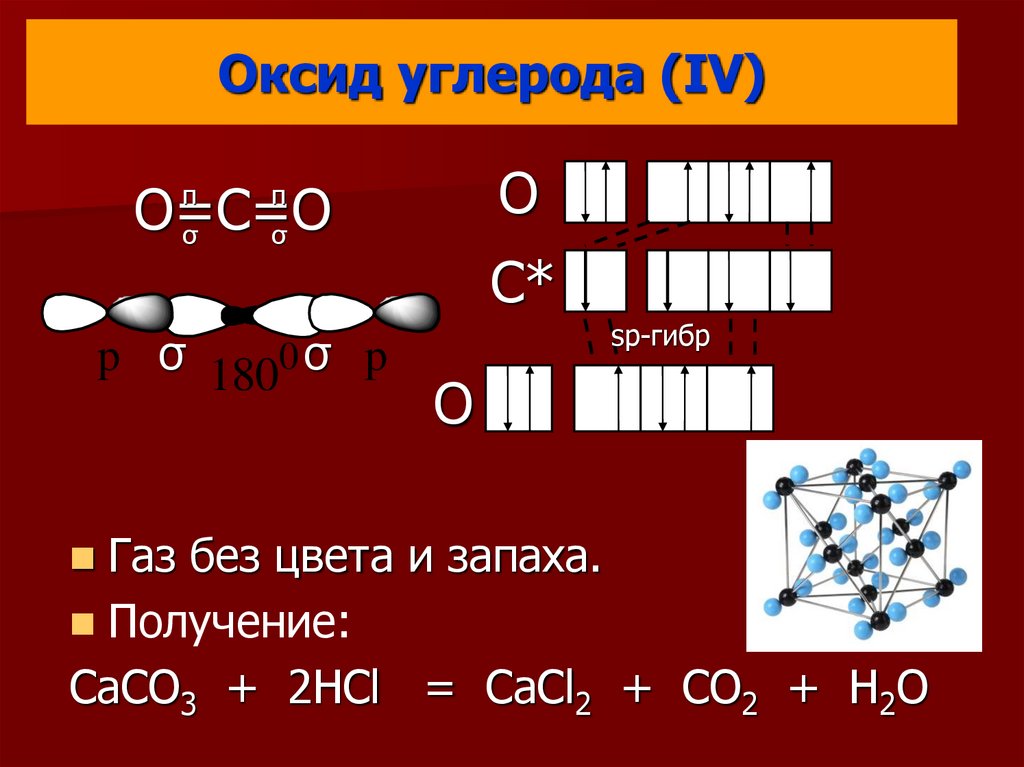
18. Оксид углерода (IV)
OO=С=О
σ
σ
π
π
p σ 1800 σ p
C*
sp-гибр
O
Газ без цвета и запаха.
Получение:
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
19. Химические свойства оксида углерода (IV)
Магний горит в углекислом газеMg + CO2 = 2MgO + C
При 1000оС образуется карбамид (мочевина):
СO2 + 2NH3 = CO(NH2)2 + H2O
Является кислотным оксидом:
H2O + СО2
H2CO3
Качественная реакция:
CO2 + Сa(OH)2 = СаCO3 + H2O
CaCO3 + CO2 + H2O = Ca(HCO3)2
20. Химические свойства угольной кислоты
1.Слабый электролитH2CO3
HCO3–
H+ + HCO3 –
H+ + CO32–
2. Разлагается, поэтому в уравнениях пишут
не угольную кислоту, а углекислый газ.
Карбонаты
1. Гидролизуются
2. Нерастворимые карбонаты
при нагревании разлагаются
ZnCO3 = ZnO + CO2
21. Домашнее задание
Приведите примеры уравненийреакций, характеризующих химические
свойства кислородных соединений
углерода. Не менее 6 уравнений
22. Сероуглерод CS2
Сероуглерод - тяжелая, маслянистаяжидкость, хороший растворитель
лаков, красок, каучуков. Ядовит.
Легко воспламеняется.
CS2 является ангидридом тиоугольной
кислоты H2CS3 :
CS2 + Na2S = Na2CS3
Na2CS3 + 2HCl = H2CS3 + 2NaCl
23. Соединения углерода с азотом
2C + N2 = (CN)2Дициан взаимодействует с водой
(CN)2 + 4H2O = (NH4)2C2O4
Дициан взаимодействует со щелочами:
(CN)2 + 2KOH = KCN + KNCO + H2O
KCN – соль цианистоводородной
кислоты (цианид калия).
KNCO – соль циановой
кислоты (цианат калия).
24. Цианистоводородная (синильная) кислота HCN
Бесцветная жидкость с запахом миндаля,сильнейший яд.
Получение (500оС, катализатор ThO2):
NH3 +CO = HCN + H2O
Эта кислота слабее угольной.
Cоли получаются по реакции:
K2CO3 + C + 2NH3 = 2KCN + 3H2O
Цианиды используются при извлечении
золота из руды и производстве
K4[Fe(CN)6] и K3[Fe(CN)6].
25. Соединения углерода с азотом
Формула HNCO соответствует тремизомерам:
H-O-C N (циановая кислота)
H-N=C=O (изоциановая кислота)
H-O-N=C (гремучая кислота)
26. Галогениды углерода
Соединения углерода с галогенамиполучают косвенным путем, например:
CH4 + Cl2 = CH3Cl + HCl;
CH3Cl + Cl2 = CH2CL2 + HCl
Смешанные галогениды CCl2F2, CCl3F,
CBr3F называются фреонами и
используются в качестве хладагентов в
холодильной технике.
27. Кремний
28.
РАСПРОСТРАНЕНИЕ ЭЛЕМЕНТОВ В ПРИРОДЕКислород
Кремний
Алюминий
Железо
Кремний 26%
Кальций
Натрий
Калий
Магний
Водород
Остальные
29. Нахождение в природе
Кремний в природе содержится в минералах в видеоксида SiO2 (кремнезем).
Общее число минералов, содержащих кремнезем,
превышает 400.
30.
Разновидности кремнезёмаГорный хрусталь
Опал
31.
Яшма – загрязненный кремнеземХалцедон
32. Разновидности кремнезёма
Окраска цитринов обусловлена присутствиемпримесей трехвалентного железа
цитрин
агат
33. Особенности окраски обусловлены присутствием минерала гематита
Разновидности кремнезёмаСердолик
Сардоникс
(оникс)
Особенности окраски обусловлены
присутствием минерала гематита
34. Разновидности кремнезёма
Цвет аметиста обусловлен примесьюХризопраз
органического
красящего вещества.
(содержит никель)
35. Алюмосиликаты
СлюдаПолевой
шпат
К2O∙Al2O3∙6SiO2
36. Хризолит
Ортосиликат железа-магния (Mg,Fe)2SiO437.
Получение кремнияИз кремнезема восстанавлением
магнием или углеродом :
SiO2+2Mg = Si+2MgO
SiO2+С = Si+СО2
При разложении
силана:
SiH4=Si+2H2
38. Химические свойства Si
В реакциях с неметаллами кремний окисляется:Si + O2 = SiO2
Si + 2F2 = SiF4
Si + C = SiC
Кремний растворим в щелочах:
Si + 2NaOH + H2O = Na2SiO3 + 2H2
Нерастворим в кислотах (кроме плавиковой).
Si + 4HF = SiF4 + 2H2
SiF4 + 2HF = H2[SiF6]
В реакциях с металлами восстанавливается:
2Mg + Si = Mg2Si
39. Химические свойства SiO2
SiO2 – атомная решетка, tпл=1715оС,кремний в состоянии sp3-гибридизации.
Взаимодействует с плавиковой кислотой
SiO2
+ 4HF = SiF4 + 2H2O
Кислотный оксид. Растворяется в щелочах:
SiO2
+ 2NaOH = Na2SiO3 + H2O
40. Кремниевая кислота и силикаты
Na2SiO3 – силикат натрия(жидкое стекло, конторский
клей) в водном растворе
сильно гидролизуется.
Кремневую кислоту можно
получить взаимодействием
соли с любой кислотой:
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3
Формулу кремневой кислоты правильно записывать
в виде xSiO2 ∙ yH2O.
При прокаливании кремневой кислоты образуется
SiO2 (силикагель), используется в качестве
поглотителя влаги.
41. Водородные соединения кремния
Водородные соединения (силаны)получают из силицидов:
Mg2Si+4HCl=2MgCl2+SiH4 (моносилан)
Силаны могут быть различного состава
- Si2H6, Si3H8, Si6H14 , ...
Это сильные восстановители, химически
очень активны, на воздухе
самовоспламеняются:
SiH4 + 2O2 = SiO2 + 2H2O
42.
СтеклоСтекло – аморфный сплав. Имеет
только ближний порядок, не имеет
четких температур плавления и кипения.
Сырьем для производства стекла
являются сода, известняк и песок:
Na2CO3 + CaCO3 + 6SiO2 1400 C>
Na2O∙CaO∙6SiO2 + 2CO2
Виды стекла: кварцевое стекло, хрусталь
(К, Рb), химическое стекло (В)
43.
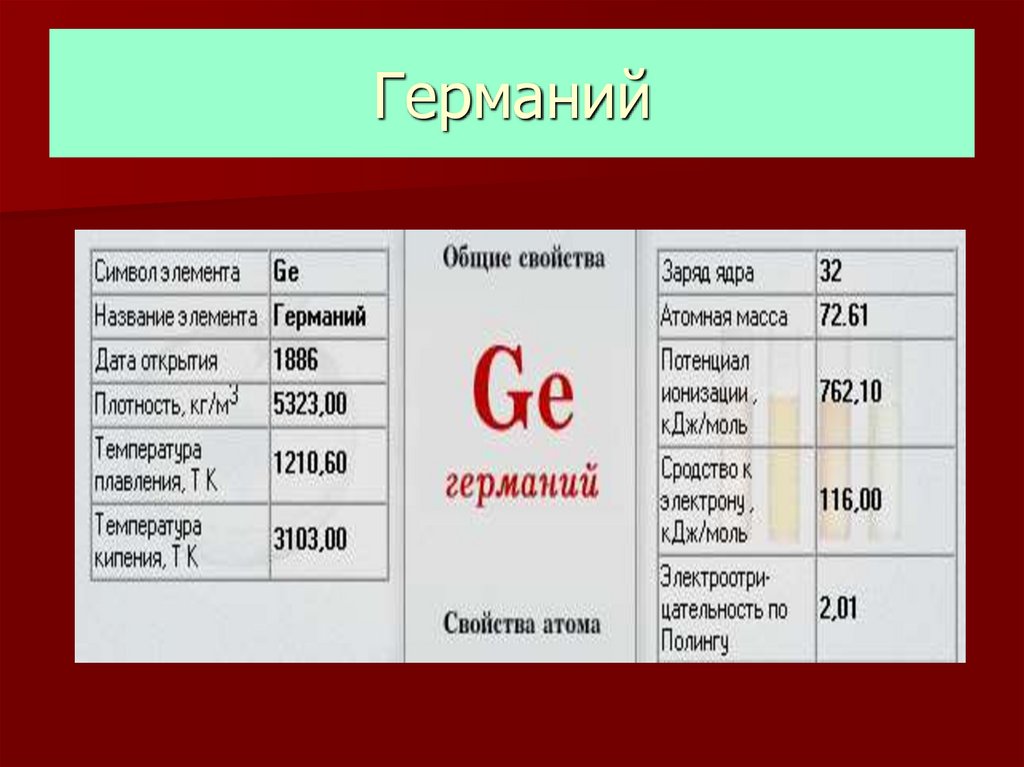
Применение44. Германий
45. Нахождение в природе
Собственные минералы германиявстречаются исключительно редко.
Германий встречается с рудами
цинка, олова, свинца, присутствует
почти во всех силикатах, внедряясь
в
кристаллические
решётки минералов.
46. Получение
Вначале получают четыреххлористыйгерманий GeCl4 , который растворяют в
воде :
GeCl4 + H2O =
GeO2 + 4HCl
GeO2 + 2H2 =
Ge + 2H2O
47. Химические свойства
При нормальных условиях устойчив к действиювоздуха и воды, щелочей и кислот.
При нагревании взаимодействует с кислородом,
серой, хлором.
Ge + 2S = GeS2
Растворим в азотной кислоте, царской водке и
в щелочном растворе перекиси водорода:
Ge + 4HNO3 = H2GeO3 + 4NO2 + H2O
Ge + 2NaOH + 2H2O2 = Na2[Ge(OH)6]
48. Оксиды германия
Германий образует GeO и GeO2 оба оксидаамфотерны:
GeO + 2HCl = GeCl2 + H2O
GeO + 2NaOH = Na2GeO2 + H2O
германит
Гидролиз солей анионного типа идет
практически необратимо:
Na2GeO2 + 2H2O = 6 Ge(OH)2 ↓ + 2NaOH
Соли катионного типа гидролизуются только
по I ступени, т.к. получающиеся основные
соли выпадают в осадок:
GeCl2 + H2O = GeOHCl + HCl
49. Гидроксиды германия
Гидроксиды германия можно получить придействии на соли щелочей:
GeCl2 + 2NaOH = Ge(OH)2 ↓ + 2NaCl
GeCl4 + 4NaOH = Ge(OH)4 ↓ + 4NaCl
Оба гидроксида амфотерны:
Ge(OН)2 + 2HCl = GeCl2 + 2H2O
Ge(OН)2 + 2NaOH = Na2[Ge(OH)4]
Sn(OH)4 + H2SO4 = Sn(SO4)2 + H2O
Sn(OH)4 + 2NaOH = Na2[Sn(OH)6]
50. Применение
Применение находят сплавы германияи стёкла на основе диоксида германия.
Полупроводниковая техника
Дозиметрические приборы
Инфракрасная техника
51. Олово и свинец
52. Нахождение в природе
Нахождениев
природе.
Нахождение в природе
Получение.
В природе олово и свинец
обычно встречаются в виде:
SnO2 – кассетерит,
PbS – свинцовый блеск.
Олово получают восстановлением углеродом из оксида.
Свинец получают обжигом
сульфида с последующим
восстановлением СО :
2PbS + 3О2 = 2PbО + 2SО2
PbО + СО = Pb + СО2
53. «Оловянная чума»
При температуре ниже 13,2 °C β-олово переходит вα- модификацию. происходит увеличение удельного
объёма олова на 25,6 %. Олово трескается и
превращается в порошок. Причём соприкосновение
серого (α-) олова и белого (β-) приводит к
«заражению» последнего. Эти явления называют
«оловянной чумой».
«Оловянная чума» — одна из причин гибели
экспедиции Скотта к Южному полюсу в 1912 г. Она
осталась без горючего из-за того, что топливо
просочилось из запаянных оловом баков,
поражённых «оловянной чумой».
«Оловянная чума» — одно из обстоятельств
поражения армии Наполеона в России — сильные
морозы привели к превращению оловянных пуговиц
на мундирах солдат в порошок.
54. Химические свойства
1. При нагревании реагируют с кислородом, серой,хлором, не реагируют с водородом, углеродом,
азотом.
2Pb + O2 = 2PbO
Sn + O2 = SnО2
(Образуется оксидная пассивирующая пленка SnО2)
2. Олово с водой не взаимодействует. Свинец
медленно растворяется в воде:
2Pb + O2 + 2H2O = 2Pb(OH)2
Олово вытесняет водород из кислот:
Sn + H2SO4 (pазб) = SnSO4 + H2
Sn + 2HCl = SnCl2 + H2
Аналогичные реакции со свинцом практически не
идут, т.к. PbCl2 и PbSO4 плохо растворимы.
55.
Химические свойстваСвинец и олово взаимодействуют с разбавленной
азотной кислотой:
3Pb + 8HNO3 (разб) = 3Pb(NO3)2 + 2NO + 4H2O
3Sn + 8HNO3 (разб) = 3Sn(NO3)2 + 2NO + 4H2O
В концентрированной азотной кислоте cвинец
пассивируется. Олово взаимодействует с конц
HNO3:
Sn + 4HNO3 = H2SnO3 + 4NO2 + H2O
В горячей концентрированной H2SO4 при
нагревании олово и свинец растворяются, образуя
Sn(SO4)2 или Pb(SO4)2 и SO2.
При нагревании в концентрированных растворах
щелочей:
Sn + 2КОН + 4Н2О = K2[Sn (OH)6] + 2H2
56. Оксиды и гидроксиды олова и свинца
Все оксиды и гидроксиды олова и свинцаамфотерны.
PbO2 можно получить по реакции:
Pb(CH3COO)2 + CaOCl2 + H2O =
PbO2↓ + CaCl2 + 2CH3COOH
Существует смешанный оксид свинца
Pb3O4 – свинцовый сурик.
Pb3O4 + 4HNO3 = PbO2↓ + 2Pb(NO3)2 + 2H2O
разб
57. Применение олова
Безопасное, нетоксичное,коррозионностойкое покрытие.
В белой жести (лужёное железо)
для изготовления тары пищевых
продуктов.
В припоях для электроники, в домовых
трубопроводах, в подшипниковых
сплавах.
Сплав олова с медью — бронза,
сплав с цинком (упаковочная
фольга).
Дисульфид олова SnS2 применяют в составе красок,
имитирующих позолоту («поталь»).
58. Области применения свинца
МеталлургияХимическая
промышленость
Цветные и
чёрные металлы
Транспортная
промышленность
Наука
Стекольная
промышленность
Кабельная
промышленность
Оборонная
промышленность
Медицина
Электротехника
59. Флеровий
Флеро́ вий (лат. Flerovium, Fl), ранее былизвестен как унунква́ дий
(лат. Ununquadium, Uuq), использовалось
также неофициальное название экасвинец — 114-й химический элемент
периодической системы.
60. Изотопы
61. Химические свойства
В некоторых исследованиях былиполучены указания на то, что Флеровий
по химическим свойствам похож не на
свинец, а на благородные газы. Это
поведение объясняется заполнением
стабилизирующей 7p2 подоболочки
валентных электронов, предсказанной
расчётами с учётом релятивистских
эффектов в электронной оболочке
сверхтяжёлых атомов.
62. Домашнее задание
Составьте интеллект карту «Общаяхарактеристика элементов IV группы»
По плану:
1. Строение атомов
2. Физические свойства и нахождение в
природе
3. Химические свойства
4. Применение



























































 chemistry
chemistry








