Similar presentations:
Химия элементов. Электронные конфигурации элементов VА-группы
1. ХИМИЯ ЭЛЕМЕНТОВ
2. Электронные конфигурации элементов VА-группы
…ns2np33.
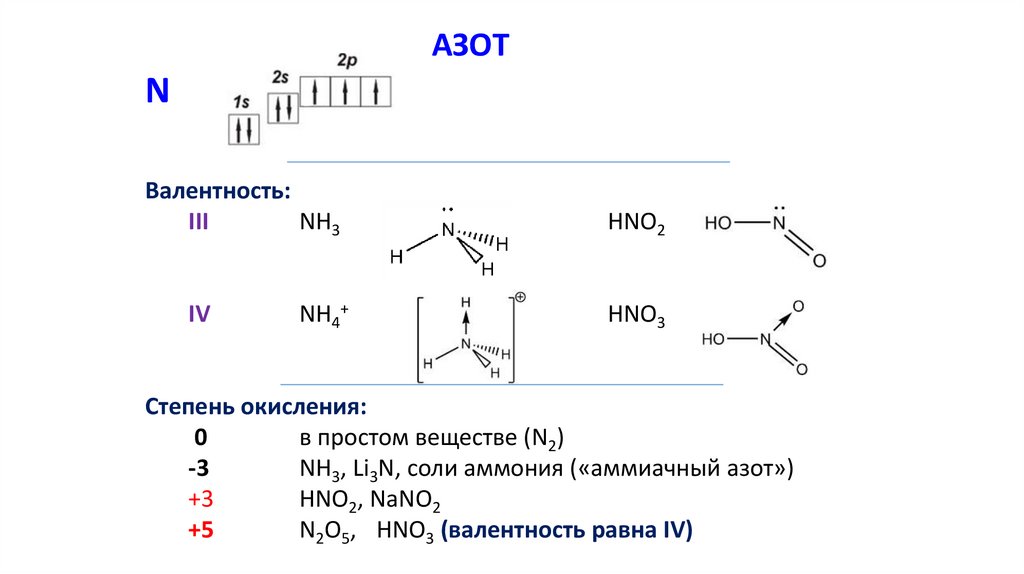
АЗОТN
Валентность:
III
NH3
IV
NH4+
HNO2
HNO3
Степень окисления:
0
в простом веществе (N2)
-3
NH3, Li3N, соли аммония («аммиачный азот»)
+3
HNO2, NaNO2
+5
N2O5, HNO3 (валентность равна IV)
4.
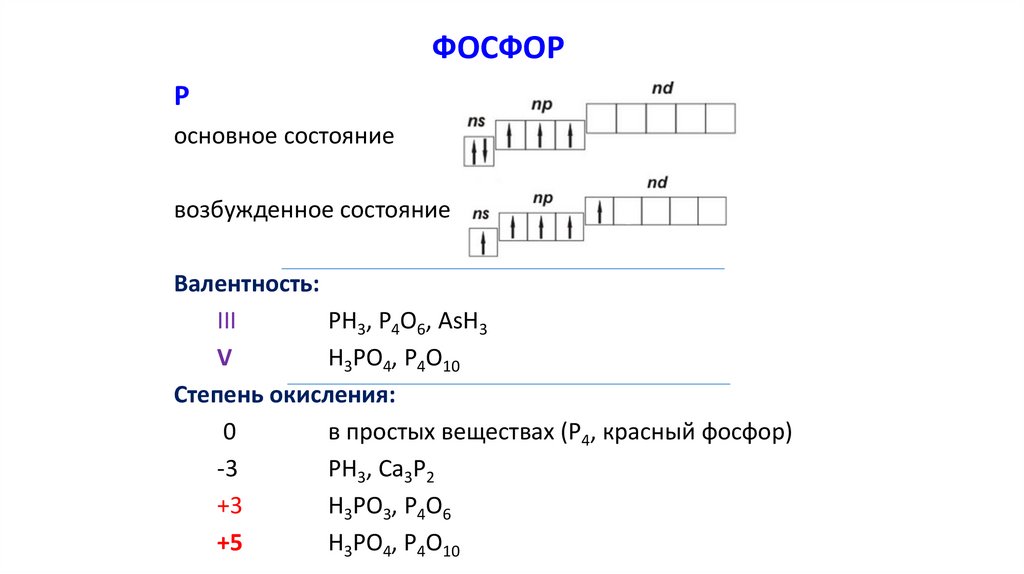
ФОСФОРР
основное состояние
возбужденное состояние
Валентность:
III
PH3, P4O6, AsH3
V
H3PO4, P4O10
Степень окисления:
0
в простых веществах (P4, красный фосфор)
-3
PH3, Ca3P2
+3
H3PO3, Р4O6
+5
H3PO4, P4O10
5.
РАСПРОСТРАНЕННОСТЬ АЗОТА В ПРИРОДЕВ природе азот встречается в как свободном виде,
так и в виде соединений
Азот – четвертый по распространенности во Вселенной
элемент, после H, He, O
В атмосфере φ(N2) ≈ 78%
Входит в состав белков, РНК и ДНК
6.
Физические свойства азотаtпл.
N2
-210 o C
tкип.
-196o C
Eсв, кДж/моль
946
(ниже, чем у кислорода)
Газ без цвета и запаха, плохо растворим в воде, в твердом
состоянии имеет молекулярную кристаллическую структуру.
Атомы в молекуле связаны тройной связью
N≡N (1σ- и 2π-связи)
При t = 3000о С степень диссоциации азота на атомы
составляет 0,75 %
Не реагирует с кислотами и щелочами
7.
Окислительные свойстваАзот проявляет окислительные свойства во всех реакциях,
кроме реакций с O2 и F2
Взаимодействие с металлами
При комнатной температуре реагирует только с литием:
6Li + N2 → 2Li3N – нитрид лития
При нагревании реагирует с другими активными
металлами:
t
3Mg + N2 Mg3N2
Нитриды металлов – твердые вещества, легко
разлагаются водой:
Li3N + 3H2O = 3LiOH + NH3↑
8.
Восстановительные свойства, взаимодействие скислородом
С кислородом реагирует при температуре 3000 о С:
разряд, t 3000 C
O2
N2 +
Обратите внимание:
o
2NO
• В данной реакции лишь незначительное количество азота и
кислорода превращаются в оксид азота(II)
• Реакция протекает в очень жестких условиях. Поэтому, при
рассмотрении процессов горения смесей, содержащих
молекулярный азот, в кислороде взаимодействие азота с
кислородом НЕ учитывают
9.
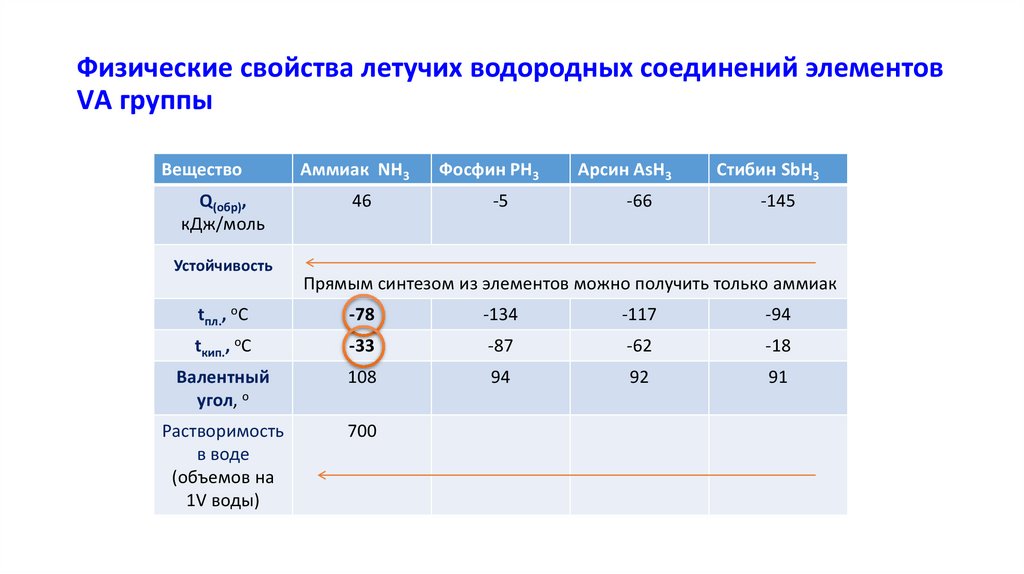
Физические свойства летучих водородных соединений элементовVА группы
Вещество
Q(обр),
кДж/моль
Аммиак NH3
46
Фосфин PH3
-5
Арсин AsH3
-66
Cтибин SbH3
-145
Устойчивость
Прямым синтезом из элементов можно получить только аммиак
tпл., оС
-78
-134
-117
-94
tкип., оС
-33
-87
-62
-18
Валентный
угол, о
108
94
92
91
Растворимость
в воде
(объемов на
1V воды)
700
10. Физические свойства летучих водородных соединений элементов VА группы
Аммиак – бесцветный газ с резким запахом3 %-ный раствор – нашатырный спирт
25 %-ный раствор – аммиачная вода
При испарении аммиака поглощается много тепла,
поэтому он используется в холодильных
установках
В отличие от HCl, при нагревании раствора аммиака
до кипения NH3 полностью улетучивается
11.
Химические свойства аммиакаNH3 является слабым основанием (Kb = 1,8·10-5):
NH3 + HCl = NH4Cl
NH3 проявляет за счет азота только восстановительные свойства:
t
4 NH 3 3O2
2 N 2 6 H 2O
12.
ЗаданиеКакие из перечисленных факторов увеличивают
скорость синтеза аммиака, а какие способствуют
смещению равновесия реакции вправо:
а) увеличение внешнего давления;
б) увеличение температуры;
в) удаление аммиака из реакционной смеси;
г) увеличение концентрации водорода
Ответ:
скорость – а) б) г)
равновесие – а) в) г)
13.
Соли аммонияNH4Cl – сублимируется при 350 оС
Сульфиды, карбонаты летучи
NH4NO3 – удобрение, входит в состав ВВ
(NH4)2SO4 – удобрение
Внутримолекулярное окисление-восстановление:
NH4NO3 N2O
NH4NO3 N2
(NH4)2Cr2O7
14. Соли аммония
1N 2O
- «веселящий газ»
Бесцветный газ со слабым приятным запахом и
сладковатым вкусом. Несолеобразующий оксид.
tкип. = -89,5 оС
0
+2
N
N
sp
-2
O
Молекула линейная
Получение
t
NH 4 NO3
N 2O 2 H 2O
15.
2NO
оксид азота(II)
свободный радикал
Бесцветный газ. tпл. = -164 оС tкип. = -152 оС
Несолеобразующий оксид. Поддерживает горение.
При обычных условиях быстро окисляется на
воздухе:
2 NO O 2 NO
2
2
Получение
В промышленности:
1.
2.
Pt , t
4 NH 3 5O2
4 NO 6 H 2O
3000 0 C
2 NO Q ( 5%)
N2 O2
В лаборатории:
3Cu 8HNO3 ( разб.) 3Cu( NO3 )2 2 NO 4 H 2O
16.
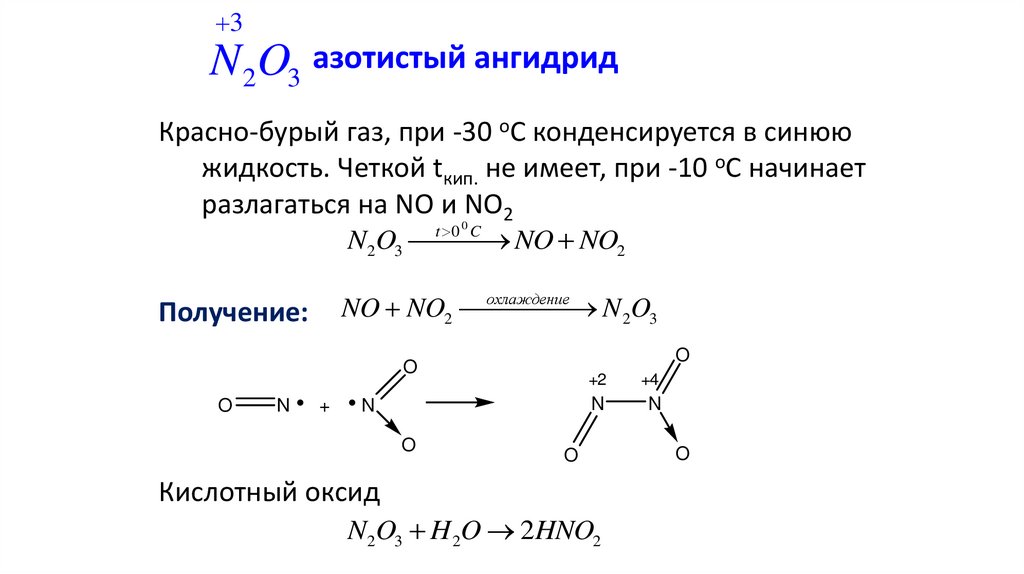
3N 2O3 азотистый ангидрид
Красно-бурый газ, при -30 оС конденсируется в синюю
жидкость. Четкой tкип. не имеет, при -10 оС начинает
разлагаться на NO и NO2
t 0 0 C
N2O3 NO NO2
охлаждение
NO NO2
N 2O3
Получение:
O
O
O
N
+
N
O
+2
+4
N
N
O
Кислотный оксид
N2O3 H 2O 2HNO2
O
17.
4NO2
- оксид азота(IV)
Газ бурого цвета. «Лисий хвост»
18.
NO2, N2O4При +22 оС NO2 конденсируется в бурую жидкость,
при -10 оС образуются бесцветные кристаллы
димера N2O4
O2N• + •NO2 ⇄ NO2–NO2 (рекомбинация радикалов)
При температуре ниже 140 оС имеет место
равновесие:
2NO2 ⇄ N2O4 + 57,2 кДж
19. NO2, N2O4
Получение NO2В промышленности:
2 NO O2 2 NO2
В лаборатории:
Cu 4HNO3 (конц.) Cu( NO3 )2 2 NO2 2H 2O
NO2 является сильным окислителем,
поддерживает горение:
C 2 NO2 2 NO CO2 ( горение)
При взаимодействии с водой образует смесь азотной и
азотистой кислот (смешанный ангидрид):
4
5
3
2 NO2 H 2O HNO3 HNO2 (диспропорционирование)
20.
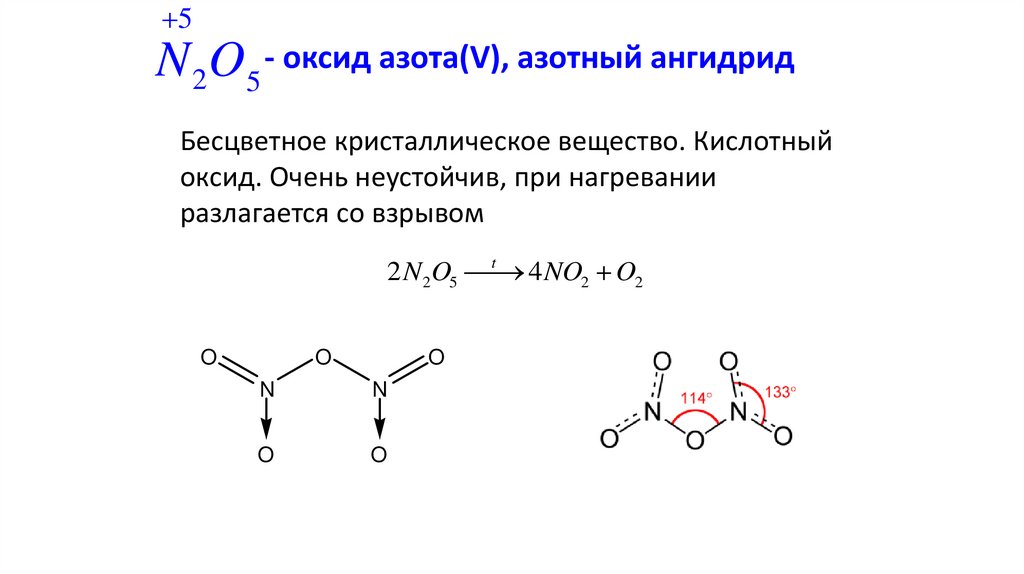
5N 2O5 - оксид азота(V), азотный ангидрид
Бесцветное кристаллическое вещество. Кислотный
оксид. Очень неустойчив, при нагревании
разлагается со взрывом
t
2 N 2O5
4 NO2 O2
O
O
O
N
N
O
O
21.
АЗОТНАЯ КИСЛОТАHNO3 – бесцветная жидкость с резким запахом, дымящая на
воздухе за счет протекания реакции:
4HNO3 = 4NO2 + 2H2O + O2
22. АЗОТНАЯ КИСЛОТА
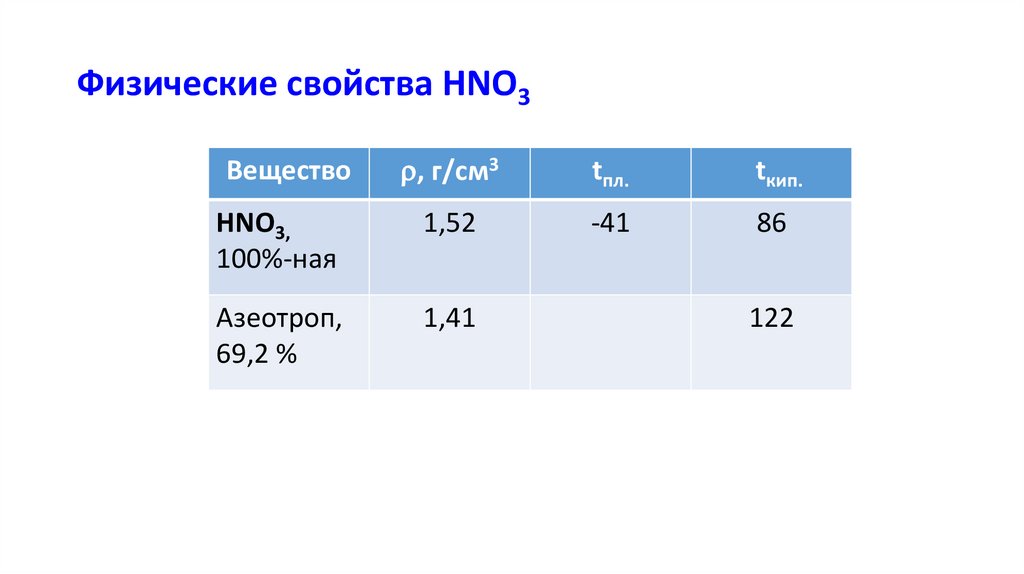
Физические свойства HNO3, г/см3
tпл.
tкип.
HNO3,
100%-ная
1,52
-41
86
Азеотроп,
69,2 %
1,41
Вещество
122
23.
Продукты взаимодействия HNO3 сметаллами
Чем ниже концентрация кислоты и чем активнее металл, тем глубже
восстанавливается азот.
Неметаллы восстанавливают HNO3 до NO2 и NO
24. Физические свойства HNO3
HNO3 – окислительКонцентрированная азотная кислота без нагревания не реагирует
с Fe, Al и Cr.
При нагревании указанные металлы реагируют с
концентрированной азотной кислотой:
t
Fe + 6HNO3 (к)
Fe(NO3 )3 + 3NO2 3H2O.
С разбавленной азотной кислотой Fe, Al и Cr реагируют без
нагревания.
25.
Царская водкаСмесь концентрированной азотной и соляной кислот
называется царской водкой.
В ней растворяются золото и платина:
Au + HNO3 3HCl AuCl3 + NO 2H2O.
26.
Получение HNO3Производство HNO3 включает три стадии:
1. Каталитическое окисление аммиака до оксида азота(II):
t, Pt
4NH3 + 5O2
4NO + 6H2O
2. Окисление оксида азота(II) до оксида азота(IV):
2NO + O2 = 2NO2
3. Поглощение смеси оксида азота(IV) с кислородом водой:
4NO2 + O2 + 2H2O = 4HNO3
27.
НИТРАТЫНитраты щелочных, щелочноземельных металлов и аммония
называются селитрами:
NaNO3
KNO3
Ca(NO3)2
NH4NO3 -
чилийская селитра
индийская селитра
норвежская селитра
аммиачная селитра
Термическое разложение нитратов
до Mg
Me(NO2) 2 + O2
от Mg до Cu
Me(NO3)2
MeO + NO2 + O2
после Cu
Me + NO2 + O2
28.
Окислительные свойства нитратовЧерный порох
Нитрат калия, наряду с углем и серой, входит в состав
черного пороха, где выступает в качестве окислителя:
2KNO3 + S + 3C
t
K2S + N2 + 3CO2
29.
ФОСФОРФосфор природе встречается только в виде
соединений
Основные соединения фосфора - фосфориты и
апатиты, основной фосфорсодержащий
компонент которых Ca3(PO4)2
Фторапатит – Ca5F(PO4)3
30.
Получение фосфораCa3 ( PO4 ) 2 3SiO2 5C 3CaSiO3 2 P 5CO
15000 C
В парáх существует только Р4
31.
Химические свойства фосфораОкислительные свойства
При нагревании фосфор взаимодействует с активными металлами:
t
3Mg 2 P
Mg3 P2
фосфид магния
Восстановительные свойства
Окисляется кислородом:
4 P 3O2 (нед.)
P4O6
500 C
t
4 P 5O2
P4O10
Дипропорционирует со щелочами (расставьте коэффициенты):
P KOH H 2O PH 3 KH 2 PO2
гипофосфит калия
32.
Оксид фосфора(V), фосфорный ангидридP2O5 (P4O10)
P2O5 - белое кристаллическое вещество (tпл > 300 оС).
Расплывается на воздухе. Кислотный оксид.
Одно из самых сильных водоотнимающих средств:
P2O5 H 2 SO4 SO3 2 HPO3
P2O5 C6 H12O6 6C P2O5 6 H 2O
Строение молекулы P4O10
33.
Ортофосфорная кислота H3PO4При растворении в воде P2O5 образует слабую трехосновную
фосфорную кислоту (H3PO4, tпл = 42 оС):
P2O5 3H 2O (изб.) 2 H 3 PO4
+5, V
При нормальных условиях H3PO4 твердое вещество
34.
Получение фосфорной кислотыВ промышленности:
Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4
35.
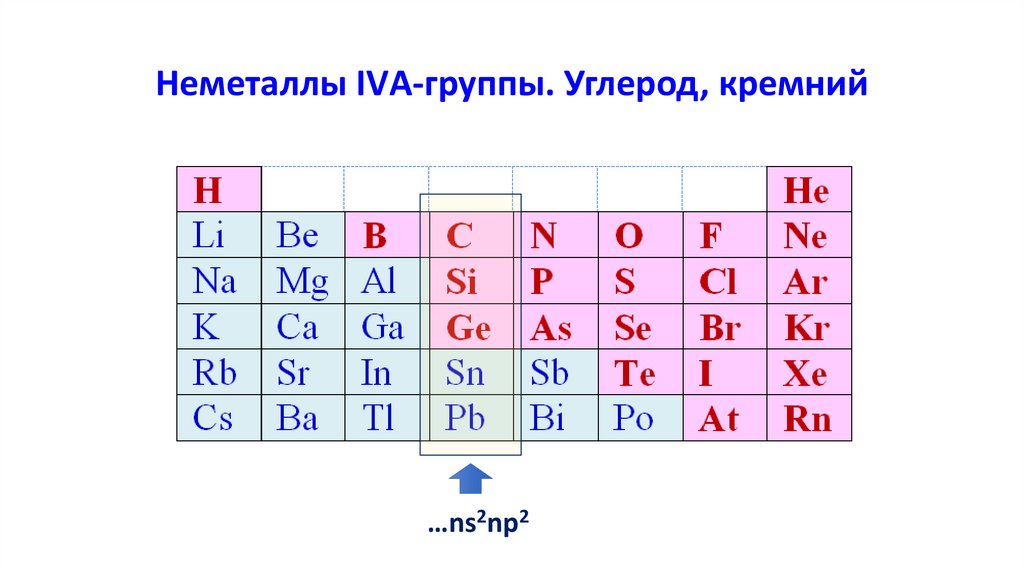
Неметаллы IVА-группы. Углерод, кремний…ns2np2
36.
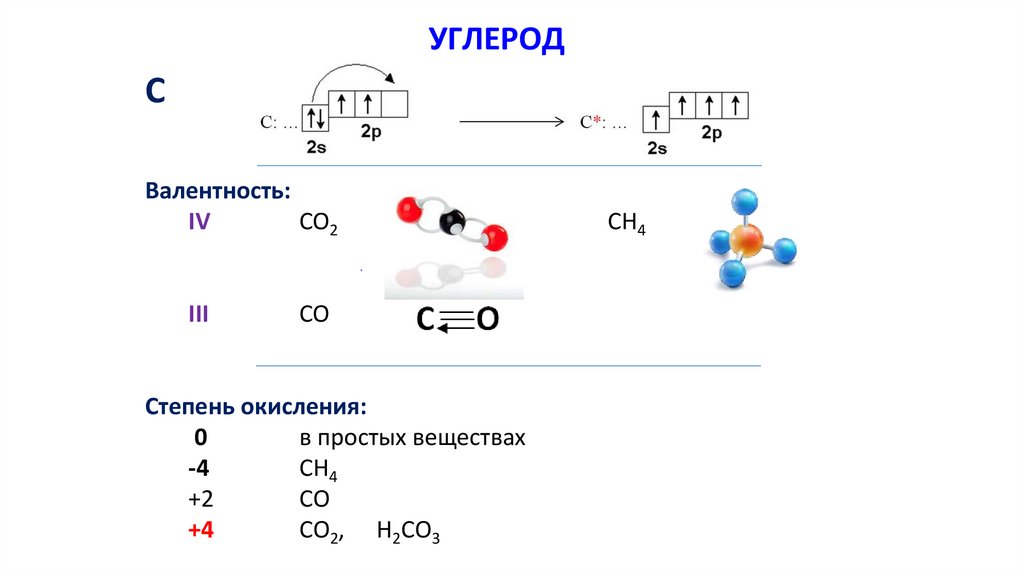
УГЛЕРОДС
Валентность:
IV
CO2
III
CO
Степень окисления:
0
в простых веществах
-4
СH4
+2
СО
+4
СO2, H2СO3
CH4
37.
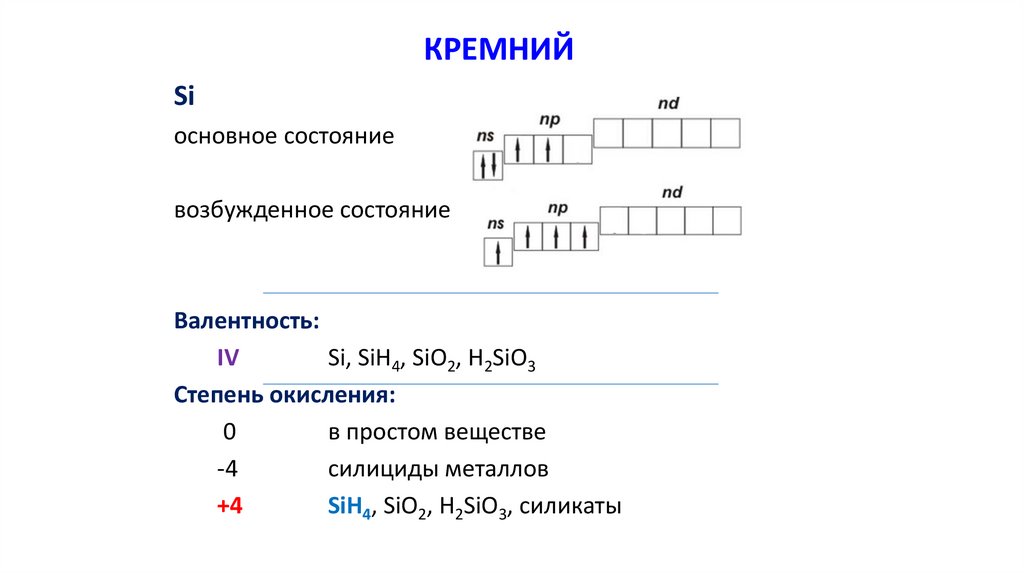
КРЕМНИЙSi
основное состояние
возбужденное состояние
Валентность:
IV
Si, SiH4, SiO2, H2SiO3
Степень окисления:
0
в простом веществе
-4
силициды металлов
+4
SiH4, SiO2, H2SiO3, силикаты
38. Неметаллы IVА-группы. Углерод, кремний
Аллотропные модификации углеродаГрафит
Алмаз
Карбин
39.
Бриллиант «Шах» (88,7 карата)40.
Алмаз «Куллинан» (3106 карат)41. Аллотропные модификации углерода
Большая звезда Африки (530,2 карат)42. Бриллиант «Шах» (88,7 карата)
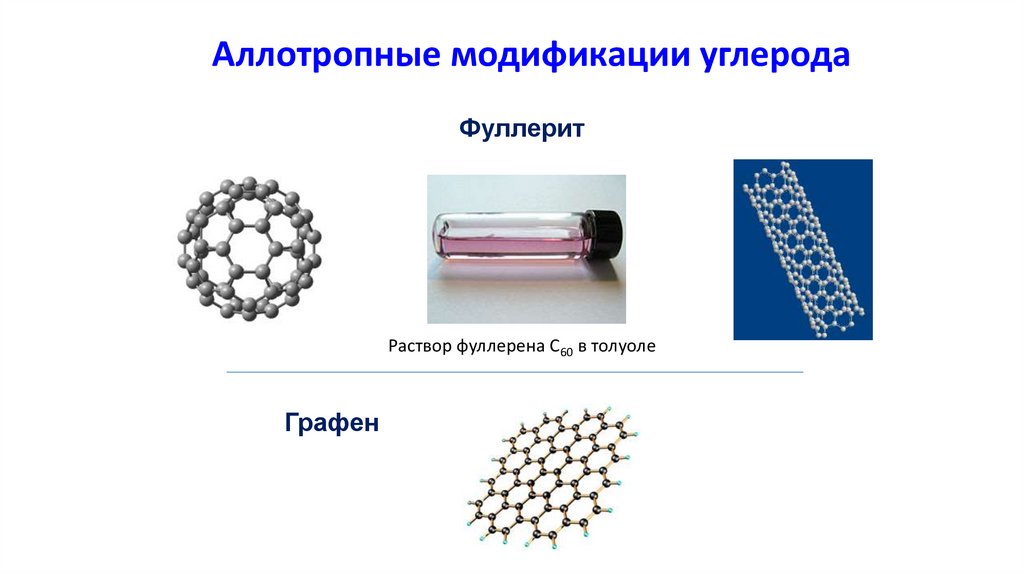
Аллотропные модификации углеродаФуллерит
Раствор фуллерена С60 в толуоле
Графен
43. Алмаз «Куллинан» (3106 карат)
Применение углерода1. Алмаз
Драгоценные камни, режущие и абразивные
материалы
2. Графит
Карандаши, электроды, тигли для плавки металлов
3. Аморфный углерод
Краски (сажа), топливо (кокс), восстановитель для
получения Fe, Cr, Si и др.
44. Большая звезда Африки (530,2 карат)
Оксид углерода(II), угарный газ СОБесцветный газ (tкип. = -102 оС), без запаха, очень ядовит, образуется
при сгорании угля в недостатке кислорода:
t 10000 C
2C O2 (нед.)
2CO
Атомы в молекуле связаны тройной связью. Молекула очень
прочная
CO – несолеобразующий оксид
45. Аллотропные модификации углерода
Оксид углерода(IV), углекислый газ СО2Бесцветный газ, без запаха, не поддерживает горение и
дыхание, образуется при полном сгорании угля:
t 10000 C
C O2 (изб.)
CO2
Молекула линейная и неполярная:
O=C=O
46.
Физические свойства СО2Содержание в воздухе – 0,03 об. %
В атмосфере Венеры – 95 %
Сжижается при 20 оС, 50 атм,
образуется «сухой лед»
tсубл. = -78 оС
Растворимость – один объем СО2 в одном объеме воды при
комнатной температуре, 1 % этого количества образует угольную
кислоту Н2СО3
47.
Химические свойства СО2Взаимодействует:
• с водой
СО2 + Н2О ⇄ Н2СО3
растворами щелочей и твердыми щелочами
2CO2 (изб.) Ca(OH )2 Ca( HCO3 )2
CO2 Ca(OH ) 2 (изб.) CaCO3 H 2O
основными оксидами:
t
CO2 MgO
MgCO3
CO2 не поддерживает горение, но предварительно зажженный Mg
горит в атмосфере CO2:
t
CO2 2Mg
2MgO C
48.
Получение СО21. Сжигание угля и органических веществ:
t
CH 4 2O2
CO2 2 H 2O
2. Разложение известняка:
CaCO3
CaO CO2
9000 C
3. В лаборатории получают действием соляной кислоты на мрамор или мел:
CaCO3 2 HCl CaCl2 H 2O CO2
Вопрос:
Как удалить влагу из CO2?
49.
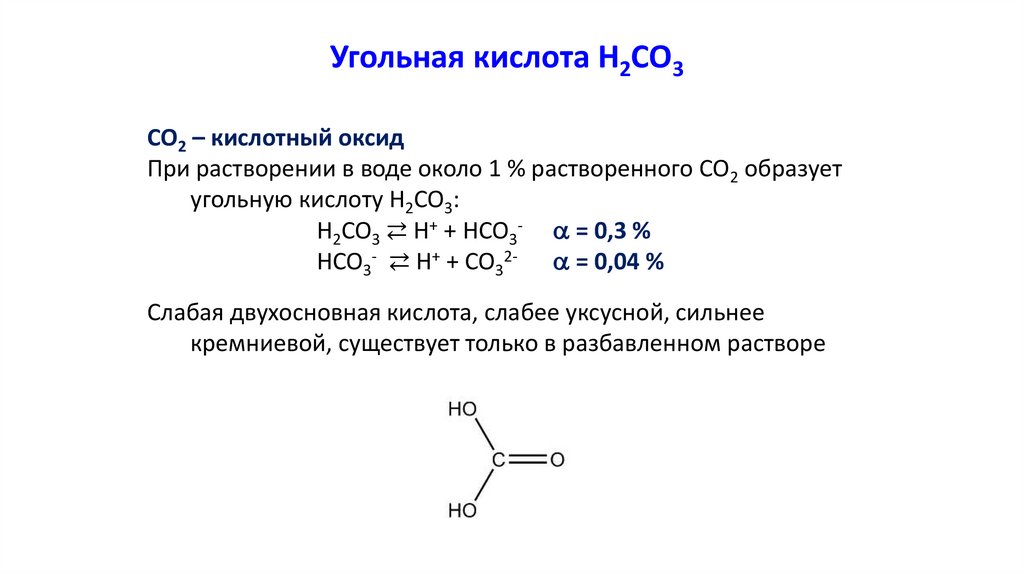
Угольная кислота Н2СО3CO2 – кислотный оксид
При растворении в воде около 1 % растворенного СО2 образует
угольную кислоту Н2СО3:
H2CO3 ⇄ H+ + HCO3- = 0,3 %
HCO3- ⇄ H+ + CO32- = 0,04 %
Слабая двухосновная кислота, слабее уксусной, сильнее
кремниевой, существует только в разбавленном растворе
50.
Химические свойства H2CO3Со щелочами образует два типа солей – карбонаты и гидрокарбонаты:
CO2 2 NaOH (изб.) Na2CO3 H 2O
CO2 (изб.) NaOH NaHCO3
Вытесняет кремниевую кислоту из растворов силикатов:
Na2 SiO3 2 H 2O 2CO2 H 2 SiO3 2 NaHCO3 .
При действии более сильных кислот на ее соли образующаяся Н2СО3 сразу же
разлагается:
CH 3COOH NaHCO3 CH 3COONa H 2O CO2
CH 3COOH HCO3 CH 3COO H 2O CO2
51.
Что такое сода?• Кальцинированная сода
Na2CO3
• Кристаллическая сода
Na2CO3 ·10H2O
• Питьевая сода
NaHCO3
• Каустическая сода
NaOH
52.
Жесткость водыЖесткость воды обусловлена наличием в ней ионов Ca2+ и Mg2+
Временная жесткость:
Обусловлена присутствием гидрокарбонатов кальция и магния.
При кипячении такой воды, происходит разложение солей, и
образуется белый налет нерастворимого карбоната –
“накипь”
Соли имеют низкую тепло- и электропроводность. Поэтому налет
карбоната кальция, покрывающий, например спираль
электрочайника, препятствует передаче тепла от спирали к
воде. В результате спираль перегревается и сгорает.
кипячение
Ca(HCO3 )2(p p)
CaCO3 CO2 H 2O.
"накипь"или
"известковый налет"
53.
Накипь54. Что такое сода?
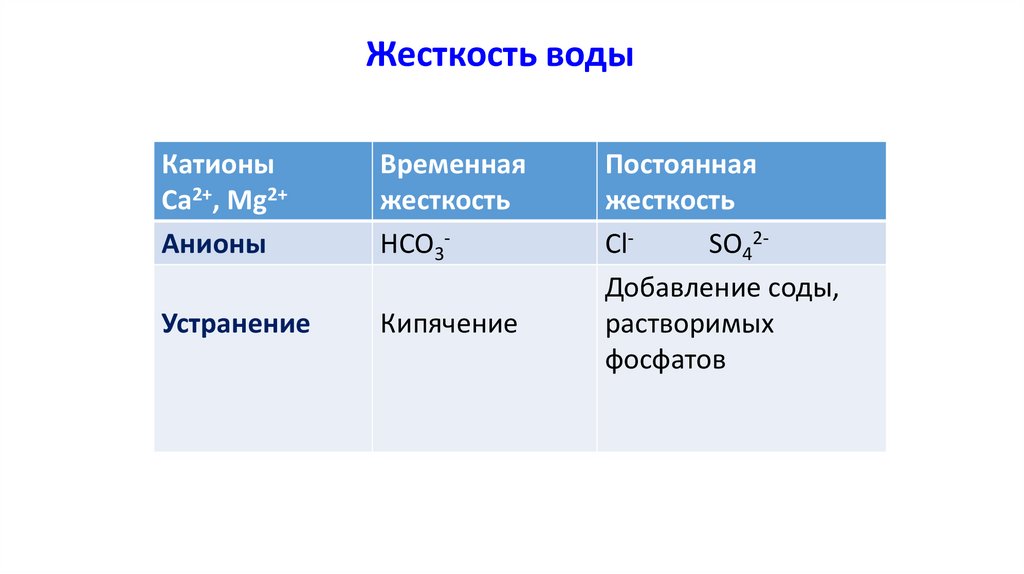
Жесткость водыКатионы
Са2+, Mg2+
Анионы
Временная
жесткость
HCO3-
Устранение
Кипячение
Постоянная
жесткость
ClSO42Добавление соды,
растворимых
фосфатов
55.
ЗаданиеПонизить жесткость воды (20 оС) можно, добавив
в нее:
А) Na2CO3
Б) MgCl2
В) KHCO3
Г) Ca(OH)2
1) а, б;
ЦТ-2016
2) а, г;
3) б, в;
4) б, г
56.
Другие вариантыПонизить жесткость воды (20 оС) можно, добавив
в нее:
Ba(OH)2
Mg(HCO3)2
K3PO4
ЦТ-2016
57.
КремнийРаспространенность в природе
В встречается только в виде соединений (силикаты).
Занимает второе место по распространенности в
земной коре.
58.
Физические свойстваВещество серо-стального цвета с металлическим блеском, обладает
полупроводниковыми свойствами.
Атомная алмазоподобная кристаллическая структура.
tпл. = 1420 оС.
Атомы кремния не образуют кратных связей.
Не имеет аллотропных модификаций.
Si менее прочен, чем алмаз
59.
Химические свойства кремнияРастворяется в плавиковой кислоте:
Si 4 HF SiF4 2 H 2 .
НЕ реагирует с концентрированными HNO3 и H2SO4!
Растворяется в щелочах при нагревании:
Si 2 NaOH H 2O Na2 SiO3 2 H 2 .
60. Задание
Оксид кремния (IV), кремнезем, кварцБелое кристаллическое тугоплавкое вещество, tпл. = 1713 оС.
Атомная кристаллическая структура:
SiO2 – кислотный оксид, ему соответствует кремниевая кислота
H2SiО3. Не реагирует с водой!
SiO2 H 2O
61. Другие варианты
Химические свойства SiO2Взаимодействует с концентрированными растворами щелочей и
твердыми щелочами:
t
SiO2 2 NaOH
Na2 SiO3 H 2O.
Взаимодействует с твердыми карбонатами:
t
SiO2 Na2CO3
Na2 SiO3 CO2 .
Взаимодействует с F2 и HF:
SiO2 2F2 SiF4 O2
SiO2 4 HF SiF4 2 H 2O
62.
Кремниевая кислота H2SiO3Твердое вещество, не растворяется в воде.
Слабая двухосновная кислота (слабее угольной):
Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3
SiO32– + CO2 + H2O = H2SiO3 + CO32–
Получение
Выпадает в осадок при действии кислот на растворы силикатов:
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl
SiO32- + 2H+ = H2SiO3
63.
Химические свойства H2SiO3Разлагается при нагревании, образуя силикагель:
t
H 2 SiO3
SiO2 H 2O.
Реагирует со щелочами образуя силикаты:
H 2 SiO3 2 NaOH Na2 SiO3 2H 2O.
Растворимые силикаты (Na2SiO3, K2SiO3) – жидкие стекла.
64.
СтеклоNa2CO3 + CaCO3 + 6SiO2 = Na2O CaO 6SiO2 + 2CO2
сода
известняк
песок
стекло
65.
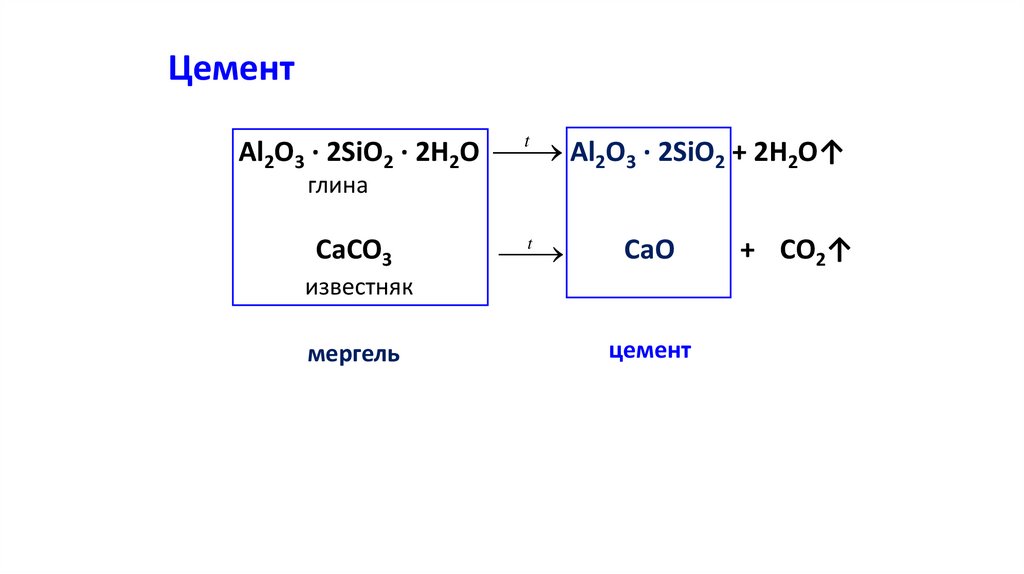
ЦементAl2O3 · 2SiO2 · 2H2O
Al2O3 · 2SiO2 + 2H2O↑
t
глина
CaCO3
t
CaO
известняк
мергель
цемент
+ CO2↑
66.
67.
§ 44 – 46Задание 5 к § 44
Задание 6 к § 45
Задание 7а к § 46





















































 chemistry
chemistry