Similar presentations:
Карбонаты и гидрокарбонаты. Тест – экспресс
1.
2.
Тест – экспресс1) Электронная конфигурация атома углерода
2) Разновидности простого вещества, образованные
одним и тем же химическим элементом
3) Количество электронов на внешней электронной
оболочке элементов IV группы главной подгруппы
4) Летучие водородные соединения углерода
5) Формула высших оксидов элементов IVа группы
6) Масса 0,5 моль углерода
7) Объем 2 моль метана при н.у.
8) Чего больше по массе в угарном газе – кислорода
или углерода
9) Степень окисления углерода в угарном и
углекислом газах
10) Где больше атомов – в 1 литре угарного или в 1
литре углекислого газах
3.
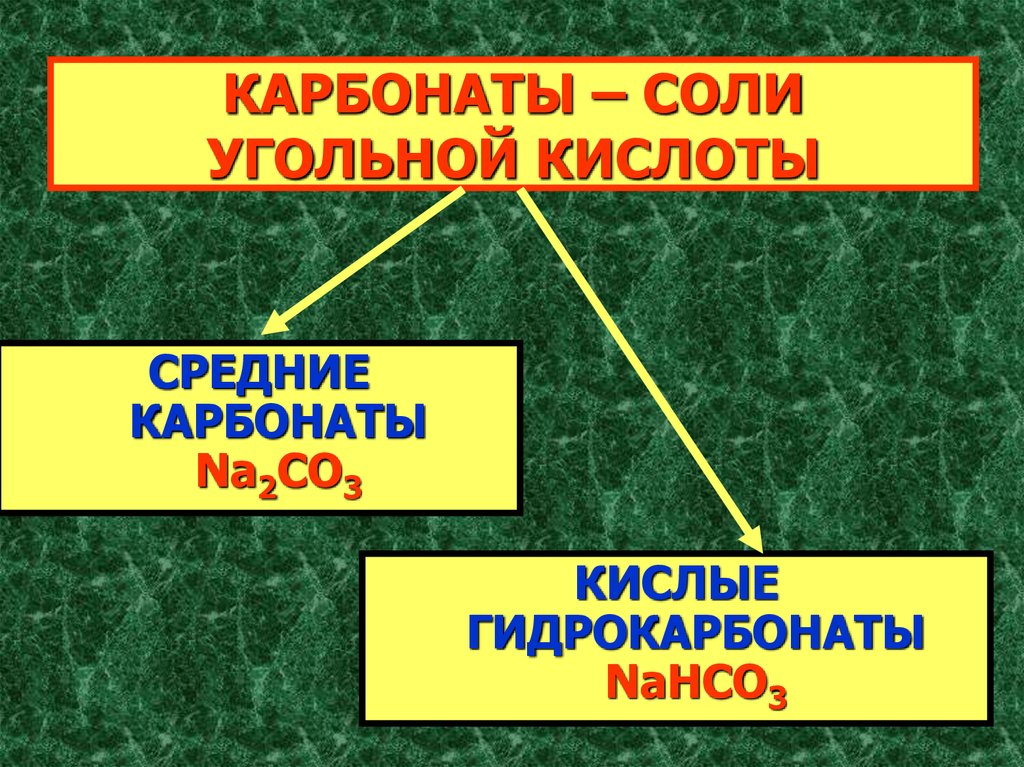
4. КАРБОНАТЫ – СОЛИ УГОЛЬНОЙ КИСЛОТЫ
СРЕДНИЕКАРБОНАТЫ
Na2CO3
КИСЛЫЕ
ГИДРОКАРБОНАТЫ
NaHCO3
5.
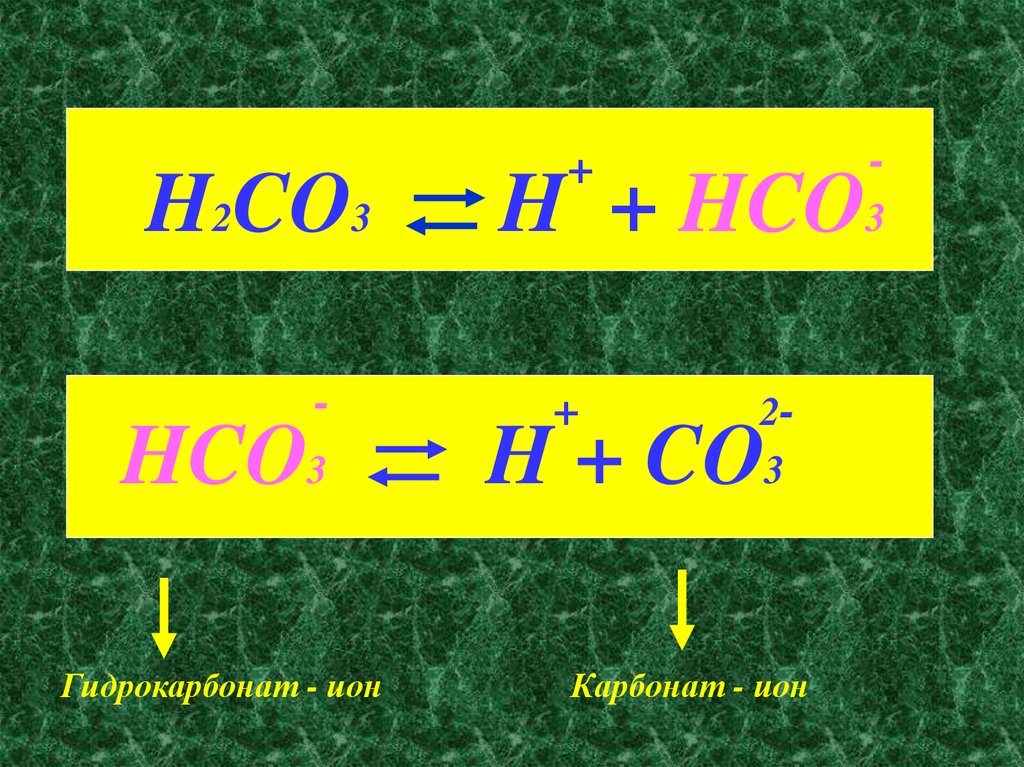
H2CO3-
HCO3
Гидрокарбонат - ион
-
+
H + HCO3
+
23
H + CO
Карбонат - ион
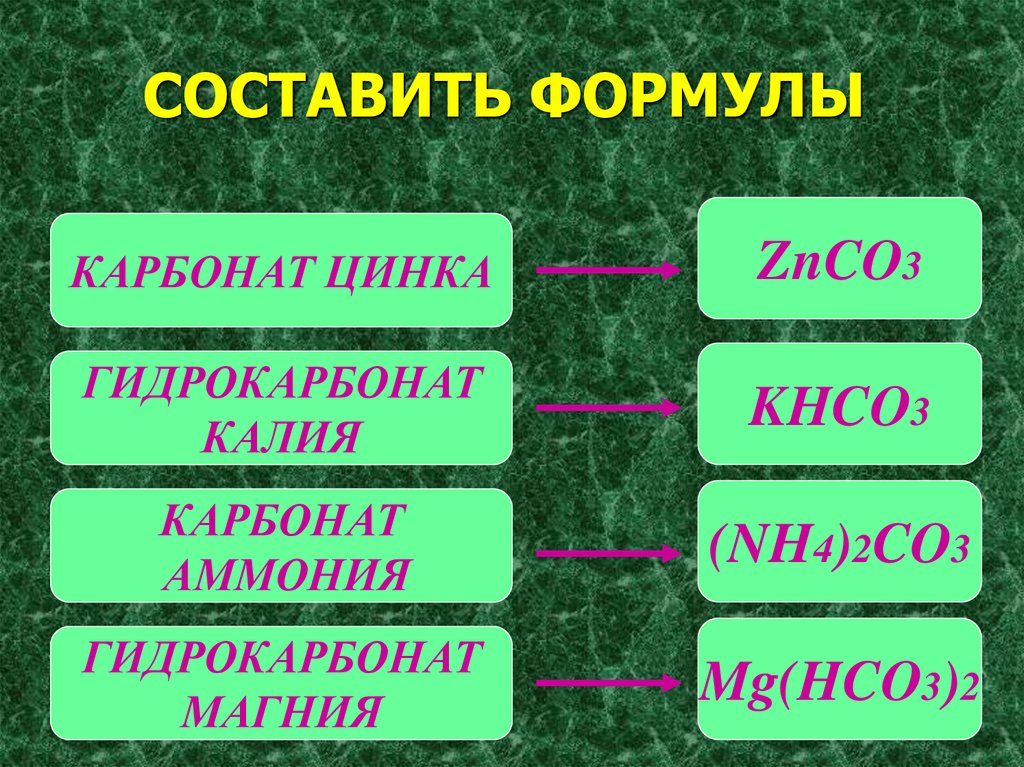
6. СОСТАВИТЬ ФОРМУЛЫ
КАРБОНАТ ЦИНКАZnCO3
ГИДРОКАРБОНАТ
КАЛИЯ
KHCO3
КАРБОНАТ
АММОНИЯ
(NH4)2CO3
ГИДРОКАРБОНАТ
МАГНИЯ
Mg(HCO3)2
7.
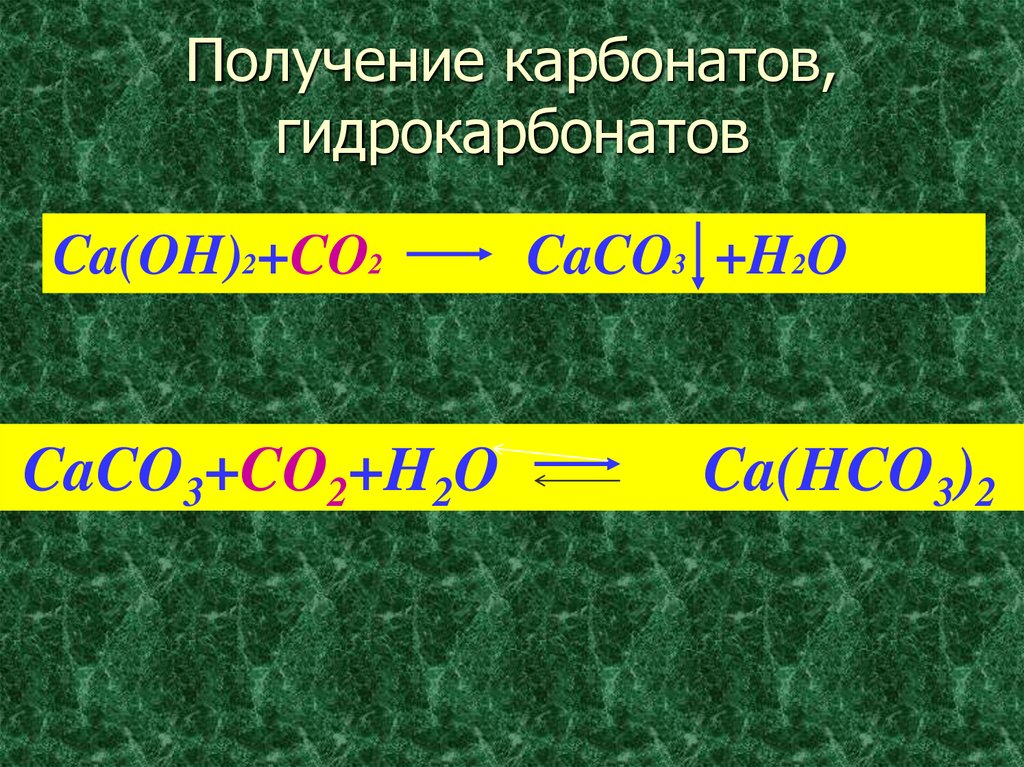
8. Получение карбонатов, гидрокарбонатов
Ca(OH)2+CO2CaCO3+CO2+H2O
CaCO3 +H2O
Ca(HCO3)2
9.
Взаимодействиес сильными кислотами
CaCO3+2HCl = CaCl2 +H2O+CO2
Качественные реакции
10.
Превращение гидрокарбонатов вкарбонаты
а) при нагревании
2NaHCO3
Na2CO3 + H2O+CO2
б) при действии щёлочи
NaHCO3 + NaOH
Na2CO3 + H2O
11.
Взаимодействиес растворами солей
Na2 CO3+BaCl2
BaCO3 +2NaCl
Разложение карбонатов
MgCO3
MgO + CO2
12.
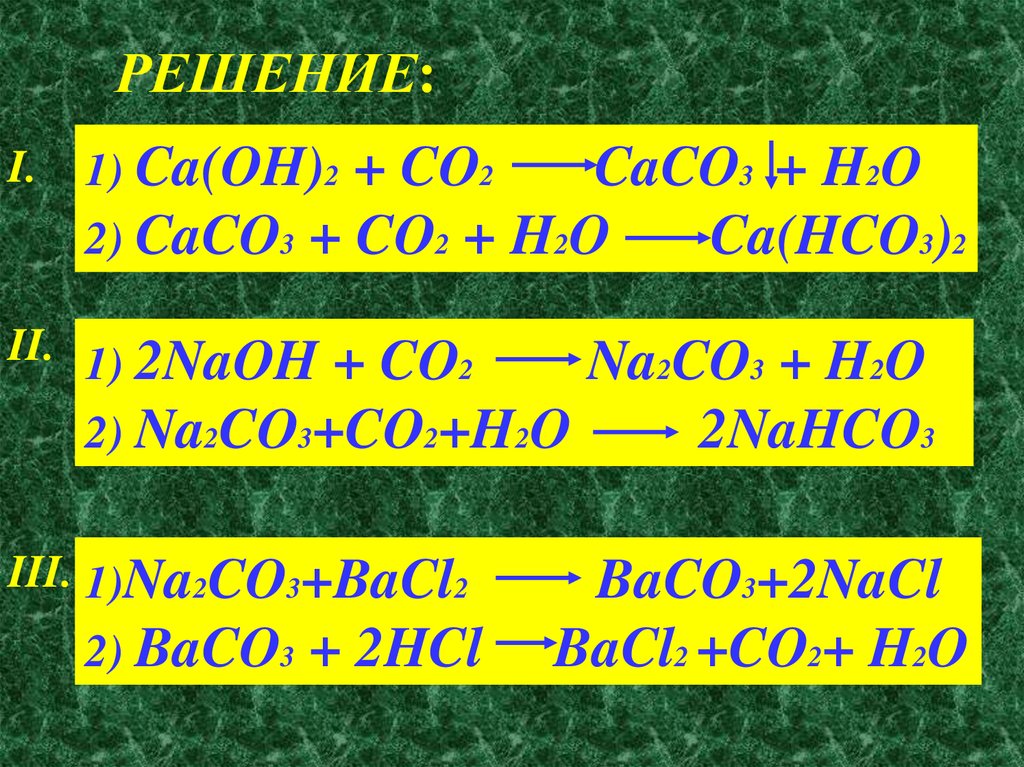
ОСУЩЕСТВИТЕ ПРЕВРАЩЕНИЕI. Ca(OH)2
CaCO3
Ca(HCO3)2
II. NaOH
Na2CO3
NaHCO3
III. Na2CO3
BaCO3
CO2
13.
РЕШЕНИЕ:I.
1) Ca(OH)2 + CO2
2) CaCO3 + CO2 +
CaCO3 + H2O
H2O
Ca(HCO3)2
II. 1) 2NaOH + CO2
2) Na2CO3+CO2+H2O
III. 1)Na2CO3+BaCl2
2) BaCO3
+ 2HCl
Na2CO3 + H2O
2NaHCO3
BaCO3+2NaCl
BaCl2 +CO2+ H2O
14.
1,7% земной коры –карбонатные породы
15.
КОРАЛЛОВЫЕ ПОЛИПЫ – CaCO316.
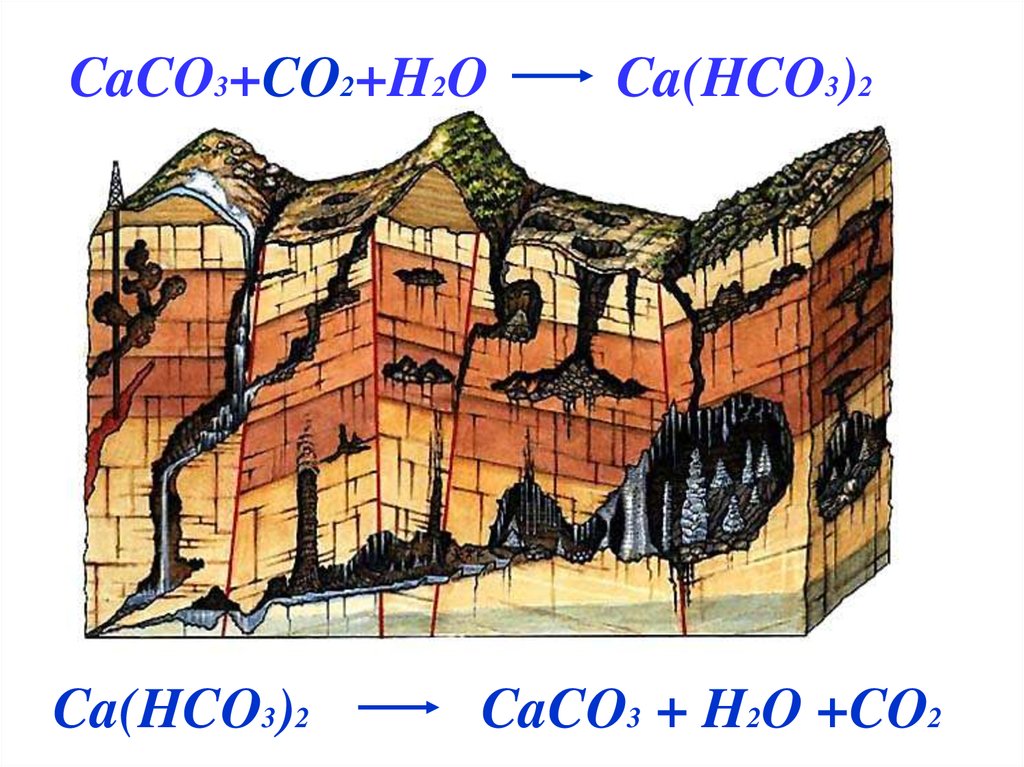
CaCO3+CO2+H2OCa(HCO3)2
Ca(HCO3)2
CaCO3 + H2O +CO2
17.
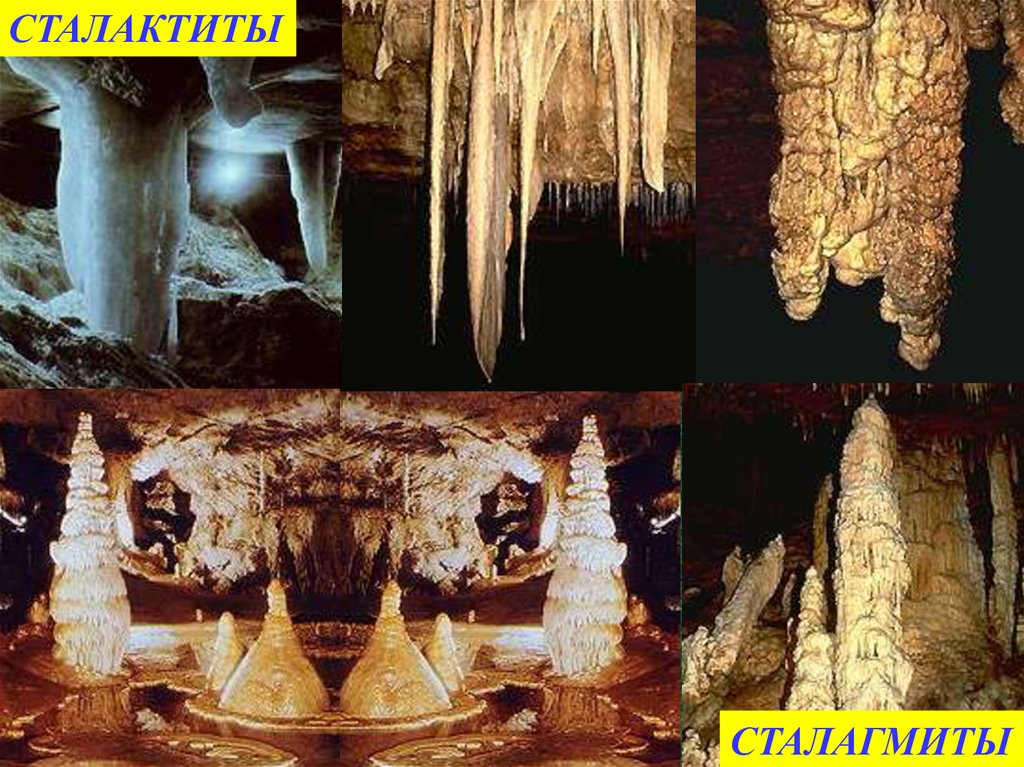
СТАЛАКТИТЫСТАЛАГМИТЫ
18.
19.
ИЗВЕСТНЯК – CaCO320. Малахит
Cu2(ОН)2CO3 –хрупкий, цвет ярко-зеленый, темно-зеленый,
блестит. Из него изготовляют художественнодекоративные предметы,используют для
получения меди.
21.
22. Кальцинированная сода
Na2CO3– белый порошок, используется впроизводстве стекла, мыла, бумаги,
моющих средств.
23.
Na HCO3 – ПИТЬЕВАЯ СОДАNaHCO3 + HCl = NaCl + CO2 + H2O
24.
25.
1)Какиеминералы содержат
кальций карбонат?
Мрамор, известняк, мел.
Зачем хозяйки добавляют
питьевую соду в тесто?
2)
2NaHCO3
Na2CO3 + H2O+CO2
Углекислый газ делает
тесто пористым.
26.
3)Что такое сталактиты?
Каменные сосульки в пещерах
состоящие из карбоната кальция.
Как химическим путем
очистить яйцо от скорлупы,
не разбивая его?
4)
Растворить скорлупу с помощью
соляной кислоты.
27.
5) Как еще называютгидрокарбонат натрия (NaHCO3)?
Питьевая сода.
6) Как вы посоветуете геологам
в полевых условиях распознать
карбонатные породы?
Подействовать кислотой
и наблюдать выделение газа.


















 chemistry
chemistry








