Similar presentations:
Общая семиотика моногенных и многофакторных болезней
1. ФГБОУ ВО МГМСУ им А.И. Евдокимова Общая семиотика моногенных и многофакторных болезней кафедра медицинской генетики
2. Моногенные болезни (МБ)-
Моногенные болезни (МБ)это большая группазаболеваний,
возникающих
в
результате
повреждения ДНК (единичные генные
мутации).
Человеческий геном содержит более
20 тысяч генов.
3.
Для моногенных болезней характерно:1.Низкая частота встречаемости в популяции
2.Разнообразие клинических проявлений
3. В каталоге наследственных болезней (OMIM
– Online Mendelian Inheritance in Man) значится
около 6000 нозологий
4.Отсутствие/незначительное влияние факторов
окружающей среды на развитие заболевания
4.
Мутации в генах характеризуютсяразнообразными
клиническими
проявлениями за счет плейотропного
(множественного) действия генов.
Например: при мутации в гене
коллагена, наблюдается многообразие
клинической симптоматики, так как
соединительная ткань представлена во
всех органах и тканях.
5.
Классификациямоногенных болезней
Моногенные болезни можно разделить на
группы в соответствии с типами
наследования:
- аутосомно-доминантный
- аутосомно-рецессивный
- Х-сцепленный доминантный
- Х-сцепленный рецессивный
- Y-сцепленный
Недостаток данного подхода – большая
частота спорадических случаев, а также
генетическая гетерогенность при сходных
фенотипах
6.
Патогенетический принципМБ делят на 3 группы в зависимости от того, на что
направлено основное патогенетическое звено
1.Болезни с нарушением обмена веществ (НОВ) с
выявленным первичным биохимическим дефектом
(преимущественное нарушение обмена углеводного,
белкового, аминокислотного, липидного, пуринового и
пиримидинового, витаминного, минерального и др.) и с
не выявленным первичным биохимическим дефектом
2.
Врожденные
природы
пороки
развития
(ВПР)
моногенной
3. Комбинированные состояния: сочетание ВПР и НОВ
7.
Клинический принципЭтот принцип отражает преимущественное поражение
какого-либо органа или системы органов.
Различают моногенные болезни с преимущественным
поражением:
сердечно - сосудистой системы
зубочелюстного аппарата
желудочно-кишечного тракта
черепно-лицевой области
опорно-двигательного аппарата
нервно-мышечной системы и др.
Данный
принцип
классификации
учитывает полисистемность и полиорганность МБ
не
8.
Общая частота генных болезней вструктуре наследственных болезней
составляет 1-2%
Частота встречаемости в популяции
1 на 10000 - высокая
1 на 10000 – 40000 – средняя
1 на 40000 и реже - низкая
9. Частота моногенных болезней зависит от:
- Расы- Национальности
- Территории проживания и уровня
изоляции (изоляты, полуизоляты,
панмиксия)
- Типа брака: панмиксный,
близкородственный, ассортативный
(положительный и отрицательный
подбор супружеских пар по фенотипу)
10. Характерные признаки моногенных болезней
1. Наследуются в полном соответствии сзаконами Менделя (аутосомно-доминантное,
аутосомно-рецессивное,
Х-сцепленное
доминантное и рецессивное, голандрическое)
2.
Генетическая
гетерогенность
(внутригенная – аллельная,
т.е. разные
мутации внутри гена приводят к развитию
одного и того же заболевания и межгенная –
локусная, т.е мутации в разных генах приводят
к развитию одного и того же заболевания.
11. Аллельная гетерогенность
Наличие аллельнойгетерогенности характерно для
большинства моногенных болезней. Как
правило, наличие различных мутаций в
одном и том же гене приводит к
возникновению заболеваний со сходной
клинической симптоматикой, с
небольшими различиями в степени
генерализации процесса и тяжести
течения
12. Пример локусной гетерогенности
Наследственная полинейропатия ДежеринаСотта, которая характеризуется врожденнойдемиелинизацией переферических нервов.
Клинические проявления этого заболевания возникают
при наличии мутации в одном из четырех генов:
1) гене периферического белка миелина (РМР22),
локализованном в области хромосомы 17 p1 1.2-12;
2) гене основного белка миелина (Ро), картированном на
хромосоме 1;
3) гене раннего белка миелина (EGR2), расположенном
на хромосоме 10;
4) гене периаксина(РRХ), обнаруженном на хромосоме
19.
13.
Сходствоклинических
проявлений
этих
различных
генетических
вариантов обусловлено единством их
патогенетических механизмов - все
четыре
гена
экспрессируются
в
миелиновой оболочке периферических
нервов, нарушение функционирования
которой
приводит
к
появлению
идентичных симптомов (дистальные
парезы
рук
и
ног,
нарушение
чувствительности, стреляющие боли,
атактические растройства и др.)
14. Генетическая гетерогенность, наличие отдельных нозологических форм в группе клинически сходных заболеваний, распознается с
учетом следующих различий:1. Фенотипических (подробное сравнение
клинической картины)
2. Биохимических (разные нарушения обмена
веществ)
3. Генетических (разные типы наследования и
группы сцепления
4. Физиологических
15.
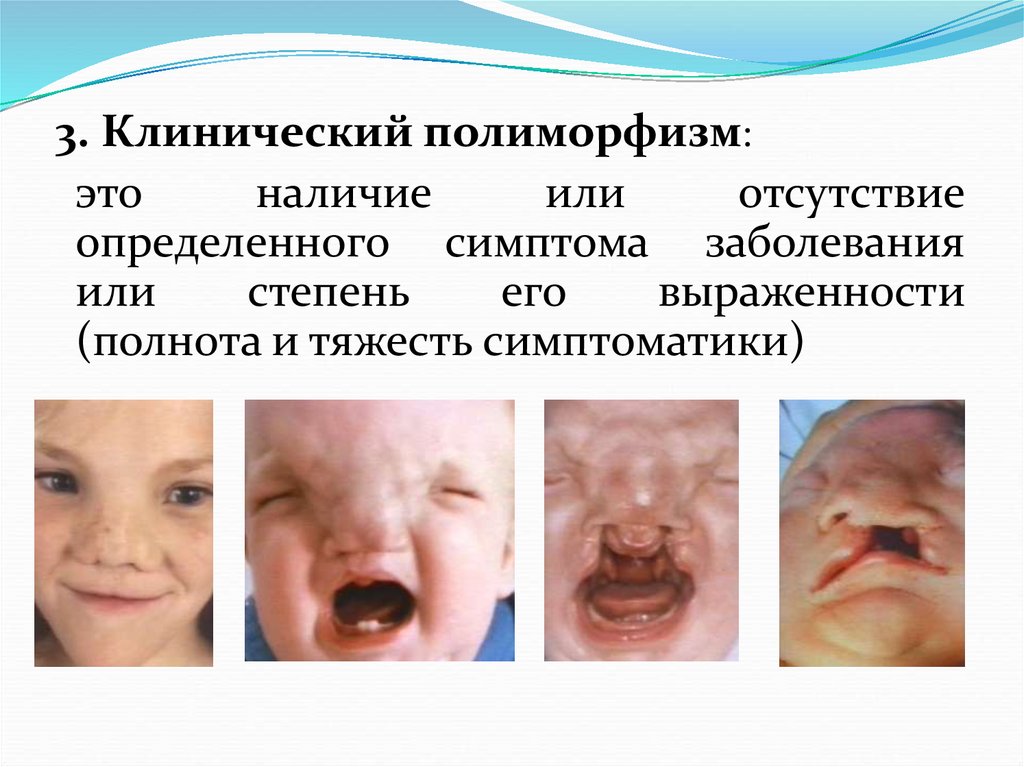
3. Клинический полиморфизм:это
наличие
или
отсутствие
определенного симптома заболевания
или
степень
его
выраженности
(полнота и тяжесть симптоматики)
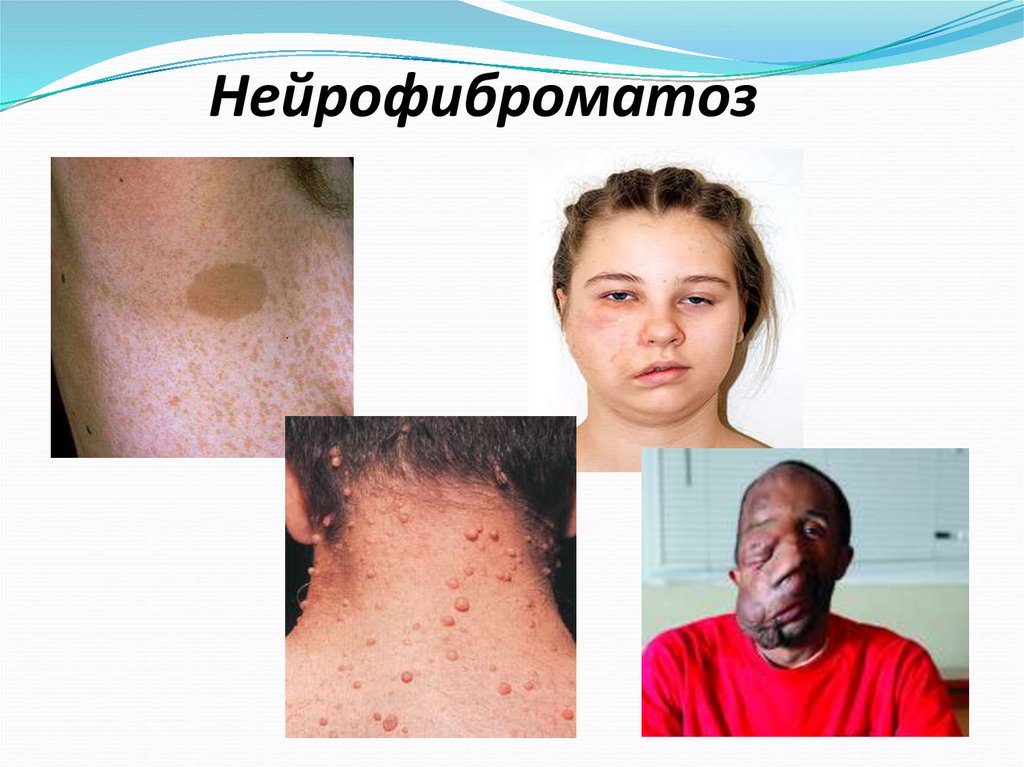
16. Нейрофиброматоз
17.
Проявления клиническогополиморфизма
1. Варьирующий возраст начала болезни
от ранних стадий эмбрионального
развития (в случаях ВПР) до пожилого
возраста (хорея Гентингтона)
25% генных болезней развиваются внутриутробно
45% проявляются в возрасте до 3-х лет
20% пубертатный и юношеский период и лишь
10% моногенных болезней развиваются в возрасте старше
20 лет.
18.
Возраст манифестации моногенных болезнейсоответствует роли и месту первичных
продуктов в онтогенезе
o
o
o
o
Болезни транскрипционных факторов
развиваются внутриутробно в виде ВПР (30%)
Патология ферментов - в течение первого года
жизни (около 45%)
Патология рецепторов от 1 года до 20 лет (15%)
Патология регуляторов белковой функции до 50
лет (10%)
19.
2. Различие в полноте и тяжестисимптоматики
3. Продолжительность и характер
течения заболевания
4. Разная толерантность к одним и тем
же методам лечения
5. Плейотропное действие генов
(множественные проявления действия
гена в разных органах и системах)
6. Продолжительность и качество жизни
20. Клиническая картина болезни может зависеть от дозы генов
Гомозиготность при аутосомно-доминантномтипе наследовании встречается редко,
предполагает внутриутробную гибель плода или
определяет более тяжелые проявления
Аутосомно-рецессивные болезни проявляются в
полной мере при условии гомозиготного
состояния по мутантному аллелю, однако
некоторые признаки могут проявляться и у
гетерозигот (нарушение толерантности к ФА у
здоровых носителей ФКУ)
21.
Генетические причины клиническогополиморфизма
могут
быть
обусловлены
не
только
патологическим
геном,
но
и
генотипом в целом, т. е. генетической
средой в виде генов-модификаторов
(наследуемые
от
родителей
комбинации других генов, которые
могут усиливать или ослаблять
действие патологического гена)
22.
Кроме того, в развитии моногенныхболезней, как и любых других
наследственных
признаков
человека, имеет значение не только
генотип, но и внешняя среда в
широком смысле слова.
23. Например:
Рост нейрофибром уженщин,
больных нейрофиброматозом,
резко усиливается при
беременности.
Симптомы ФКУ у ребенка
более тяжелые, если во время
его внутриутробного развития
в диете матери было много
продуктов, богатых ФА
Обострение наследственных миодистрофий
наблюдается после
стрессов, охлаждений,
переутомления.
Клиническая картина гемофилии у ребенка усиливается тем больше, чем больше у него кровоизлияний
от падений и травм.
24. Особенности клинической картины одного и того же моногенного заболевания
1) Многообразие проявлений – т.е.затрагивается не одна система или орган,
а несколько, уже на первичных этапах
формирования болезни. Биологической
основой этого служит генный контроль
первичных механизмов обмена.
25. Например:
Локализация первичного дефекта вклеточных и межклеточных структурах
характерна для болезней соединительной
ткани,
когда
нарушается
синтез
специфичного для каждой болезни белка
той или иной волокнистой структуры.
Поскольку соединительная ткань есть во
всех органах и тканях, то многообразие
клинической симптоматики – следствие
аномалии соединительной ткани.
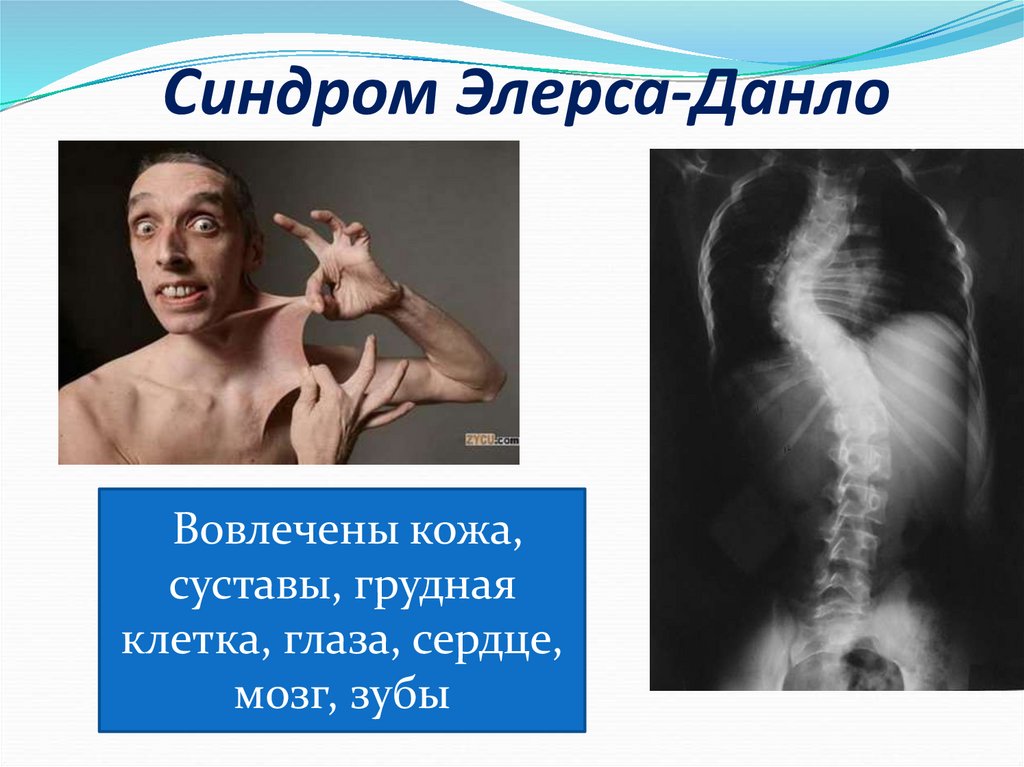
26. Синдром Элерса-Данло
Вовлечены кожа,суставы, грудная
клетка, глаза, сердце,
мозг, зубы
27.
2)Прогредиентность
(нарастание
симптомов) клинической картины, а
также хроническое затяжное течение с
рецидивами.
Это
обусловлено
непрерывностью
функционирования патологического гена (либо
отсутствием продукта гена). Постепенно
присоединяются
вторичные
процессы
–
воспаление, дистрофия, гиперплазия, нарушение
обмена веществ и др., которые усиливают
первично запущенный патологический процесс
28. Диагностика моногенных заболеваний
1. Клинико-генеалогический метод сфенотипическим анализом
2. Лабораторная диагностика:
(биохимическая, молекулярная ДНКдиагностика, иммунологическая)
3. Инструментальная (УЗИ,
рентгенологическое исследование, ЭХОКГ, ЭЭГ и др.)
29.
Методы лабораторнойдиагностики моногенной
патологии
30. Молекулярно-генетические методы
Молекулярно-генетические методыприменяются для работы с геном:
1) определяют структуру гена
(секвенирование), т.е. последовательность
азотистых оснований и изменения в ней
(мутации и др.)
2)определяют последовательность
аминокислот в белке
3) определяют положение гена на хромосоме по
отношению к другим генам и расстояние между
ними (физическое картирование)
31. Методы ДНК-диагностики
прямыекосвенные
применяются,
если
известен
ген,
ответственный
за
развитие
НЗ,
и
основные
типы его
патологических
мутаций.
Предусматривают
использование ДНКзондов и детектируют
мутацию
детектируют
маркер мутации
32.
Прямая и косвенная ДНК-диагностикаоснована на методах, позволяющих
идентифицировать небольшой, но строго
определенный фрагмент ДНК человека.
33.
Основа современной (прежде всего прямой)ДНК-диагностики
-
метод
PCR
или
ПЦР
(Polymerase Chain Reaction или Полимеразная
Цепная Реакция),
течение
заданного
облегчает
часа
который позволяет in vitro в
получить
фрагмента
миллион
молекулы
идентификацию
пациента(пробанда)
копий
ДНК,
в
что
геноме
сайта
представляющего диагностический интерес
ДНК,
34.
С помощью ДНК-анализаповрежденный ген можно
обнаружить не только при наличии
развернутой клинической картины
заболевания, но и до появления
симптомов, а также у здоровых
гетерозиготных носителей мутации
в гене
35.
Обнаружение мутации всоответствующем гене позволяет
абсолютно точно подтвердить
диагноз наследственного
заболевания и определить генотип
всех членов отягощенной семьи
36. Биохимические методы
Биохимические методы используютсядля диагностики наследственных
болезней обмена (НБО)
Биохимические методы чрезвычайно
многообразны и их значение в
диагностике наследственных болезней
постоянно возрастает
37.
В большинстве случаев биохимическиеисследования дополняют молекулярно-
генетические методы диагностики
наследственных болезней, т.к.
«необнаружение» в гене мутации не
всегда является полной гарантией
нормального биохимического фенотипа.
38.
Современные высокоточные технологии(электрофорез, бумажная и
тонкослойная (одно- и двумерная)
хроматографии, тандемная массспектрометрия, магнитная резонансная
спектроскопия и др.) позволяют
идентифицировать любые метаболиты,
специфические для конкретной
наследственной болезни
39.
Объекты биохимической диагностики:моча
пот
плазма и сыворотка крови
форменные элементы крови
культуры клеток (фибробласты,
лимфоциты)
40.
Выбор метода биохимической диагностикиосновывается на клинической картине
болезни и генеалогических сведениях, что
позволяет определить ход обследования на
основе поэтапного исключения
определённых классов болезней .
Данные методы делятся на три группы:
качественные, полуколичественные и
количественные
41.
Качественные методы позволяют выявлятьизбыточные концентрации субстратов или их
производных при ферментных реакциях.
Универсальные
(определяют группу
заболеваний с ведущим
биохимическим
дефектом)
Специфические –
тест на
гомогентизиновую
кислоту при
алкаптонурии, тест на
медь при болезни
Вильсона-Коновалова
и др.)
42.
С помощью полуколичественных иколичественных методов можно
разделить метаболиты, принадлежащие к
одному классу химических веществ, а
также определить концентрацию
определенного вещества
Эти методы высокоточные, сложные в
исполнении, дорогостоящие
43.
Для диагностики некоторых НБО врамках массового неонатального
скрининга в регионах может применяться
микробиологический тест Гатри, в основе
которого выращивание на минимальной
питательной среде микроорганизмов,
чувствительных к определенному
метаболиту
44. Лечение моногенных болезней
Внастоящее
время
в
связи
с
расшифровкой
этиопатогенетических
механизмов
значительного
числа
наследственных болезней появилась
возможность разработки способов их
эффективного лечения
45. Лечение
1. Симптоматическое2. Патогенетическое
3. Этиологическое
46. 1) Симптоматическое лечение
используется при всех наследственныхболезнях. Оно направлено на коррекцию
патологических
симптомов
и,
не
воздействуя на причину болезни, приводит
к
улучшению
состояния
больного,
предотвращению осложнений и снижению
темпов прогрессирования заболевания.
При этом могут быть использованы
лекарственные препараты, хирургическое
вмешательство,
физиотерапевтические,
рентгенологические и другие методы.
47. 2) Патогенетическое лечение
Направленона
коррекцию
биохимических и патофизиологических
процессов, нарушенных в результате
изменения первичного генного продукта.
Эти
методы
лечения наиболее
эффективны
при
наследственных
болезнях обмена.
48. МЕТОДЫ:
1) Восполнение дефицита фермента (белка)(болезнь Гоше – глюкоцереброзидаза,
наследственый панкреатит – ферменты
поджелудочной железы, гемофилия – переливание
крови)
2) Восполнение дефицита кофактора (витамины
или коэнзимы)
(пиридоксинзависимые судороги – В6,
метилмалоновая ацидурия – В12, атаксия с
дефицитом витамина Е – вит. Е)
3) Восполнение дефицита конечного продукта
(ВДКН – кортизол, кортинефф, ВГ – тироксин,
гипофизарный нанизм – соматотропин)
49.
4) Ограничение количества субстрата в пище(ФКУ – фенилаланинсодержащие продукты,
Тирозинемия – ФА, тирозин, галактоземия –
лактоза и галактоза, нарушение цикла мочевины –
белок)
5) Коррекция выведения продукта
(Болезнь Вильсона-Коновалова – D-пенициламин,
органические ацидурии – L-карнитин)
6) Ограничение применения лекарственной
терапии
(дефицит глюкозо-6-фосфатдегидрогеназы –
сульфаниламиды, порфирия – барбитураты)
50.
7) Замещение поврежденных тканей(поликистоз почек – трансплантация почки,
тяжелые формы Х-сцепленного
комбинированного иммунодефицита трансплантация костного мозга)
8) Удаление пораженных тканей
(семейный аденоматозный полипоз –
колонэктомия, сфероцитарная анемия –
спленэктомия, нейрофиброматоз – удаление
фибром)
51. 3) Этиологическое лечение
Наиболее перспективным и эффективным способомлечения наследственной патологии человека
является коррекция генетического дефекта на
уровне гена – генотерапия (молекулярное
протезирование).
Коррекцию функции мутантных генов
и
восстановление их экспрессии можно осуществлять
двумя путями:
1) заменой мутантного гена его нормальной копией
2)введение нормальной копии гена при сохранении
мутантной
52. Профилактика
1. Медико-генетическое консультированиесемей
с
расчетом
теоретического
(менделевского риска) рождения ребенка
с моногенным заболеванием
2. Массовый скрининг беременных
женщин с помощью неинвазивных
методов пренатальной диагностики (УЗИ
и определение сывороточных – фетальных
маркеров ) и по показаниям – инвазивных
методов пренатальной диагностики
53.
3. Неонатальный (массовый) скрининг4. Селективный (выборочный) скрининг
на гетерозиготное носительство либо при
наличии определенных показаний
(изменение цвета и запаха мочи,
непереносимость некоторых пищевых
продуктов и лекарственных препаратов
и др.)
54.
В биохимической диагностике наследственныхболезней обмена можно выделить следующие
уровни:
первичный
скрининг,
(массовый)
селективный скрининг, уточняющая диагностика.
В России с 2006 года проводится массовый
неонатальный
скрининг
на
5
аутосомно-
рецессивных моногенных заболеваний:
- муковисцидоз
- фенилкетонурия
- адреногенитальный синдром
- врожденный гипотиреоз
- галактоземия
55.
Скрининговую программу утверждаетместный Минздрав.
В Москве с 2018 года неонатальный скрининг
расширили до 11 нозологий. Включили еще
шесть заболеваний, для которых существует
зарегистрированное лечение.
В Приморском крае добавили еще 20
заболеваний.
Лечение в основном недорогое, состоит в
использовании лечебного питания, витаминов в
высоких дозах.
56.
Программа неонатального скрининга включаетследующие этапы:
1. Взятие биологического материала
Обследованию подлежат все новорожденные.
У доношенных детей забор крови осуществляется на 4 день,
у недоношенных на 7 день жизни
2. Лабораторная просеивающая диагностика
3. Уточняющая диагностика во всех случаях получения
положительных результатов при просеивающем
исследовании
4. Лечение с соответствующим контролем и диспансеризация
больных
5. Медико-генетическое консультирование семьи.
57.
ЗАБОЛЕВАНИЯМНОГОФАКТОРНЫЕ /
МУЛЬТИФАКТОРИАЛЬНЫЕ/
ПОЛИГЕННЫЕ/
С НАСЛЕДОВАНИЕМ
ПРЕДРАСПОЛОЖЕННОСТИ
58.
Болезни с наследованиемпредрасположенности были выделены из
группы генных болезней благодаря
широким генетико-эпидемиологическим
исследованиям в разных популяциях
(клинико-генеалогическим, близнецовым,
популяционно-статистическим)
59.
Многофакторные болезни (МФБ)МФБ обусловлены суммарным действием
нескольких генных мутаций, каждая из
которых самостоятельно не может вызвать
появление симптомов болезни.
Обязательным условием
для развития
клинических проявлений болезней этой
группы
служит
воздействие
неблагоприятных факторов внешней среды.
60.
МФЗ возникают у пациентов сопределенной генетической конституцией
Генетическая конституция - это комбинация
генов, полученная от родителей
(комбинативная изменчивость) и
изменения в структуре ДНК клеток,
возникающие в процессе жизни человека,
начиная с эмбриогенеза (мутационная
изменчивость).
61.
Средовые факторы могут бытьспецифическими для экспрессии
определенных мутантных генов, влиять
на частоту, тяжесть, характер течения
того или иного заболевания, что
существенно зависит и от степени
генетической предрасположенности
62. Этиология МФЗ
В основе этиологии этой группы заболеванийлежит сложное взаимодействие множества
генов в виде полигенного комплекса
предрасположенности (генная сеть) с
генетическими модифицирующими
факторами риска по данному заболеванию
(возраст, пол, конституциональные
особенности) и средовыми факторами (образ
жизни, питания, методы лечения)
63.
Наследование многофакторных болезней несоответствует
классическим
правилам
простого менделевского наследования.
Модели наследования МФЗ:
1) аддитивно-полигенное наследование с пороговым
эффектом: патологический фенотип проявляется
когда действие генных и средовых факторов
достигает и превышает некоторое пороговое
значение подверженности.
2) «эффект главного гена» - на фоне аддитивного
действия нескольких мутантных генов болезнь
возникает в результате влияния одного, так
называемого, главного гена
64.
3) полигенное наследование безпорогового эффекта
4)все гены системы, определяющие
развитие
болезни,
подвержены
минимальным
мутациям,
которые
дополняют друг друга. При этом
проявление патологического признака в
семье может меняться от нулевого до
максимального в зависимости от числа
генов, подвергшихся мутациям.
65.
5) Комплекс предрасположенностимногофакторной природы концептуальная модель,
представляющая совокупность главных
генов и генов всего полигенного
комплекса и их взаимодействие с генами
– модификаторами
Все модели основаны на определении
степени накопления повторных случаев
заболевания в семье в сравнении с
частотой болезни в популяции
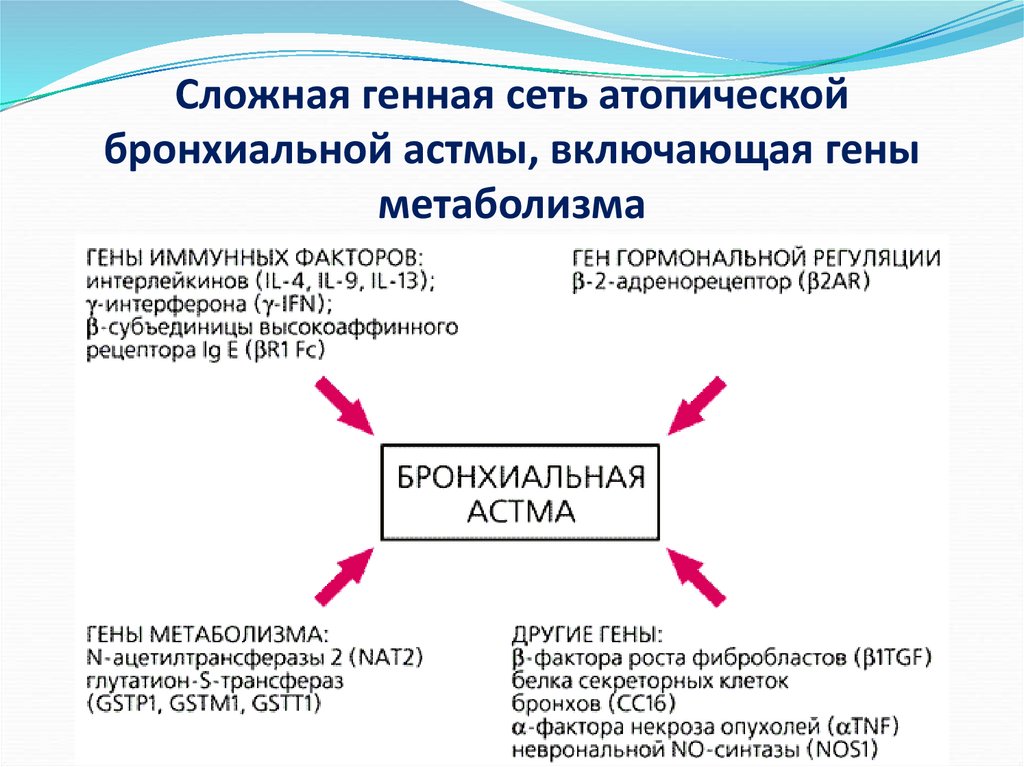
66. Сложная генная сеть атопической бронхиальной астмы, включающая гены метаболизма
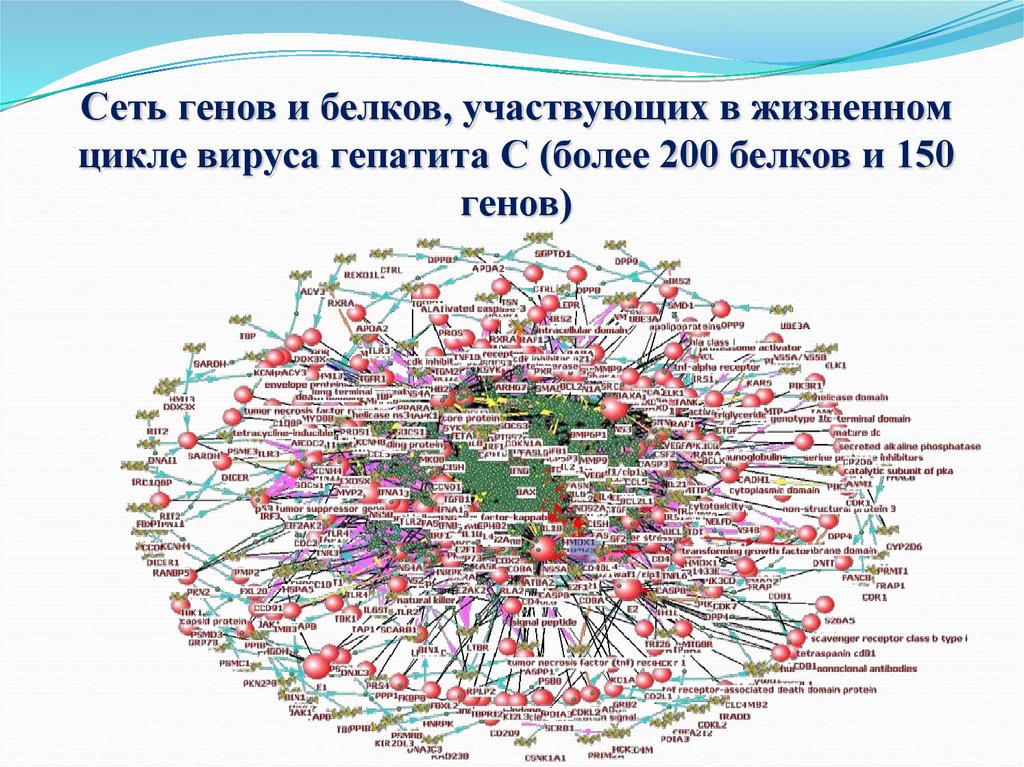
67.
Сеть генов и белков, участвующих в жизненномцикле вируса гепатита С (более 200 белков и 150
генов)
68.
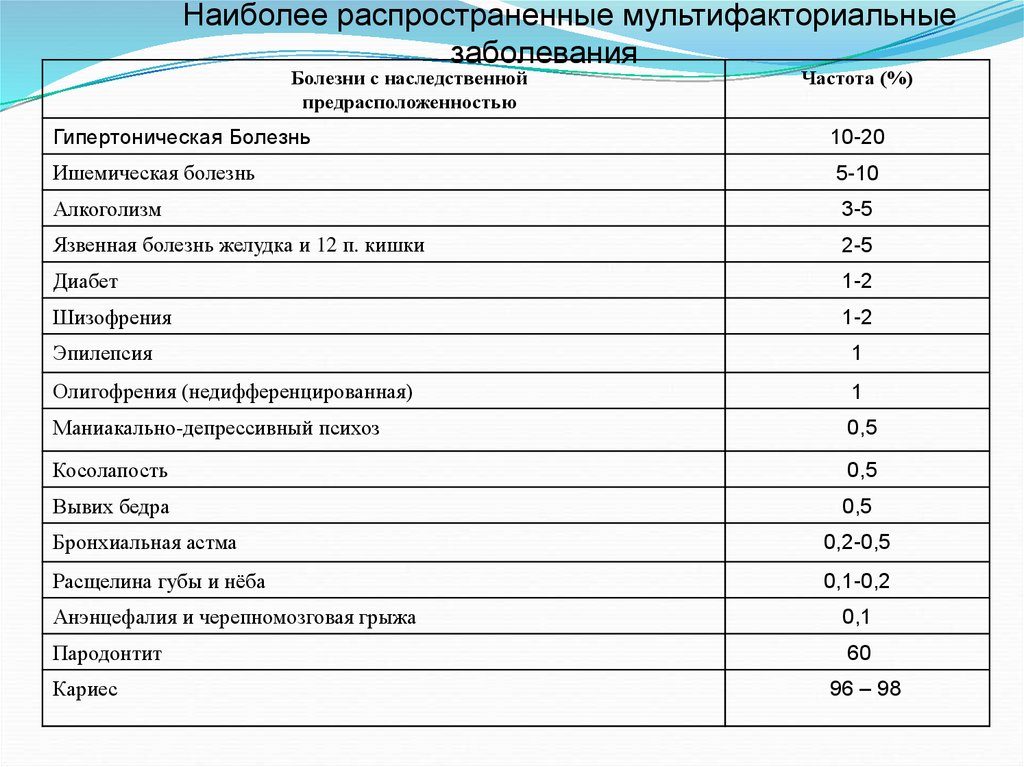
Наиболее распространенные мультифакториальныезаболевания
Болезни с наследственной
предрасположенностью
Частота (%)
Гипертоническая Болезнь
10-20
Ишемическая болезнь
5-10
Алкоголизм
3-5
Язвенная болезнь желудка и 12 п. кишки
2-5
Диабет
1-2
Шизофрения
1-2
Эпилепсия
1
Олигофрения (недифференцированная)
1
Маниакально-депрессивный психоз
0,5
Косолапость
0,5
Вывих бедра
0,5
Бронхиальная астма
0,2-0,5
Расщелина губы и нёба
0,1-0,2
Анэнцефалия и черепномозговая грыжа
0,1
Пародонтит
60
Кариес
96 – 98
69. Особенности многофакторной патологии
1) Неменделирующий характернаследования ( не подчиняются законам
Менделя)
2) Выраженная генетическая
гетерогенность: внутригенная и
межгенная
70.
3)Клинический полиморфизм, который
выражается:
- в различных сроках начала
- полноте и степени выраженности
симптомов
- характере, тяжести,
продолжительности течения
- толерантности к лечению
- в выходе из болезни (выздоровление,
инвалидность, смерть)
71.
4)Антиципация – более ранняя
манифестация и утяжеление клиники в
последующих поколениях за счет
полигенного характера наследования
предрасположенности
72. Общие признаки многофакторных болезней
1)Высокая частота встречаемости в
популяции
2) Существование клинических форм,
образующих непрерывный ряд от
скрытых субклинических до резко
выраженных проявлений
73.
3)Относительно
низкая
конкордантность по манифестным
проявлениям болезни у монозиготных
близнецов (60% и ниже), тем не менее
существенно
превышающая
соответствующий
уровень
у
дизиготных близнецов
4) Значительные половые и возрастные
различия
74.
5)Зависимость степени риска дляродственников больного от частоты
болезни в популяции (чем реже
встречается данное заболевание, тем
выше риск)
6) Риск повышается с рождением каждого
следующего больного, а также по мере
увеличения степени тяжести болезни
пробанда
75. Клиническое многообразие МФЗ можно разделить на следующие варианты:
I. ВПР многофакторной природы - расщелинагубы и неба, спинно-мозговая грыжа, анэнцефалия и
черепно-мозговая грыжа, гидроцефалия, стеноз
привратника, вывих бедра, косолапость, гипоспадия,
крипторхизм и др.
II. Нарушения развития у детей- некоторые
виды умственной отсталости и задержки психического
развития, дислексия, логоневроз и др.
76.
III. Болезни «среднего» возраста:ИБС, ГБ, атеросклероз, кариес, пародонтит,
аллергические заболевания, онкология, остеопороз,
язвенная болезнь, системные заболевания, заболевания
опорно-двигательного аппарата, псориаз, мочекаменная
и желчекаменная болезни, сахарный диабет, ожирение,
нарушение зрения, варикозная болезнь вен нижних
конечностей, болезни зависимостей, шизофрения,
депрессивные расстройства, болезнь Альцгеймера и др.
77.
IV. Генетические болезни соматических клеток1)при некоторых злокачественных новообразованиях
специфические перестройки хромосом в клетках
вызывают активацию онкогенов (ретинобластома,
опухоль Вильмса)
2) спорадические случаи изолированных врождённых
пороков развития
3) аутоиммунные процессы
4) старение
V. Экогенетические болезни– заболевания, при
которых для проявления мутации необходимо
воздействие специфического (относительно
редкого)фактора окружающей среды
78. Диагностика МФЗ
1) Клинико-генеалогический метод2) Лабораторная диагностика:
(биохимическая, иммунологическая,
цитологическая, молекулярная ДНКдиагностика)
3) Инструментальная (УЗИ,
рентгенологическое исследование,
радиологическое и др.)
79. Лечение
1) Симптоматическое2) Патогенетическое (лекарственная
терапия, хирургические методы лечения,
физиотерапия, лечебная физкультура,
диетотерапия, санаторно-курортное
лечение и т.д.)
80. Профилактика
ПрофилактикаМФЗ
представляет
основополагающую задачу современной
медицины.
Профилактика МФЗ является третичной
и заключается в медико-генетическом
консультировании пробанда с расчетом
генетического риска (эмпирического)
развития
у
него
патологии
с
последующей коррекцией среды.
81.
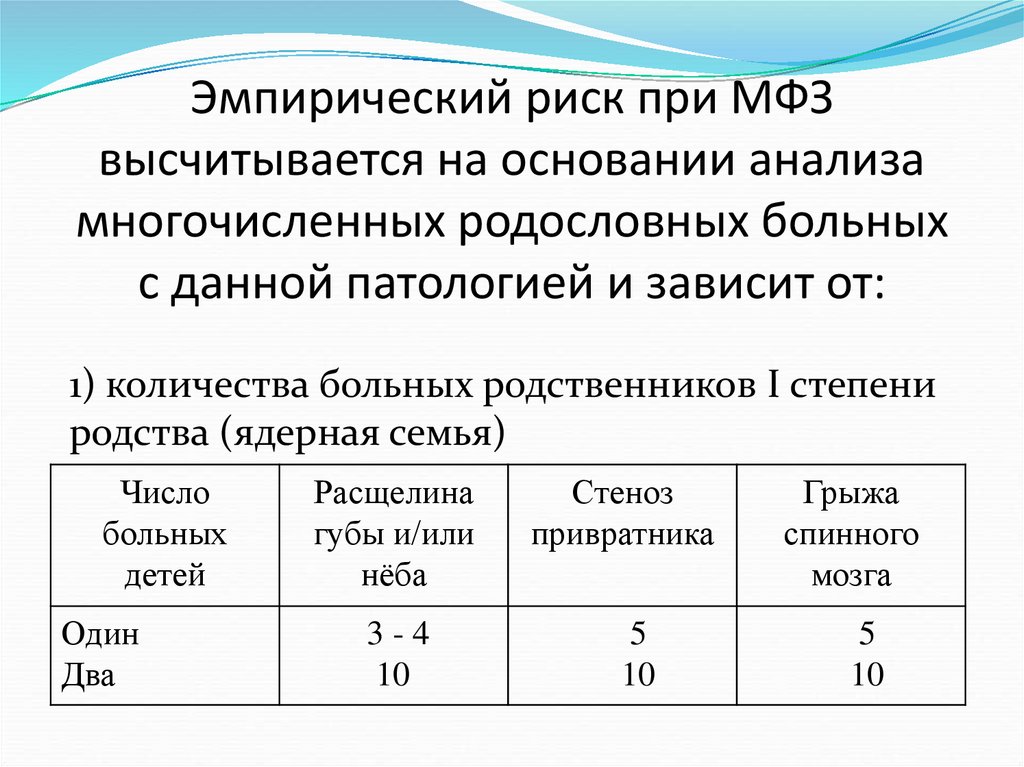
Эмпирический риск при МФЗвысчитывается на основании анализа
многочисленных родословных больных
с данной патологией и зависит от:
1) количества больных родственников Ι степени
родства (ядерная семья)
Число
больных
детей
Один
Два
Расщелина
губы и/или
нёба
3-4
10
Стеноз
привратника
5
10
Грыжа
спинного
мозга
5
10
82.
2) Внутрисемейной встречаемостизаболевания (родственники ΙΙ, ΙΙΙ и далее
степени родства)
При мультифакториальном характере
заболевания ожидается уменьшение
частоты заболевания с уменьшением
степени родства (третьей по сравнению
со второй и второй по сравнению с
первой)
83.
3) от пола пробанда и пораженныхродственников
4) конституциональных особенностей
(гиперстеническое, нормостеническое,
астеническое телосложение и т.д.)
5) от типа личности
6)
иммунологических
характеристик
пробанда
7)
а
также
тяжести
поражения
родственников с данным заболеванием
84.
Ишемическая болезнь сердца:Генетические факторы предрасположенности:
- мужской пол
- гипер- и нормостенический тип телосложения
- характерологические особенности
-изменения биохимических показателей крови:
повышенное содержание холестерина, ЛПНП
пониженное содержание ЛПВП,
высокий уровень фибриногена плазмы,
гомоцистеина, липопротеина L и др.
85.
Для реализации генотипанеобходимо определённое временное
воздействие средовых факторов:
- курение
- высококалорийное питание с высоким
содержанием животных жиров и низким растительных
- определённый способ приготовления пищи
- низкая физическая нагрузка
- хронический стресс и др.
86. Одно из направлений молекулярной медицины – разработка молекулярных основ профилактической (предиктивной) медицины.
Предиктивная медицина – раздел молекулярноймедицины, направленный на досимптоматическое
выявление лиц с высокой наследственной
предрасположенностью к МФЗ с целью
своевременной (упреждающей) профилактики
Отличительной особенностью предективной
медицины является индивидуальный подход к
каждому пациенту
87.
Генетическоетестирование
наследственной предрасположенности к
различным МФЗ направлено на разработку
тест-систем (панелей) в случаях выявления
неслучайных ассоциаций полиморфных
маркеров с соответствующей патологией и
повышенного
эмпирического
риска
развития заболевания в семье
88. Интерпретация результатов исследования генов предрасположенности к МФЗ
Само наличие неблагоприятного аллеля непозволяет судить ни о времени начала
заболевания, ни о его тяжести. Генетическое
тестирование в досимптоматический период
дает возможность выявить существующие пока
только в геноме наследственные тенденции к
развитию будущих болезней и, исходя из
современного врачебного опыта, наметить
пути их ранней профилактики, что позволит
снизить заболеваемость, инвалидность и
смертность
















































































 medicine
medicine








