Similar presentations:
Фенолы. Прстые эфиры
1.
ФенолыПростые эфиры
1.
2.
29.09.2021
1
2.
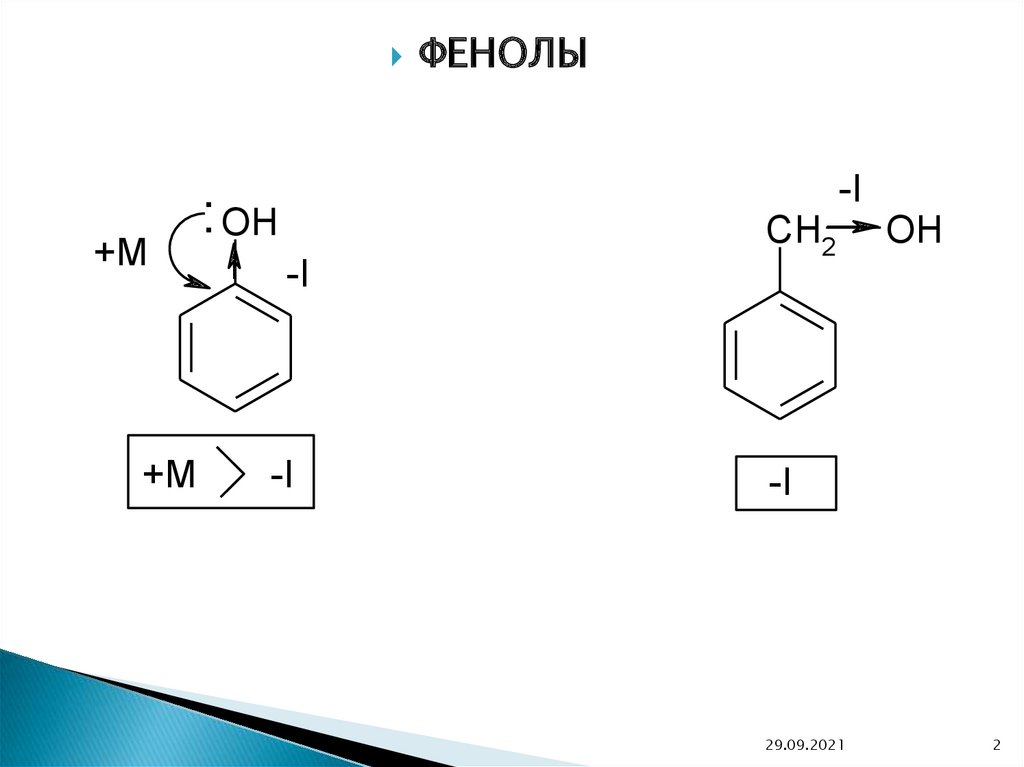
+M+M
ФЕНОЛЫ
-I
: OH
-I
-I
CH2
OH
-I
29.09.2021
2
3.
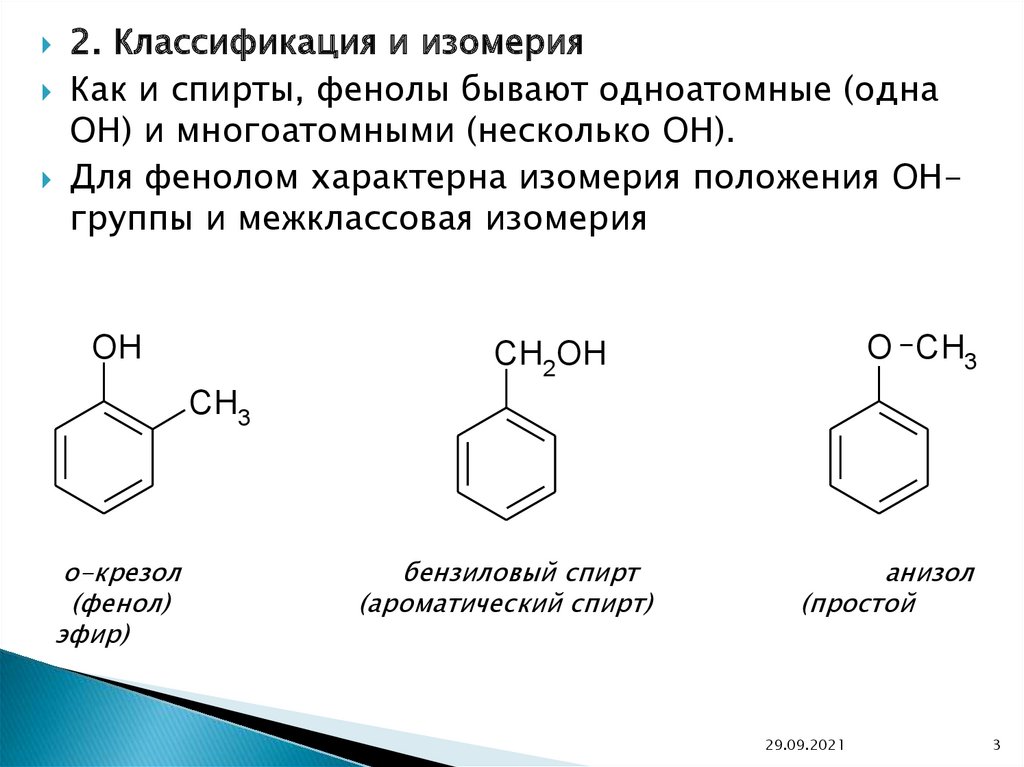
2. Классификация и изомерияКак и спирты, фенолы бывают одноатомные (одна
OH) и многоатомными (несколько OH).
Для фенолом характерна изомерия положения OHгруппы и межклассовая изомерия
OH
O CH3
CH2OH
CH3
о-крезол
(фенол)
эфир)
бензиловый спирт
(ароматический спирт)
анизол
(простой
29.09.2021
3
4.
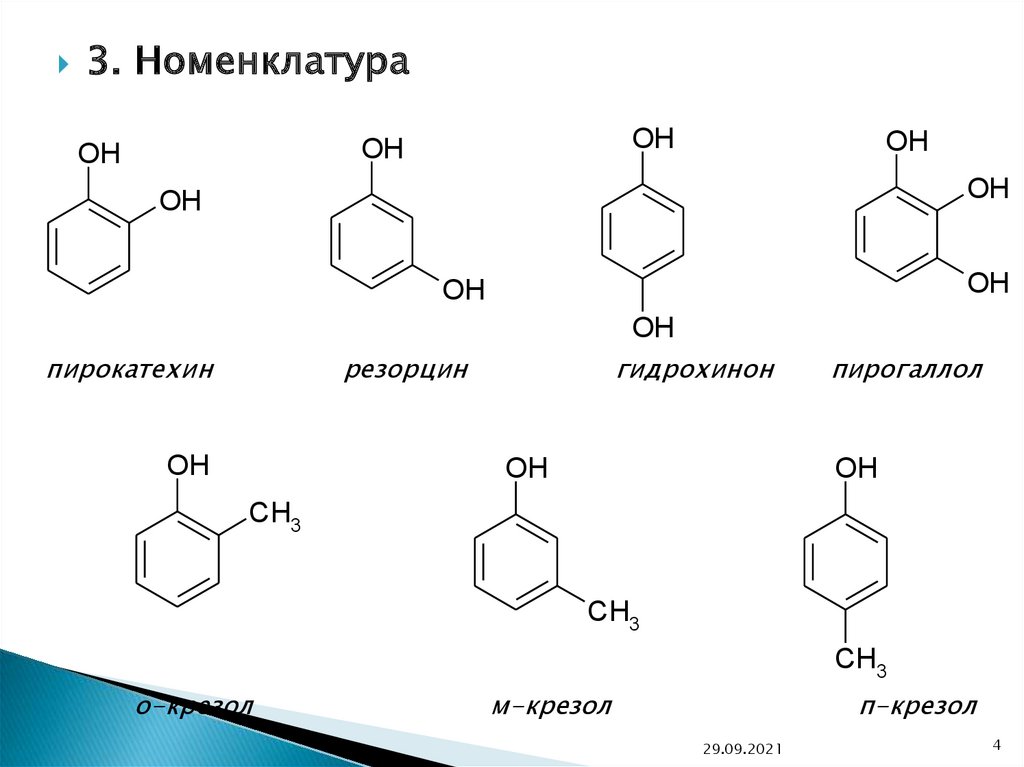
3. НоменклатураOH
OH
OH
OH
OH
OH
OH
OH
пирокатехин
OH
гидрохинон
резорцин
OH
OH
пирогаллол
OH
CH3
CH3
CH3
о-крезол
м-крезол
п-крезол
29.09.2021
4
5.
4. Физические и биологические свойства29.09.2021
6.
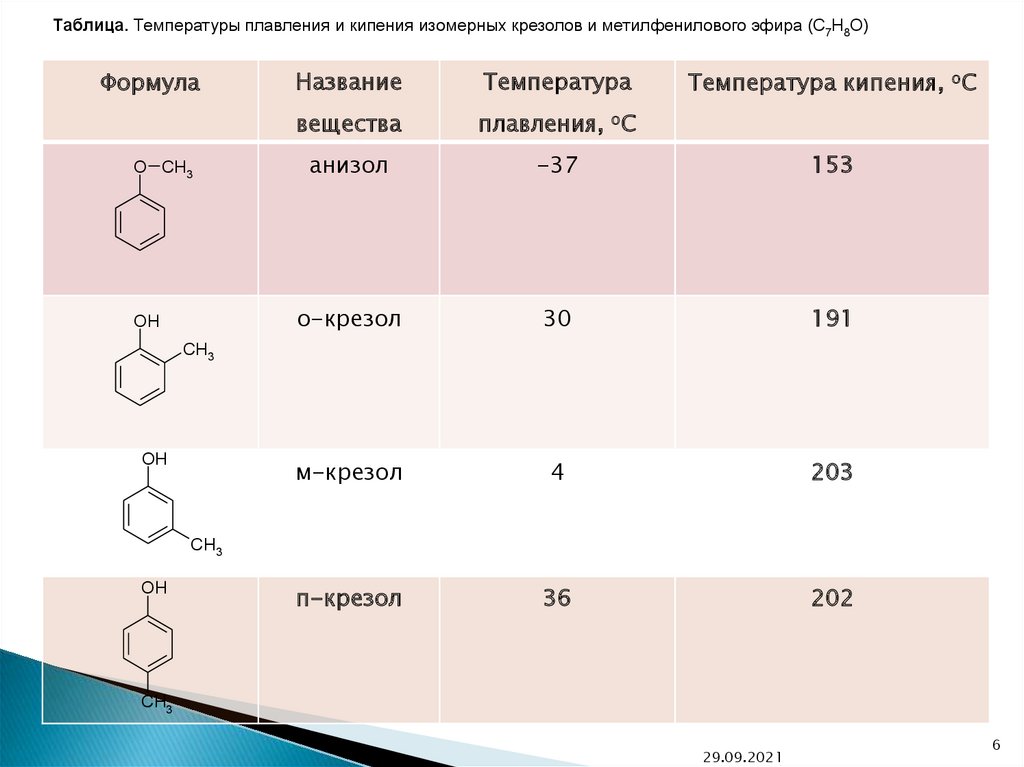
Таблица. Температуры плавления и кипения изомерных крезолов и метилфенилового эфира (C7H8O)Формула
O CH3
OH
Название
Температура
вещества
плавления, oC
анизол
-37
153
о-крезол
30
191
м-крезол
4
203
п-крезол
36
202
Температура кипения, oC
CH3
OH
CH3
OH
CH3
29.09.2021
6
7.
Фенол очень токсичен, при попадании на кожу вызываетожоги. Фенол обладает хорошими дезинфицирующими
свойствами; это было первое вещество, которое
использовалось для дезинфекции (Дж. Листер, 1867)
Фенолы входят в состав креозота – жидкости, получаемой
из каменноугольной смолы и используемой для пропитки
шпал для предотвращения их гниения. Очищенный
креозот используется как антисептик в медицине.
Пентахлорфенол применяется для пропитки древесины
как антисептик, инсектицид и фунгицид.
Пентахлорфенолятом натрия обработаны брёвна Кижских
церквей.
29.09.2021
7
8.
Нижник Я.П.http://norgchem.professorjournal.
ru
29.09.2021
8
9.
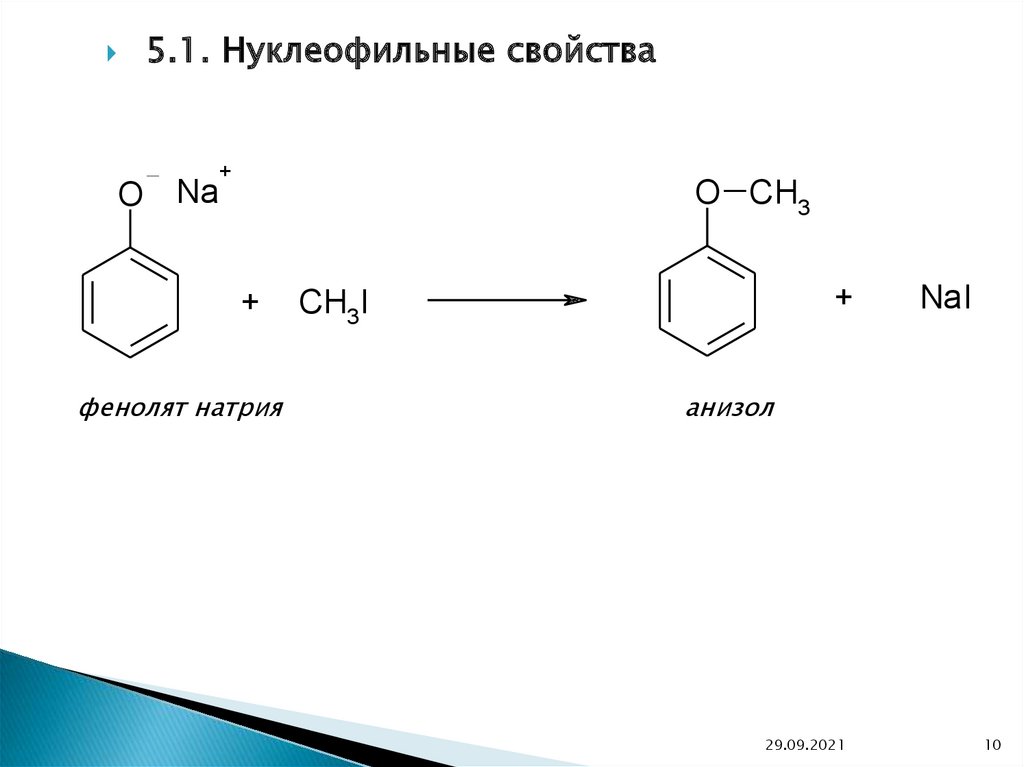
5. Химические свойства5.1. Кислотные свойства
O Na
OH
+
Фенол
NaOH
+
+
H2O
фенолят натрия
29.09.2021
9
10.
5.1. Нуклеофильные свойстваO Na
+
O CH3
+
фенолят натрия
+
CH3 I
NaI
анизол
29.09.2021
10
11.
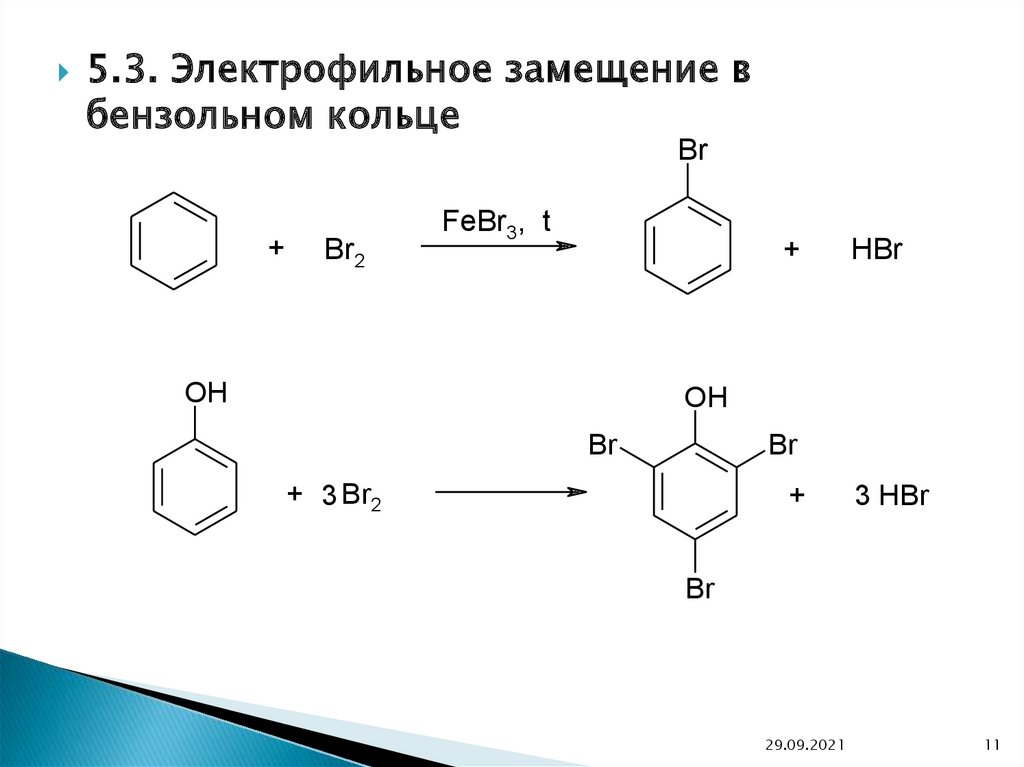
5.3. Электрофильное замещение вбензольном кольце
Br
+
Br2
FeBr3, t
+
OH
HBr
OH
Br
Br
+ 3 Br2
+
3 HBr
Br
29.09.2021
11
12.
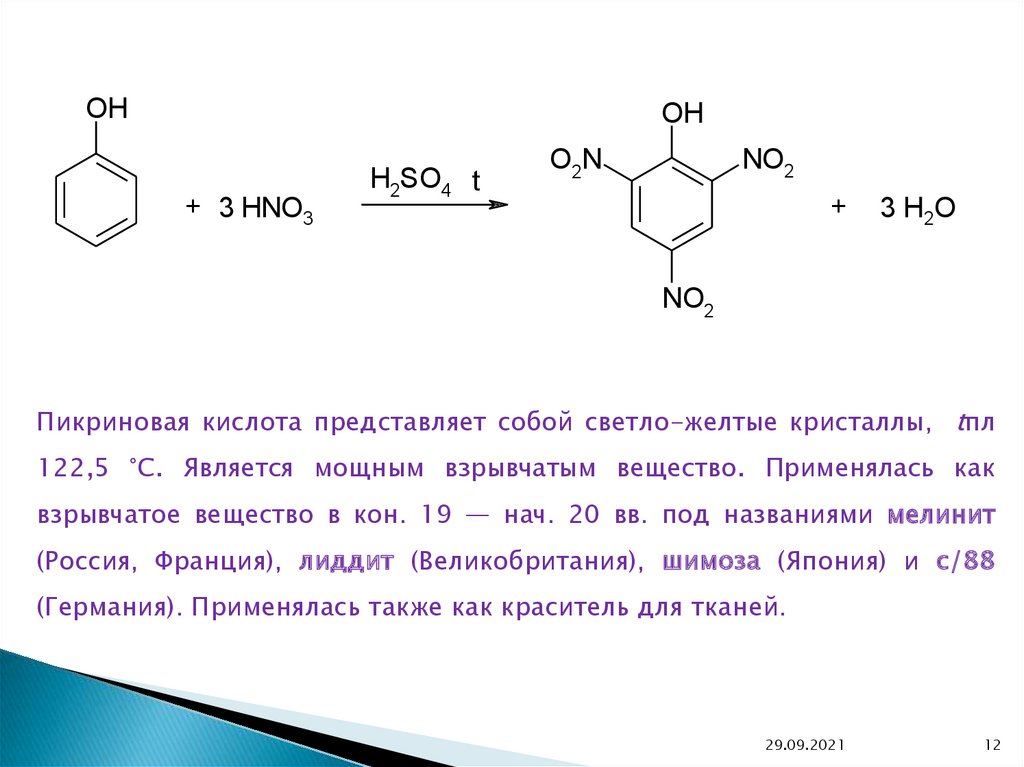
OHOH
+ 3 HNO3
H2SO4 t
NO2
O2N
+
3 H2O
NO2
Пикриновая кислота представляет собой светло-желтые кристаллы, tпл
122,5 °С. Является мощным взрывчатым вещество. Применялась как
взрывчатое вещество в кон. 19 — нач. 20 вв. под названиями мелинит
(Россия, Франция), лиддит (Великобритания), шимоза (Япония) и с/88
(Германия). Применялась также как краситель для тканей.
29.09.2021
12
13.
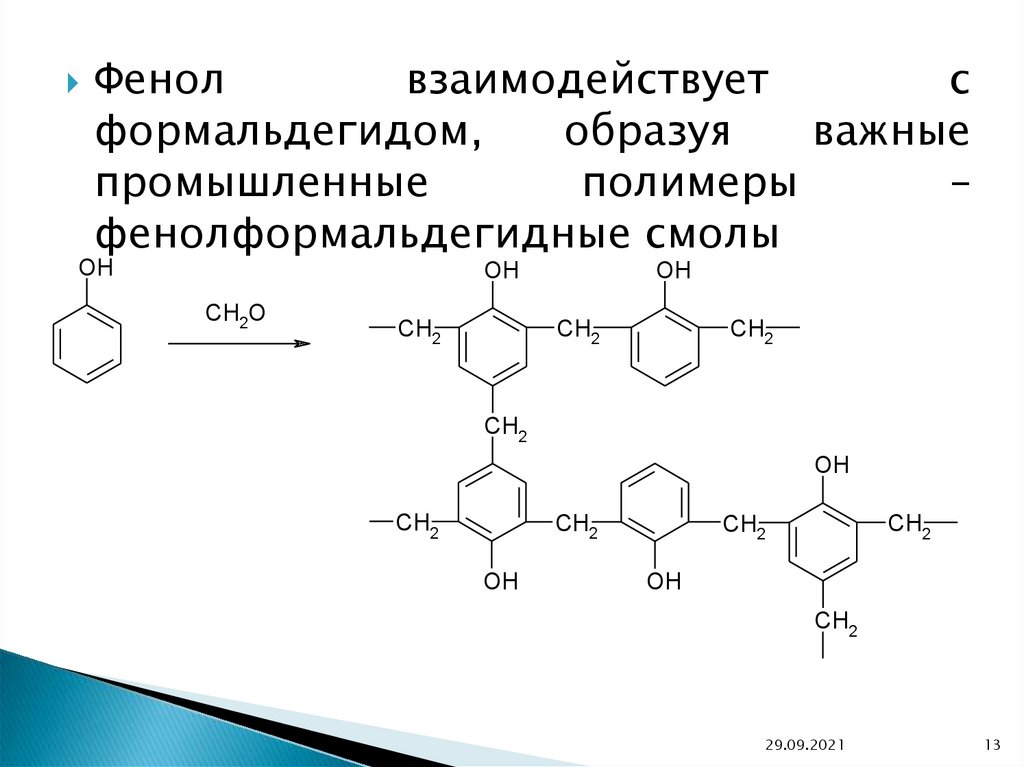
Фенолвзаимодействует
с
формальдегидом,
образуя
важные
промышленные
полимеры
–
фенолформальдегидные смолы
OH
OH
CH2O
CH2
OH
CH2
CH2
CH2
OH
CH2
CH2
OH
CH2
CH2
OH
CH2
29.09.2021
13
14.
Фенолформальдегидныесмолы
являются
вязкими
жидкостями или твердыми веществами. Отвержденные
фенолоформальдегидные
смолы
обладают
электроизоляционными
и
механическими
свойствами.
Применяются в производстве фенопластов, клеев, лаков,
герметиков, фанеры, фенолформальдегидного волокна
(кайнол).
Фенолформальдегидные
смолы
являлись
первыми
промышленными синтетическими смолами; их производство
под названием “бакелит” было начато в 1909 году.
Также,
в
промышленности
используются
крезолоформальдегидные
смолы,
резорцино-формальдегидные
смолы, феноло-анилино-формальдегидные смолы, фенологексаметилентетраминовые смолы, феноло-фурфурольные
смолы и смешанные смолы.
29.09.2021
14
15.
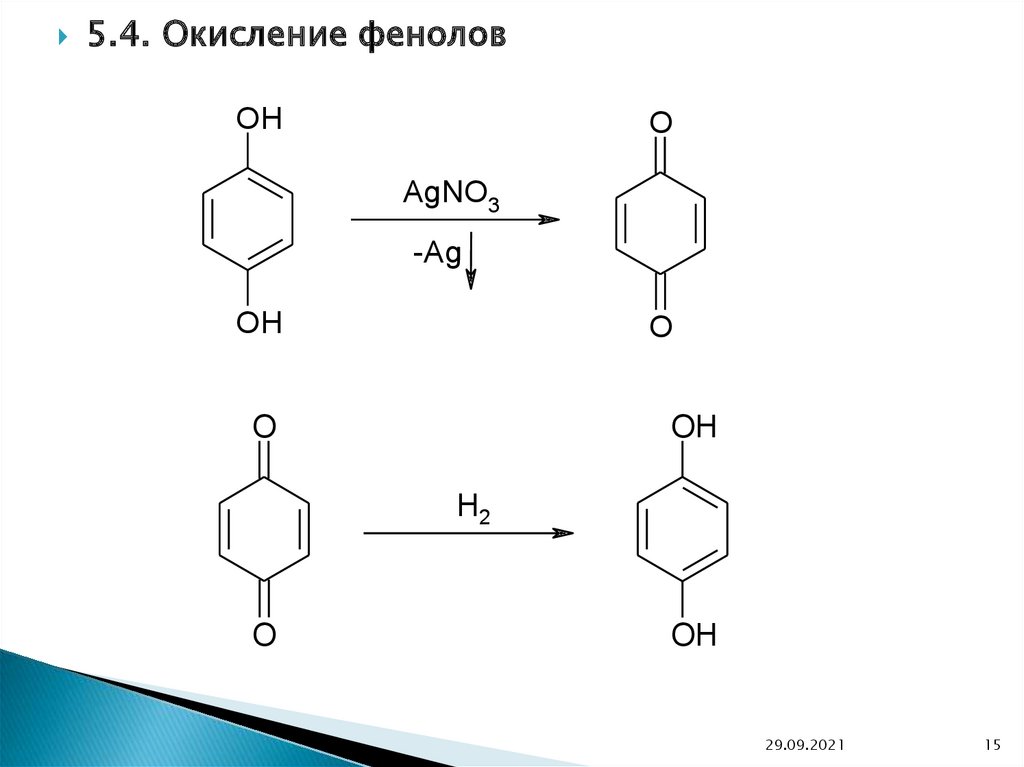
5.4. Окисление феноловOH
O
AgNO3
-Ag
OH
O
O
OH
H2
O
OH
29.09.2021
15
16.
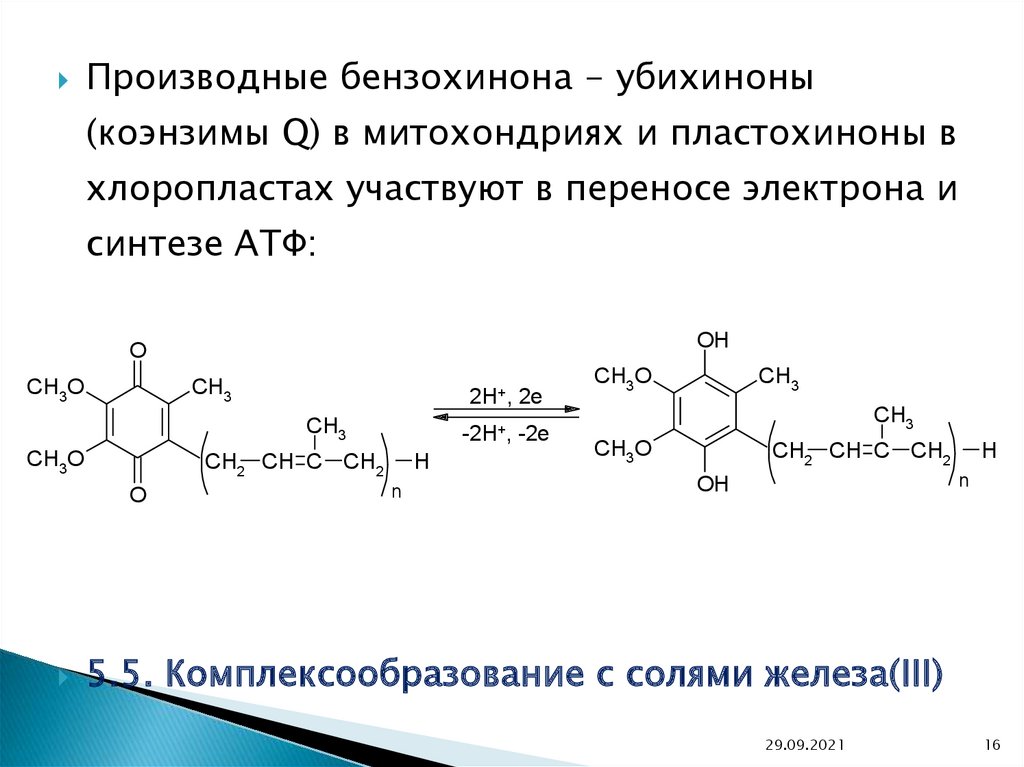
Производные бензохинона - убихиноны(коэнзимы Q) в митохондриях и пластохиноны в
хлоропластах участвуют в переносе электрона и
синтезе АТФ:
OH
O
CH3
CH3O
2H+,
CH3
CH3O
-2H+, -2e
CH2 CH C CH2
O
2e
H
n
CH3
CH3O
CH3
CH3O
CH2 CH C CH2
H
n
OH
5.5. Комплексообразование с солями железа(III)
29.09.2021
16
17.
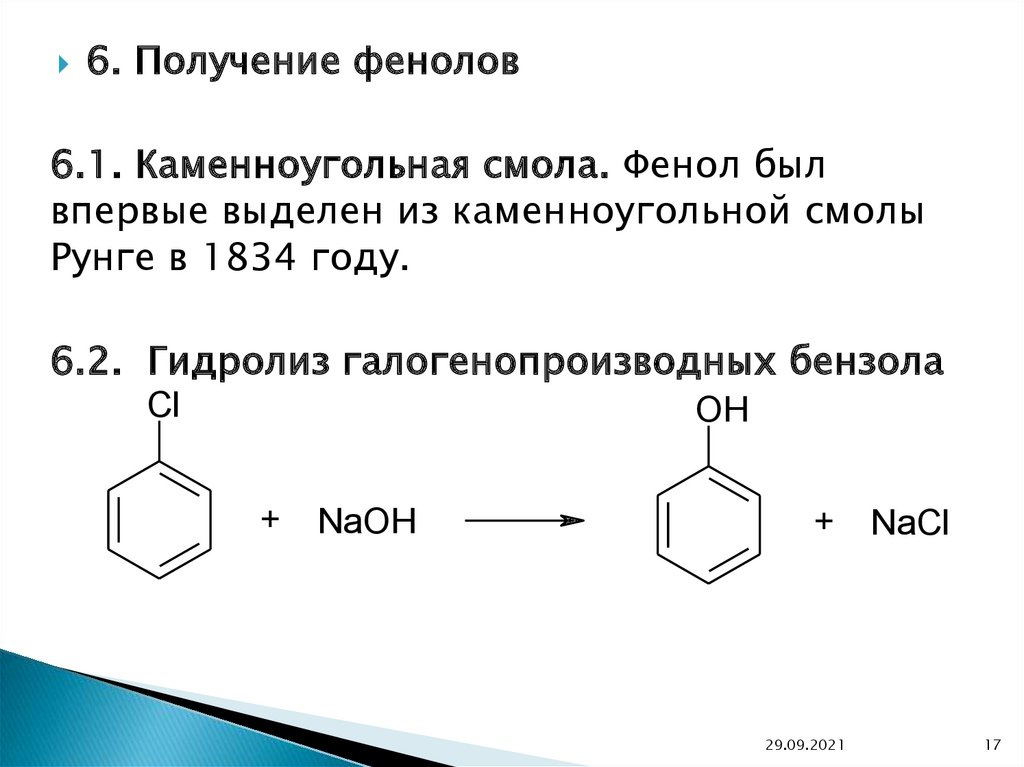
6. Получение фенолов6.1. Каменноугольная смола. Фенол был
впервые выделен из каменноугольной смолы
Рунге в 1834 году.
6.2. Гидролиз галогенопроизводных бензола
Cl
OH
+
NaOH
+
29.09.2021
NaCl
17
18.
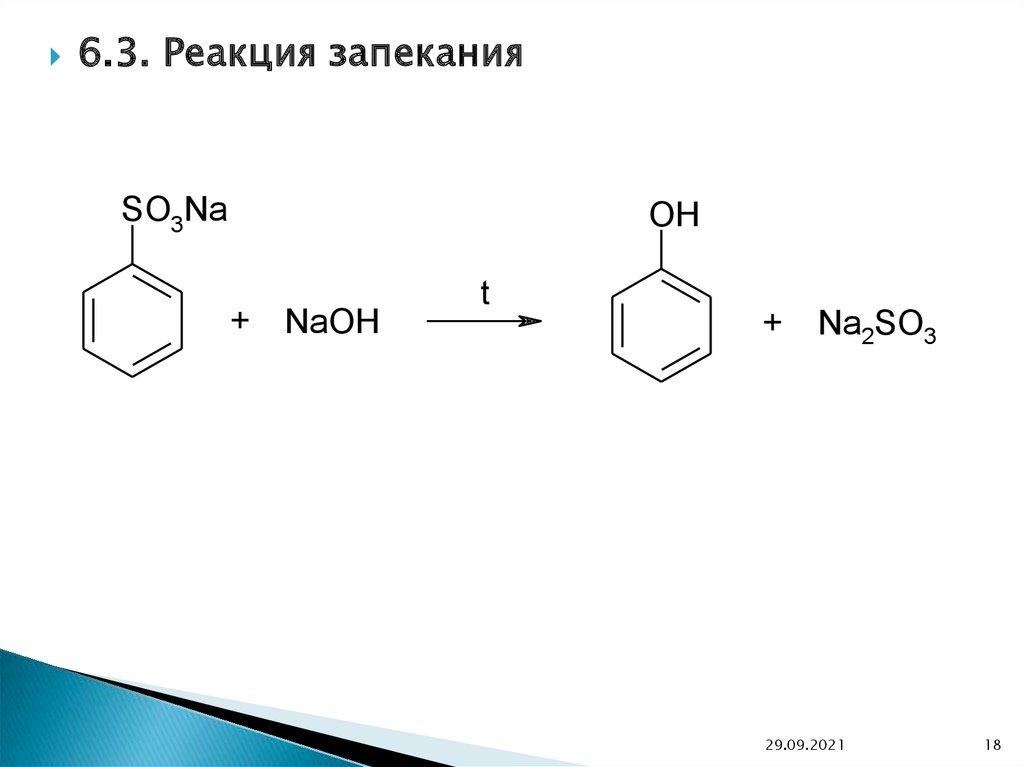
6.3. Реакция запеканияSO3Na
OH
+
NaOH
t
+
Na2SO3
29.09.2021
18
19.
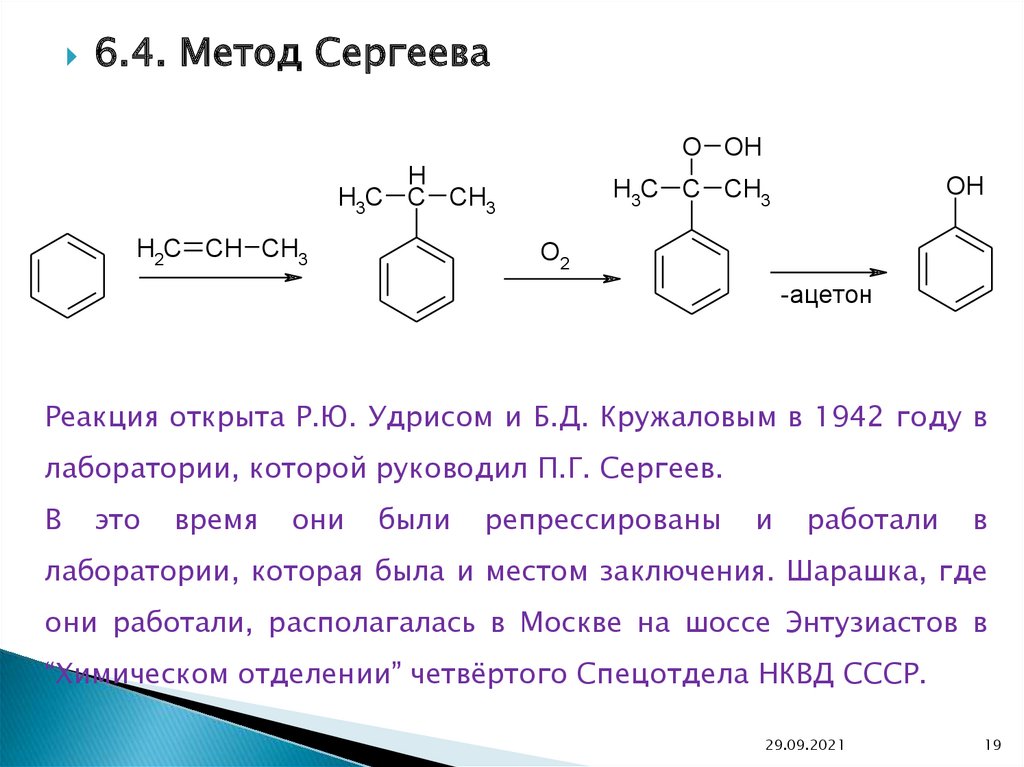
6.4. Метод СергееваO OH
H
H3C C CH3
H2C CH CH3
OH
H3C C CH3
O2
-ацeтон
Реакция открыта Р.Ю. Удрисом и Б.Д. Кружаловым в 1942 году в
лаборатории, которой руководил П.Г. Сергеев.
В
это
время
они
были
репрессированы
и
работали
в
лаборатории, которая была и местом заключения. Шарашка, где
они работали, располагалась в Москве на шоссе Энтузиастов в
“Химическом отделении” четвёртого Спецотдела НКВД СССР.
29.09.2021
19
20.
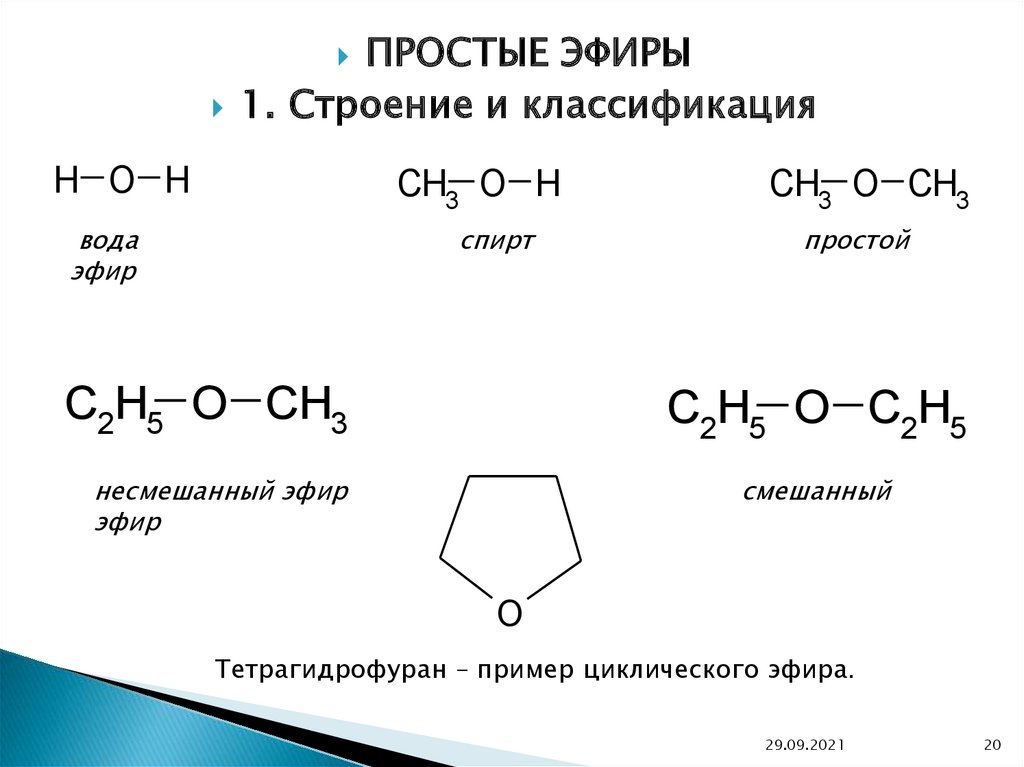
ПРОСТЫЕ ЭФИРЫ1. Строение и классификация
H O H
CH3 O H
вода
эфир
спирт
C2H5 O CH3
CH3 O CH3
простой
C2H5 O C2H5
несмешанный эфир
эфир
смешанный
O
Тетрагидрофуран – пример циклического эфира.
29.09.2021
20
21.
2. НоменклатураОбычно простые эфиры называют по
радикально-функциональной номенклатуре,
перечисляя радикалы в виде прилагательного и
добавляя слово эфир.
По номенклатуре ИЮПАК эфиры называются как
алкоксильные производные углеводородов,
используя приставки алкокси-, алкенилокси-,
арилокси- и т.д.
диметиловый эфир
CH3 O CH3
метоксиметан
29.09.2021
21
22.
3. Изомерия3.1. Cтруктурная изомерия
3.1.1. Метамерия
CH3 CH2 CH2 O CH3
метилпропиловый эфир
CH3 CH2 O CH2 CH3
диэтиловый эфир
3.1.2. Изомерия углеродного скелета.
CH3
CH3 CH2 CH2 CH2 O CH3
метилбутиловый эфир
CH3 CH CH2 O
CH3
метилизобутиловый эфир
29.09.2021
22
23.
3.1.3. Межклассовая изомерияCH3 CH2 OH
этанол
CH3 O CH3
диметиловый эфир
29.09.2021
23
24.
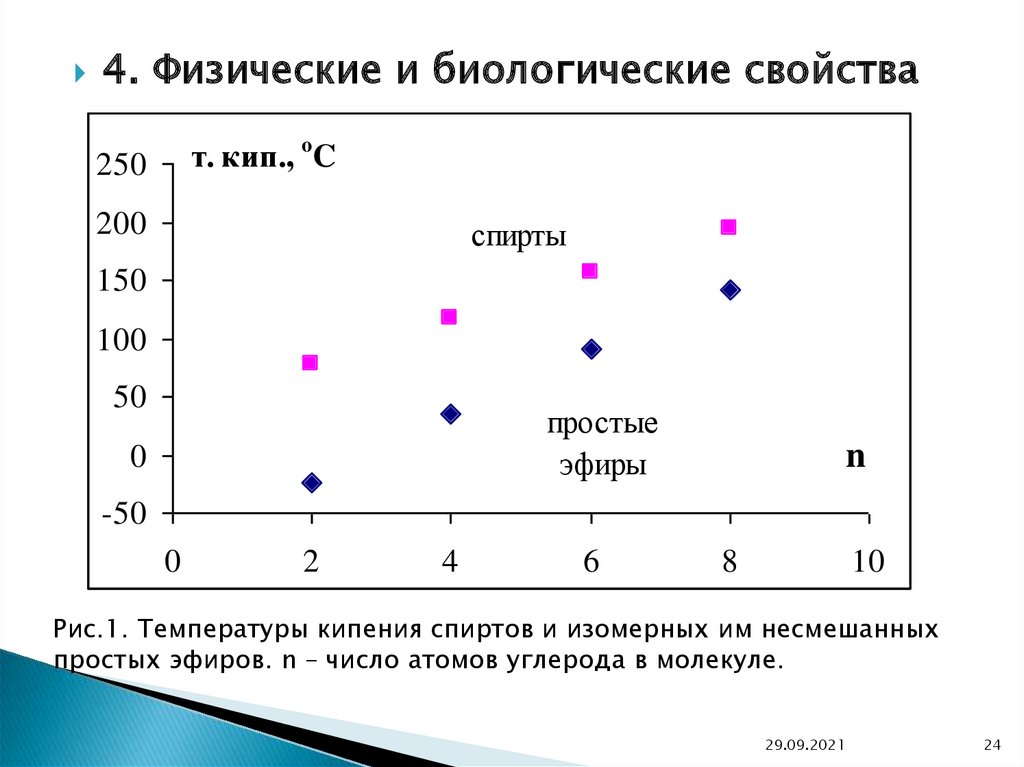
4. Физические и биологические свойстват. кип., o C
250
200
спирты
150
100
50
простые
эфиры
0
n
-50
0
2
4
6
8
10
Рис.1. Температуры кипения спиртов и изомерных им несмешанных
простых эфиров. n – число атомов углерода в молекуле.
29.09.2021
24
25.
Простые эфиры являются довольно инертнымисоединениями,
и
значит
относительно
малотоксичными. Простые эфиры проявляют
наркотические свойства:
диэтиловый эфир
широко использовался и используется для
наркоза.
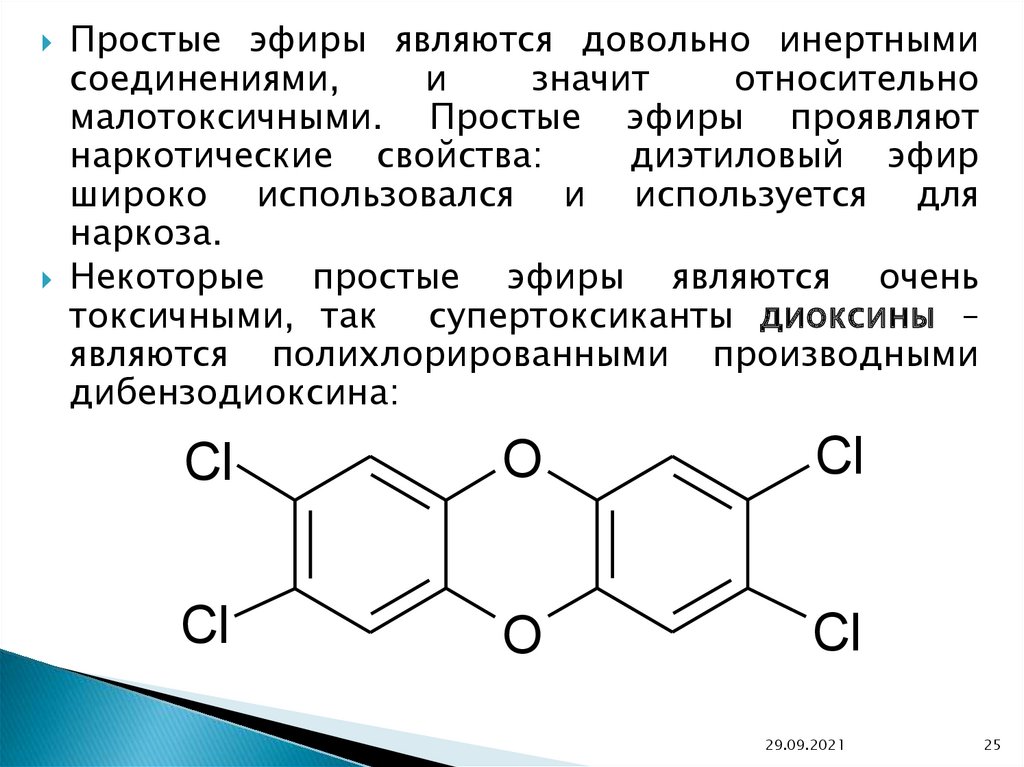
Некоторые простые эфиры являются очень
токсичными, так супертоксиканты диоксины –
являются полихлорированными производными
дибензодиоксина:
Cl
O
Cl
Cl
O
Cl
29.09.2021
25
26.
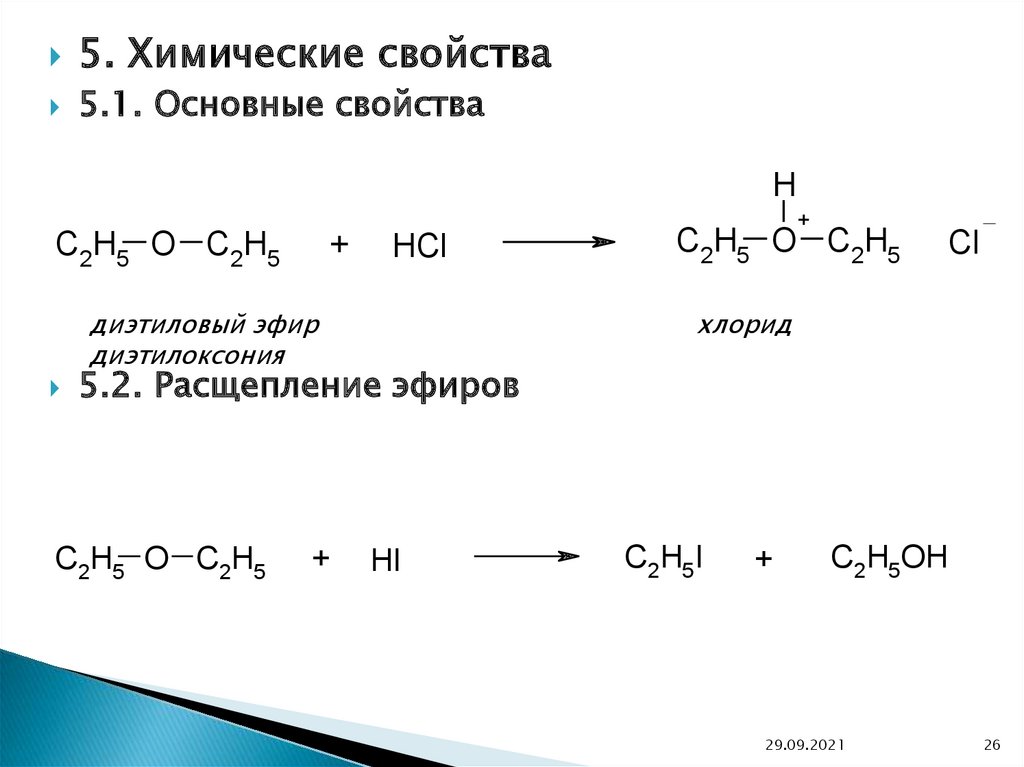
5. Химические свойства5.1. Основные свойства
H
C2H5 O C2H5
+
+
HCl
диэтиловый эфир
диэтилоксония
C2H5 O C2H5
Cl
хлорид
5.2. Расщепление эфиров
C2H5 O C2H5
+
HI
C2H5I
+
C2H5OH
29.09.2021
26
27.
5.3. Окисление эфировПри длительном контакте с кислородом в
эфире
накапливаются
чрезвычайно
взрывчатые гидроперекиси, которые могут
образовать кристаллический осадок на дне
ёмкости с эфиром.
Особенно
склонен
образовывать
такие
соединения диизопропиловый эфир.
29.09.2021
27
28.
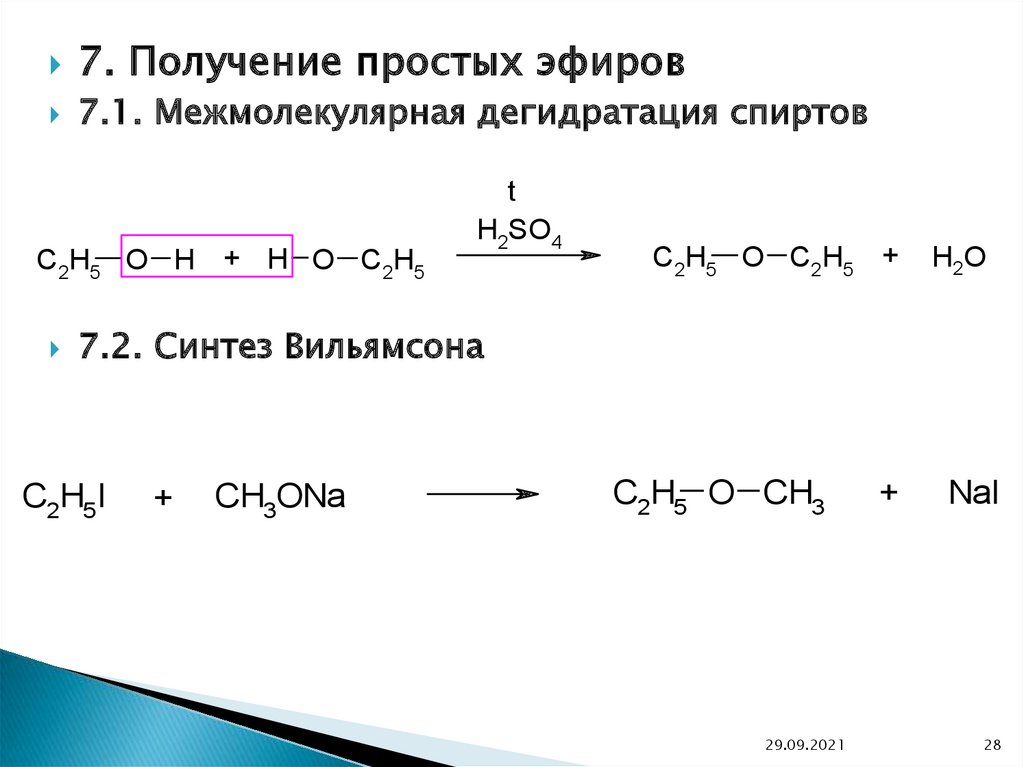
7. Получение простых эфиров7.1. Межмолекулярная дегидратация спиртов
C2H5 O H + H O C2H5
t
H2SO4
C2H5 O C2H5 +
H2O
7.2. Синтез Вильямсона
C2H5I
+
CH3ONa
C2H5 O CH3
29.09.2021
+
NaI
28
29.
29.09.202129










 chemistry
chemistry








