Similar presentations:
Органическая химия
1. ОРГАНИЧЕСКАЯ ХИМИЯ Лекция 9
*1. Фенолы
2. Простые эфиры
1
21.08.2017
2.
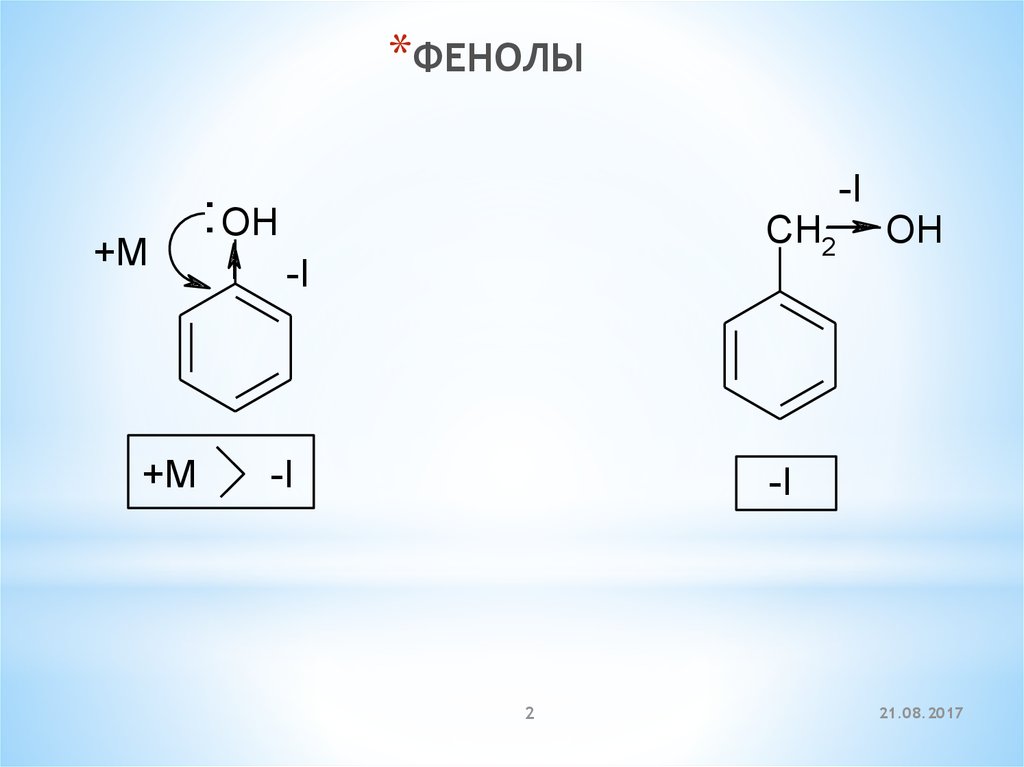
*ФЕНОЛЫ+M
+M
-I
: OH
CH2
-I
-I
OH
-I
2
21.08.2017
3.
*2. Классификация и изомерия*Как и спирты, фенолы бывают одноатомные (одна OH) и
многоатомными (несколько OH).
*Для фенолов характерна изомерия положения OHгруппы и межклассовая изомерия
OH
CH2OH
O CH3
CH3
о-крезол
(фенол)
бензиловый спирт
(ароматический спирт)
3
анизол
(простой эфир)
21.08.2017
4.
* 3. НоменклатураOH
OH
OH
OH
OH
OH
OH
OH
OH
пирокатехин
резорцин
OH
гидрохинон
OH
пирогаллол
OH
CH3
CH3
CH3
о-крезол
м-крезол
4
п-крезол
21.08.2017
5.
*4. Физические и биологические свойстваD.R.Allan, S.J.Clark, A.Dawson, P.A.McGregor, S.Parsons // Acta Crystallogr.,Sect.B, 2002, Vol.58, P.1018
5
21.08.2017
6.
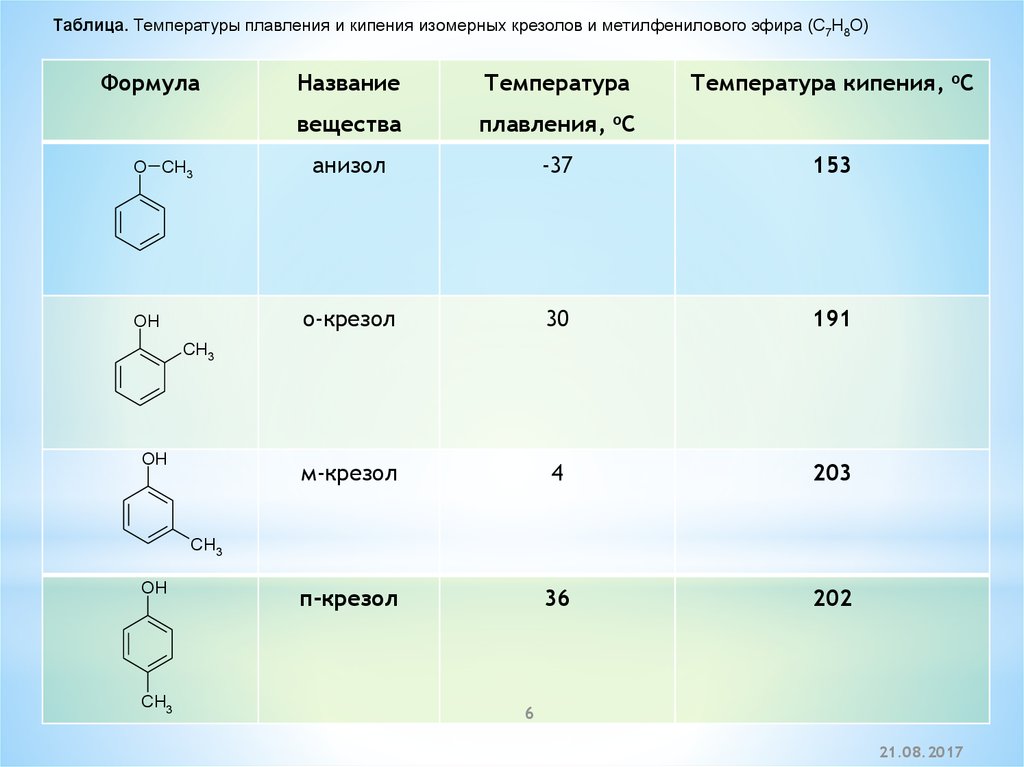
Таблица. Температуры плавления и кипения изомерных крезолов и метилфенилового эфира (C7H8O)Формула
O CH3
OH
Название
Температура
Температура кипения, oC
вещества
плавления, oC
анизол
-37
153
о-крезол
30
191
м-крезол
4
203
п-крезол
36
202
CH3
OH
CH3
OH
CH3
6
21.08.2017
7.
* Фенол очень токсичен, при попадании на кожу вызываетожоги. Фенол обладает хорошими дезинфицирующими
свойствами; это было первое вещество, которое
использовалось для дезинфекции (Дж. Листер, 1867)
* Фенолы входят в состав креозота – жидкости, получаемой из
каменноугольной смолы и используемой для пропитки шпал
для предотвращения их гниения. Очищенный креозот
используется как антисептик в медицине.
* Пентахлорфенол применяется для пропитки древесины как
антисептик, инсектицид и фунгицид. Пентахлорфенолятом
натрия обработаны брёвна Кижских церквей.
7
21.08.2017
8.
821.08.2017
9.
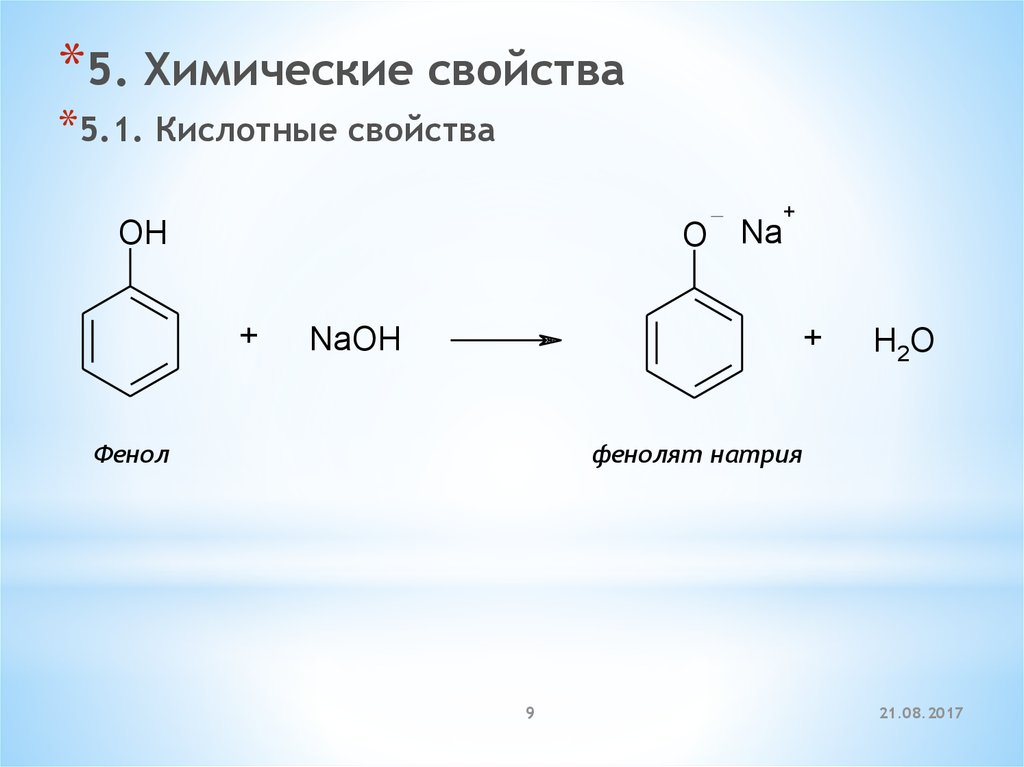
*5. Химические свойства*5.1. Кислотные свойства
O Na
OH
+
+
+
NaOH
Фенол
H2O
фенолят натрия
9
21.08.2017
10.
* 5.1. Нуклеофильные свойстваO Na
+
O CH3
+
+
CH3 I
фенолят натрия
NaI
анизол
10
21.08.2017
11.
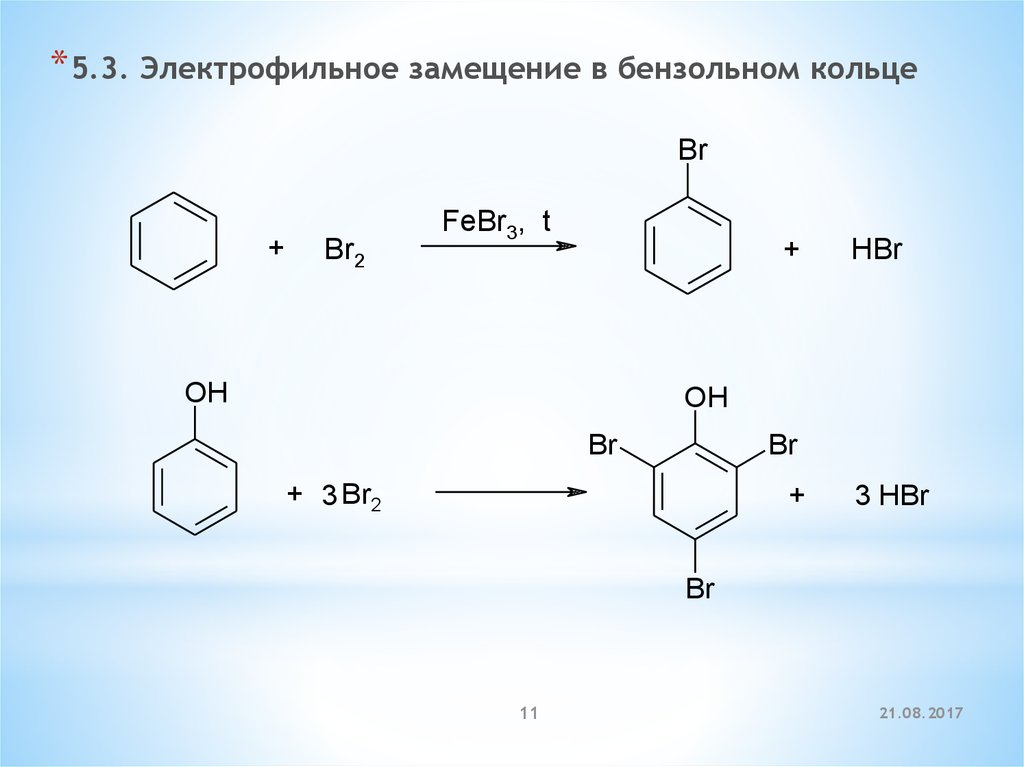
* 5.3. Электрофильное замещение в бензольном кольцеBr
+
Br2
FeBr3, t
+
OH
HBr
OH
Br
Br
+ 3 Br2
+
3 HBr
Br
11
21.08.2017
12.
OHOH
+ 3 HNO3
NO2
O2N
H2SO4 t
+
3 H2O
NO2
Пикриновая кислота представляет собой светло-желтые кристаллы, tпл 122,5
°С. Является мощным взрывчатым вещество. Применялась как взрывчатое
вещество в кон. 19 — нач. 20 вв. под названиями мелинит (Россия, Франция),
лиддит (Великобритания), шимоза (Япония) и с/88 (Германия). Применялась
также как краситель для тканей.
12
21.08.2017
13.
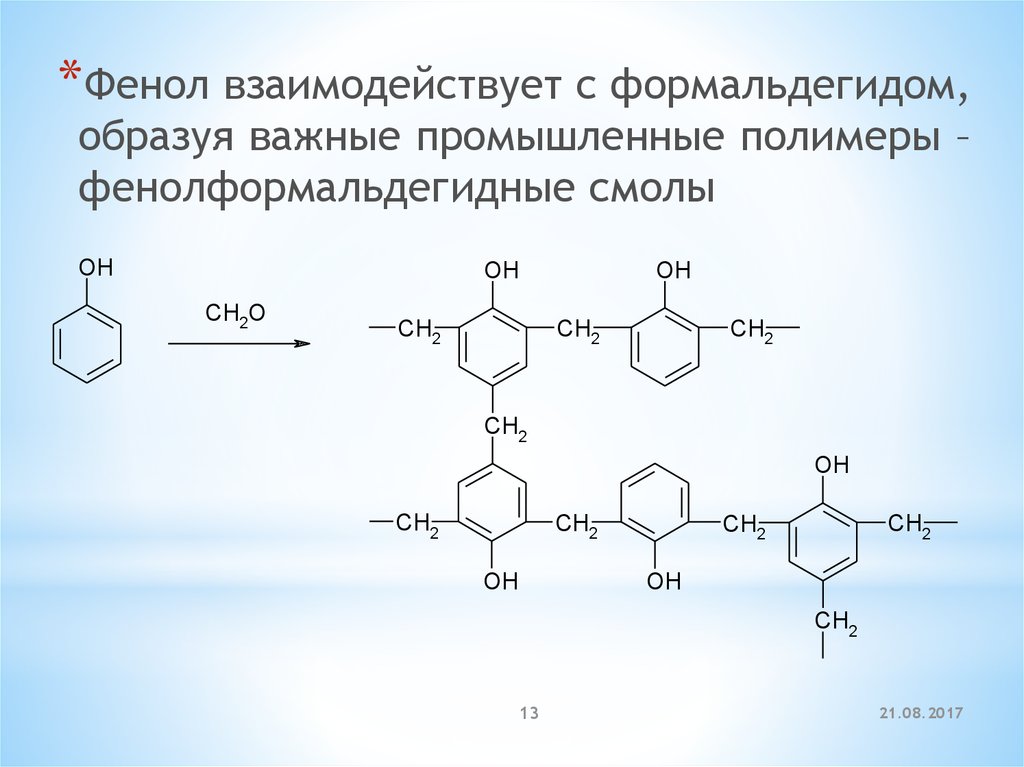
*Фенол взаимодействует с формальдегидом,образуя важные промышленные полимеры –
фенолформальдегидные смолы
OH
OH
CH2O
CH2
OH
CH2
CH2
CH2
OH
CH2
CH2
OH
CH2
CH2
OH
CH2
13
21.08.2017
14.
* Фенолформальдегидные смолы являются вязкими жидкостями илитвердыми веществами. Отвержденные фенолоформальдегидные
смолы обладают электроизоляционными и механическими
свойствами. Применяются в производстве фенопластов, клеев,
лаков, герметиков, фанеры, фенолформальдегидного волокна
(кайнол).
*
Фенолформальдегидные
смолы
являлись
первыми
промышленными синтетическими смолами; их производство под
названием “бакелит” было начато в 1909 году.
* Также,
в
промышленности
используются
крезолоформальдегидные смолы, резорцино-формальдегидные смолы,
феноло-анилино-формальдегидные
смолы,
фенологексаметилентетраминовые смолы, феноло-фурфурольные смолы
и смешанные смолы.
14
21.08.2017
15.
*5.4. Окисление феноловOH
O
AgNO3
-Ag
OH
O
O
OH
H2
O
OH
15
21.08.2017
16.
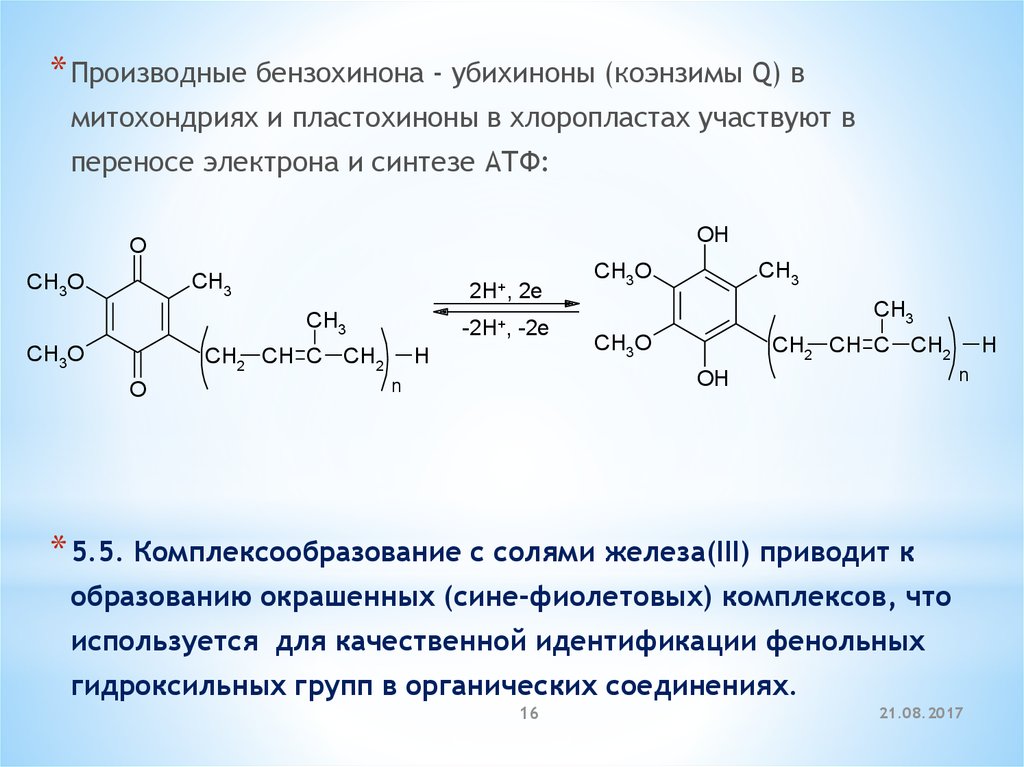
* Производные бензохинона - убихиноны (коэнзимы Q) вмитохондриях и пластохиноны в хлоропластах участвуют в
переносе электрона и синтезе АТФ:
OH
O
CH3
CH3O
2H+, 2e
CH3
CH3O
-2H+,
CH2 CH C CH2
O
-2e
H
CH3
CH3O
CH3
CH3O
CH2 CH C CH2
n
OH
n
H
* 5.5. Комплексообразование с солями железа(III) приводит к
образованию окрашенных (сине-фиолетовых) комплексов, что
используется для качественной идентификации фенольных
гидроксильных групп в органических соединениях.
16
21.08.2017
17.
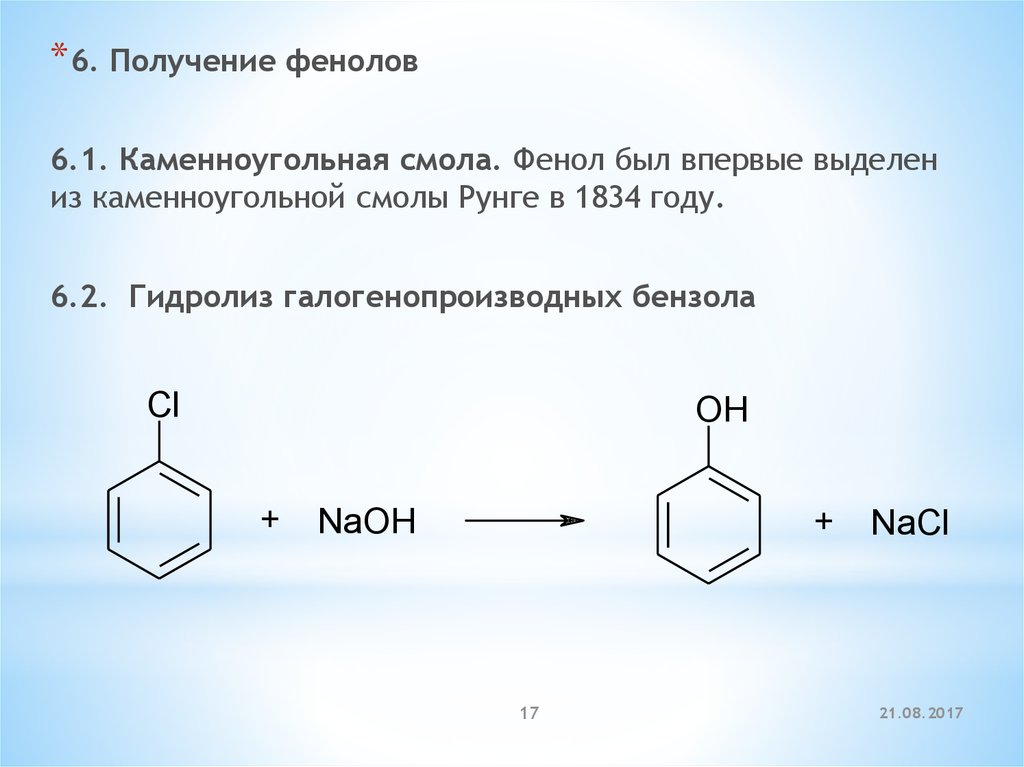
* 6. Получение фенолов6.1. Каменноугольная смола. Фенол был впервые выделен
из каменноугольной смолы Рунге в 1834 году.
6.2. Гидролиз галогенопроизводных бензола
Cl
OH
+
NaOH
+
17
NaCl
21.08.2017
18.
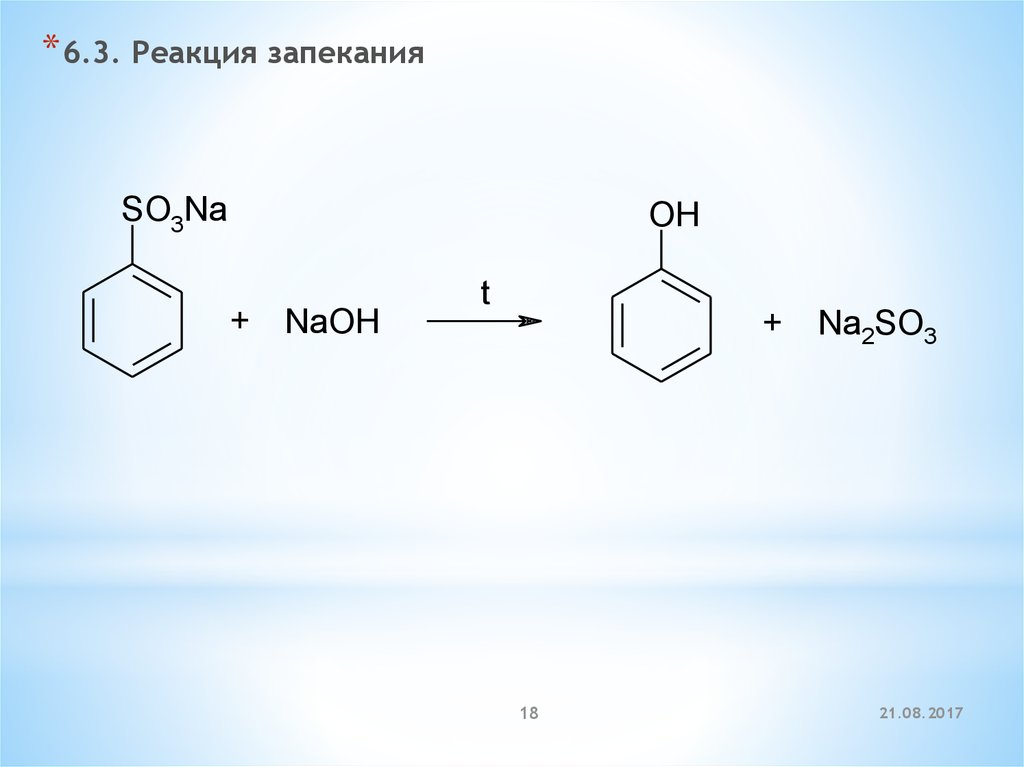
* 6.3. Реакция запеканияSO3Na
OH
+
NaOH
t
+
18
Na2SO3
21.08.2017
19.
* 6.4. Метод СергееваO OH
H
H3C C CH3
OH
H3C C CH3
H2C CH CH3
O2
-ацeтон
Реакция открыта Р.Ю. Удрисом и Б.Д. Кружаловым в 1942 году в
лаборатории, которой руководил П.Г. Сергеев.
В это время они были репрессированы и работали в лаборатории,
которая была и местом заключения. Шарашка, где они работали,
располагалась в Москве на шоссе Энтузиастов в “Химическом
отделении” четвёртого Спецотдела НКВД СССР.
19
21.08.2017
20.
* ПРОСТЫЕ ЭФИРЫ* 1. Строение и классификация
H O H
CH3 O H
вода
спирт
CH3 O CH3
простой эфир
C2H5 O CH3
C2H5 O C2H5
смешанный эфир
несимм.
несмешанный эфир
симм
O
Тетрагидрофуран – пример циклического эфира.
20
21.08.2017
21.
*2. Номенклатура*Обычно простые эфиры называют по радикально-
функциональной номенклатуре, перечисляя радикалы
в виде прилагательного и добавляя слово эфир.
*По номенклатуре ИЮПАК эфиры называются как
алкоксильные производные углеводородов, используя
приставки алкокси-, алкенилокси-, арилокси- и т.д.
диметиловый эфир
CH3 O CH3
метоксиметан
21
21.08.2017
22.
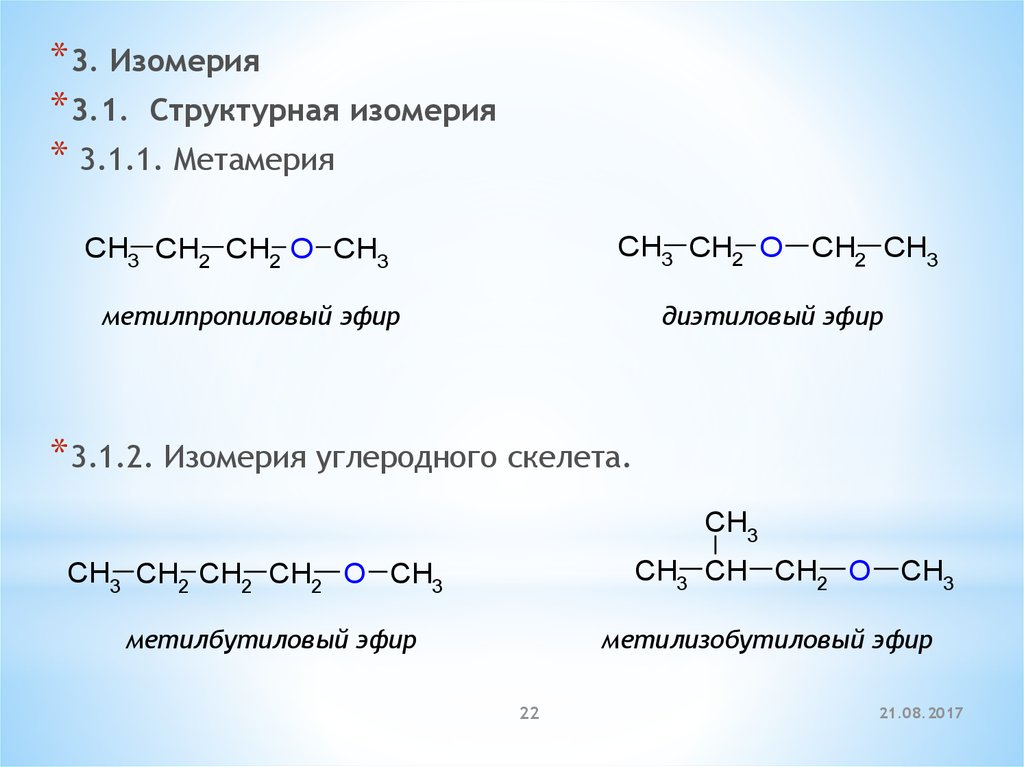
* 3. Изомерия* 3.1. Cтруктурная изомерия
* 3.1.1. Метамерия
CH3 CH2 O CH2 CH3
CH3 CH2 CH2 O CH3
метилпропиловый эфир
диэтиловый эфир
* 3.1.2. Изомерия углеродного скелета.
CH3
CH3 CH CH2 O
CH3 CH2 CH2 CH2 O CH3
метилбутиловый эфир
CH3
метилизобутиловый эфир
22
21.08.2017
23.
* 3.1.3. Межклассовая изомерияCH3 O CH3
CH3 CH2 OH
этанол
диметиловый эфир
23
21.08.2017
24.
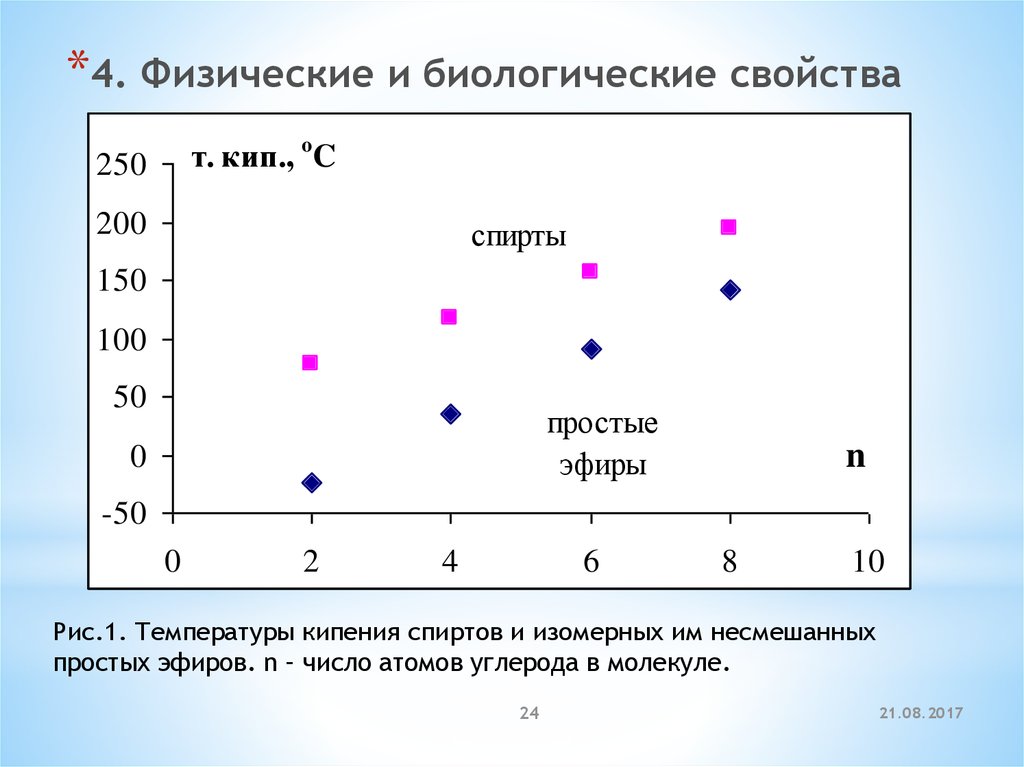
*4. Физические и биологические свойстват. кип., o C
250
200
спирты
150
100
50
простые
эфиры
0
n
-50
0
2
4
6
8
10
Рис.1. Температуры кипения спиртов и изомерных им несмешанных
простых эфиров. n – число атомов углерода в молекуле.
24
21.08.2017
25.
* Простыеэфиры
являются
довольно
инертными
соединениями, и значит относительно малотоксичными.
Простые
эфиры
проявляют
наркотические
свойства:
диэтиловый эфир широко использовался и используется для
наркоза.
* Некоторые
простые эфиры являются очень токсичными, так
супертоксиканты диоксины – являются полихлорированными
производными дибензодиоксина:
Cl
O
Cl
Cl
O
Cl
25
21.08.2017
26.
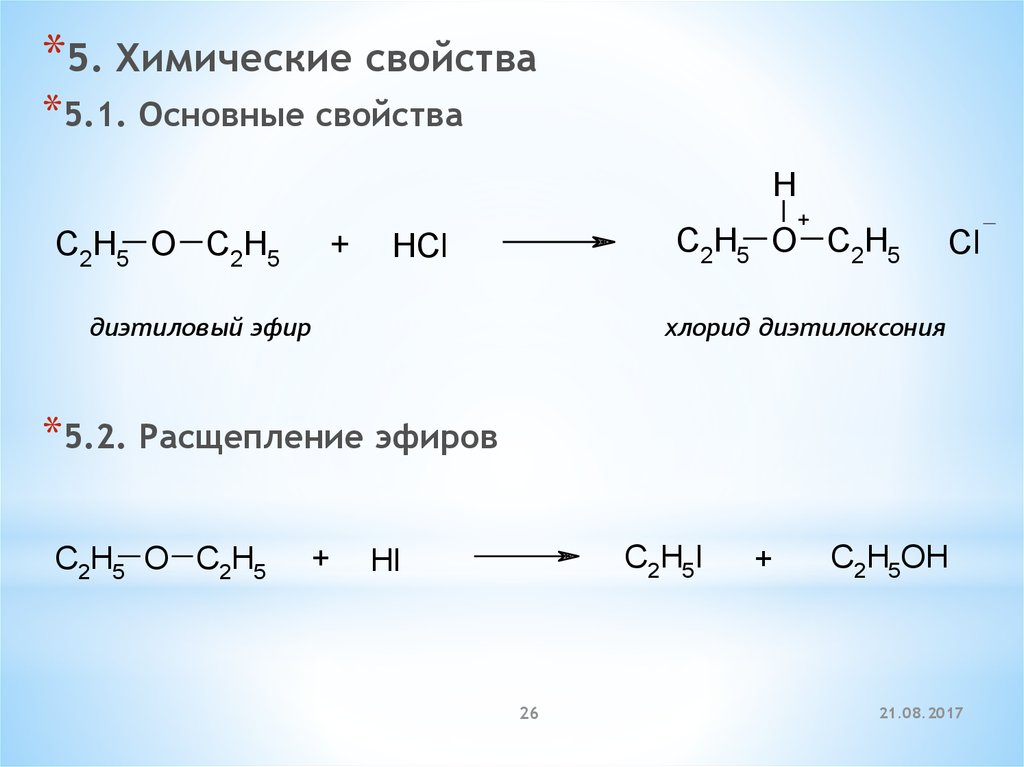
*5. Химические свойства*5.1. Основные свойства
H
C2H5 O C2H5
+
+
C2H5 O C2H5
HCl
диэтиловый эфир
Cl
хлорид диэтилоксония
*5.2. Расщепление эфиров
C2H5 O C2H5
+
C2H5I
HI
26
+
C2H5OH
21.08.2017
27.
* 5.3. Окисление эфиров* При
длительном
контакте
с
кислородом
в
эфире
накапливаются чрезвычайно взрывчатые гидроперекиси,
которые могут образовать кристаллический осадок на дне
ёмкости с эфиром.
* Особенно
склонен
образовывать
такие
соединения
диизопропиловый эфир.
27
21.08.2017
28.
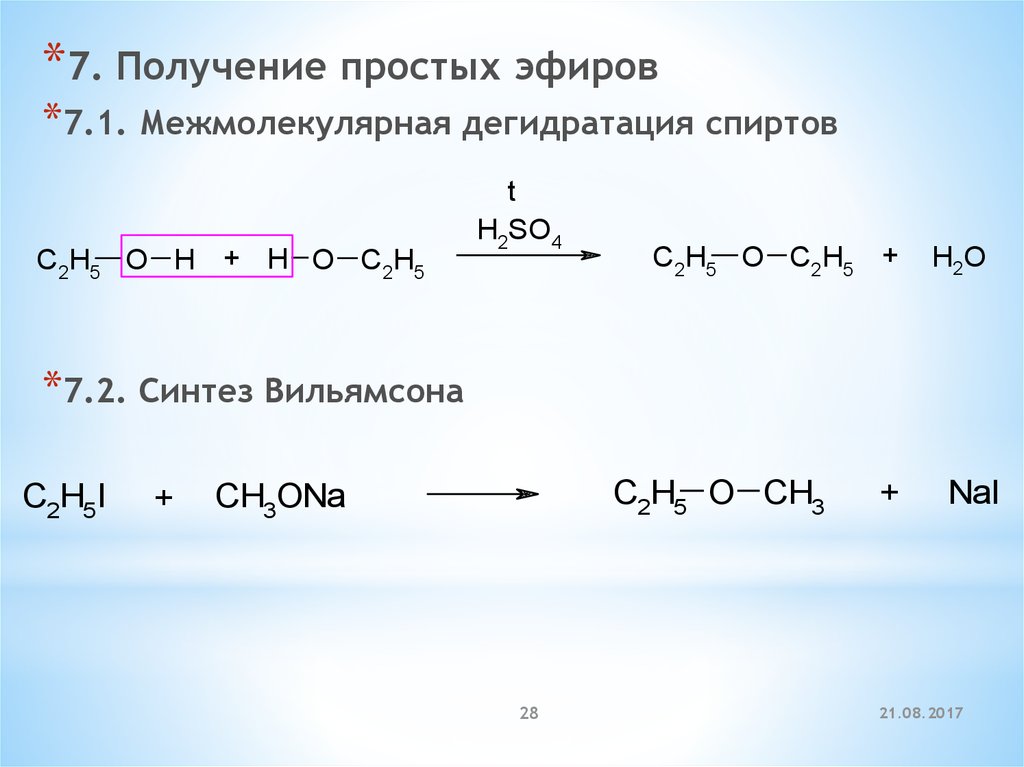
*7. Получение простых эфиров*7.1. Межмолекулярная дегидратация спиртов
C2H5 O H + H O C2H5
t
H2SO4
C2H5 O C2H5 +
H2O
*7.2. Синтез Вильямсона
C2H5I
+
C2H5 O CH3
CH3ONa
28
+
NaI
21.08.2017
29. Спасибо за Ваше внимание!
2921.08.2017

















 chemistry
chemistry








