Similar presentations:
Неметаллы. Общая характеристика и свойства неметаллов
1.
НЕМЕТАЛЛЫОБЩАЯ
ХАРАКТЕРИСТИКА И
СВОЙСТВА
НЕМЕТАЛЛОВ.
2.
НЕМЕТАЛЛЫ В ПРИРОДЕ• В
природе
встречаются
самородные
неметаллы N2 и O2 (в воздухе), сера (в
земной коре), но чаще неметаллы в природе
находятся в химически связанном виде. В
первую очередь это вода и растворённые в
ней соли, затем минералы и горные породы
(например
различные
силикаты,
алюмосиликаты,
фосфаты,
бораты,
сульфаты и карбонаты).
• По распространенности в земной коре
неметаллы занимают самые различные
места: от трех самых распространенных
элементов (O, Si, H) до весьма редких (As,
Se, I, Te).
3.
МКрасный фосфор
Алмаз
Сера
Кислород
4.
Содержание неметаллов в земной кореМассовых
процентов
Ряд1
60
50
40
30
20
10
0
49
27
0,88
0,27
КИСЛОРОД КРЕМНИЙ ВОДОРОД УГЛЕРОД
Неметалл
0,08
ФОСФОР
5.
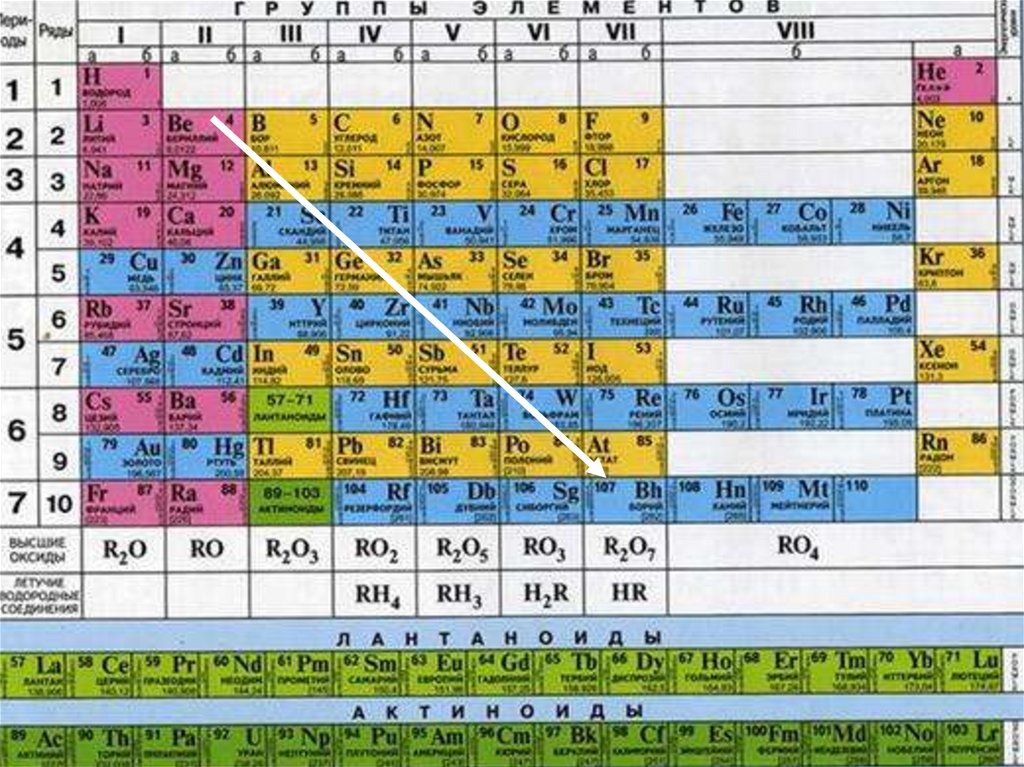
Положение неметаллов вПериодической системе
химических элементов
• Если
провести
воображаемую
диагональ от бериллия Be к астату At,
то неметаллы расположатся в главных
подгруппах выше диагонали (т. е. в
верхнем правом углу). К неметаллам
относятся также водород Н и инертные
газы.
6.
7.
Характерные физические свойстваФизические свойста
неметаллов.
неметаллов
Признаки
сравнения
Агрегатное состояние
Твёрдое (фосфор, сера), жидкое
(бром), газообразное (кислород,
хлор)
Цвет
Разнообразный (сера – жёлтый,
фосфор – белый и красный)
Блеск
Отсутствует
Прозрачность
Ковкость
Газы водород, кислород, азот
бесцветны
Отсутствует
Теплопроводность,
электропроводность
Слабая
Плотность и температуры
кипения и плавления
Низкая
8.
ПризнакиХИМИЧЕСКОЕ
сравнения
СТРОЕНИЕ И Химическое
СВОЙСТВАстроение
МЕТАЛЛОВ
неметаллов
И НЕМЕТАЛЛОВ
Число электронов на
более 4
внешнем
энергетическом уровне
Электроотрицательность высокая
Кристаллическая
структура
атомные решётки (углерод,
кремний), молекулярные
решётки (сера, фосфор,
кислород)
Окислительно –
восстановительные
свойства
окислители
9.
АЛЛОТРОПИЯ• Аллотро́пия (от др-греч. αλλος —
«другой», τροπος — «поворот,
свойство») — существование одного и
того же химического элемента в виде
двух и более простых веществ,
различных по строению и свойствам:
так называемых аллотропических
модификаций или аллотропических
форм.
10.
11.
Аллотропияуглерода
ГРАФИТ
АЛМАЗ
12.
ДОМАШНЕЕ ЗАДАНИЕ•Параграф 12,
•Упражнения 3, 5,
7* или 8*











 chemistry
chemistry








