Similar presentations:
Рівняння стану ідеального газу. Ізопроцеси
1.
2. ПОВТОРЕННЯ
1. Що називається ідеальним газом?2. Чому ідеальний газ чинить тиск на
дно й стінки посудини?
3. Як виглядає основне рівняння
молекулярно-кінетичної теорії газів.
4. Які мікроскопічні та макроскопічні
параметри характеризують стан
ідеального газу?
5. Назвіть одиницю вимірювання
абсолютної температури.
3.
6. Яке співвідношення між абсолютноютемпературою та температурою за
шкалою Цельсія?
7. Чому на шкалі Кельвіна відсутні
від’ємні температури?
8. Чому дорівнює стала Больцмана?
9. Як пов’язані між собою середня
кінетична енергія та абсолютна
температура?
10. Як пов’язані між собою тиск та
абсолютна температура?
4.
Рівняння стануідеального газу.
Ізопроцеси
5.
6.
► Чомуна балонах з газом
пишуть: “Не нагрівати!”?
► Чому нагріта медична
банка “присмоктується”
до тіла людини?
► Чому від палаючих полін
з тріском відлітають
іскри?
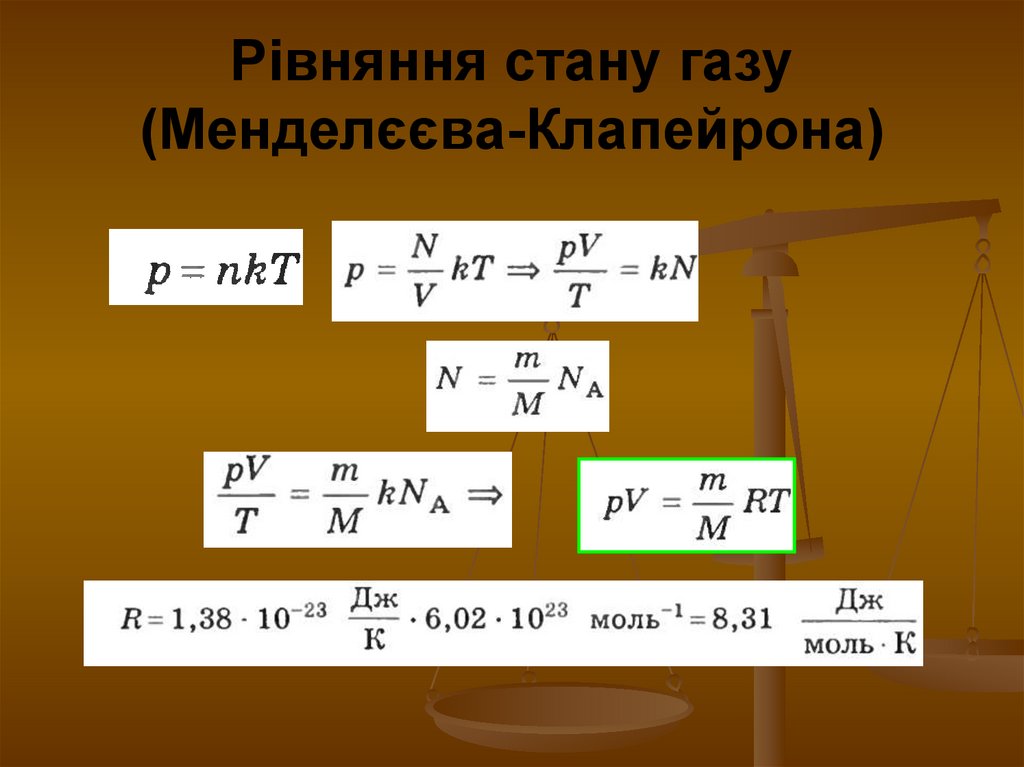
7. Рівняння стану газу (Менделєєва-Клапейрона)
8. Рівняння стану газу (рівняння Клапейрона)
Рівняння, яке пов’язує між собоюмакропараметри стану газу (p, V, T)
- рівняння Клапейрона, m = const
9.
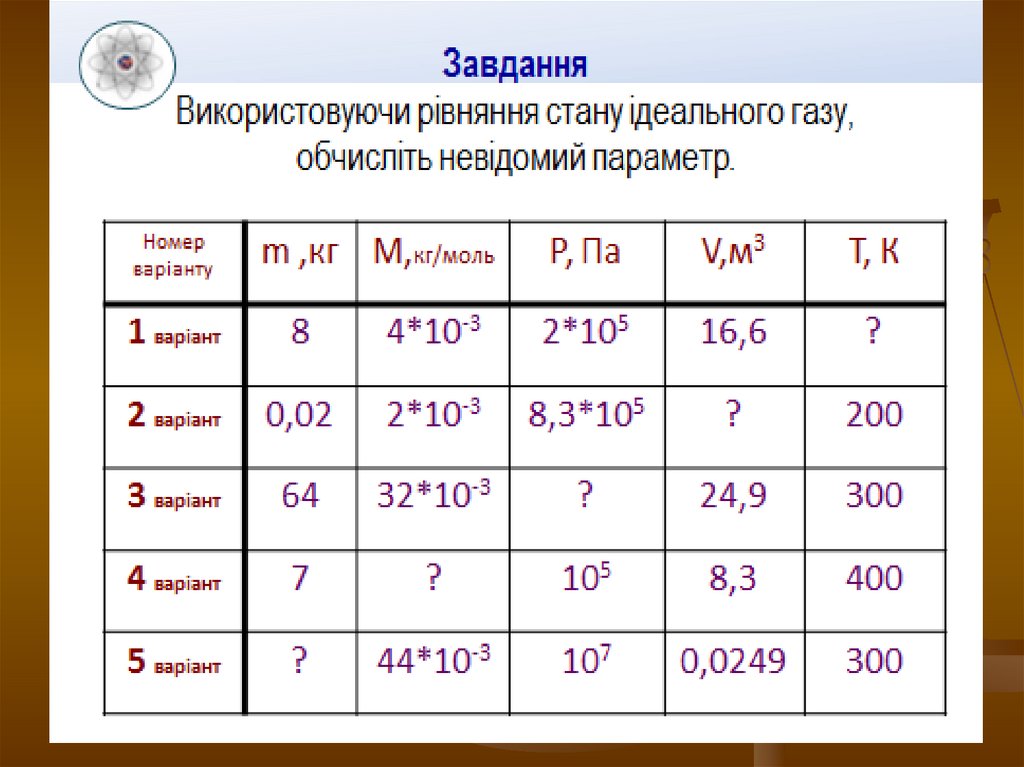
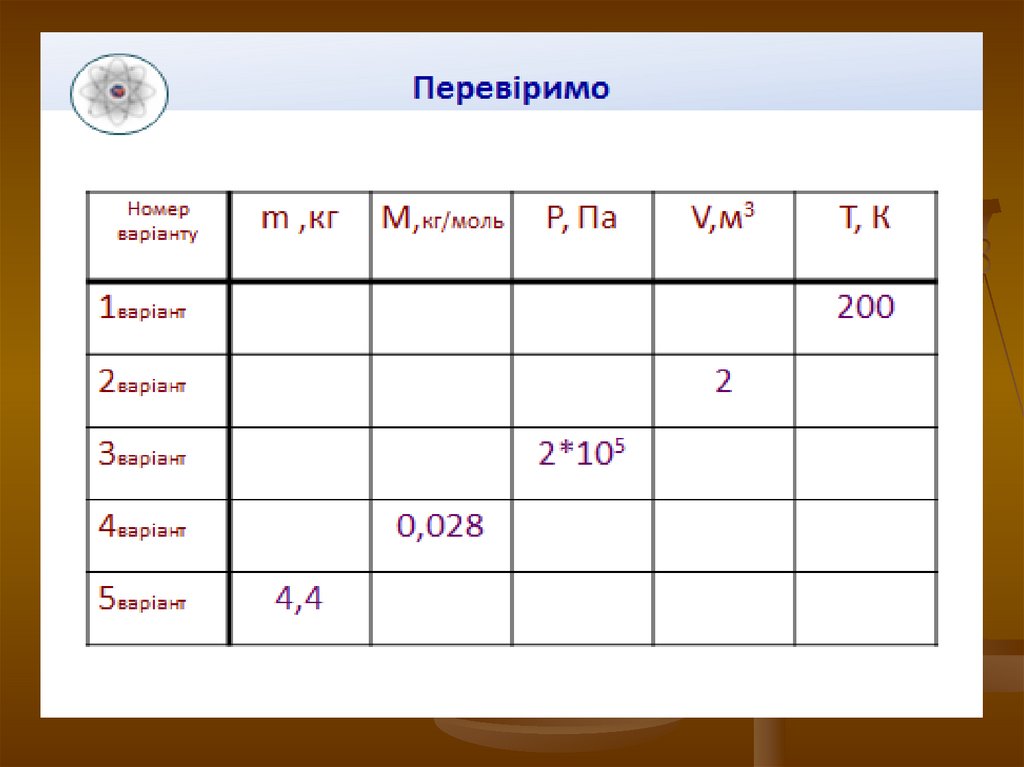
10. Давайте попрацюємо!
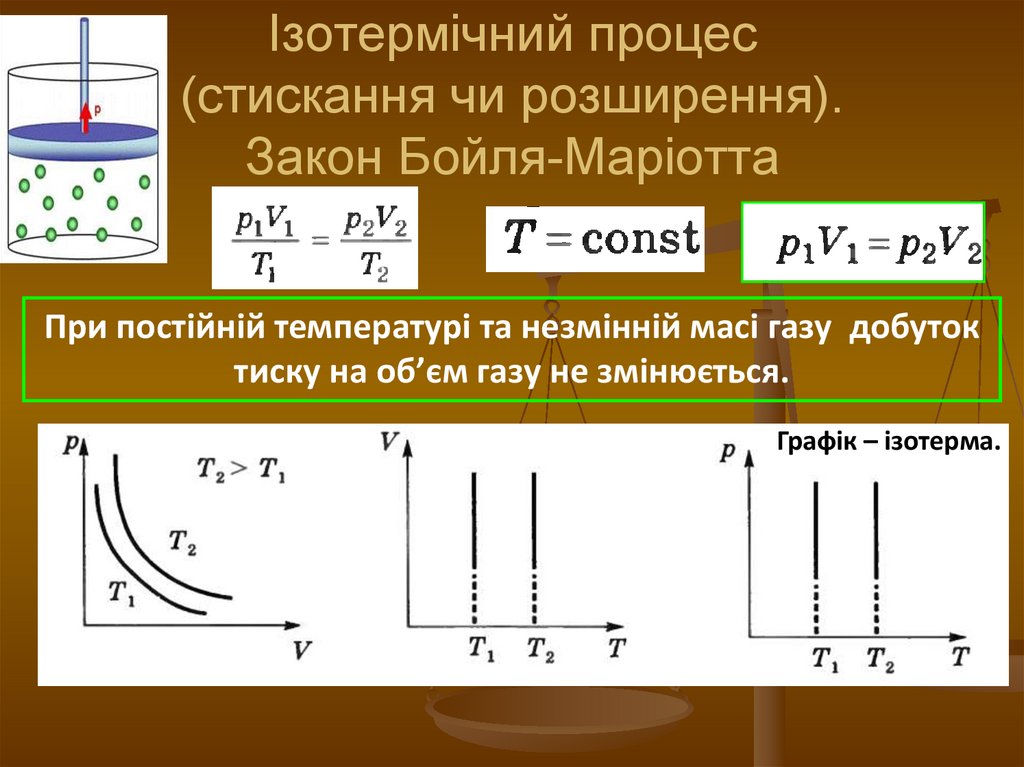
11. Ізотермічний процес (стискання чи розширення). Закон Бойля-Маріотта
При постійній температурі та незмінній масі газу добутоктиску на об’єм газу не змінюється.
Графік – ізотерма.
12. Ізобарний процес (стискання чи розширення). Закон Ґей-Люссака
При постійному тиску та незмінній масі газувідношення об’єму до температури не змінюється.
Графік – ізобара.
13. Ізохорний процес (нагрівання чи охолодження). Закон Шарля
При постійному об’ємі та незмінній масі газувідношення тиску до температури не змінюється
Графік – ізохора.
14.
15. Розв’яжіть задачу:
При температурі 27°С тиск газу взакритій посудині був 75 кПа. Яким буде
тиск цього газу при температурі -13°С?
16.
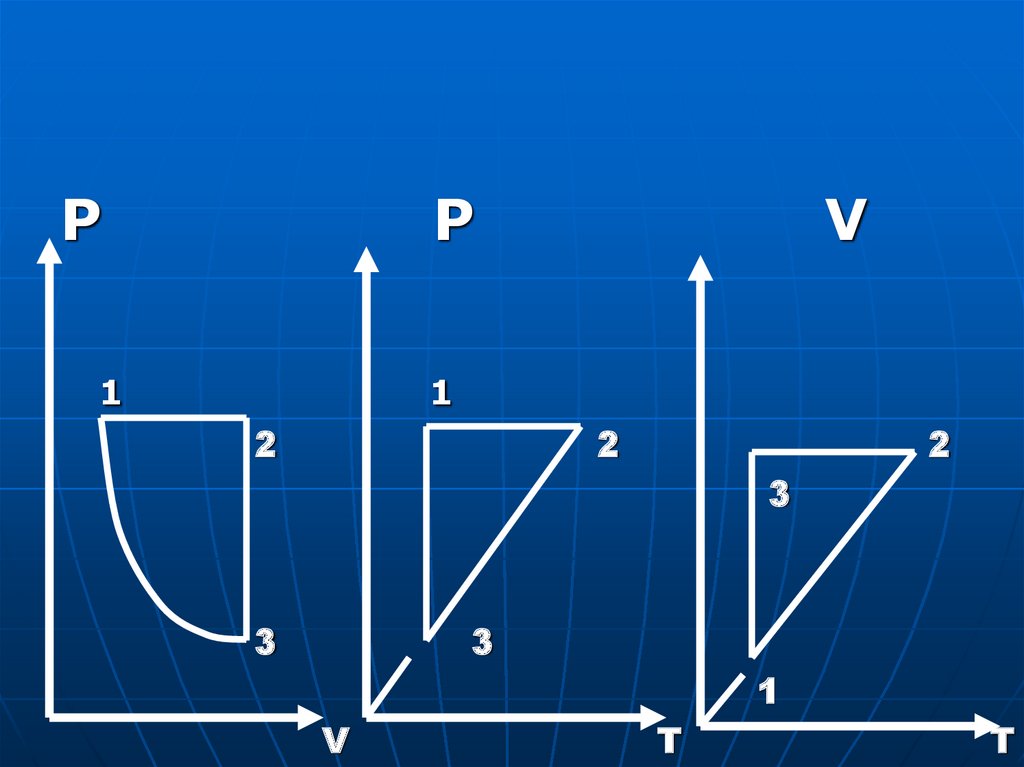
PP
1
V
1
2
2
2
3
3
3
1
V
T
T
17. Домашнє завдання:
Опрацювати § 30Письмово вправи 30.1, 30.3















 physics
physics








