Similar presentations:
Кинетика роста островков оксидной фазы на поверхности Ni в окрестности точки Кюри
1.
Лекция 3 Кинетика роста островков оксидной фазы на поверхности Ni вокрестности точки Кюри. Флуктуации магнитного момента в точке фазового
перехода второго рода (переход ферро-парамагнетик).
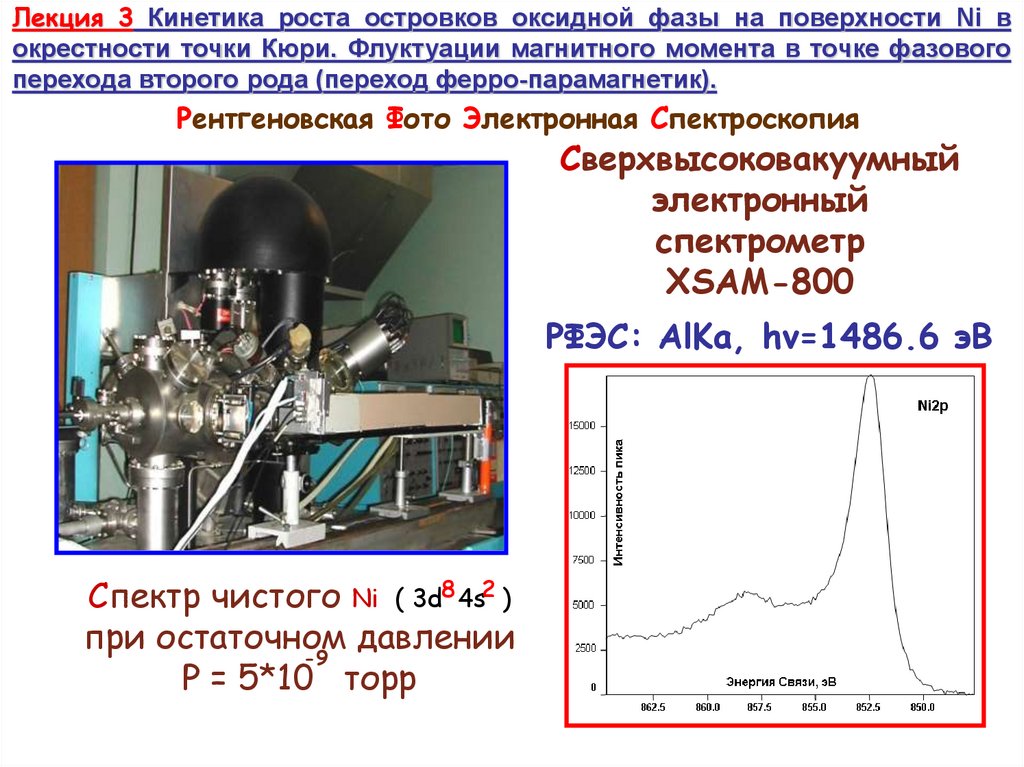
Рентгеновская Фото Электронная Спектроскопия
Сверхвысоковакуумный
электронный
спектрометр
XSAM-800
РФЭС: AlKa, hv=1486.6 эВ
Спектр чистого Ni ( 3d8 4s2 )
при остаточном
давлении
-9
P = 5*10 торр
2.
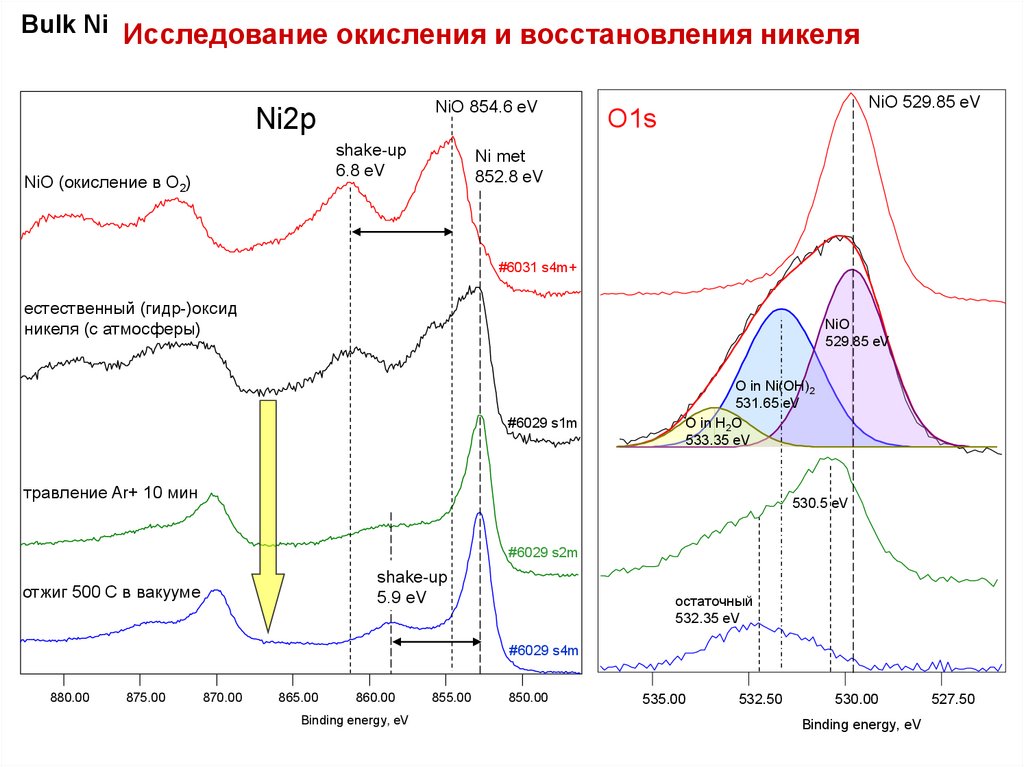
Bulk Ni Исследование окисления и восстановления никеляNiO 854.6 eV
Ni2p
shake-up
6.8 eV
NiO (окисление в O2)
NiO 529.85 eV
O1s
Ni met
852.8 eV
#6031 s4m+
естественный (гидр-)оксид
никеля (с атмосферы)
NiO
529.85 eV
#6029 s1m
O in Ni(OH)2
531.65 eV
O in H2O
533.35 eV
травление Ar+ 10 мин
530.5 eV
#6029 s2m
shake-up
5.9 eV
отжиг 500 С в вакууме
остаточный
532.35 eV
#6029 s4m
880.00
875.00
870.00
865.00
860.00
Binding energy, eV
855.00
850.00
535.00
532.50
530.00
Binding energy, eV
527.50
3.
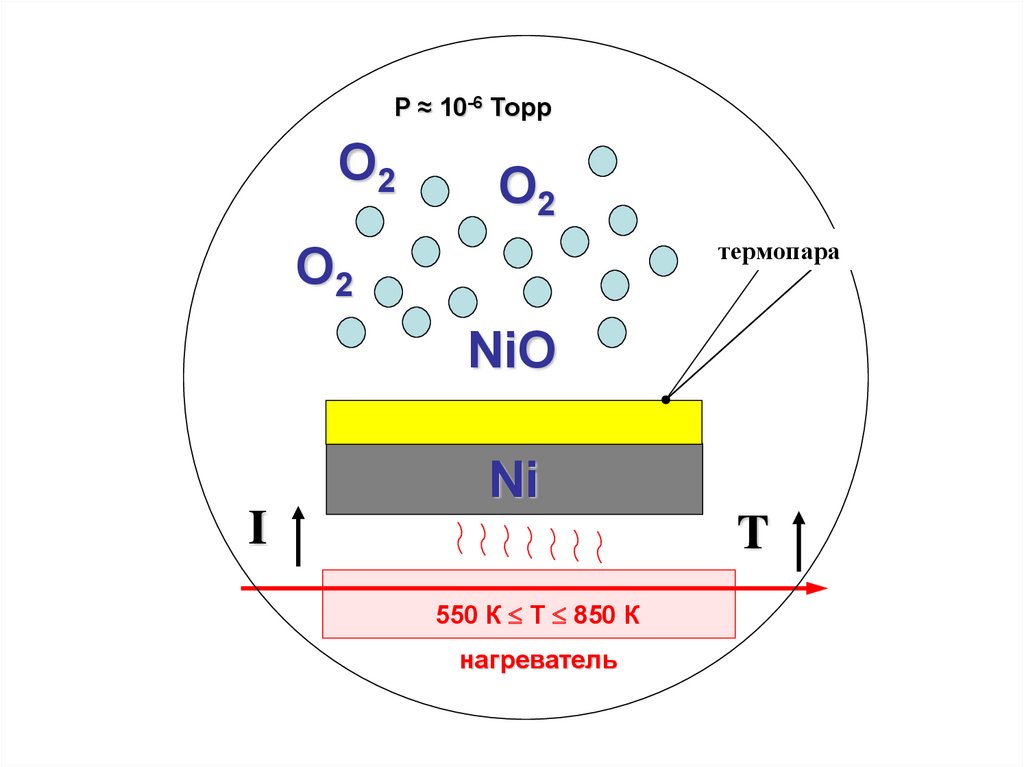
P ≈ 10-6 ТоррO2
O2
термопара
O2
NiO
Ni
I
T
550 К T 850 К
нагреватель
4.
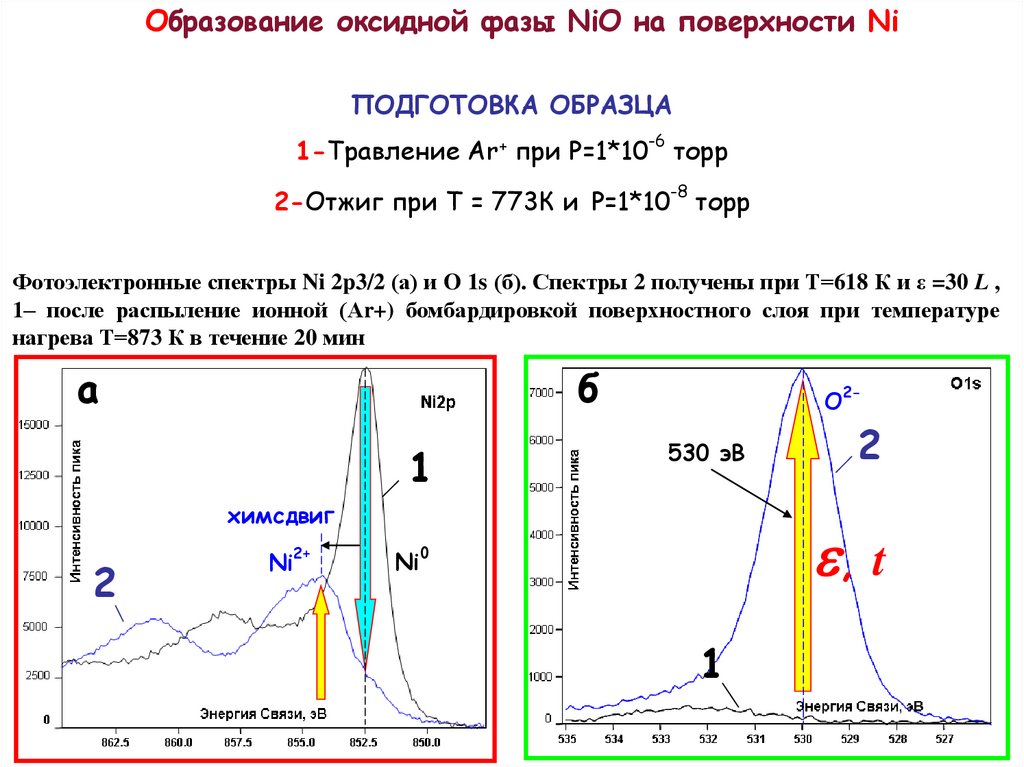
Образование оксидной фазы NiO на поверхности NiПОДГОТОВКА ОБРАЗЦА
-6
1-Травление Ar+ при Р=1*10 торр
2-Отжиг при Т = 773К и P=1*10-8 торр
Фотоэлектронные спектры Ni 2p3/2 (а) и O 1s (б). Спектры 2 получены при Т=618 К и ε =30 L ,
1– после распыление ионной (Аr+) бомбардировкой поверхностного слоя при температуре
нагрева Т=873 К в течение 20 мин
а
б
1
2-
O
530 эВ
химсдвиг
2
2+
Ni
2
e, t
0
Ni
1
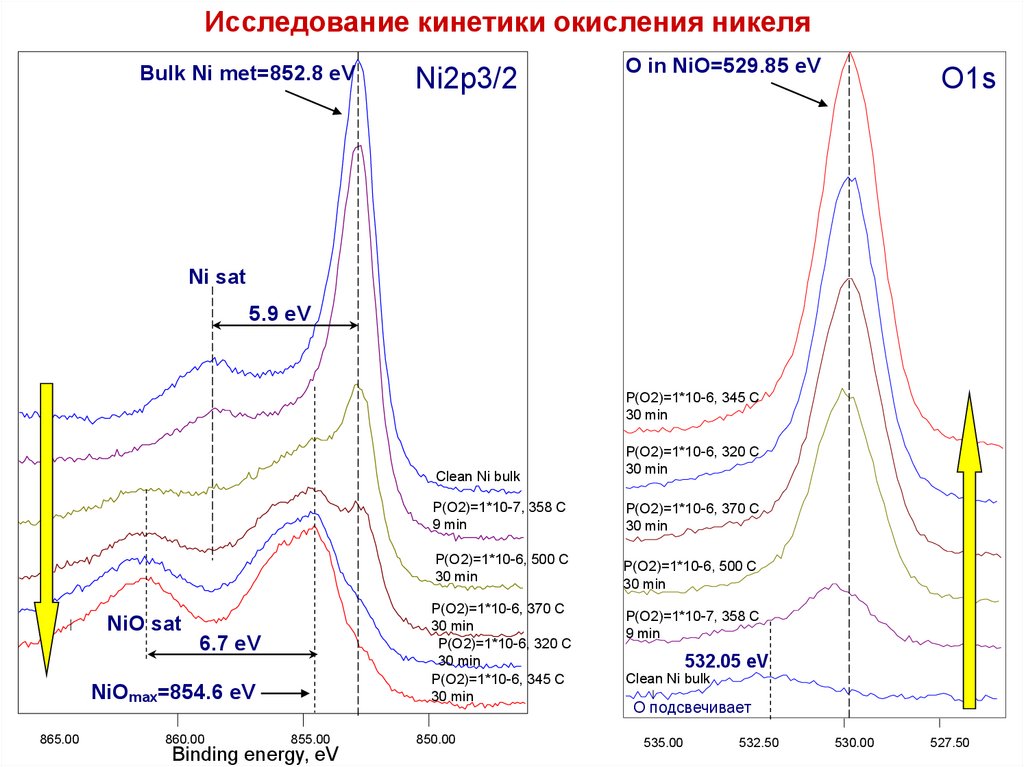
5.
Исследование кинетики окисления никеляBulk Ni met=852.8 eV
Ni2p3/2
O in NiO=529.85 eV
O1s
Ni sat
5.9 eV
P(O2)=1*10-6, 345 C
30 min
Clean Ni bulk
NiO sat
NiOmax=854.6 eV
865.00
860.00
P(O2)=1*10-7, 358 C
9 min
P(O2)=1*10-6, 370 C
30 min
P(O2)=1*10-6, 500 C
30 min
P(O2)=1*10-6, 500 C
30 min
P(O2)=1*10-6, 370 C
30 min
P(O2)=1*10-6, 320 C
30 min
P(O2)=1*10-6, 345 C
30 min
6.7 eV
855.00
Binding energy, eV
P(O2)=1*10-6, 320 C
30 min
850.00
P(O2)=1*10-7, 358 C
9 min
532.05 eV
Clean Ni bulk
O подсвечивает
535.00
532.50
530.00
527.50
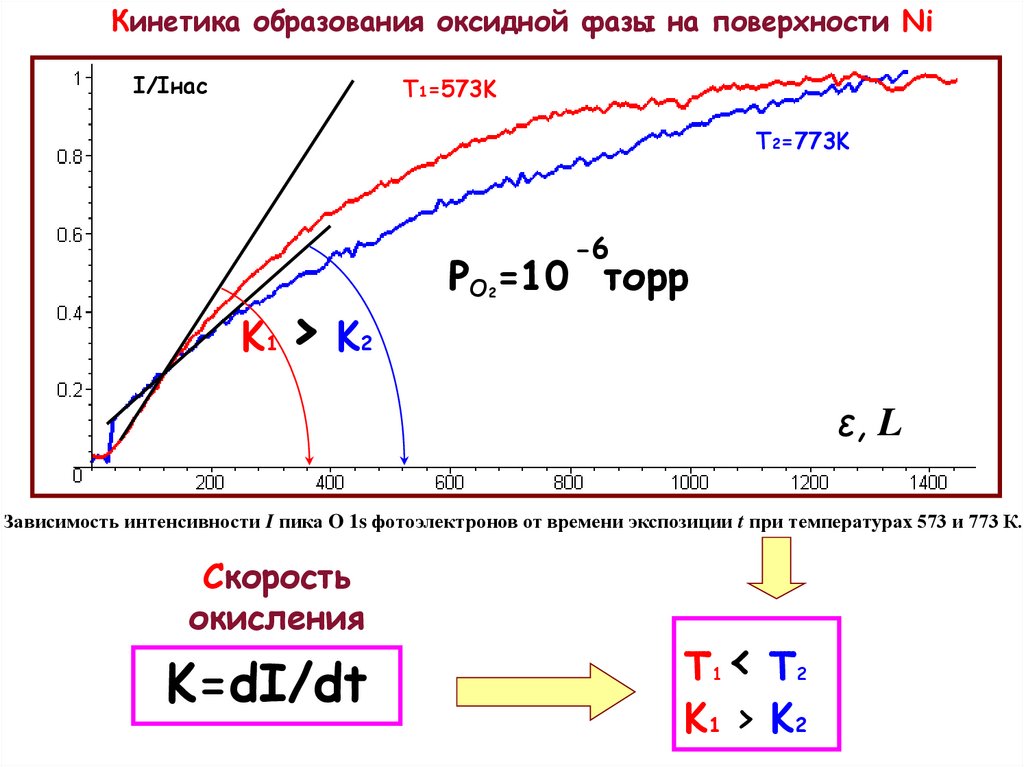
6.
Кинетика образования оксидной фазы на поверхности NiI/Iнас
T1=573K
T2=773K
-6
K1 > K2
PO =10 торр
2
ε, L
Зависимость интенсивности I пика O 1s фотоэлектронов от времени экспозиции t при температурах 573 и 773 К.
Скорость
окисления
K=dI/dt
Т1 < T2
K1 > K2
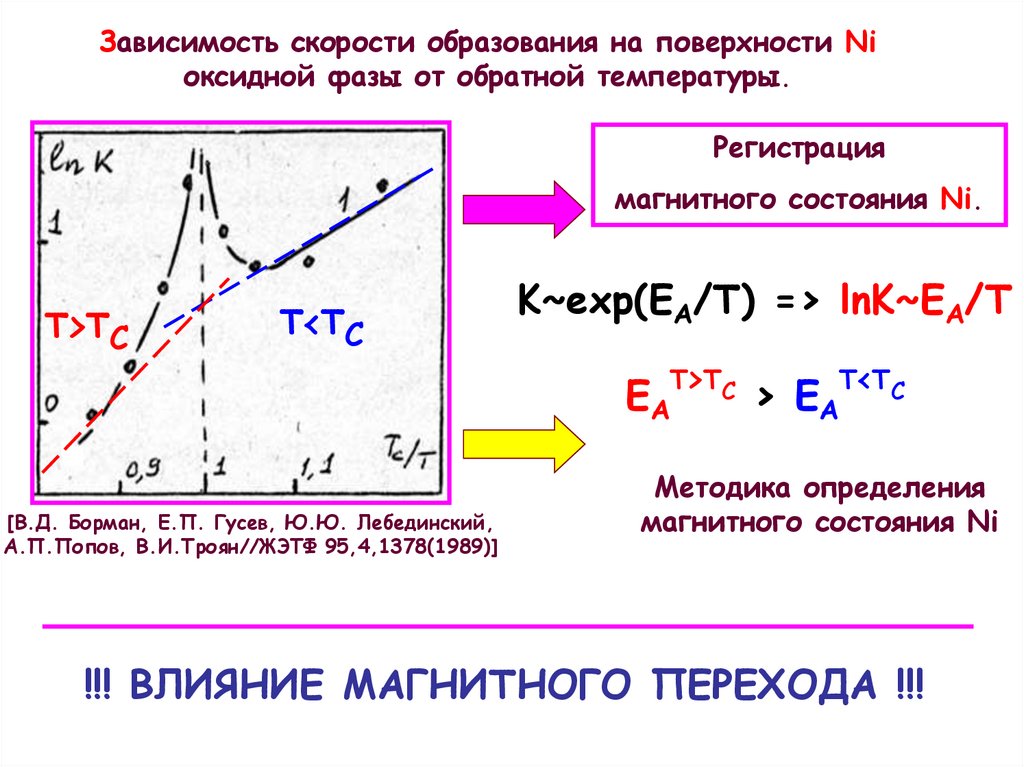
7.
Зависимость скорости образования начальной оксиднойфазы К от обратной температуры.
8.
Зависимость скорости образования на поверхности Niоксидной фазы от обратной температуры.
Регистрация
магнитного состояния Ni.
Т>TС
Т<TС
[В.Д. Борман, Е.П. Гусев, Ю.Ю. Лебединский,
А.П.Попов, В.И.Троян//ЖЭТФ 95,4,1378(1989)]
K~exp(EA/Т) => lnK~EA/T
Т T
Т T
ЕА > С > Е А < С
Методика определения
магнитного состояния Ni
!!! ВЛИЯНИЕ МАГНИТНОГО ПЕРЕХОДА !!!
9.
-Представлена методика, позволяющая на основе измерения кинетическихзависимостей степени окисления поверхности поликристаллического
никеля судить о фазовом состоянии материала.
-По измеренным зависимостям интенсивности пика O1s (BE=530,5 эВ) от
температуры определена скорость роста оксидной фазы на поверхности Ni
в зависимости от экспозиции и температуры. При этом было обнаружено,
что скорость окисления на начальной стадии с увеличением температуры
уменьшается, что можно трактовать как процесс с отрицательной энергией
активации.
-Обнаружено аномальное поведение скорости образования оксидной фазы
в окрестности точки Кюри при субмонослойных покрытиях. В точке Кюри
наблюдается максимум скорости образования оксидной фазы, а в
ферромагнитной – минимум.
-С ростом степени заполнения поверхности островками оксидной фазы
особенности вблизи точки Кюри исчезают. Наблюдаемое изменение
энергии активации процесса при переходе через Tк. Такое поведение
скорости образования оксидной фазы в окрестности Tк обусловлено
влиянием динамики флуктуации магнитного момента в точке фазового
ферро – пара перехода позволяющее при использовании данной методики
судить о фазовом состоянии вещества.
10.
Исследование окисления нанокластеровникеля сформированных на ВОПГ в
окрестности точки Кюри методом РФЭС
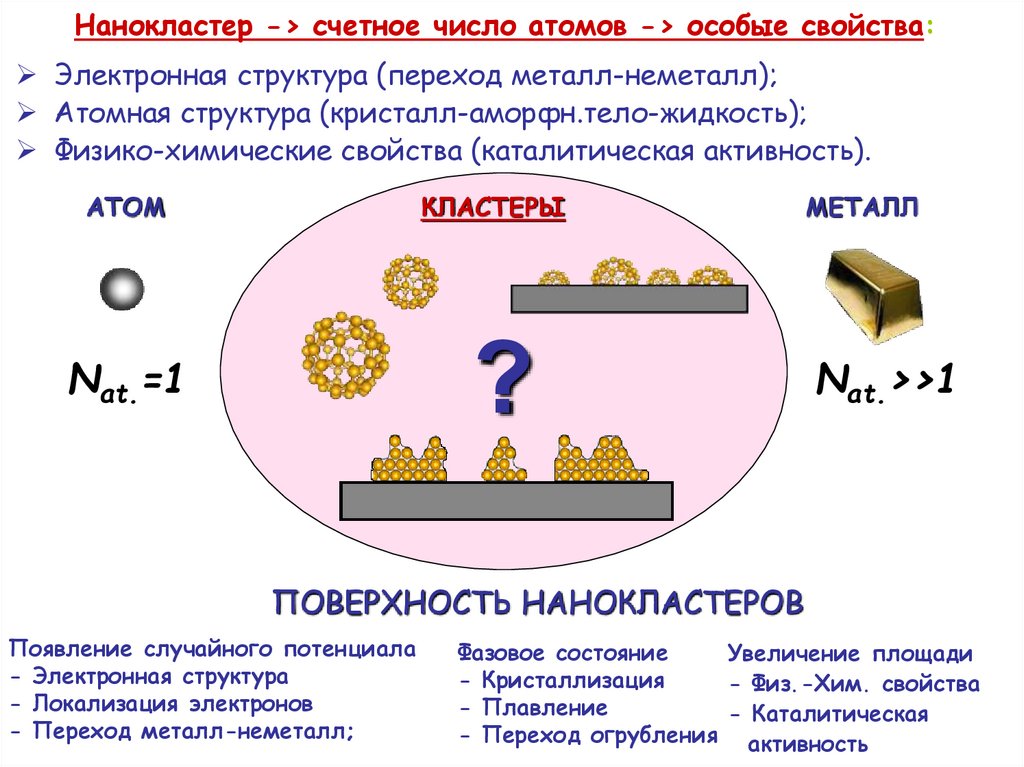
11.
Нанокластер -> счетное число атомов -> особые свойства:Электронная структура (переход металл-неметалл);
Aтомная структура (кристалл-аморфн.тело-жидкость);
Физико-химические свойства (каталитическая активность).
ATOM
КЛАСТЕРЫ
?
Nat.=1
METAЛЛ
Nat.>>1
ПОВЕРХНОСТЬ НАНОКЛАСТЕРОВ
Появление случайного потенциала
- Электронная структура
- Локализация электронов
- Переход металл-неметалл;
Фазовое состояние
Увеличение площади
- Кристаллизация
- Физ.-Хим. свойства
- Плавление
- Каталитическая
- Переход огрубления активность
12.
Формирования и контроль размеров наноластеров Ni наВОПГ с изменением температуры подложки.
Принцип ИЛО: импульс лазерного излучения
(1), поверхность мишени (2), плазменный
факел (3), подложка (4).
Наиболее явные особенности и преимущества метода ИЛО для формирования кластеров
нанометрового размера и тонких плёнок, отличающие его от методов, основанных на
термическом испарении, следующие:
высокая прецизионность (контроль количества осаждённых атомов) до 0.01 монослоя;
отсутствие ограничений на материал мишени (возможность формирования нанокластеров
любых металлов на подложке);
кинетическая энергия эмитированных частиц Е≤100 эВ, что значительно превышает
соответствующее значение для термического осаждения;
возможность существенного влияния на формирование осаждаемой пленки эффекта
самораспыления.
В силу данных характеристик метод ИЛО является одним из наиболее удобных методов
формирования ультратонких пленок и нанокластеров металлов на поверхности различных
подложек при проведении экспериментальных исследований. В дополнение к этому, в случае
попеременного использования нескольких мишеней возможен рост сплавных покрытий с
заданной концентрацией, что и объясняет его использование в работе.
13.
Схема устройства и внешний вид СВВ комплекса для импульсного лазерногоосаждения и in situ исследования электронной структуры и топологии
поверхности сверхтонких слоев и нанокластеров процессе их роста методами
РФЭС, ОЭС, СРМИ и масс-спектрометрии, созданный на базе электронного
спектрометра XSAM-800 (Kratos)
14.
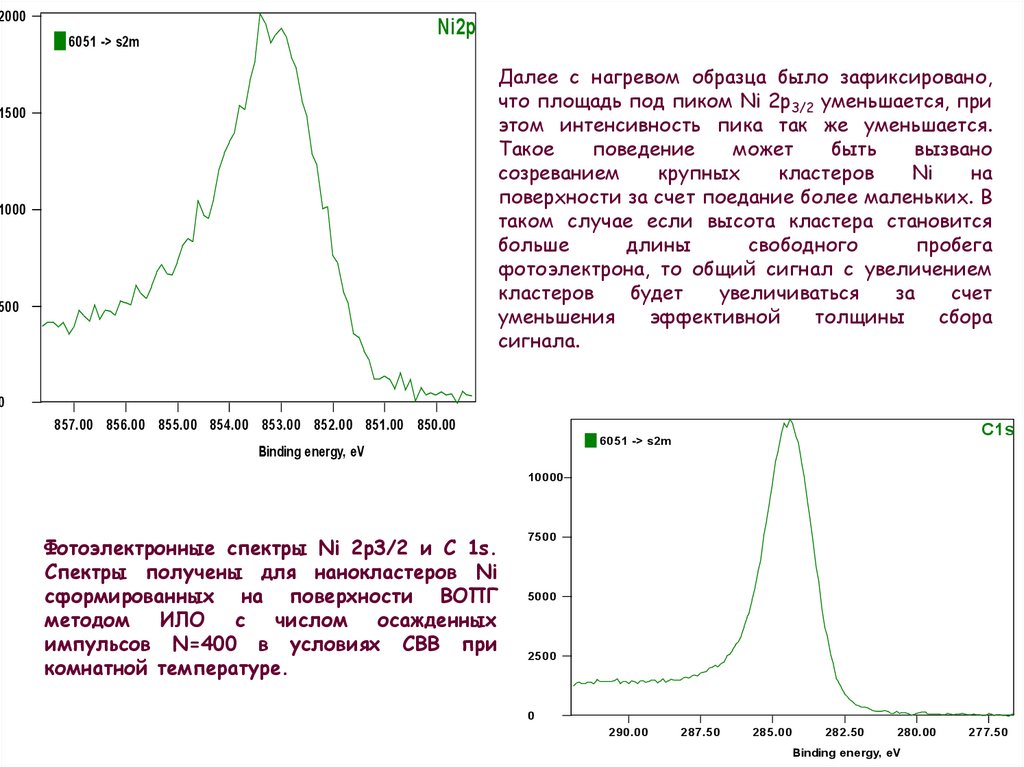
2000Ni2p
6051 -> s2m
Далее с нагревом образца было зафиксировано,
что площадь под пиком Ni 2p3/2 уменьшается, при
этом интенсивность пика так же уменьшается.
Такое
поведение
может
быть
вызвано
созреванием
крупных
кластеров
Ni
на
поверхности за счет поедание более маленьких. В
таком случае если высота кластера становится
больше
длины
свободного
пробега
фотоэлектрона, то общий сигнал с увеличением
кластеров
будет
увеличиваться
за
счет
уменьшения
эффективной
толщины
сбора
сигнала.
1500
1000
500
0
857.00 856.00 855.00 854.00 853.00 852.00 851.00 850.00
C1s
6051 -> s2m
Binding energy, eV
10000
Фотоэлектронные спектры Ni 2p3/2 и С 1s.
Спектры получены для нанокластеров Ni
сформированных на поверхности ВОПГ
методом ИЛО с числом осажденных
импульсов N=400 в условиях СВВ при
комнатной температуре.
7500
5000
2500
0
290.00
287.50
285.00
282.50
280.00
Binding energy, eV
277.50
15.
1.1T =520C
1
T =438C
0.9
S норм
0.8
T =390C
0.7
0.6
T =358C
0.5
0.4
T =333C
0.3
T =290
0.2
0
1
2
3
4
5
t, мин
6
7
8
Т =536С
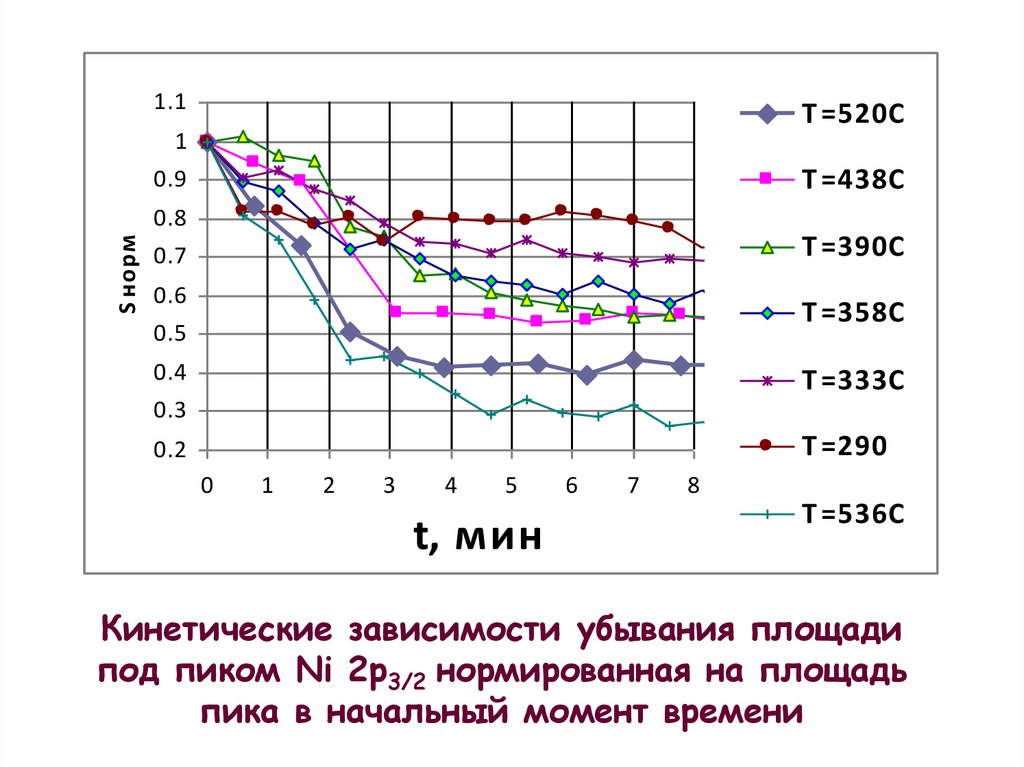
Кинетические зависимости убывания площади
под пиком Ni 2p3/2 нормированная на площадь
пика в начальный момент времени
16.
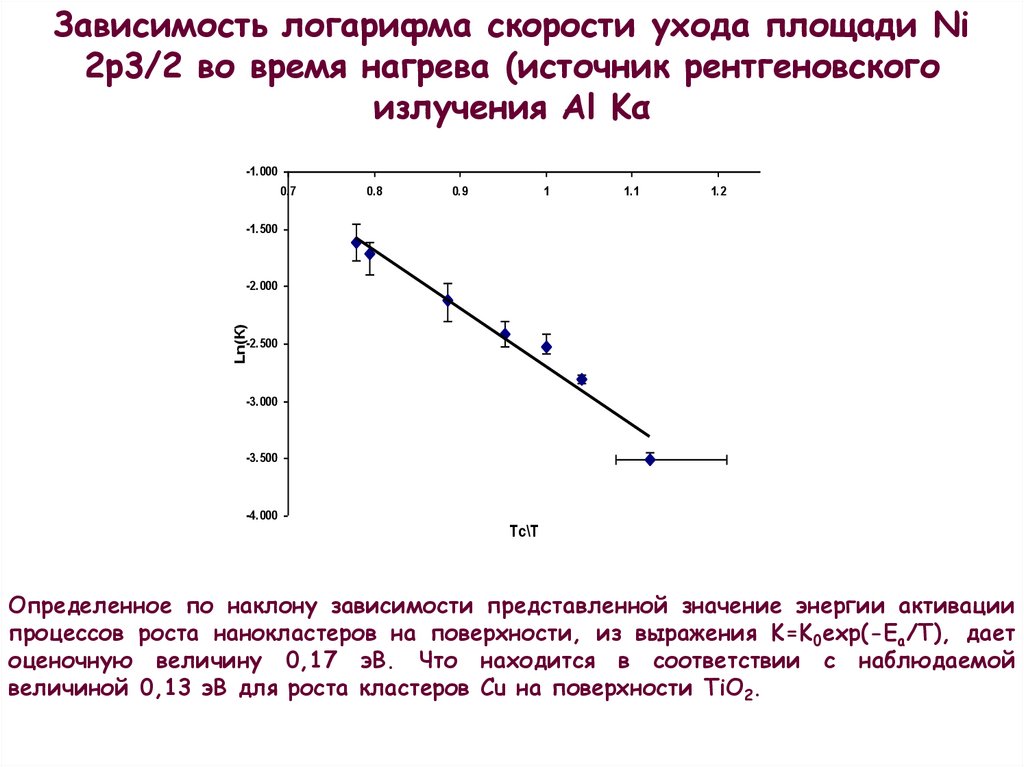
Зависимость логарифма скорости ухода площади Ni2p3/2 во время нагрева (источник рентгеновского
излучения Al Kα
-1.000
0.7
0.8
0.9
1
1.1
1.2
-1.500
Ln(К)
-2.000
-2.500
-3.000
-3.500
-4.000
Tc\T
Определенное по наклону зависимости представленной значение энергии активации
процессов роста нанокластеров на поверхности, из выражения K=K0exp(-Ea/T), дает
оценочную величину 0,17 эВ. Что находится в соответствии с наблюдаемой
величиной 0,13 эВ для роста кластеров Сu на поверхности TiO2.
17.
Для исследования образования оксида на нанокластерах Ni приразличных температурах был зафиксирован средний размер
нанокластеров. Следуя описанной выше методики контроля роста
нанокласетров, окислялся образец Ni с числом импульсов N=400 cо
сформировавшимися размерами. Окисление проводилось при
следующих температурах: T=293 К, 573 К, 613 К и 773 К.
Полученные при этом спектры Ni 2p3/2, (спектры 1, 2, 3, 4 рис.
Слева) с увеличением температуры сдвигаются в сторону меньших
энергий связи, а так же уменьшаются по интенсивности, что
находится в соответствии с изложенной выше методикой контроля
роста нанокластеров. Спектры 3 и 4 соответствуют оксидному
состоянию Ni. Спектры кислорода O1s, измеренные на никеле при
указанных температурах представлены на рис. снизу (спектры 1, 2,
3, 4). Как видно из рисунка с увеличением температуры пик
кислорода соответствующий оксиду Ni c энергией связи ВE=530,5
эВ так же увеличивается.
Фотоэлектронные спектры Ni 2p3/2 (а) и О
1s (б). Спектры получены для
нанокластеров Ni сформированных на
поверхности ВОПГ методом ИЛО с
числом осажденных импульсов N=400 в
условиях СВВ при комнатной
температуре. Спектры соответствуют
температурам 1 - T=293 К, 2 - 573 К, 3
- 613 К и 4 - 773 К.







 physics
physics








