Similar presentations:
Карбоновые кислоты
1.
Карбоновые кислоты2.
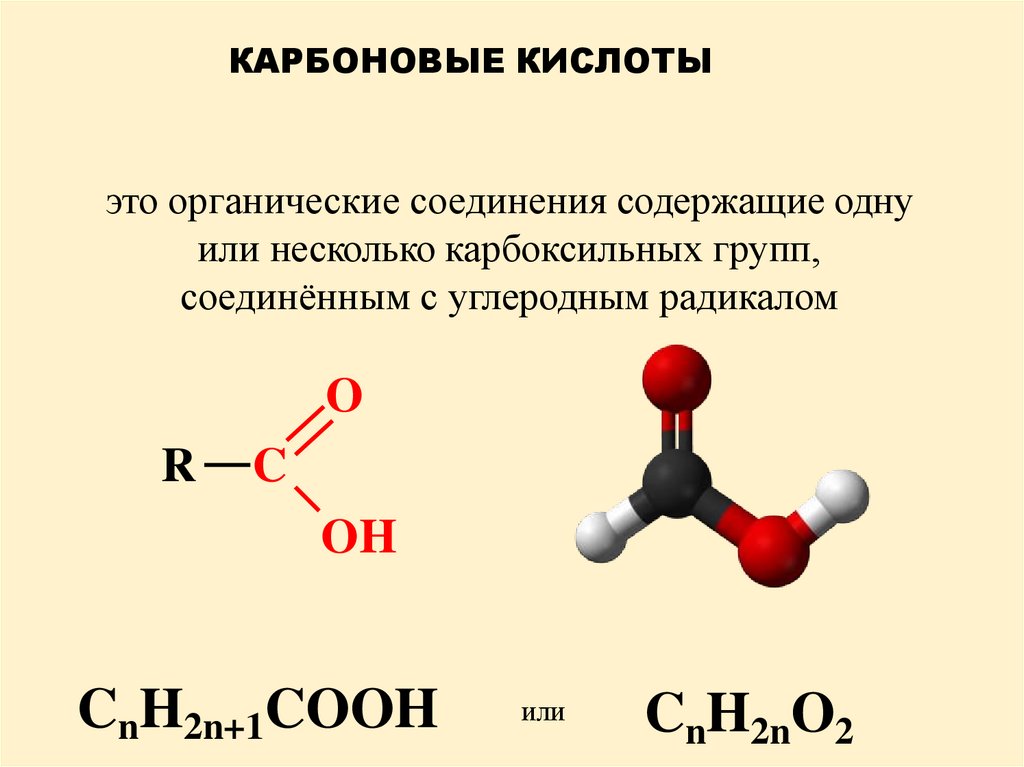
КАРБОНОВЫЕ КИСЛОТЫэто органические соединения содержащие одну
или несколько карбоксильных групп,
соединённым с углеродным радикалом
O
R
C
OH
CnH2n+1COOH
или
CnH2nO2
3.
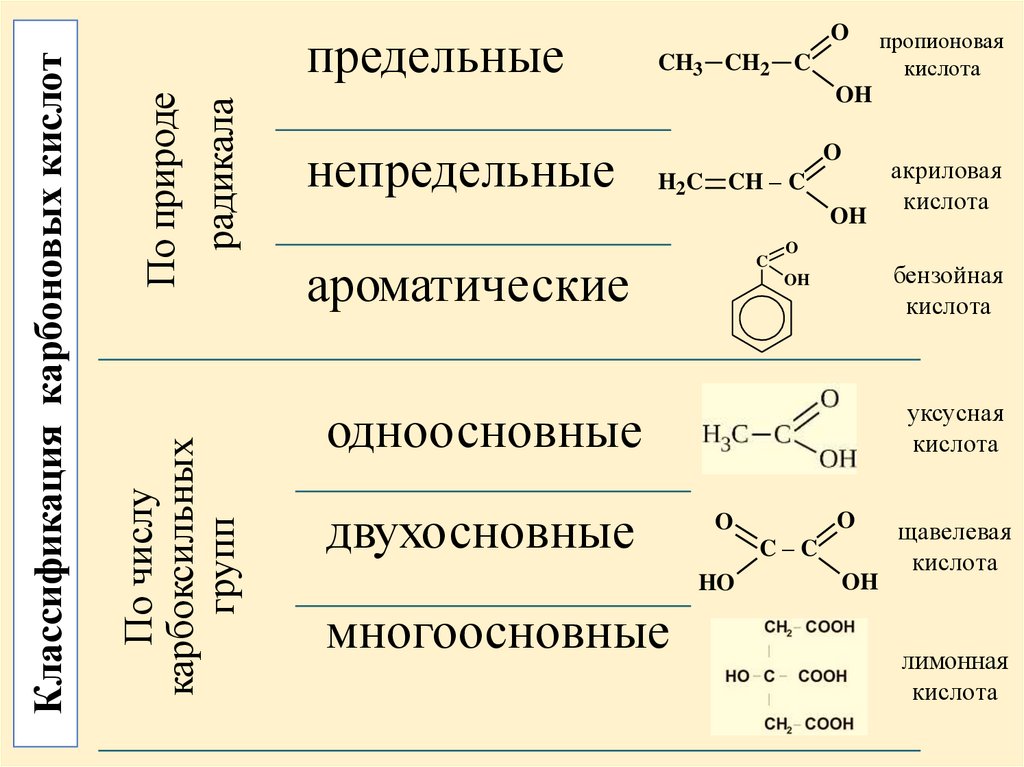
По природерадикала
По числу
карбоксильных
групп
Классификация карбоновых кислот
предельные
O
CH3 CH2
C
пропионовая
кислота
OH
непредельные
O
H2C
CH – C
OH
ароматические
C
O
бензойная
кислота
OH
уксусная
кислота
одноосновные
двухосновные
O
O
C–C
HO
многоосновные
акриловая
кислота
OH
щавелевая
кислота
лимонная
кислота
4.
НОМЕНКЛАТУРАВ соответствии с номенклатурой ИЮПАК названия карбоновых кислот
образуются из названия алкана с тем же числом атомов углерода в
молекуле с помощью суффикса –ов, окончания –ая и слова кислота
Нумерацию атомов углерода главной цепи начинают с атома углерода
карбоксильной группы.
Количество карбоксильных групп указывается в названии префикса –ди,
-три, -тетра.
Многие кислоты имеют исторически сложившиеся или тривиальные
названия.
4
CH3
3
CH2
1 O
2
CH C
CH3
OH
2-метилбутановая кислота
5.
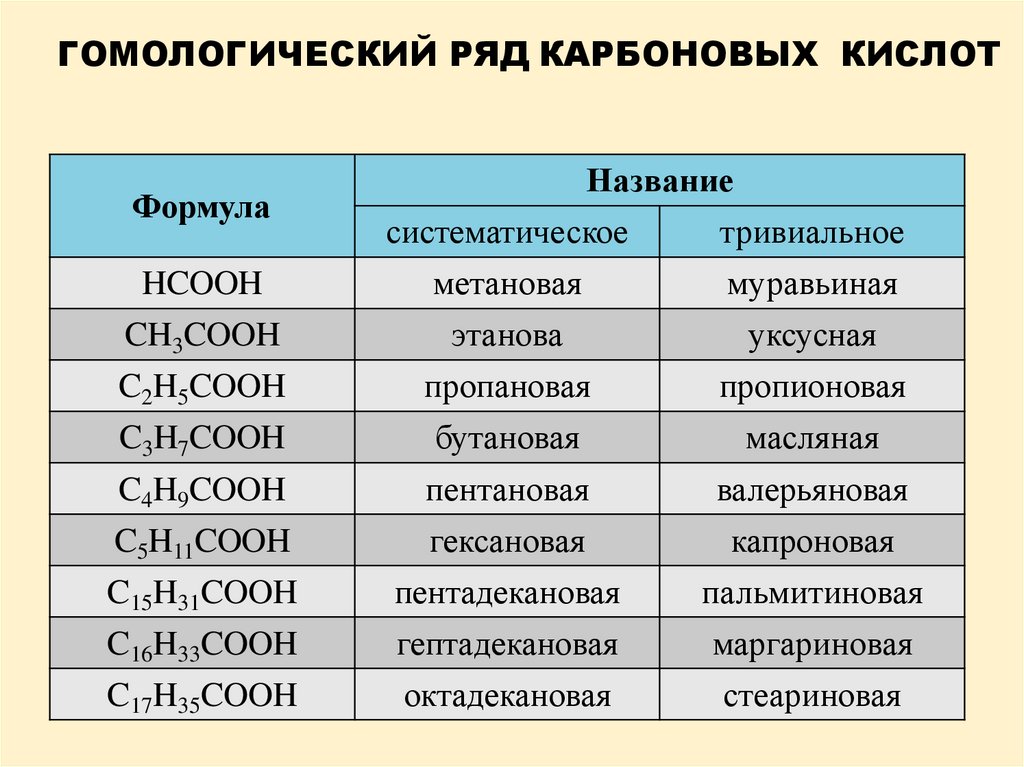
ГОМОЛОГИЧЕСКИЙ РЯД КАРБОНОВЫХ КИСЛОТФормула
HCOOH
CH3COOH
C2H5COOH
C3H7COOH
Название
систематическое
тривиальное
метановая
муравьиная
этанова
уксусная
пропановая
пропионовая
бутановая
масляная
C4H9COOH
C5H11COOH
C15H31COOH
пентановая
гексановая
пентадекановая
валерьяновая
капроновая
пальмитиновая
C16H33COOH
C17H35COOH
гептадекановая
октадекановая
маргариновая
стеариновая
6.
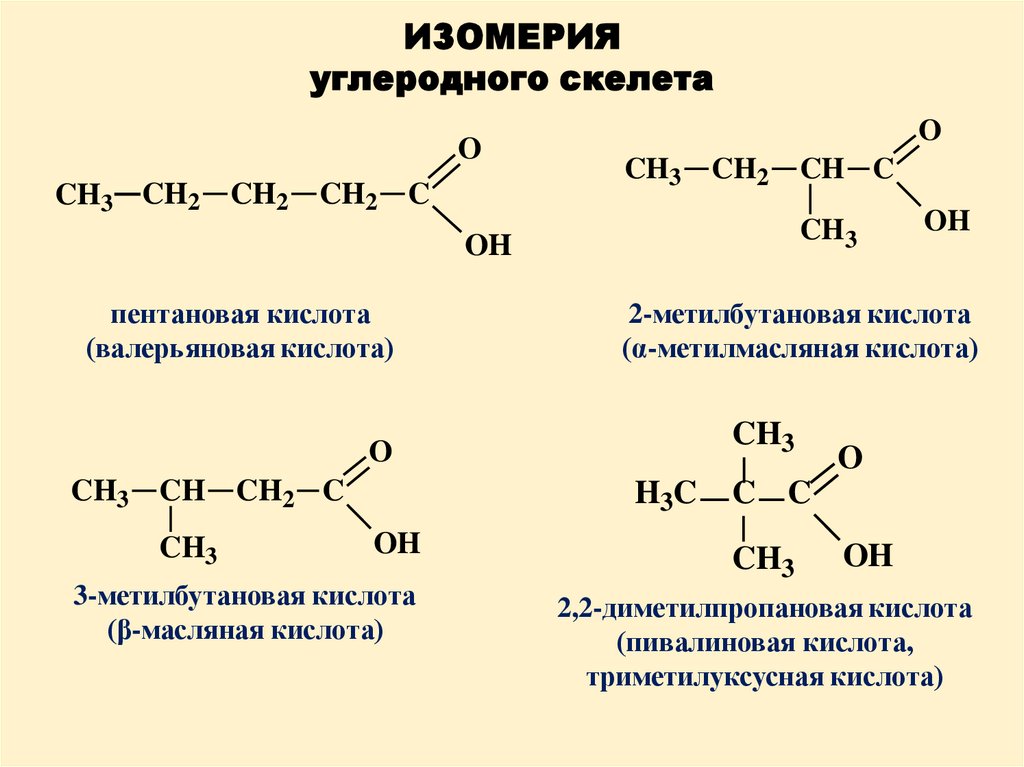
ИЗОМЕРИЯуглеродного скелета
O
CH3 CH2
CH2
CH2 C
O
CH3
CH2
CH3
OH
пентановая кислота
(валерьяновая кислота)
CH3
CH2 C
CH3
H3C
OH
3-метилбутановая кислота
(β-масляная кислота)
OH
2-метилбутановая кислота
(α-метилмасляная кислота)
O
CH3 CH
CH C
O
C C
CH3
OH
2,2-диметилпропановая кислота
(пивалиновая кислота,
триметилуксусная кислота)
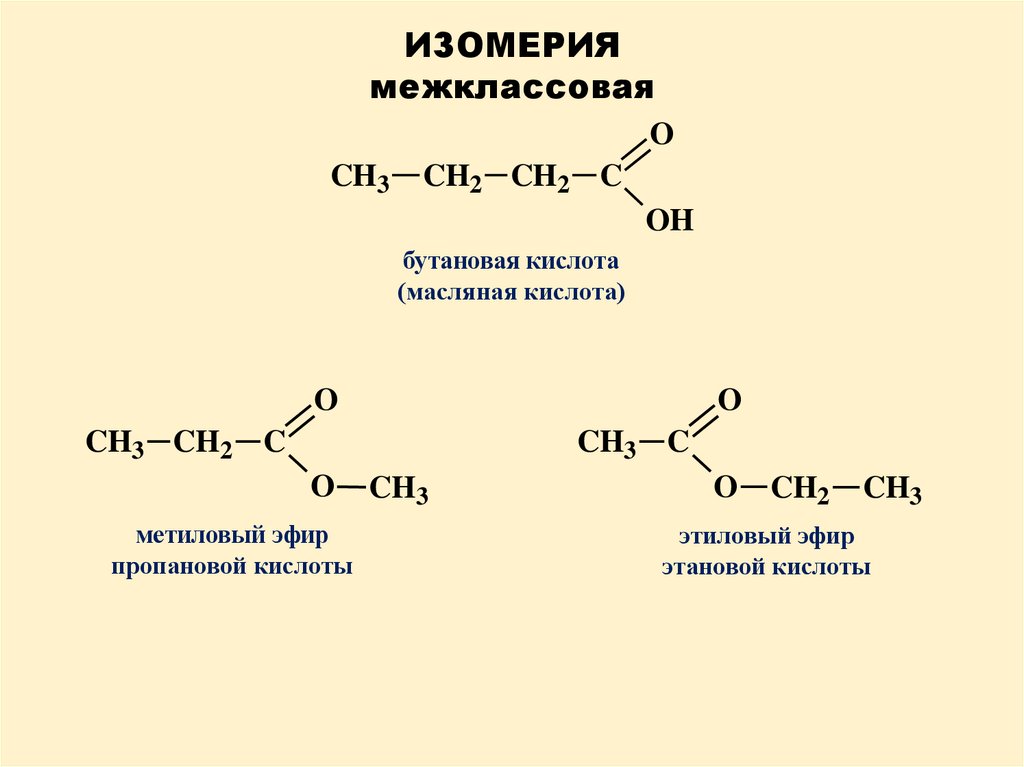
7.
ИЗОМЕРИЯмежклассовая
O
CH3
CH2 CH2 C
OH
бутановая кислота
(масляная кислота)
O
O
CH3 CH2 C
CH3 C
O
метиловый эфир
пропановой кислоты
CH3
O
CH2
CH3
этиловый эфир
этановой кислоты
8.
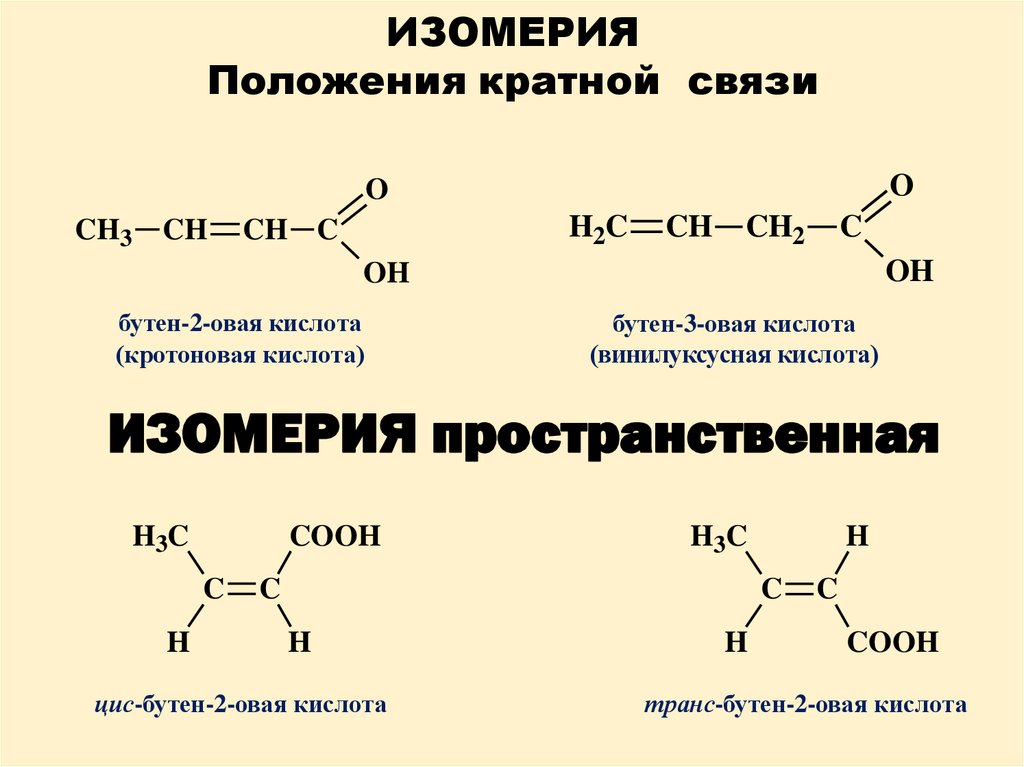
ИЗОМЕРИЯПоложения кратной связи
O
O
CH3
CH
H2C
CH C
CH
CH2
C
OH
OH
бутен-2-овая кислота
(кротоновая кислота)
бутен-3-овая кислота
(винилуксусная кислота)
ИЗОМЕРИЯ пространственная
H3C
COOH
C
H
H3C
C
H
C
H
цис-бутен-2-овая кислота
H
C
COOH
транс-бутен-2-овая кислота
9.
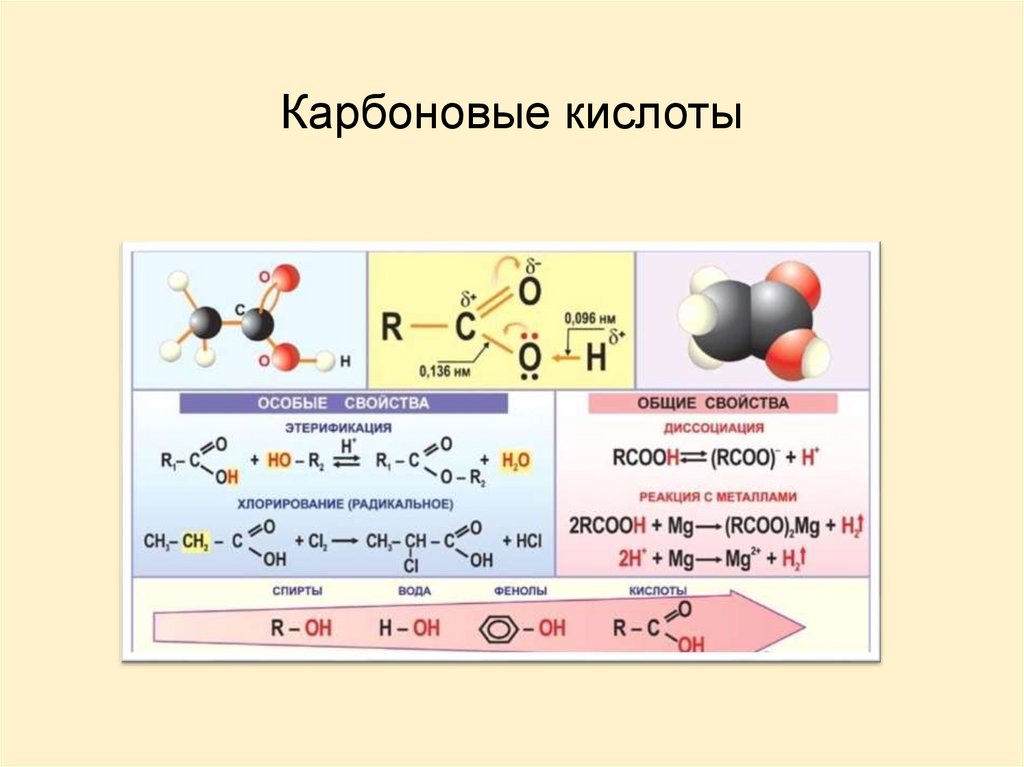
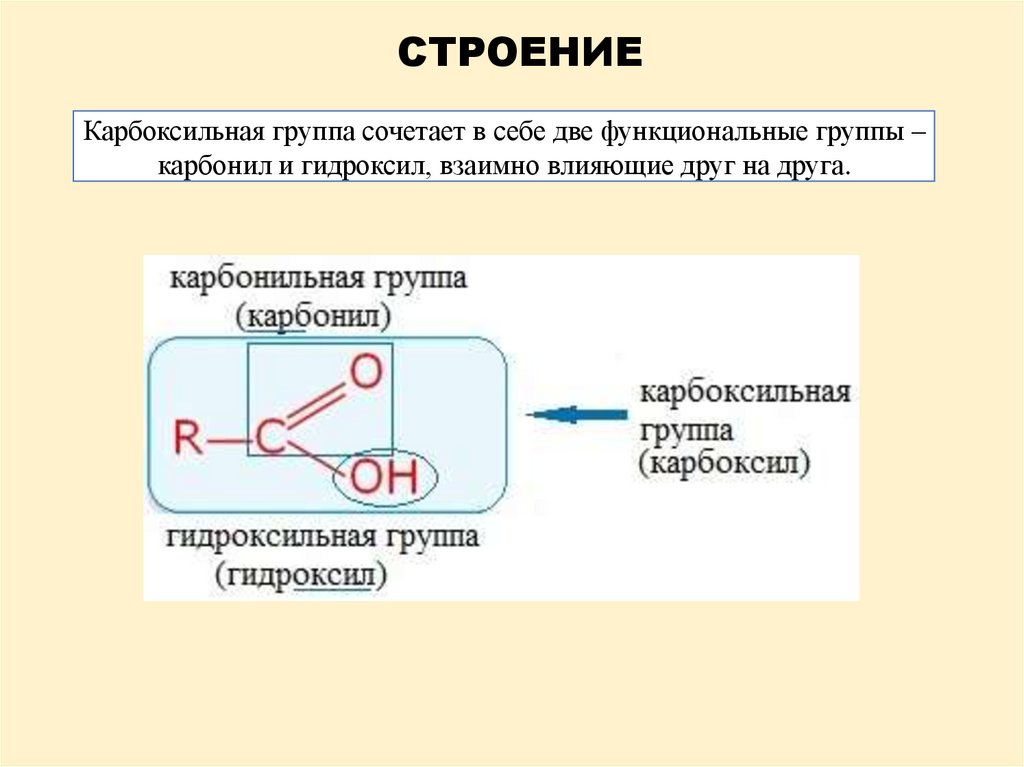
СТРОЕНИЕКарбоксильная группа сочетает в себе две функциональные группы –
карбонил и гидроксил, взаимно влияющие друг на друга.
10.
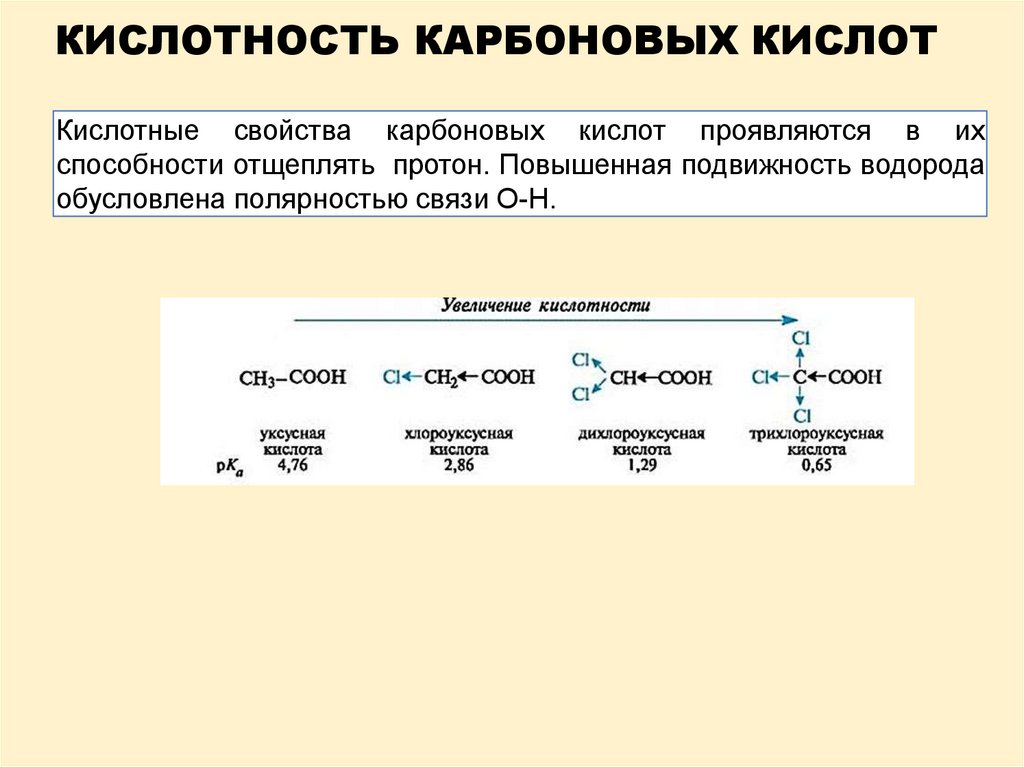
КИСЛОТНОСТЬ КАРБОНОВЫХ КИСЛОТКислотные свойства карбоновых кислот проявляются в их
способности отщеплять протон. Повышенная подвижность водорода
обусловлена полярностью связи О-Н.
11.
ФИЗИЧЕСКИЕ СВОЙСТВАНизшие кислоты (первые четыре) – легкоподвижные бесцветные
жидкости с характерным резким запахом, смешиваются с водой в
любых соотношениях. Кислоты С4 – С9 - маслянистые жидкости с
неприятным запахом, малорастворимы в воде. Высшие кислоты (С10) твёрдые вещества без запаха, нерастворимые в воде, при перегонке
разлагаются.
Температура кипения возрастает по мере увеличения молекулярной
массы, при одном и том же числе углеродных атомов кислоты
нормального строения кипят при более высокой температуре, чем
кислоты изостроения.
Все карбоновые кислоты обладают кислой реакцией (обнаруживается
индикаторами).
В большинстве случаев в водном растворе карбоновые кислоты
диссоциированы лишь в малой степени и являются слабыми
кислотами, значительно уступая таким кислотам как соляная, азотная,
серная.
12.
Получение карбоновых кислотОкисление алканов
При повышенной температуре и в присутствии катализатора
становится возможным неполное окисление алканов, в
результате которого образуются кислоты.
13.
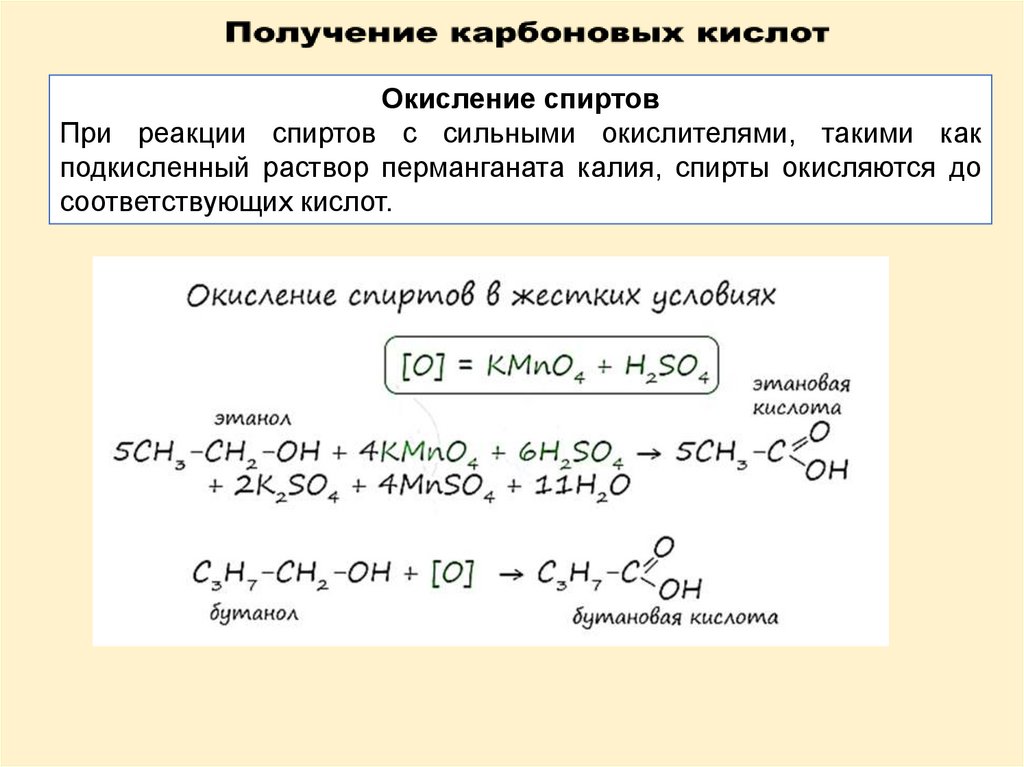
Окисление спиртовПри реакции спиртов с сильными окислителями, такими как
подкисленный раствор перманганата калия, спирты окисляются до
соответствующих кислот.
14.
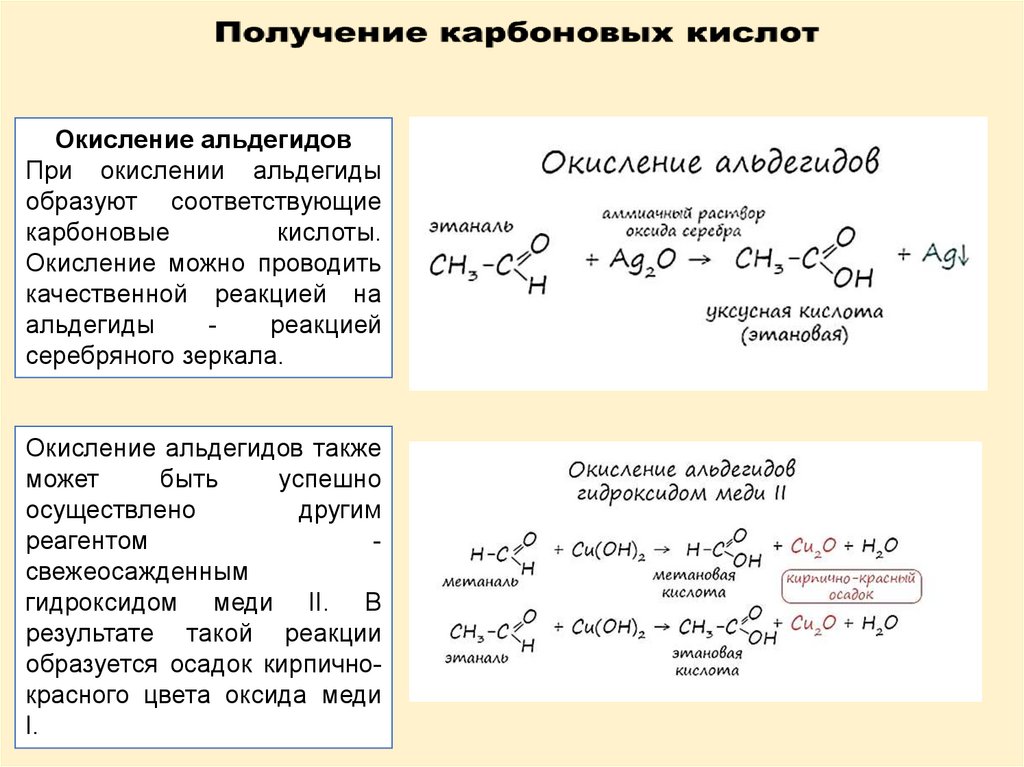
Окисление альдегидовПри окислении альдегиды
образуют соответствующие
карбоновые
кислоты.
Окисление можно проводить
качественной реакцией на
альдегиды
реакцией
серебряного зеркала.
Окисление альдегидов также
может
быть
успешно
осуществлено
другим
реагентом
свежеосажденным
гидроксидом меди II. В
результате такой реакции
образуется осадок кирпичнокрасного цвета оксида меди
I.
15.
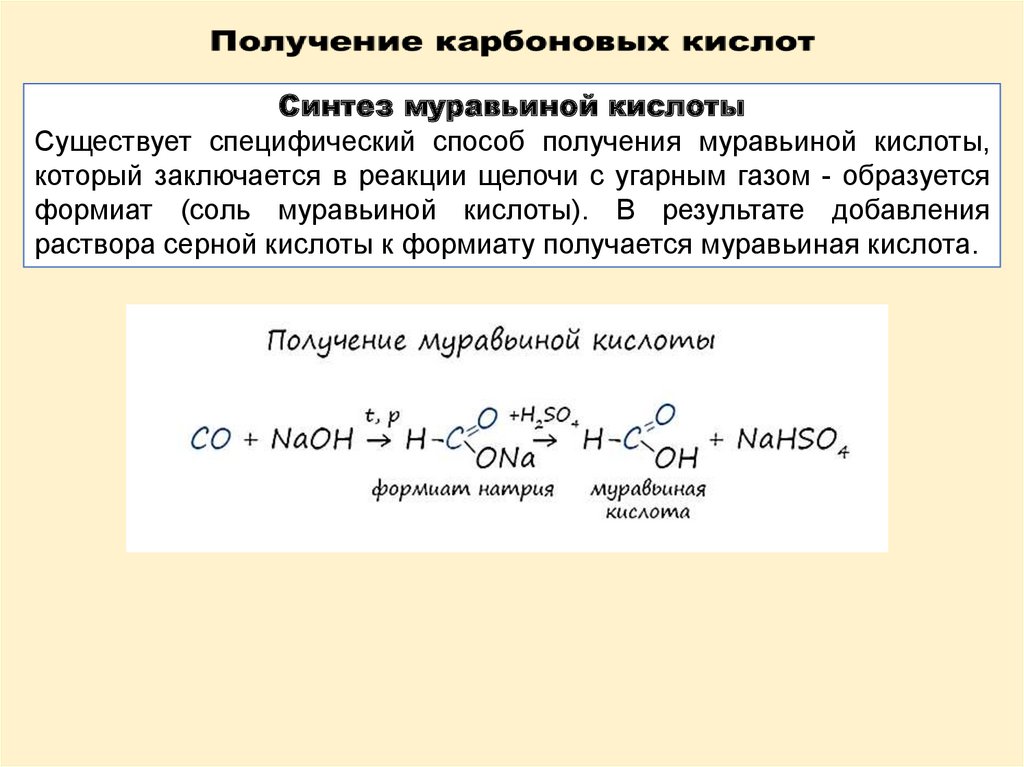
Синтез муравьиной кислотыСуществует специфический способ получения муравьиной кислоты,
который заключается в реакции щелочи с угарным газом - образуется
формиат (соль муравьиной кислоты). В результате добавления
раствора серной кислоты к формиату получается муравьиная кислота.
16.
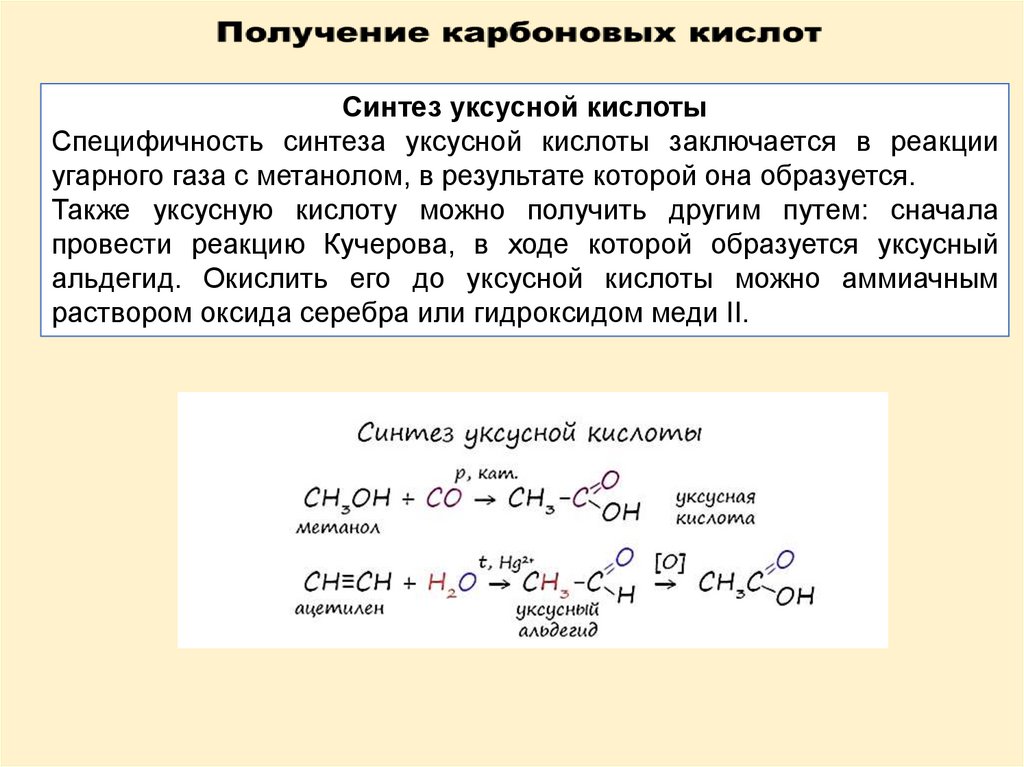
Синтез уксусной кислотыСпецифичность синтеза уксусной кислоты заключается в реакции
угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала
провести реакцию Кучерова, в ходе которой образуется уксусный
альдегид. Окислить его до уксусной кислоты можно аммиачным
раствором оксида серебра или гидроксидом меди II.
17.
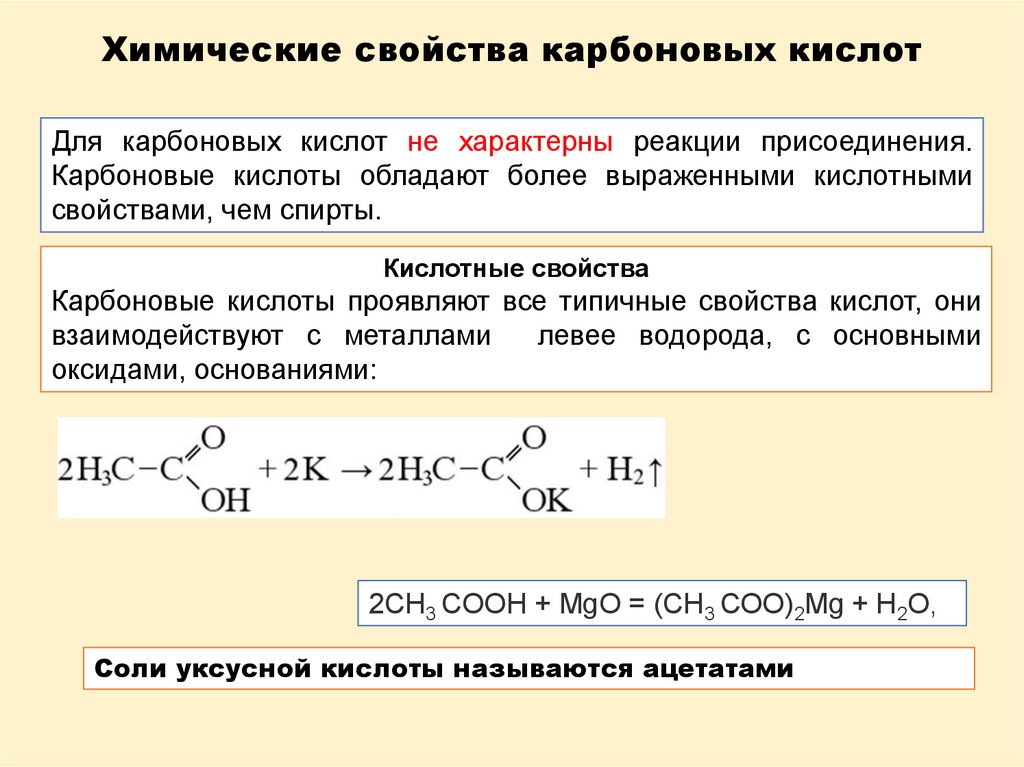
Химические свойства карбоновых кислотДля карбоновых кислот не характерны реакции присоединения.
Карбоновые кислоты обладают более выраженными кислотными
свойствами, чем спирты.
Кислотные свойства
Карбоновые кислоты проявляют все типичные свойства кислот, они
взаимодействуют с металлами
левее водорода, с основными
оксидами, основаниями:
2СН3 СООН + МgО = (СН3 СОО)2Мg + Н2О,
Соли уксусной кислоты называются ацетатами
18.
ГалогенированиеГалогенирование происходит по типу замещения в радикале, который
соединен с карбоксильной группой.
Разложение муравьиной кислоты
При нагревании и в присутствии серной кислоты (водоотнимающего
компонента) муравьиная кислота распадается на воду и угарный
газ.
HCOOH → (t, H2SO4) CO↑ + H2O
19.
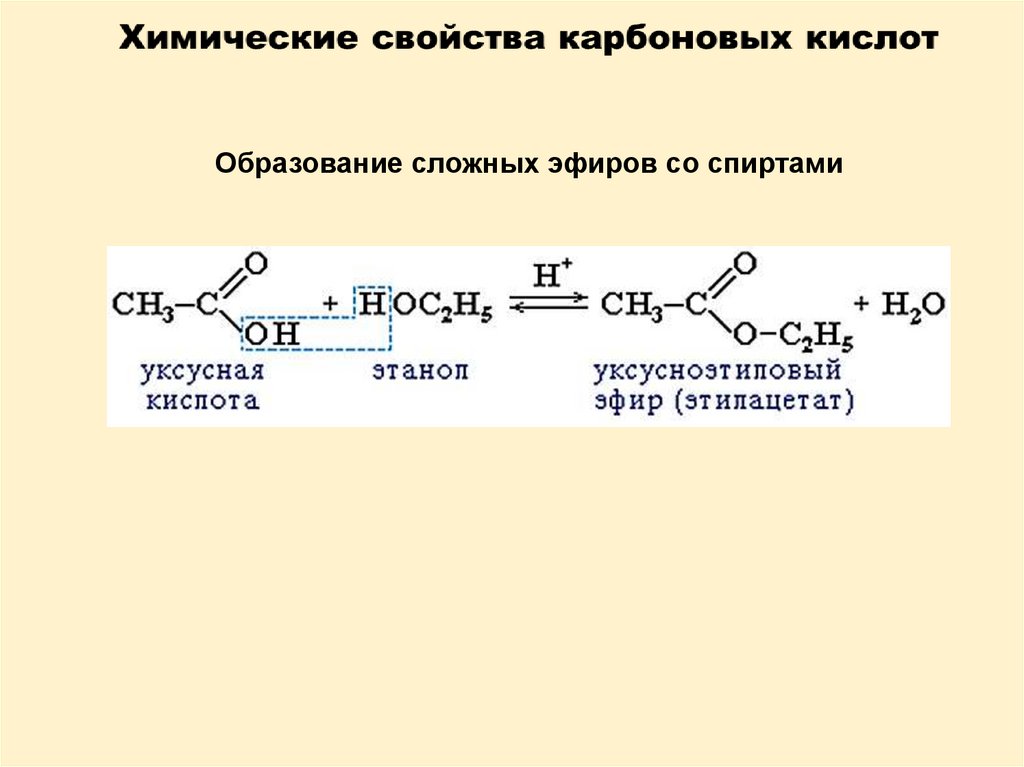
Образование сложных эфиров со спиртами20.
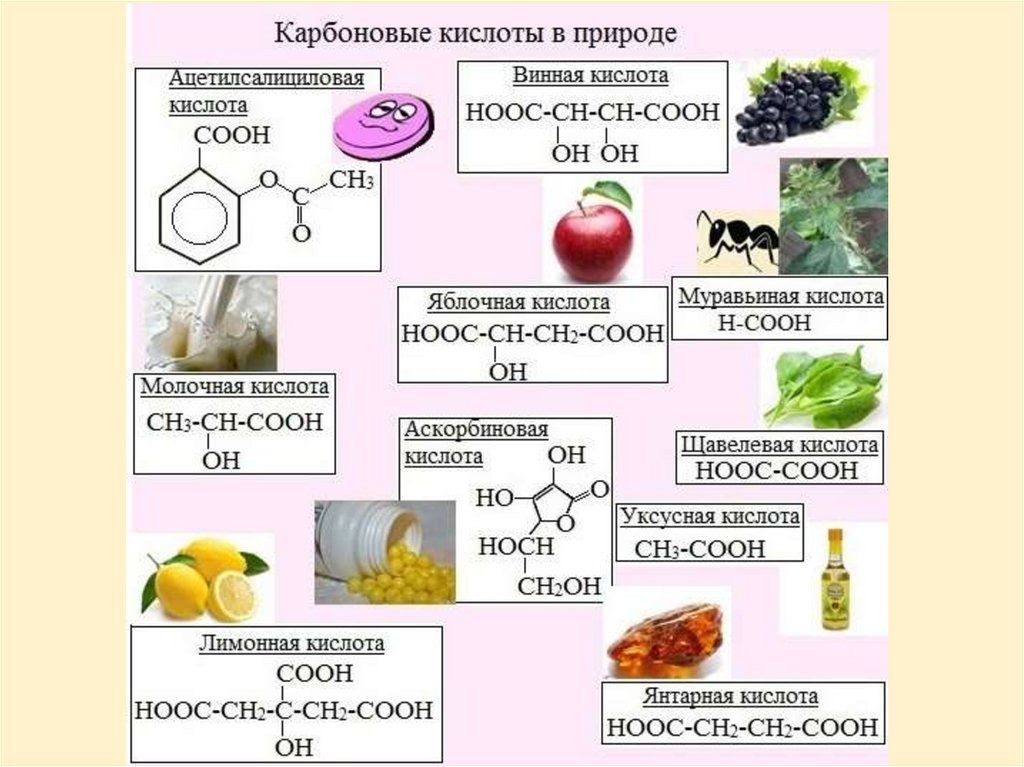
ПРИМЕНЕНИЕМуравьиная кислота – в медицине, в пчеловодстве, в
органическом синтезе, при получении растворителей и
консервантов, в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической
промышленности (органическое стекло, кинопленка), для
синтеза красителей, медикаментов и сложных эфиров.
Масляная кислота – для получения ароматизирующих
добавок, пластификаторов. Стеариновая и пальмитиновая
кислота – в качестве поверхностно-активных веществ,
смазочных материалов в металлообработке.
21.
Муравьирода
Formika
используют
различные кислоты как средство общения
друг с другом, точно так же, как многие
общественные
насекомые.
Муравьиная
кислота, выделяемая муравьями в момент
опасности, служит сигналом для всех
остальных особей этого вида и является
средством защиты при нападении хищников.
Благодаря этой кислоте муравьи имеют не так
уж много врагов.
Муравьиная кислота полезна для крупных
млекопитающих, так, медведи после зимней
спячки избавляются от паразитов, ложась на
муравейник. Муравьи, кусая его, впрыскивают
муравьиную кислоту.
Муравьиная кислота широко встречается в
природе. Она содержится в соке крапивы,
хвое, фруктах, а также в небольших количествах в поте и моче.
22.
Молочная кислота (С3Н6О3) является промежуточным продуктомобмена веществ у теплокровных животных. Запах этой кислоты
улавливается кровососущими насекомыми, в частности комарами, на
значительном расстоянии. Это позволяет насекомым находить свою
жертву.
Она содержится в квашеной капусте, соленых огурцах, образуется
при созревании сыра.
Конкуренция среди особей различных видов встречается не только
среди животных, но и у растений. Многие сорные растения выделяют
вещества, угнетающие рост культурных растений. Некоторые
дикорастущие растения выделяют уксусную и масляную кислоту,
которая подавляет рост или вызывает гибель других растений.
23.
Лимонную кислоту получают не только из лимонов (25 кг на тоннулимонов), но и из плесневого гриба Aspergillus niger.
24.
Пчеловоды применяют растворщавелевой кислоты с массовой
долей 3,2 % в сахарном сиропе для
борьбы с паразитическим клещом.
При
завершении
мраморных
структур
ею
обрабатывают
поверхности для уплотнения и
придания им блеска. Щавелевая
кислота и оксалаты присутствует во
многих растениях, в том числе в
черном
чае,
встречаются
в
организме животных.









 chemistry
chemistry








