Similar presentations:
Карбоновые кислоты
1. Карбоновые кислоты
2.
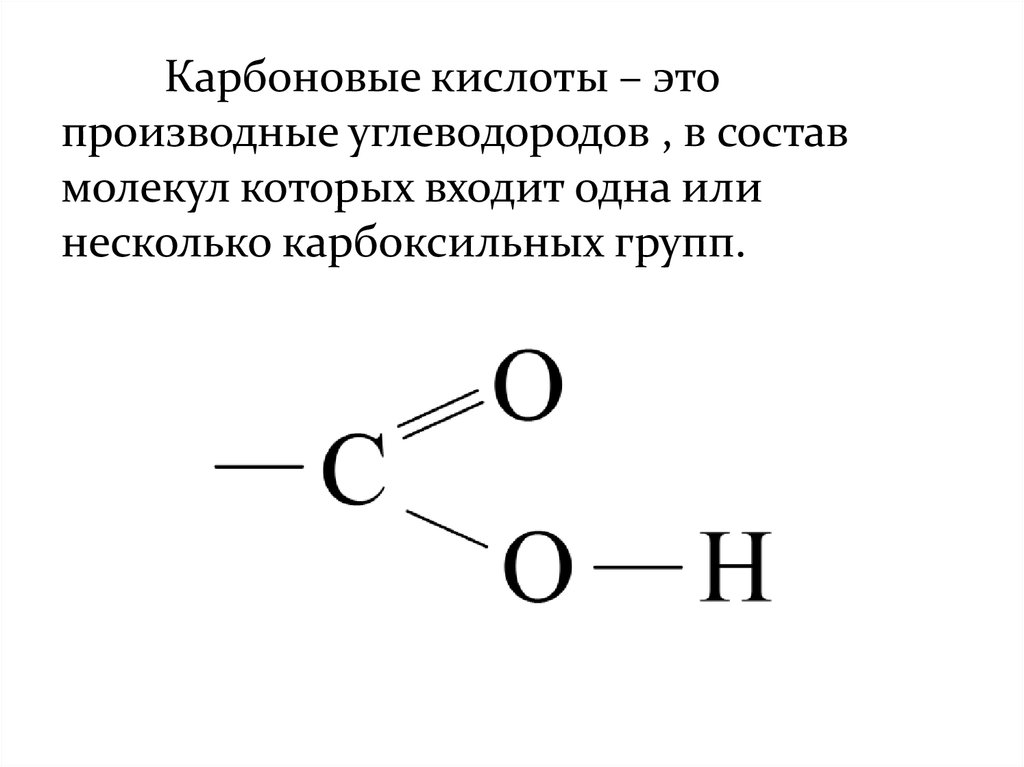
Карбоновые кислоты – этопроизводные углеводородов , в состав
молекул которых входит одна или
несколько карбоксильных групп.
3.
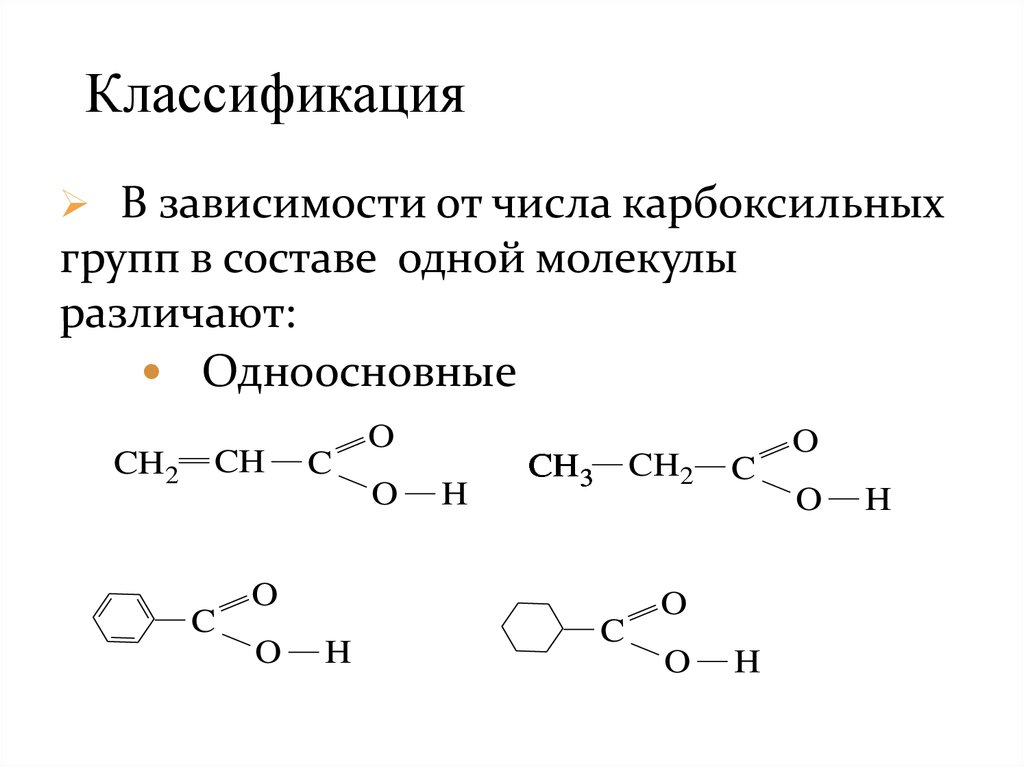
КлассификацияВ зависимости от числа карбоксильных
групп в составе одной молекулы
различают:
Одноосновные
CH2
CH
C
O
O
C
H
CH2
CH3
O
O
H
C
C
O
O
O
O
H
H
4.
ДвухосновныеТрех и более основные кислоты
O
H
O
C
CH2
O
C
O H
O
CH CH2 C
O
H
5. НОМЕНКЛАТУРА
Систематическая номенклатурапредлагает два способа построения
названий карбоновых кислот:
Способ I. Названия карбоновых кислот
образуют от названия родоначальных
углеводородов с тем же числом атомов
углерода, считая атом углерода
карбоксильной группы, суффикса –ов-,
окончания –ая и слова «кислота»
6. НОМЕНКЛАТУРА
Способ II. Названия карбоновых кислотобразуют от названия родоначальных
углеводородов считая карбоксильную
группу заместителем. Таким образом к
названию углеводородного радикала
прибавляют окончание –карбоновая и слово
«кислота».
7.
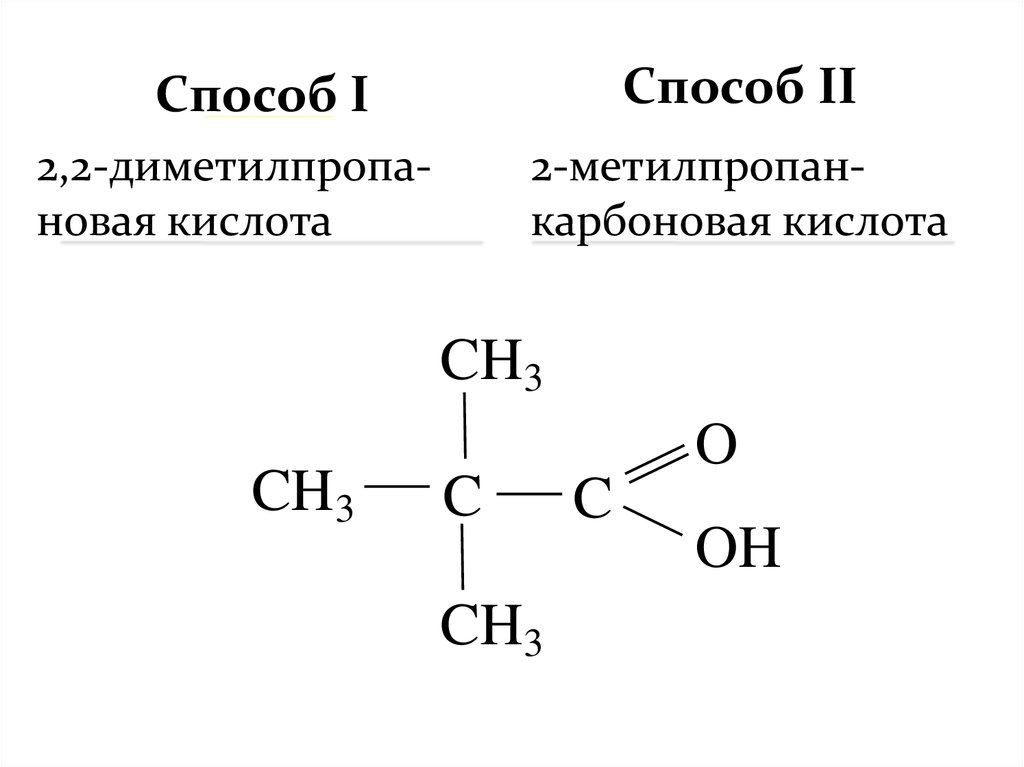
Способ II_____ I
Способ
2,2-диметилпропановая кислота
2-метилпропанкарбоновая кислота
CH3
CH3
C
CH3
O
C
OH
8.
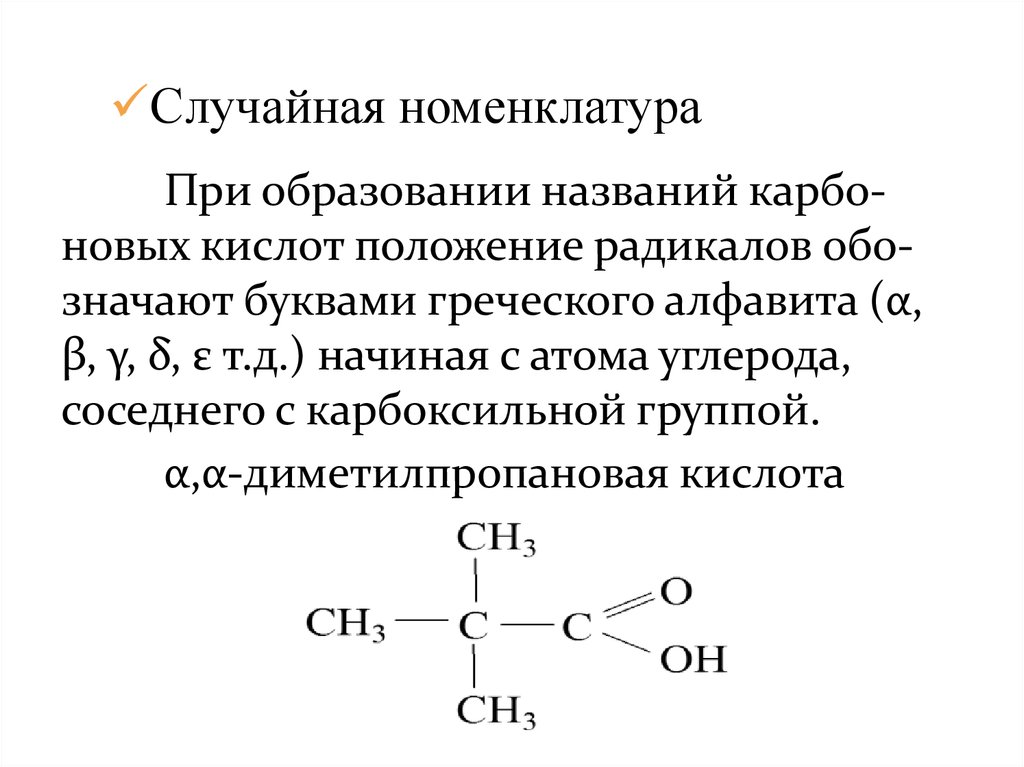
Случайная номенклатураПри образовании названий карбоновых кислот положение радикалов обозначают буквами греческого алфавита (α,
β, γ, δ, ε т.д.) начиная с атома углерода,
соседнего с карбоксильной группой.
α,α-диметилпропановая кислота
9.
Многие карбоновые кислоты сохраняюттривиальные названия
O
CH3
C
OH
CH3
CH3
C
O
C
OH
CH3
O
O
OH
OH
O
C
C
C
C
OH
OH
O
10. Одноосновные насыщенные (предельные) карбоновые кислоты
11.
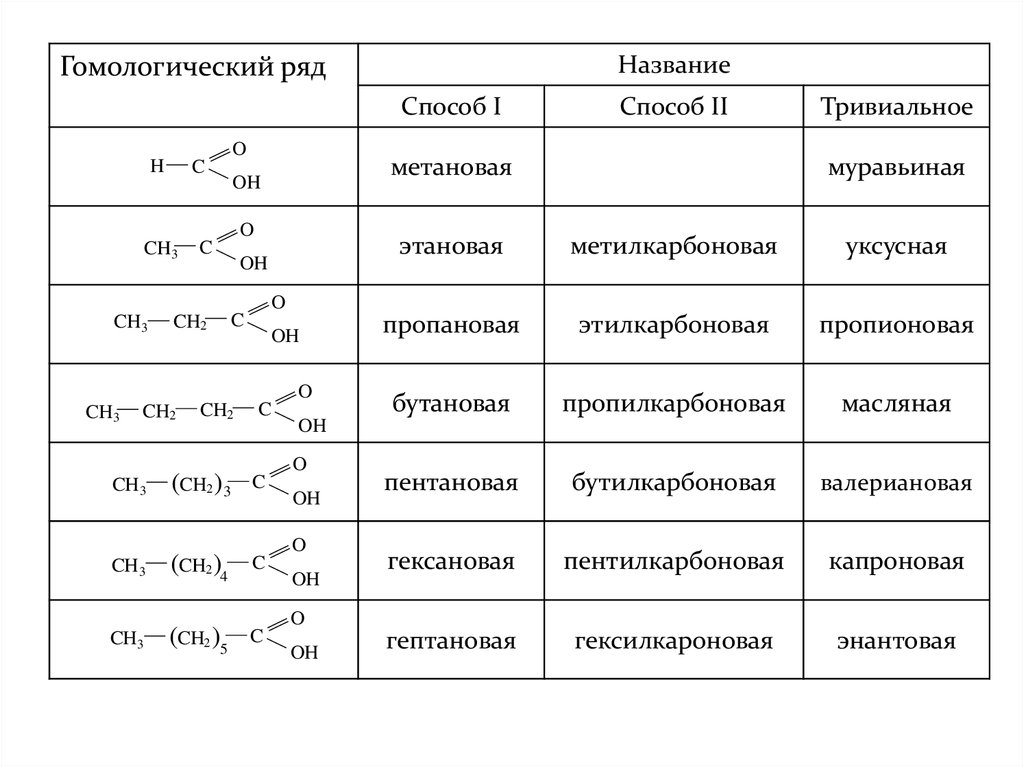
НазваниеГомологический ряд
Способ I
O
H
C
метановая
OH
O
CH3
C
Способ II
OH
Тривиальное
муравьиная
этановая
метилкарбоновая
уксусная
пропановая
этилкарбоновая
пропионовая
бутановая
пропилкарбоновая
масляная
пентановая
бутилкарбоновая
валериановая
гексановая
пентилкарбоновая
капроновая
гептановая
гексилкароновая
энантовая
O
CH3
CH2
C
OH
O
CH3
CH2
C
(CH2 )3
C
CH2
CH3
OH
O
OH
O
CH3
(CH2 )4
C
CH3
(CH2 )5
C
OH
O
OH
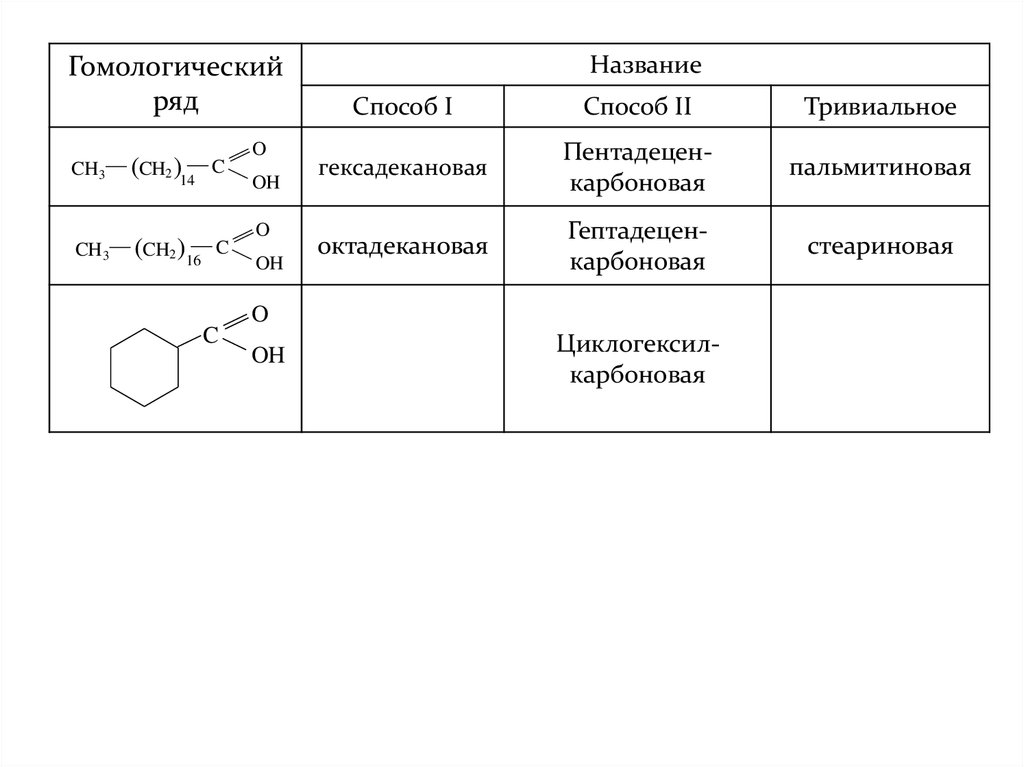
12.
Гомологическийряд
O
CH3
(CH2 )14
C
CH3
(CH2 )16
C
OH
O
OH
Название
Способ I
Способ II
Тривиальное
гексадекановая
Пентадеценкарбоновая
пальмитиновая
октадекановая
Гептадеценкарбоновая
стеариновая
O
C
OH
Циклогексилкарбоновая
13.
ИзомерияИзомерия насыщенных карбоновых
кислот определяется строением
углеводородного радикала (или
структурная изомерия)
14.
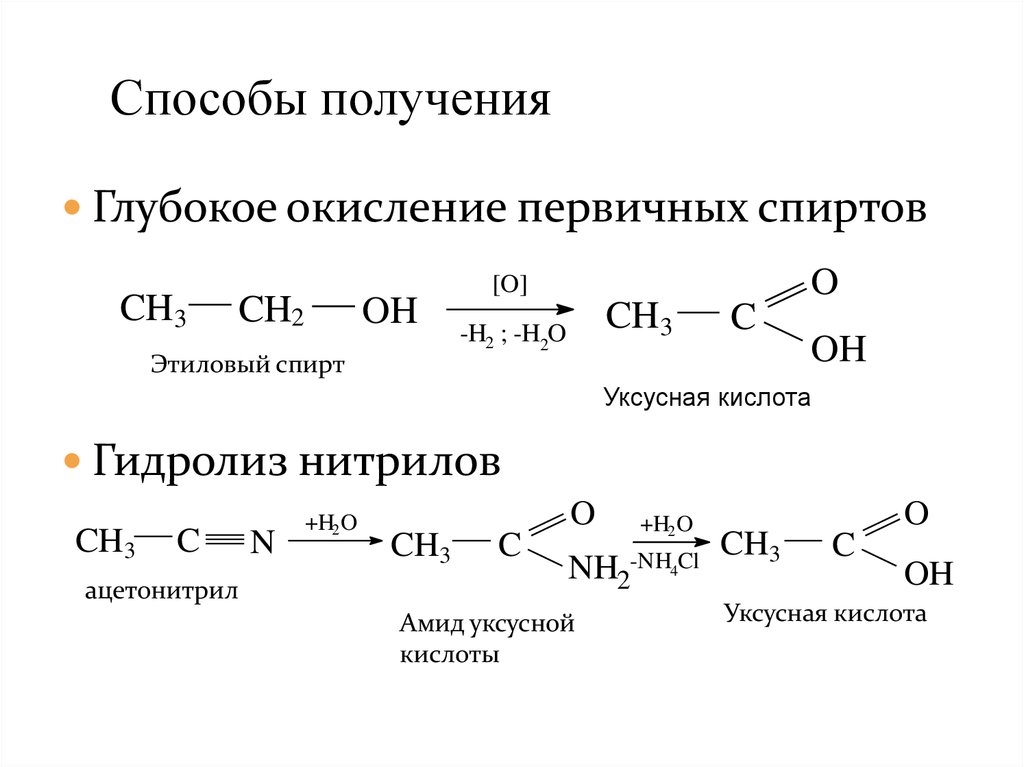
Способы полученияГлубокое окисление первичных спиртов
CH3
CH2
OH
Этиловый спирт
O
[O]
CH3
-H2 ; -H2O
C
OH
Уксусная кислота
Гидролиз нитрилов
CH3
C
ацетонитрил
N
+H2 O
O
CH3
C
+H2 O
-NH4Cl
NH2
Амид уксусной
кислоты
CH3
O
C
OH
Уксусная кислота
15.
Гидролиз сложных эфиров глицерина(жиров).
Реакция широко применяется для
получения высокомолекулярных (С14 – С22)
карбоновых кислот.
H2C
HC
H2C
O
C R
O
O
C R1
O
O
C R2
O
H2C
+ H2O ; + H
+ H2O ; + H
H2C
OH
HC
O
H2C
O
+
O + O
C R 1 HO
O
C R2
H2C
OH
+
HC
O
H2C
OH
O
C
O
+
R1
HO
+ H2O ; + H
C
R2
+
HC
H2C
C
R
+ H2O ; + H
+
OH
O
OH +
HO
OH
C
R1
16.
Химические свойстваХимическое поведение кислот, в
первую очередь, связано с наличием в их
молекуле карбоксильной группы, а так же
строением углеводородного радикала.
δδ+
C
O
O
∙∙
δ+
H
δ+
Атом водорода становится подвижным и
приобретает способность отщепляться в виде
протонов.
17.
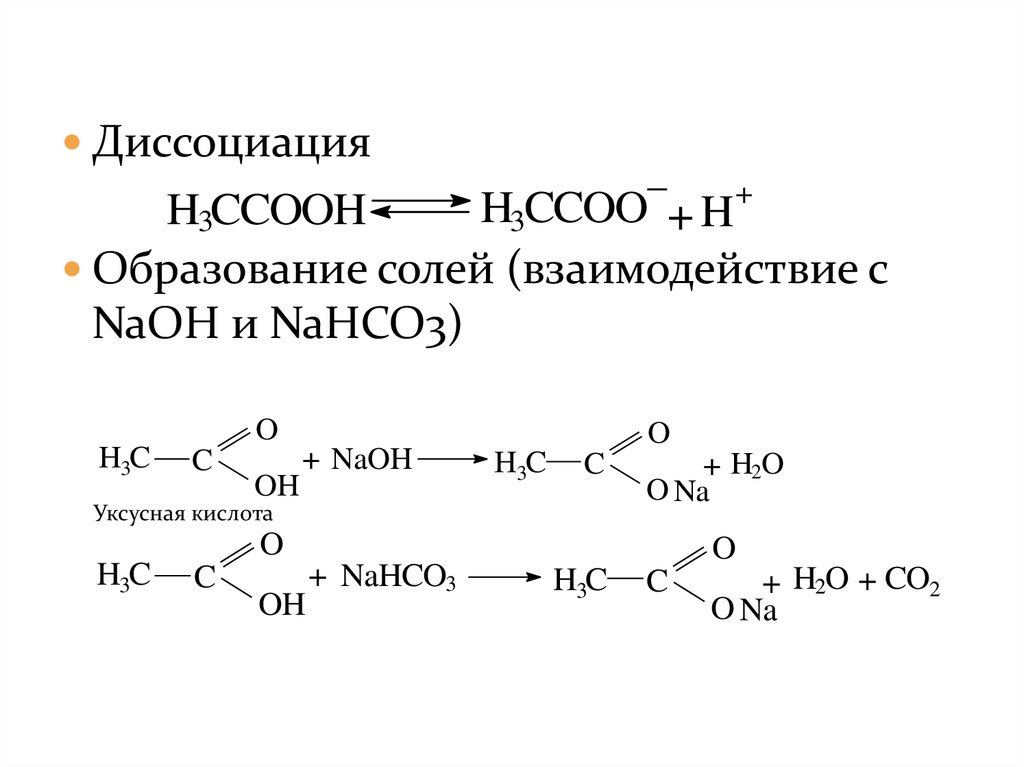
Диссоциация+
H3CCOO + H
H3CCOOH
Образование солей (взаимодействие с
NaOH и NaHCO3)
O
H3C
C
OH
+ NaOH
O
H3C
C
Уксусная кислота
+ H2O
O Na
O
H3C
C
OH
+ NaHCO3
O
H3C
C
+ H2O + CO2
O Na
18.
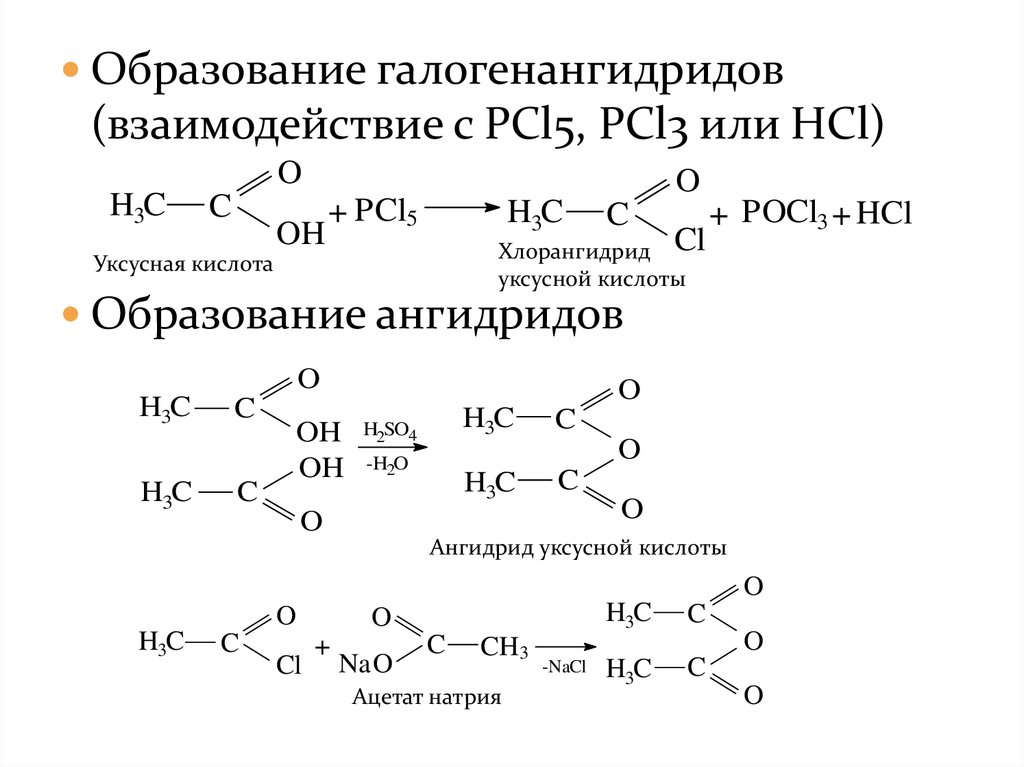
Образование галогенангидридов(взаимодействие с PCl5, PCl3 или HCl)
O
H3C
C
OH
O
+ PCl5
H3C
C
Хлорангидрид Cl
уксусной кислоты
Уксусная кислота
+ POCl3 + HCl
Образование ангидридов
O
H3C
H3C
C
O
OH
OH
C
H3C
H2SO4
C
O
-H2O
H3C
C
O
O
Ангидрид уксусной кислоты
O
O
H3C
C
Cl
O
+
Na O
C
CH3
Ацетат натрия
-NaCl
H3C
C
H3C
C
O
O
19.
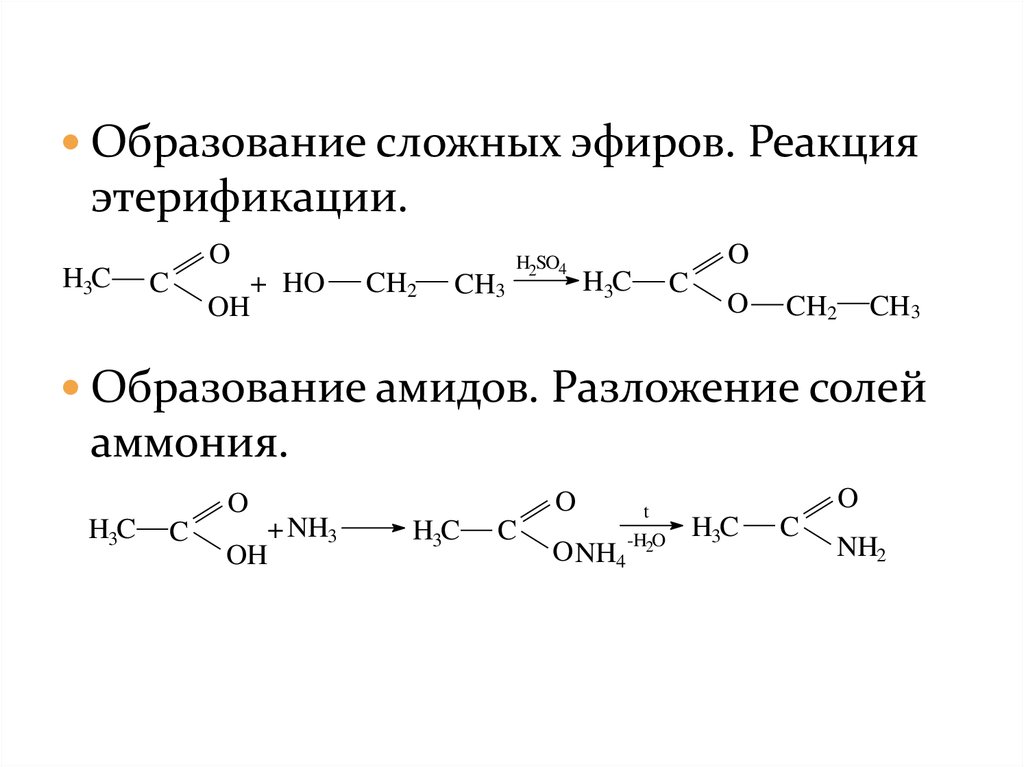
Образование сложных эфиров. Реакцияэтерификации.
H3C
O
C
OH
+ HO
CH2
CH3
H2SO4
O
H3C
Этиловый спирт
C
O
CH2
CH3
Этиловый эфир уксусной
Образование амидов. Разложение солей
аммония.
O
O
H3C
C
+ NH3
OH
H3C
C
O NH4
Ацетат аммония
t
-H2O
O
H3C
C
NH2
Амид уксусной кислоты
20.
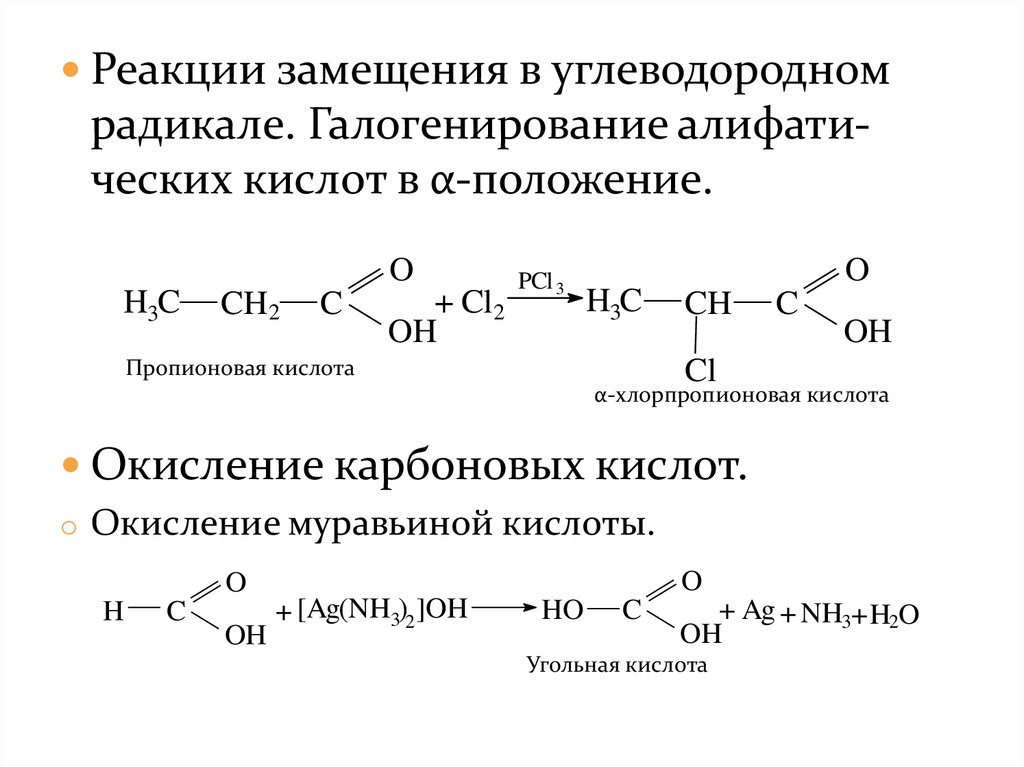
Реакции замещения в углеводородномрадикале. Галогенирование алифатических кислот в α-положение.
O
H3C
CH2
C
+ Cl2
OH
PCl 3
O
H3C
Пропионовая кислота
CH
C
OH
Cl
α-хлорпропионовая кислота
Окисление карбоновых кислот.
o Окисление муравьиной кислоты.
O
O
H
C
OH
+ [Ag(NH3)2]OH
HO
C
+ Ag + NH3+ H2O
OH
Угольная кислота
21.
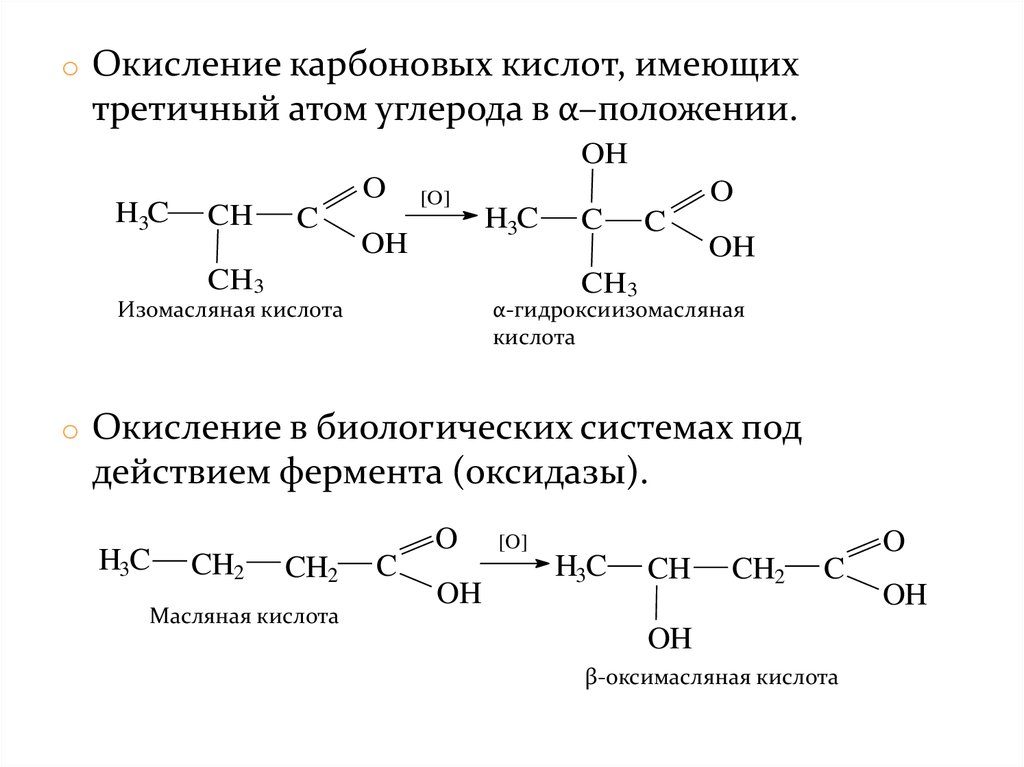
o Окисление карбоновых кислот, имеющихтретичный атом углерода в α–положении.
OH
H3C
O
CH
C
[O]
OH
H3C
CH3
O
C
C
OH
CH3
Изомасляная кислота
α-гидроксиизомасляная
кислота
o Окисление в биологических системах под
действием фермента (оксидазы).
H3C
CH2
CH2
Масляная кислота
C
O
OH
[O]
H3C
CH
CH2
C
OH
β-оксимасляная кислота
O
OH
22. Одноосновные ненасыщенные (непредельные) карбоновые кислоты
23.
Гомологический рядH2C
CH
H2C
OH
O
C
OH
CH3
H3C
H
C
H
H3C
H3C
(CH2) 7
H
HC
C
C
C
C
H
C
C
O
OH
H
C
C
Способ I
Способ II
Тривиальное
пропеновая
Этиленкарбоновая
акриловая
2-метилпропеновая
Пропенкарбоновая-2
Метакриловая
транс-бутен2-овая
транспропенкарбоновая
кротоновая
цис-бутен-2овая
циспропенкарбоновая
изокротовая
цисоктадецен-9овая
цисгептодецен-8карбоновая
олеиновая
пропиновая
Ацетиленкарпропиоловая
боноваяя
O
C
C
Название
C
(CH2)7
H
O
OH
O
OH
C
O
OH
24.
ИзомерияИзомерия ненасыщенных карбоновых
кислот определяется:
строением углеводородного радикала
(или структурная изомерия)
Положением двойных или тройных
связей
Пространственная (геометрическая или
цис-транс-)
25.
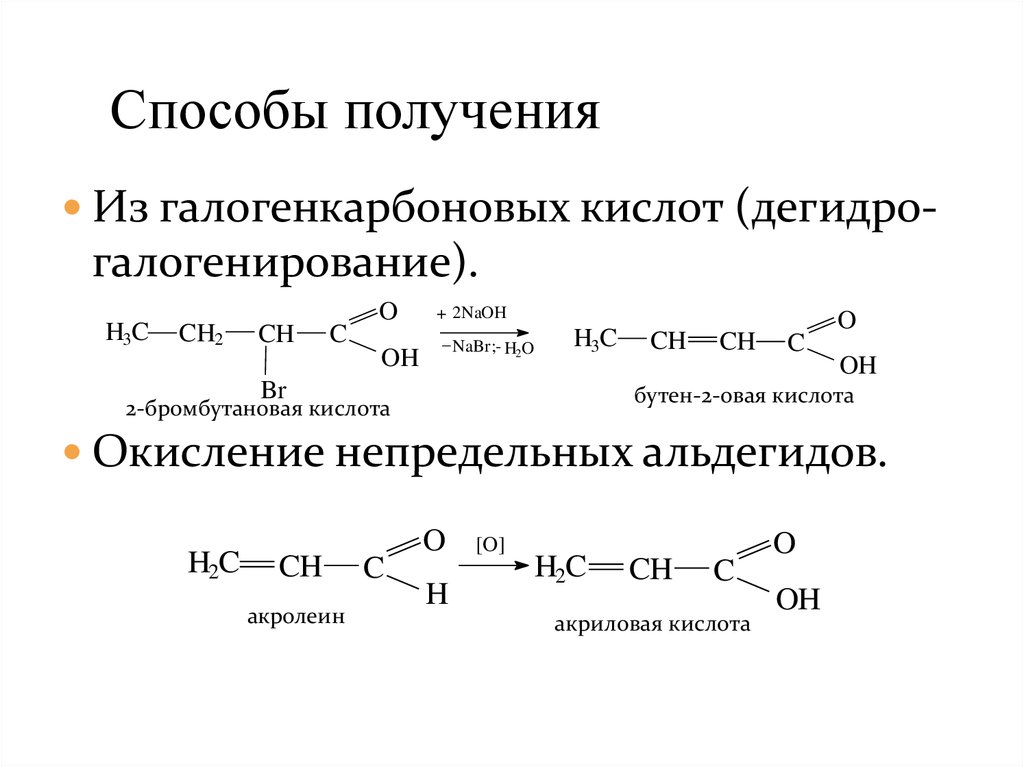
Способы полученияИз галогенкарбоновых кислот (дегидро-
галогенирование).
H3C
CH2
CH
C
O
OH
+ 2NaOH
_ NaBr ;H2 O
H3C
Br
CH
CH
C
O
OH
бутен-2-овая кислота
2-бромбутановая кислота
Окисление непредельных альдегидов.
H2C
CH
акролеин
C
O
H
[O]
H2C
CH
C
акриловая кислота
O
OH
26.
Химические свойстваНенасыщенные одноосновные кислоты
вступают во все реакции, характерные для кислот (образование солей, сложных эфиров, ангидридов, галогенангидридов, амидов и т.д.), а в
связи с наличием кратной связи – в реакции
присоединения, окисления, полимеризации.
α-ненасыщенные кислоты отличаются некоторыми особенностями в химическом поведении. (Например: присоединение галогеноводородов и воды протекает против правила Марковникова.
27.
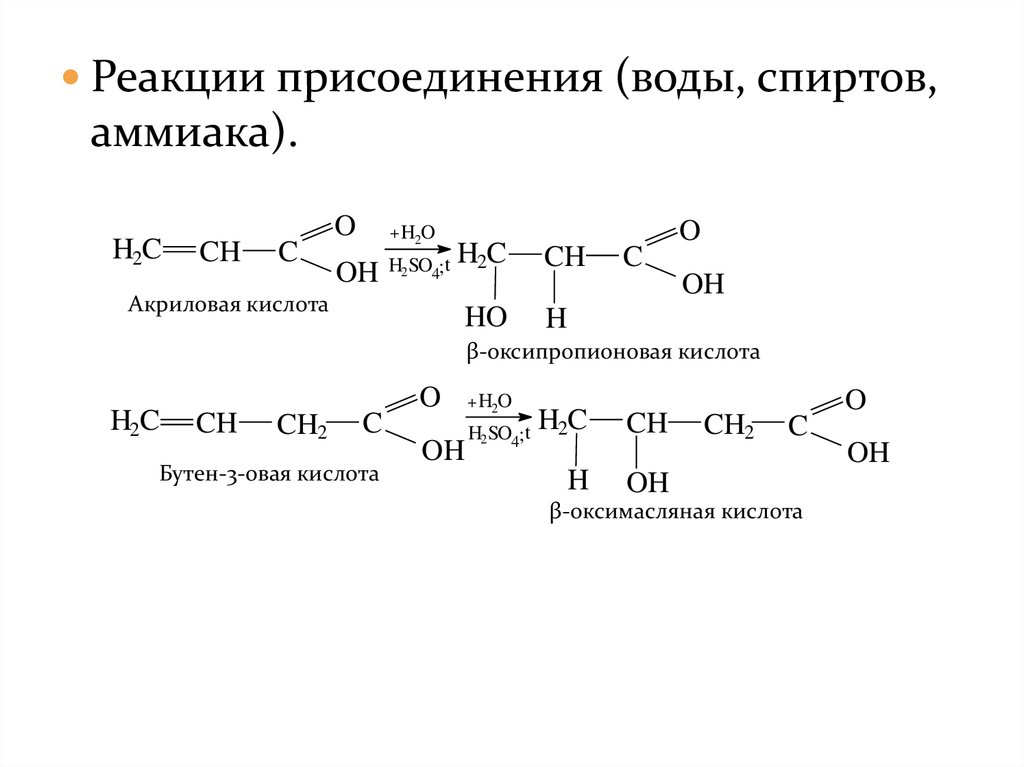
Реакции присоединения (воды, спиртов,аммиака).
H2C
CH
C
O
+ H2O
OH
H2 SO4; t
H2C
Акриловая кислота
CH
C
O
OH
HO
H
β-оксипропионовая кислота
H2C
CH
CH2
C
Бутен-3-овая кислота
O
OH
+ H2O
H2 SO4; t
H2C
H
CH
CH2
C
OH
β-оксимасляная кислота
O
OH
28.
ОкислениеO
H2C
CH
C
O
H
[O]
C
CH2
C
O
OH
Малональдегидная кислота
OH
H3C
O
C
C
O
OH
Пировиноградная кислота
H3C
CH
CH
C
O
[O]
O
H3C
C CH2 C OH
O Ацетоуксусная кислота
OH
H3C
CH2
O
C
C
O
OH
α-кетомасляная кислота
29.
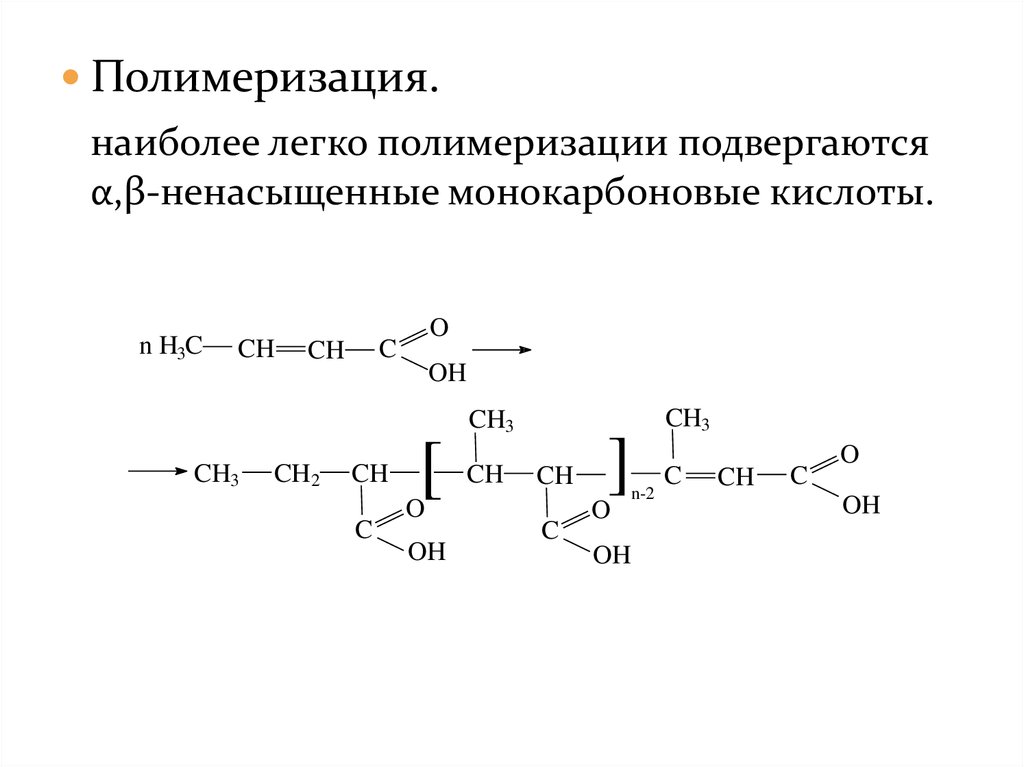
Полимеризация.наиболее легко полимеризации подвергаются
α,β-ненасыщенные монокарбоновые кислоты.
n H3C
CH
O
C
CH
OH
CH3
CH3
CH3
CH2
CH
C
[
O
OH
CH
CH
C
]
O
OH
n-2
C
CH
C
O
OH
30.
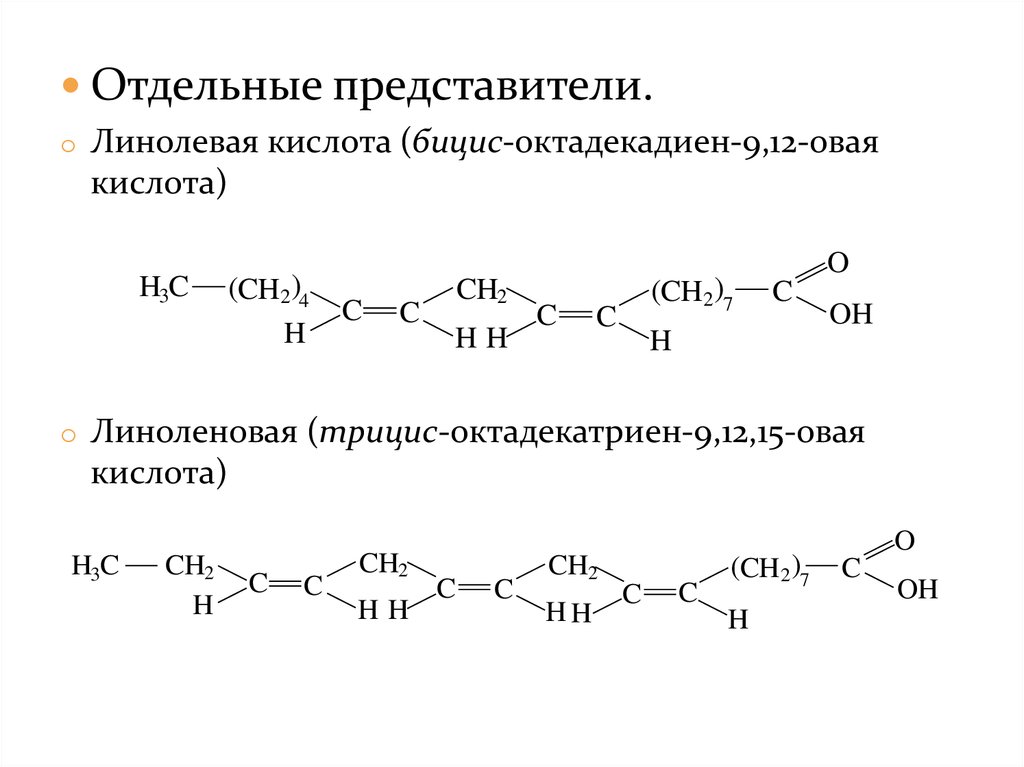
Отдельные представители.o Линолевая кислота (бицис-октадекадиен-9,12-овая
кислота)
H3C
(CH2 )4
H
C
C
CH2
HH
C
(CH2 )7
C
O
C
H
OH
o Линоленовая (трицис-октадекатриен-9,12,15-овая
кислота)
H3C
CH2
H
C
C
CH2
HH
C
C
CH2
HH
C
C
(CH2 )7
H
O
C
OH
31.
Ароматические карбоновыекислоты
32.
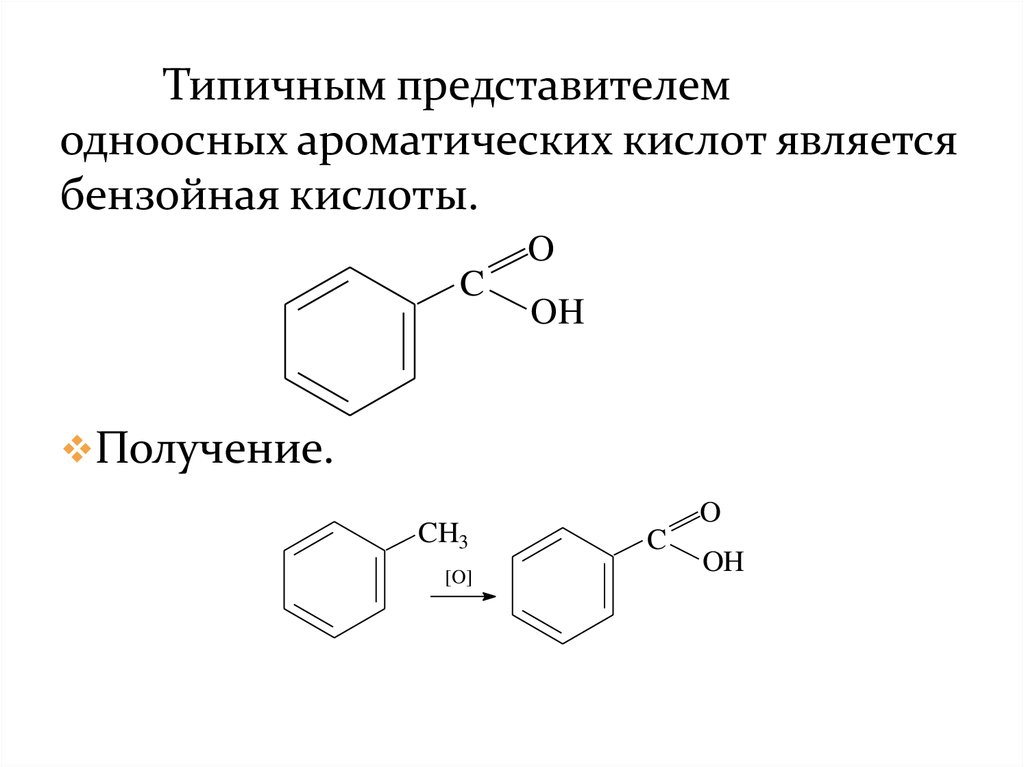
Типичным представителемодноосных ароматических кислот является
бензойная кислоты.
O
C
OH
Получение.
CH3
[O]
O
C
OH
33.
Химические свойстваРеакции карбоксильной группы.
Для аренкарбоновых кислот характерны все
реакции насыщенных карбоновых кислот в
карбоксильной группе.
34.
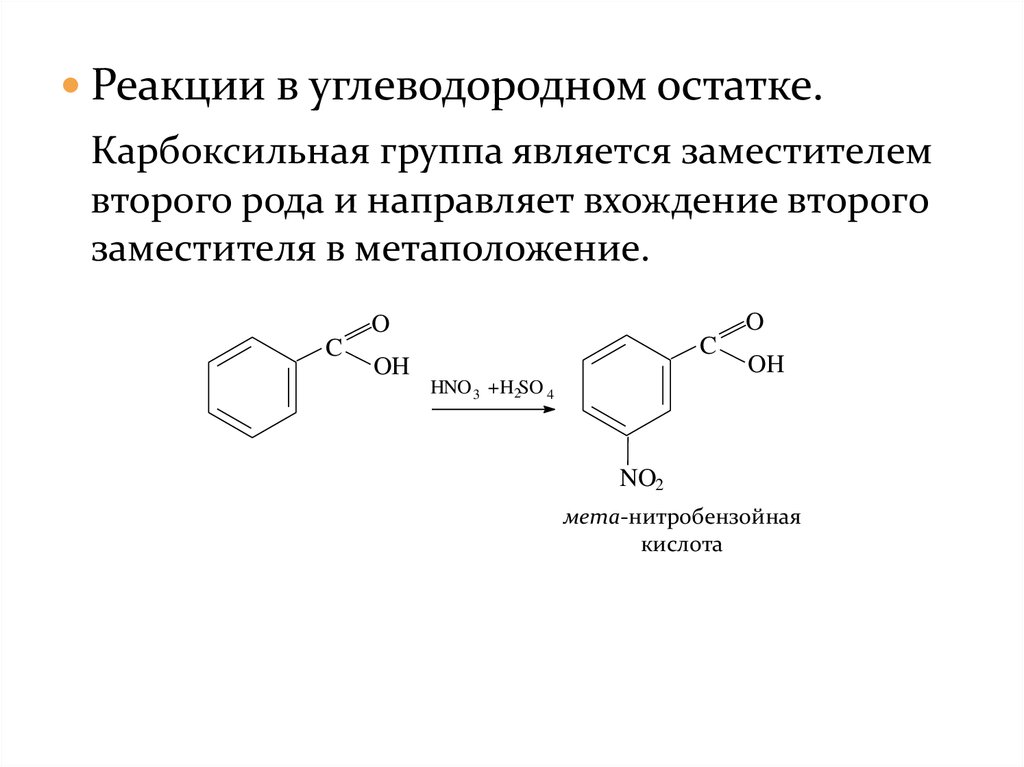
Реакции в углеводородном остатке.Карбоксильная группа является заместителем
второго рода и направляет вхождение второго
заместителя в метаположение.
O
O
C
OH
C
OH
HNO 3 +H2SO 4
NO2
мета-нитробензойная
кислота
35.
Двухосновные кислоты36.
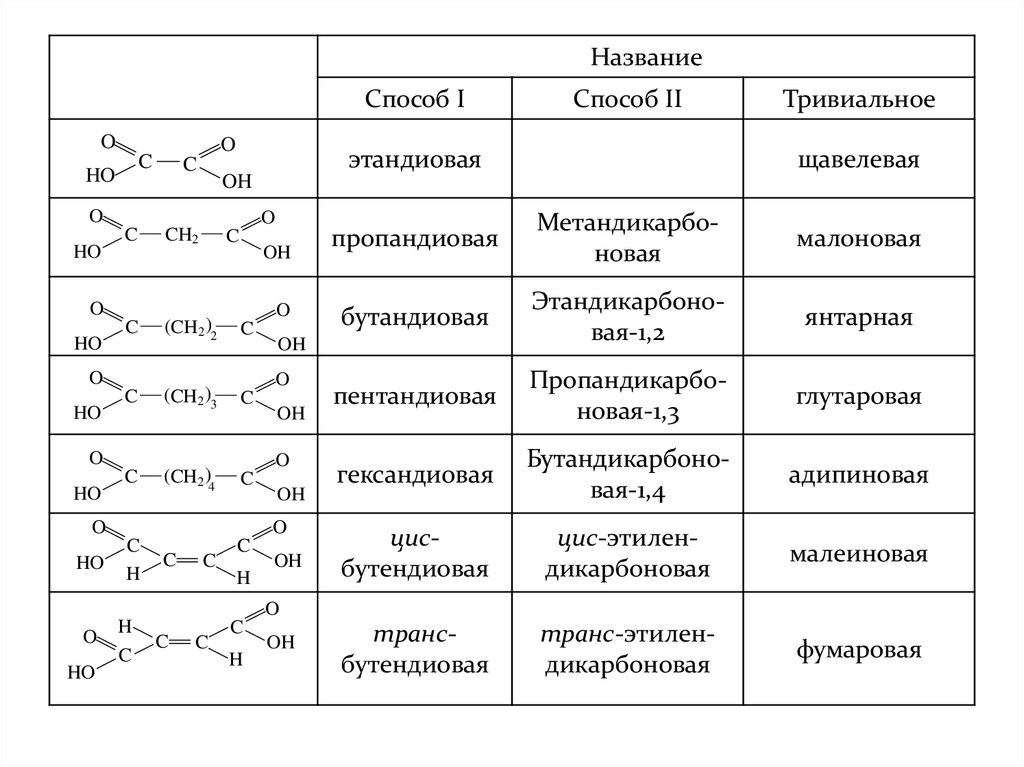
Гомологическийряд
O
O
C
HO
C
HO
O
HO
C
O
HO
C
O
HO
C
HO
O
CH2
C
(CH2 )2
(CH2 )3
(CH2 )4
OH
O
C
Тривиальное
щавелевая
O
C
OH
O
C
C
C
H
пропандиовая
Метандикарбоновая
малоновая
бутандиовая
Этандикарбоновая-1,2
янтарная
пентандиовая
Пропандикарбоновая-1,3
глутаровая
гександиовая
Бутандикарбоновая-1,4
адипиновая
цисбутендиовая
цис-этилендикарбоновая
малеиновая
трансбутендиовая
транс-этилендикарбоновая
фумаровая
OH
OH
O
C
Способ II
OH
O
C
H
Способ I
этандиовая
O
C
Название
OH
O
O
HO
H
C
C
C
C
H
OH
37.
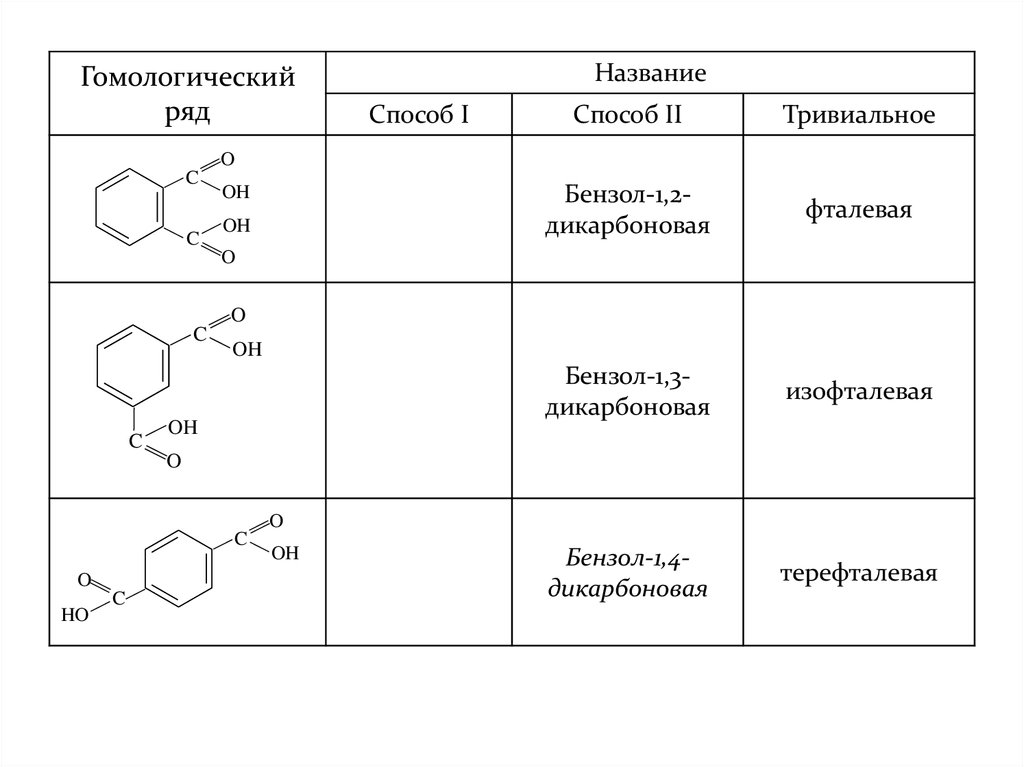
Гомологическийряд
Название
Способ I
Способ II
Тривиальное
Бензол-1,2дикарбоновая
фталевая
Бензол-1,3дикарбоновая
изофталевая
Бензол-1,4дикарбоновая
терефталевая
O
C
C
OH
OH
O
O
C
C
OH
OH
O
O
C
O
HO
C
OH
38.
ИзомерияСтруктурная изомерия насыщенных али-
фатических двухосновных карбоновых
кислот.
У ненасыщенных кислот имеет место
геометрическая изомерия.
У ароматических двухосновных кислот
изомерия также изомерия положения
карбоксильных групп.
39.
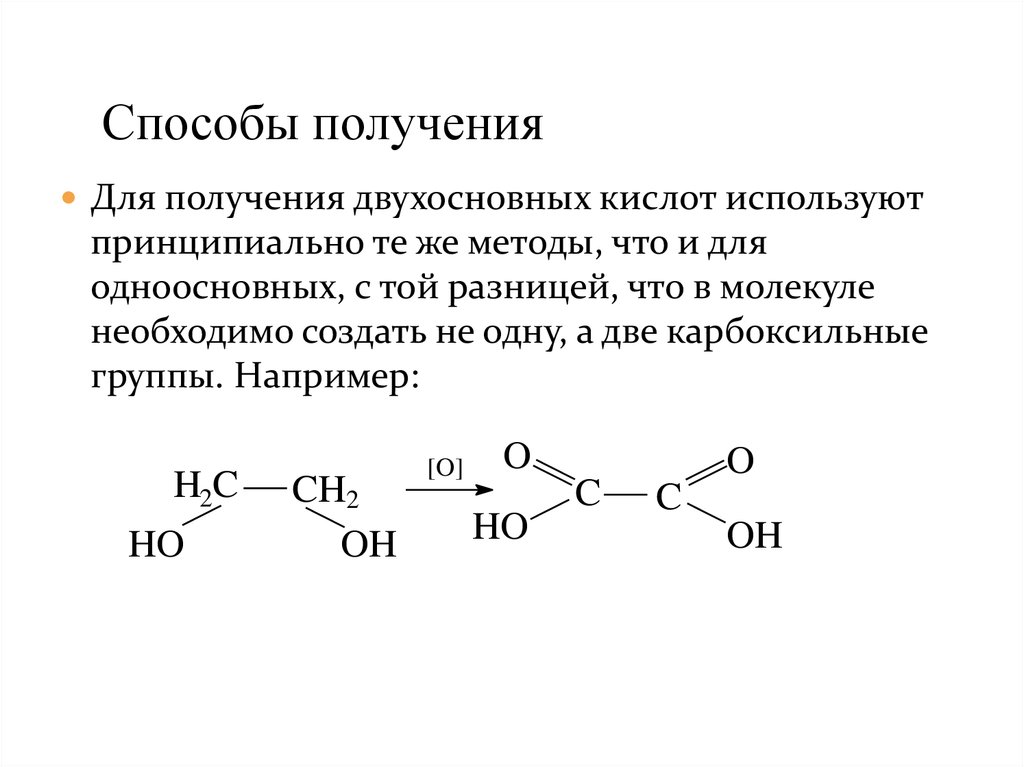
Способы полученияДля получения двухосновных кислот используют
принципиально те же методы, что и для
одноосновных, с той разницей, что в молекуле
необходимо создать не одну, а две карбоксильные
группы. Например:
H2C
HO
CH2
OH
[O]
O
HO
C
O
C
OH
40.
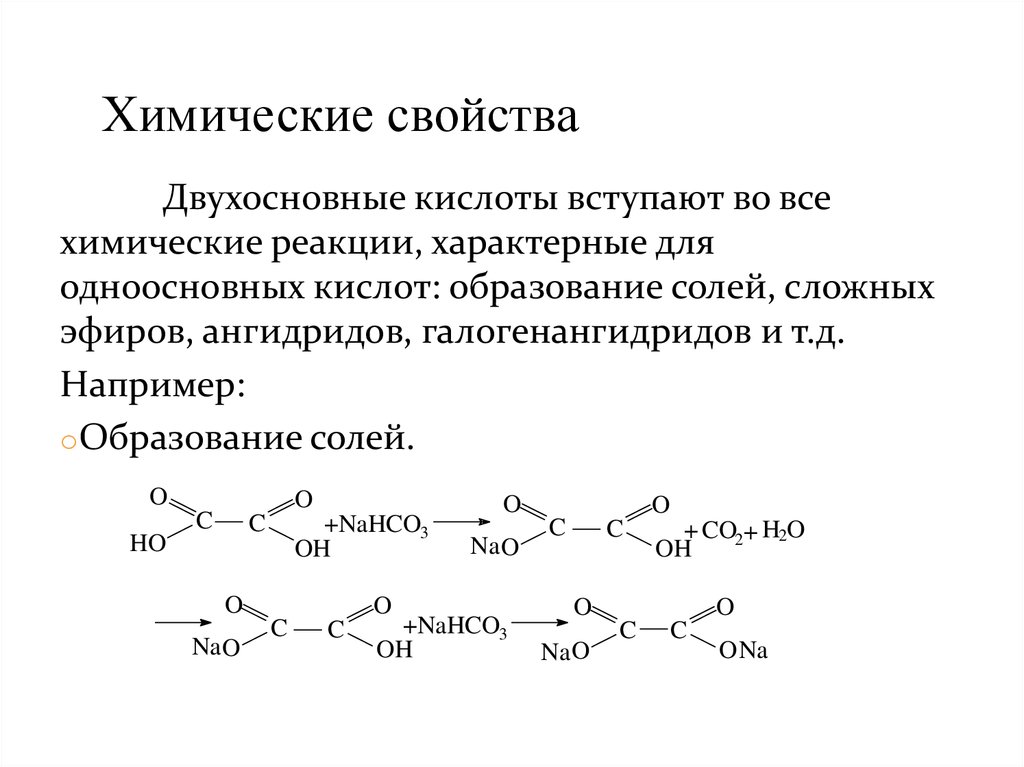
Химические свойстваДвухосновные кислоты вступают во все
химические реакции, характерные для
одноосновных кислот: образование солей, сложных
эфиров, ангидридов, галогенангидридов и т.д.
Например:
oОбразование солей.
O
HO
O
C
C
+NaHCO3
OH
O
Na O
O
C
C
O
Na O
+NaHCO3
OH
O
C
C
+ CO2 + H2O
OH
O
Na O
O
C
C
O Na
41.
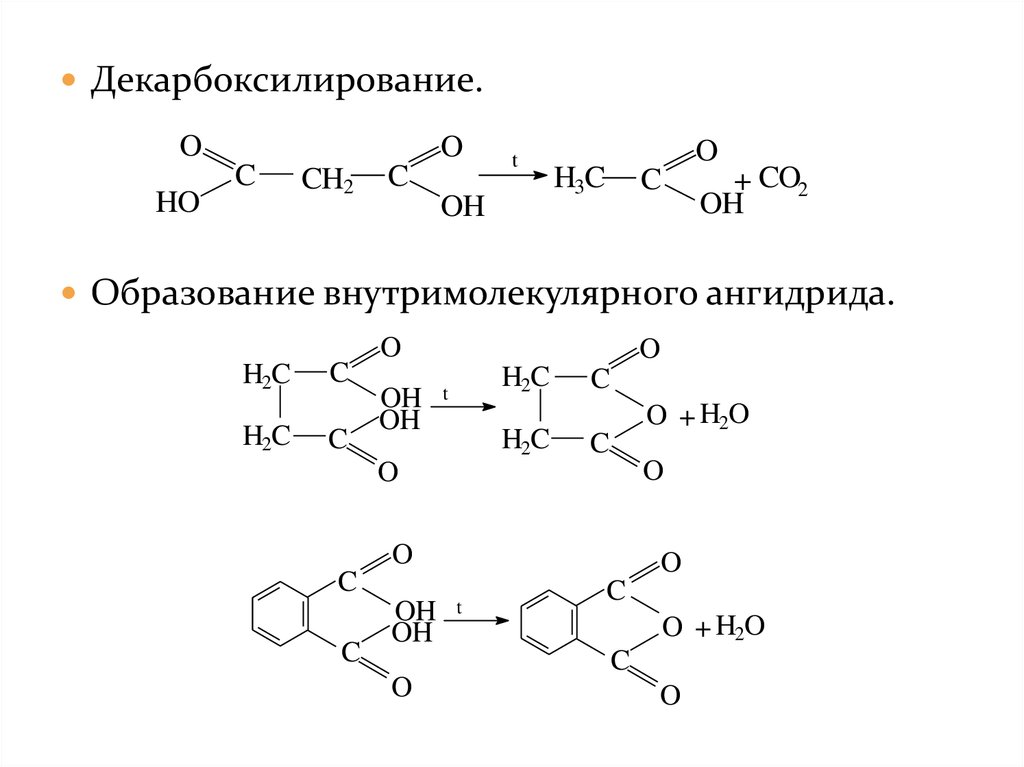
Декарбоксилирование.O
HO
O
C
CH2
C
t
OH
O
H3C
+ CO2
OH
C
Образование внутримолекулярного ангидрида.
H2C
H2C
C
C
O
OH
OH
O
H2C
t
H2C
C
O + H2O
C
O
O
O
O
C
C
OH
OH
t
C
O + H2O
C
O
O


















 chemistry
chemistry








