Similar presentations:
I начало термодинамики
1.
ГЛАВА II. МОЛЕКУЛЯРНАЯФИЗИКА И
ТЕРМОДИНАМИКА
§3. I начало термодинамики
О. И. Лубенченко
НИУ МЭИ
Кафедра физики им. В. А. Фабриканта
2020
2.
§3. I начало термодинамикиI. Внутренняя энергия
Внутренняя энергия термодинамической системы — ФВ — сумма
следующих составляющих:
1. Кинетическая энергия теплового движения молекул (поступательного,
вращательного и колебательного)
2. Потенциальная энергия взаимодействия молекул
3. Потенциальная энергия взаимодействия атомов в молекуле
4. Энергия атомных оболочек
5. Внутриядерная энергия
II. Внутренняя энергия идеального газа
Внутренняя энергия идеального газа — ФВ — кинетическая энергия
поступательного и вращательного движения молекул.
3
ε
kT
Для одноатомного газа
2
3
3
3
3m
U N ε NkT νN A kT νRT
RT
2
2
2
2μ
Число степеней свободы механической системы — наименьшее число
независимых координат, которыми определяется положение системы в
пространстве.
2
3.
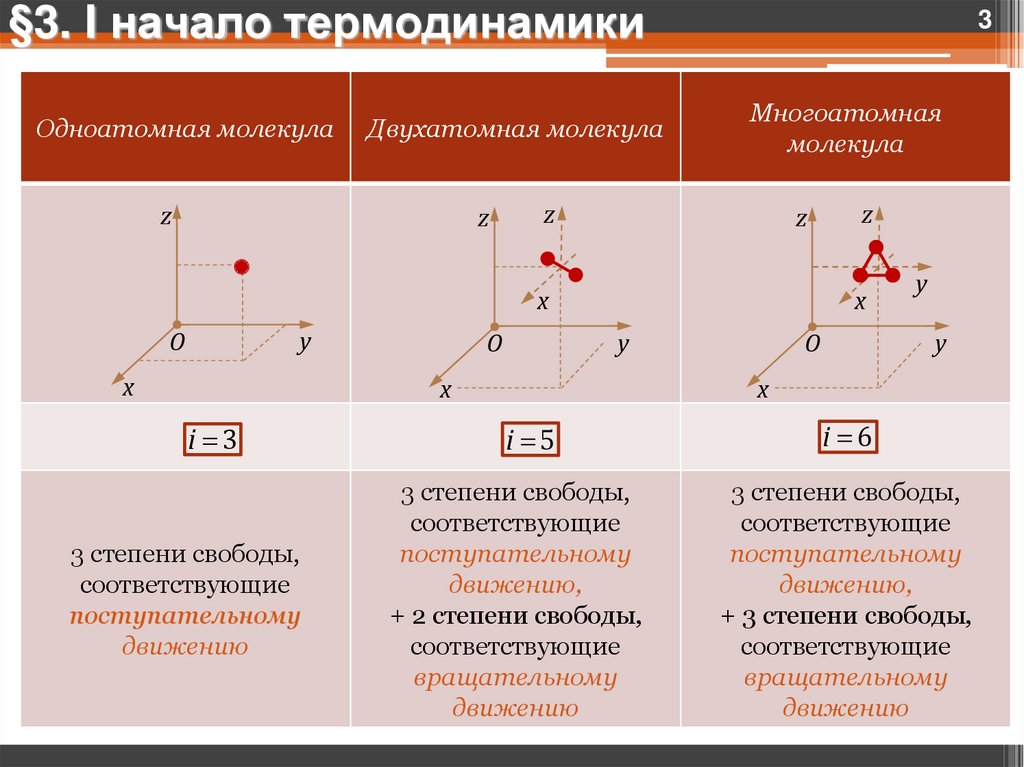
§3. I начало термодинамикиОдноатомная молекула
Двухатомная молекула
z
z
3
Многоатомная
молекула
z
z
z
x
y
O
x
O
x
y
x
i 3
3 степени свободы,
соответствующие
поступательному
движению
O
y
y
x
i 5
3 степени свободы,
соответствующие
поступательному
движению,
+ 2 степени свободы,
соответствующие
вращательному
движению
i 6
3 степени свободы,
соответствующие
поступательному
движению,
+ 3 степени свободы,
соответствующие
вращательному
движению
4.
§3. I начало термодинамики4
Закон равномерного распределения энергии по степеням свободы:
в любой термодинамической системе на одну степень свободы молекулы
приходится энергия, в среднем равная kT .
2
Доказательство
3
2
Для поступательного движения εпоступ kT
εпоступ
m0 v2
2
2
2
2
m
v
m
v
m
v
m0 2
0
x
0
y
0
z
vx v2y v2z
3 ε1
2
2
2
2
kT
ε1
2
i
i
i
im
U N ε NkT νN A kT νRT
RT
2
2
2
2μ
U
im
RT
2μ
5.
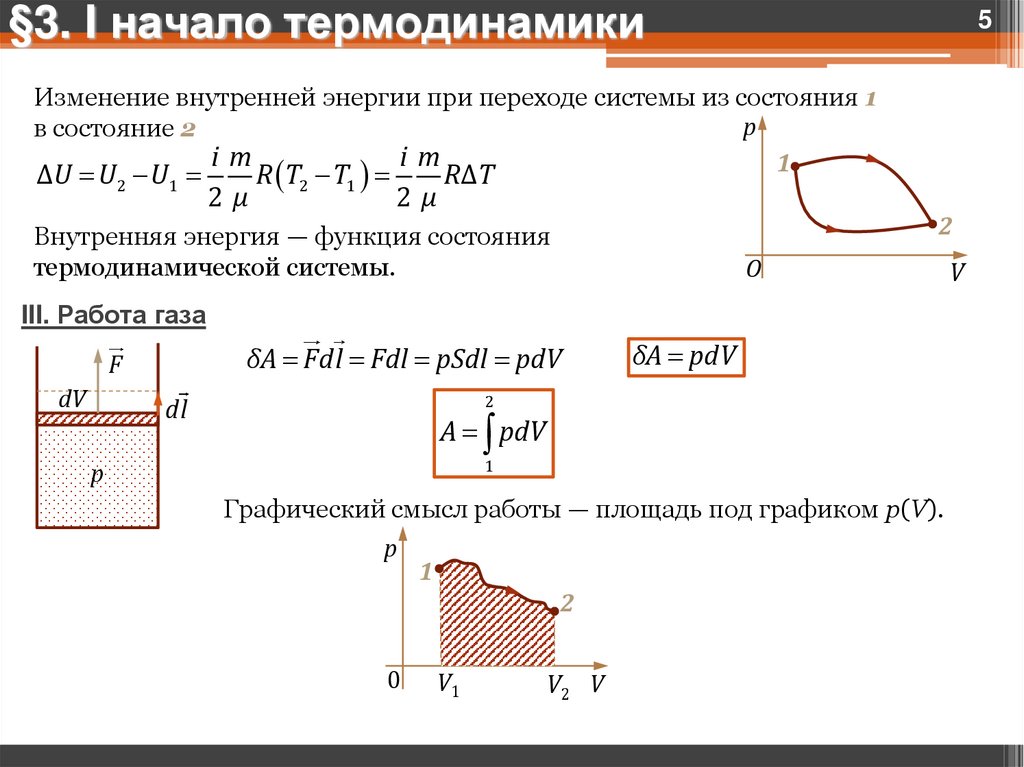
§3. I начало термодинамики5
Изменение внутренней энергии при переходе системы из состояния 1
p
в состояние 2
im
im
1
ΔU U U
R T T
RΔT
2
1
2μ
2
1
2μ
2
Внутренняя энергия — функция состояния
термодинамической системы.
O
III. Работа газа
δA Fdl Fdl pSdl pdV
F
dV
δA pdV
2
dl
A pdV
1
p
Графический смысл работы — площадь под графиком p(V).
p
1
2
0
V1
V2 V
V
6.
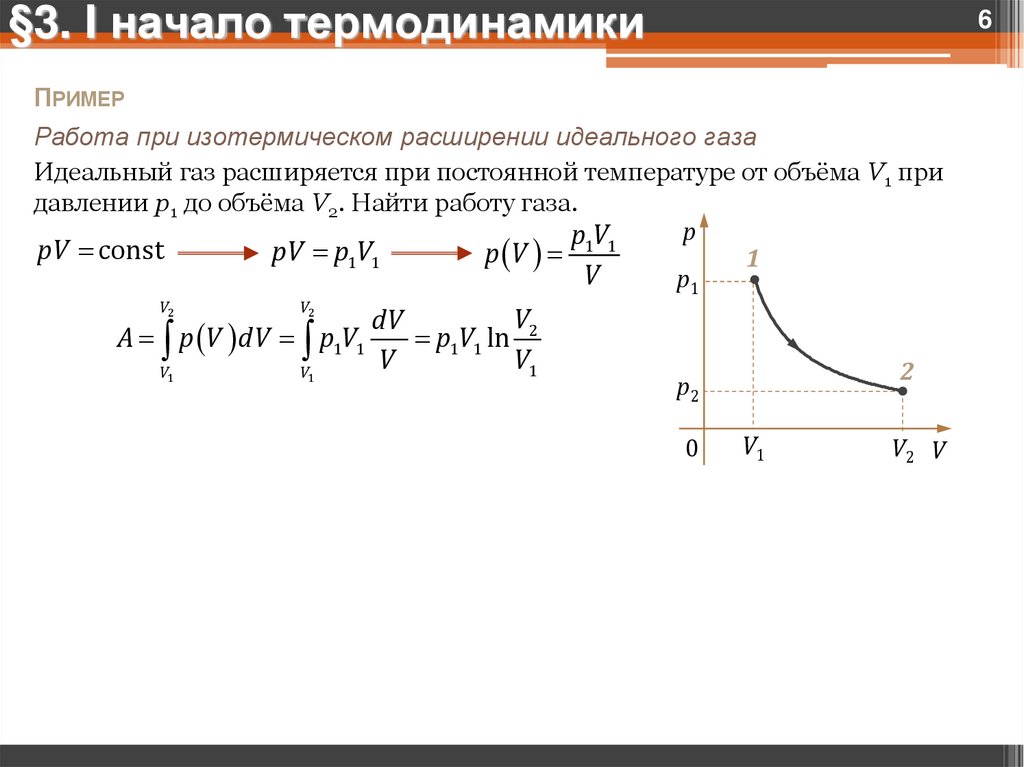
§3. I начало термодинамики6
ПРИМЕР
Работа при изотермическом расширении идеального газа
Идеальный газ расширяется при постоянной температуре от объёма V1 при
давлении p1 до объёма V2. Найти работу газа.
p
p1V1
pV const
pV p1V1
p V
1
V
p1
V2
V2
V2
dV
A p V dV p1V1
p1V1 ln
V
V1
V1
V1
2
p2
0
V1
V2 V
7.
§3. I начало термодинамики7
IV. Количество теплоты. Теплоёмкость
Количество теплоты — ФВ — характеристика термодинамического
процесса — энергия, передаваемая термодинамической системе без
совершения работы.
Теплоёмкость системы (тела) — ФВ — характеристика
термодинамической системы и совершаемого ею процесса, равная количеству
теплоты, которое необходимо передать системе для нагревания её на один
градус:
δQ
Дж
C
dT
C
К
Удельная теплоёмкость вещества — ФВ — теплоёмкость вещества
единичной массы:
c
δQ
mdT
c
Дж
кг К
Молярная теплоёмкость вещества — ФВ — теплоёмкость одного моля
вещества:
Cμ
δQ
νdT
Дж
C μ
моль К
8.
§3. I начало термодинамикиV. I начало термодинамики
ЗСЭ в применении к термодинамическим процессам
I начало термодинамики: количество теплоты, переданное
термодинамической системе, равно сумме изменения внутренней энергии
системы и работы, совершённой системой:
в интегральной форме:
Q ΔU A
в дифференциальной форме: δQ dU δA
8





 physics
physics








