Similar presentations:
Фармацевтическая система качества применительно к надлежащей инженерной практике
1.
Фармацевтическая Система Качестваприменительно к Надлежащей Инженерной
Практике
Директор по качеству
Группы компаний «Р-Фарм»
Вязьмина Т.М.
2.
Нормативная документацияРешение Совета Евразийской экономической комиссии от 03.11.2016 N 77 «Об утверждении Правил надлежащей
производственной практики Евразийского экономического союза»
Приказ Минпромторга России от 14.06.2013 N 916 «Об утверждении Правил надлежащей производственной практики»
Руководство ISPE «Good Engineering Practice»/«Надлежащая инженерная практика»
ГОСТ Р 52896-2017. Национальный стандарт Российской Федерации. Производство лекарственных средств.
Производственные системы и оборудование для производства лекарственных средств. Общие требования.
Руководство ISPE «Heating, Ventilation and Air Conditioning»/«Отопление, вентиляция и кондиционирование»
Руководство ISPE «Process Gases»/«Технологические газы»
Руководство ISPE «Pharmaceutical Engineering Guides for New and Renovated Facilities. Oral solid dosage form»/
«Руководство по фармацевтическому инжинирингу новых и реконструируемых участков. Твердые лекарственные формы
для перорального применения»
Руководство ISPE «Pharmaceutical Engineering Guides for New and Renovated Facilities. Sterile Product Manufacturing
Facilities»/ «Руководство по фармацевтическому инжинирингу новых и реконструируемых участков. Участки по
производству стерильных продуктов»
Руководство ISPE «Pharmaceutical Engineering Guides for New and Renovated Facilities. Water and Steam Systems»/
«Руководство по фармацевтическому инжинирингу новых и реконструируемых участков. Системы подготовки воды и
пара»
Руководство ISPE «Commissioning and Qualification of Pharmaceutical Water and Steam Systems»/ «Ввод в эксплуатацию и
квалификация воды и пара фармацевтического качества»
3.
Определение GEPGEP (Good Engineering Practice) – надлежащая инженерная практика.
1. Установленные инженерные методы и стандарты, которые применяются на протяжении всего
«жизненного цикла» проекта с целью получения соответствующих экономически эффективных решений.
2. Система, посредством которой отдельные проектные решения реализуются квалифицированным
персоналом и документально оформляются таким образом, который позволяет проследить их от
требований пользователя до финального проекта (дизайна). Документация GEP рассматривает цель,
ответственные стороны, ссылки, предположения, методы расчёта, заключения и влияние на другие грани
проекта (дизайна). Требования Надлежащей инженерной практики принимают во внимание
промышленные практики действий, требования по технологичности и безопасности, а также
экономические и нормативные требования.
GEP гарантирует, что технический (инженерный) проект соответствует требованиям пользователя, являясь
экономически эффективным, соответствующим нормам, регуляторным требованиям и четко оформленным
документально.
При этом философия, принципы и подходы, совокупность инженерных методов и стандартов в отношении
технологического оборудования, инженерных систем, чистых помещений применяется на протяжении всего
жизненного цикла проекта.
4.
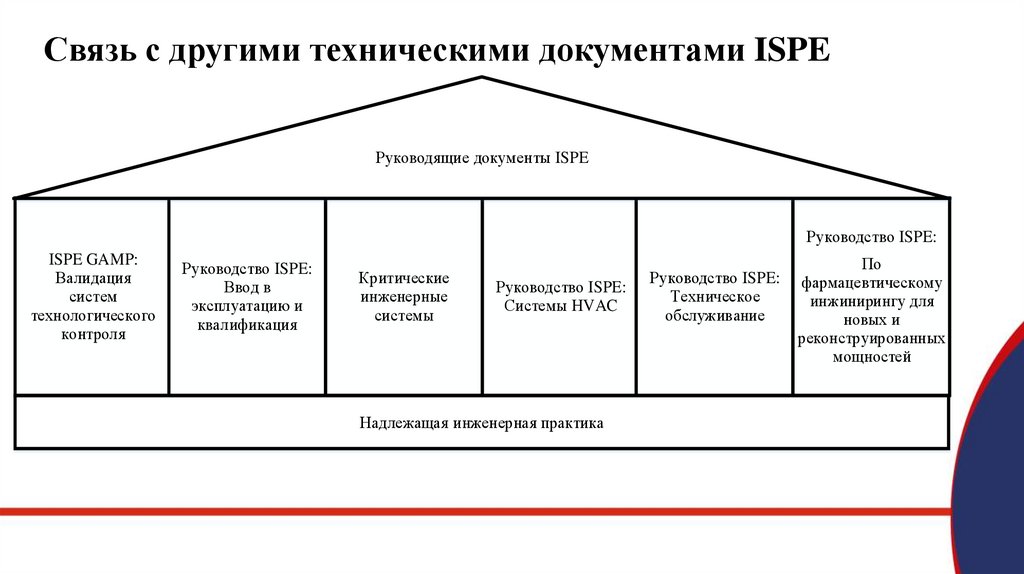
Связь с другими техническими документами ISPEРуководящие документы ISPE
Руководство ISPE:
ISPE GAMP:
Валидация
систем
технологического
контроля
Руководство ISPE:
Ввод в
эксплуатацию и
квалификация
Критические
инженерные
системы
Руководство ISPE:
Системы HVAC
Надлежащая инженерная практика
Руководство ISPE:
Техническое
обслуживание
По
фармацевтическому
инжинирингу для
новых и
реконструированных
мощностей
5.
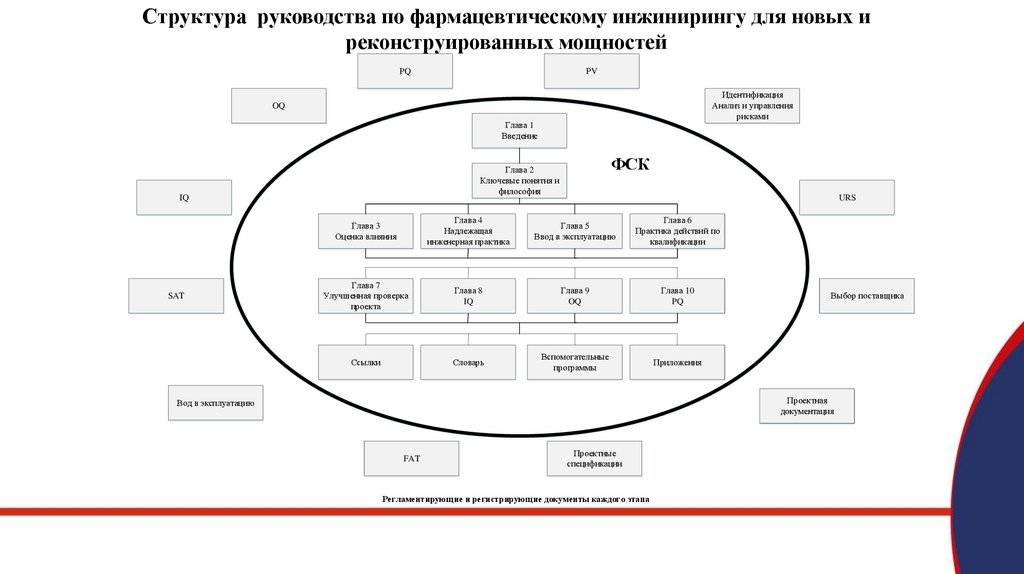
Структура руководства по фармацевтическому инжинирингу для новых иреконструированных мощностей
PQ
PV
Идентификация
Анализ и управления
рисками
OQ
Глава 1
Введение
IQ
SAT
ФСК
Глава 2
Ключевые понятия и
философия
URS
Глава 3
Оценка влияния
Глава 4
Надлежащая
инженерная практика
Глава 5
Ввод в эксплуатацию
Глава 6
Практика действий по
квалификации
Глава 7
Улучшенная проверка
проекта
Глава 8
IQ
Глава 9
OQ
Глава 10
PQ
Ссылки
Словарь
Вспомогательные
программы
Приложения
Выбор поставщика
Проектная
документация
Вод в эксплуатацию
FAT
Проектные
спецификации
Регламентирующие и регистрирующие документы каждого этапа
6.
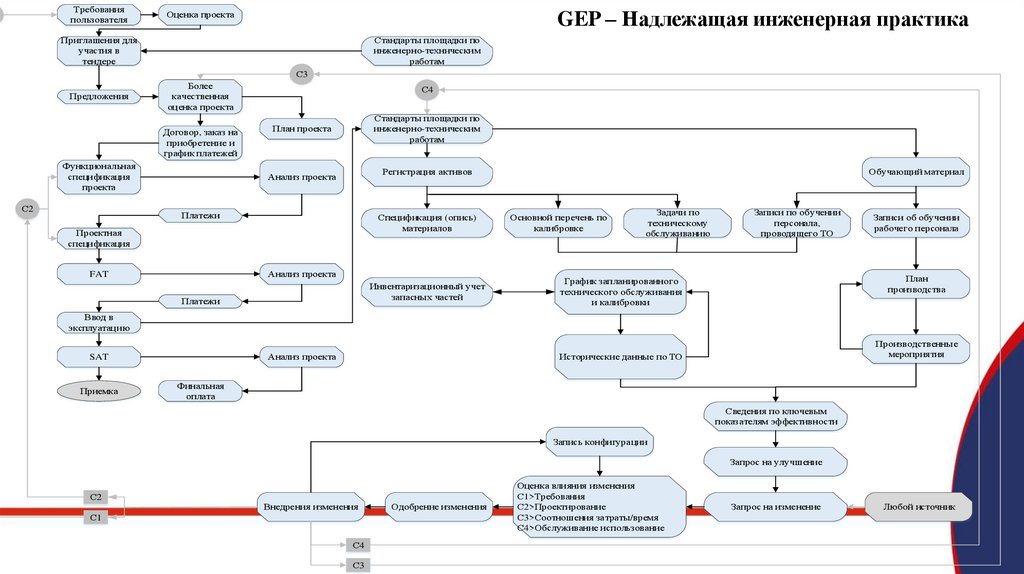
Требованияпользователя
GEP – Надлежащая инженерная практика
Оценка проекта
Приглашения для
участия в
тендере
Стандарты площадки по
инженерно-техническим
работам
С3
Предложения
Более
качественная
оценка проекта
Договор, заказ на
приобретение и
график платежей
Функциональная
спецификация
проекта
С2
С4
Стандарты площадки по
инженерно-техническим
работам
План проекта
Регистрация активов
Анализ проекта
Платежи
Спецификация (опись)
материалов
Проектная
спецификация
Анализ проекта
FAT
Инвентаризационный учет
запасных частей
Платежи
Обучающий материал
Основной перечень по
калибровке
Задачи по
техническому
обслуживанию
Записи по обучении
персонала,
проводящего ТО
Записи об обучении
рабочего персонала
План
производства
График запланированного
технического обслуживания
и калибровки
Ввод в
эксплуатацию
Анализ проекта
SAT
Приемка
Производственные
мероприятия
Исторические данные по ТО
Финальная
оплата
Сведения по ключевым
показателям эффективности
Запись конфигурации
Запрос на улучшение
С2
Внедрения изменения
С1
С4
С3
Одобрение изменения
Оценка влияния изменения
С1>Требования
С2>Проектирование
С3>Соотношения затраты/время
С4>Обслуживание использование
Запрос на изменение
Любой источник
7.
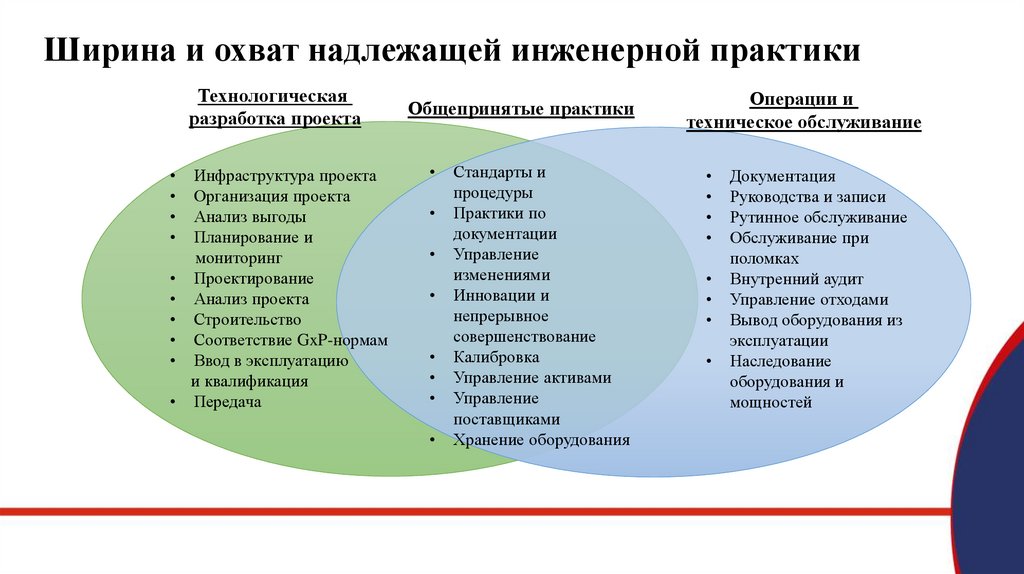
Ключевые понятияТри основных аспекта по надлежащей инженерной практике:
Технологическая разработка проекта
Общепринятые практики действий
Операции и обслуживание
Технологическая разработка проекта: действия, связанные с внедрением нового или существенным образом
изменённого оборудования или мощностей.
Общепринятые практики действий: это практики действий, относящиеся как к технологической разработке
проекта, так и к выполнению обычных операций и технического обслуживания.
Операции и техническое обслуживание: действия, необходимые для поддержания оборудования и
мощностей в надлежащем состоянии и их использования для производственных целей.
8.
Ширина и охват надлежащей инженерной практикиТехнологическая
разработка проекта
Инфраструктура проекта
Организация проекта
Анализ выгоды
Планирование и
мониторинг
Проектирование
Анализ проекта
Строительство
Соответствие GxP-нормам
Ввод в эксплуатацию
и квалификация
Передача
Общепринятые практики
Стандарты и
процедуры
Практики по
документации
Управление
изменениями
Инновации и
непрерывное
совершенствование
Калибровка
Управление активами
Управление
поставщиками
Хранение оборудования
Операции и
техническое обслуживание
Документация
Руководства и записи
Рутинное обслуживание
Обслуживание при
поломках
Внутренний аудит
Управление отходами
Вывод оборудования из
эксплуатации
Наследование
оборудования и
мощностей
9.
Планирование проекта по качествуПлан проекта по качеству должен определять приемлемые стандарты качества, а также то, каким образом
будет достигаться и оцениваться необходимое качество (например, стадии анализа, одобрение, управление
качеством поставщиков).
План проекта по качеству должен охватывать:
Процесс контроля изменений и его реализацию
Применение стратегии управления рисками (как управлять рисками и когда проводить оценку)
Проверку, согласование и утверждение документов перед их выдачей на предварительно определённых
стадиях (концепция, одобрено к проектированию и одобрено к строительству)
Идентификацию, кодирование документов и контроль версий
Идентификацию оборудования и контрольно-измерительных приборов
Анализ проекта и анализ продвижения/прогресса действий
Распространение и контроль документации
10.
Сравнение несоответствийНесоответствия всех уровней
Только критические и существенные несоответствия
1
Конструкция и обслуживание помещений
Потенциальная контаминация (химическая,
физическая , микробиологическая)
2
Конструкция и обслуживание оборудования
Процедуры выпуска серии в реализацию
3
Производственная документация
Конструкция и обслуживание помещений
4
Документация системы качества
(элементы/процедуры)
Конструкция и обслуживание оборудования
5
Обучение персонала
Обеспечение стерильности
6
Валидация очистки
Валидация процесса
7
Валидация процесса
Валидация очистки
8
Обзор качества продукции
Расследование отклонений
9
Аудит поставщика и подрядчиков
Документация системы качества (элементы/процедуры)
10
Калибровка измерительного оборудования
Регуляторные требования (регистрационное досье)
11.
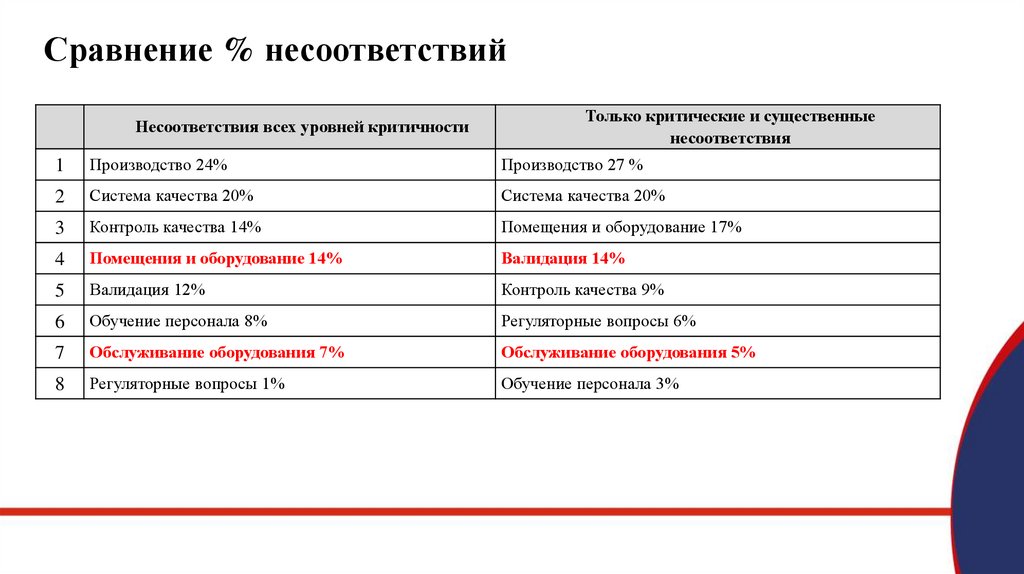
Сравнение % несоответствийНесоответствия всех уровней критичности
Только критические и существенные
несоответствия
1
Производство 24%
Производство 27 %
2
Система качества 20%
Система качества 20%
3
Контроль качества 14%
Помещения и оборудование 17%
4
Помещения и оборудование 14%
Валидация 14%
5
Валидация 12%
Контроль качества 9%
6
Обучение персонала 8%
Регуляторные вопросы 6%
7
Обслуживание оборудования 7%
Обслуживание оборудования 5%
8
Регуляторные вопросы 1%
Обучение персонала 3%
12.
НесоответствияРазличная идентификация объектов квалификации производственных участков и в технических и
технологических документах проекта.
Отсутствует идентификация HEPA-фильтров в «чистых» производственных помещениях, что затрудняет
обеспечение прослеживаемости профилактических операций с ними.
Отсутствуют фильтры на вытяжных устройствах в «чистых» производственных помещениях, что несет
риск контаминации внутренних поверхностей трубопроводов HVAC.
Герметичная установка решеток на вытяжках на пылящих стадиях производства свидетельствует об
отсутствии технической возможности проводить периодическую очистку пространства между
вентиляционной решеткой и фильтром.
Отсутствуют технические устройства для контроля аэродинамического сопротивления HEPA-фильтров,
через которые поступает воздух в «чистые» производственные помещения, что не позволяет
контролировать степень загрязненности фильтров,
Журнал эксплуатации оборудования не позволяет обеспечить прослеживаемость всех этапов жизненного
цикла технологического оборудования (FAT/SAT/IQ/OQ/PQ/PV, профилактических остановок, поломок,
ремонтов и др.)
13.
НесоответствияКонструкция, эксплуатация и обслуживание систем воздухоподготовки не обеспечивает возможность
снабжения производственных помещений воздухом надлежащей степени очистки. На участках
производства жидких и мягких лекарственных форм классификация помещений по классам чистоты не
предусмотрена. Очистка воздуха, поступающая в эти помещения, отсутствует.
Не производится постоянный контроль аэрозольных частиц в асептическом ядре стерильного
производства.
Помещение взвешивания сырья участка производства нестерильных лекарственных препаратов не
оборудовано системой очистки воздуха.
Поверхности помещения изготовлены из материалов, которые не позволяют проводить многократные
процедуры очистки и обработки дезинфицирующими средствами. Это представляет риск контаминации
продукции.
14.
БЛАГОДАРЮ ЗА ВНИМАНИЕ!!!Вопросы?









 medicine
medicine








