Similar presentations:
Химическое равновесие. Необратимые и обратимые реакции
1. Химическое равновесие
2. Необратимые и обратимые реакции
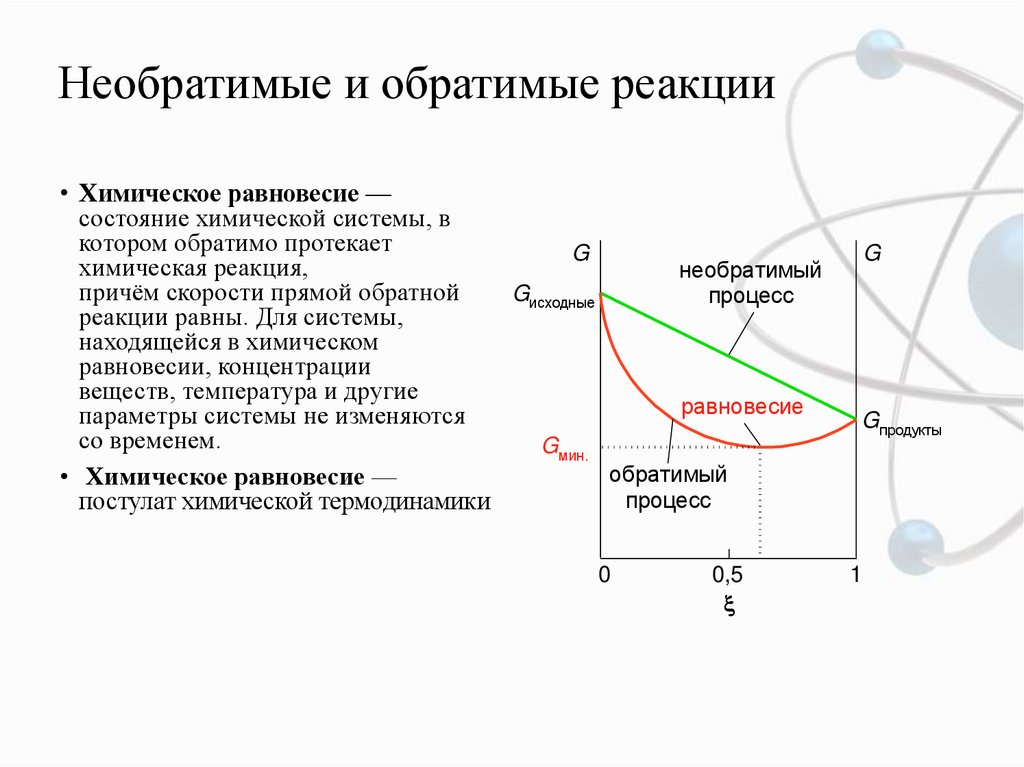
• Химическое равновесие —состояние химической системы, в
котором обратимо протекает
G
химическая реакция,
необратимый
причём скорости прямой обратной
Gисходные
процесс
реакции равны. Для системы,
находящейся в химическом
равновесии, концентрации
веществ, температура и другие
равновесие
параметры системы не изменяются
со временем.
Gмин.
обратимый
• Химическое равновесие —
процесс
постулат химической термодинамики
0
0,5
G
Gпродукты
1
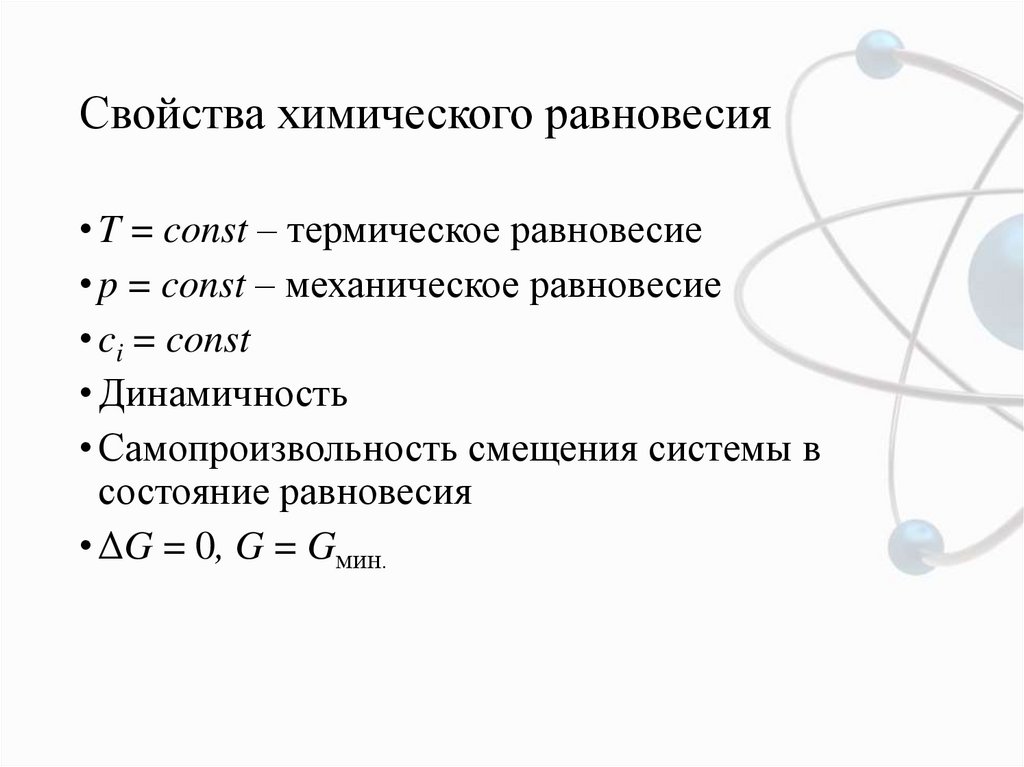
3. Свойства химического равновесия
• T = const – термическое равновесие• p = const – механическое равновесие
• ci = const
• Динамичность
• Самопроизвольность смещения системы в
состояние равновесия
• ΔG = 0, G = Gмин.
4. Характеристики равновесия
aA + bBcC + dD
v k cAa cBb скорость прямой реакции
c d
v k cC cD скорость обратной реакции
При равновесии v v или
a b c d
k [A] [B] k [C] [D]
или
k [C]c [D]d
константа равновесия
K
b
a
k [A ] [B]
[A ], [B], [C], [D] равновесные концентрации веществ
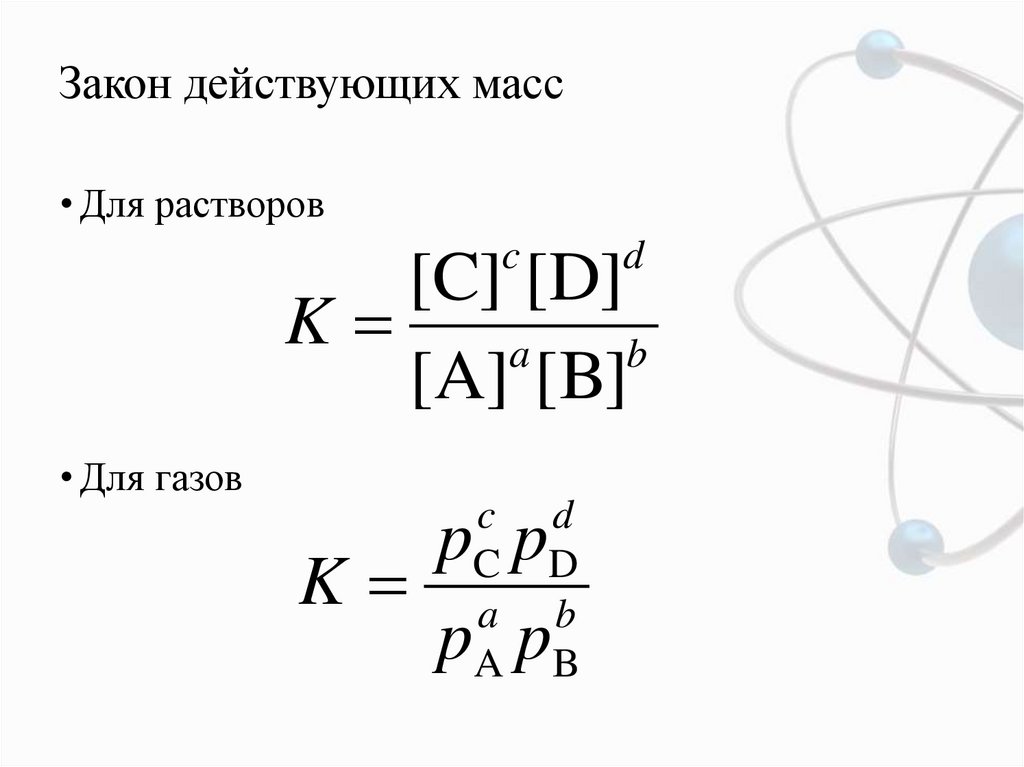
5. Закон действующих масс
• Для растворовc
d
[C] [D]
K
a
b
[A] [B]
• Для газов
c
C
a
A
d
D
b
B
p p
K
p p
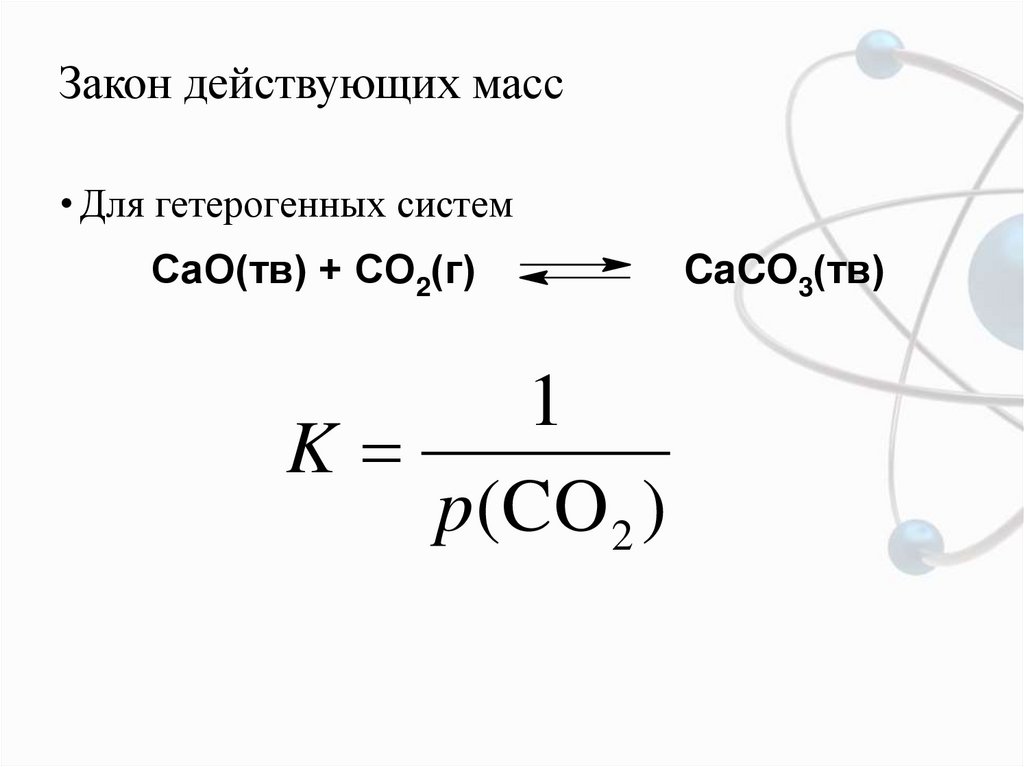
6. Закон действующих масс
• Для гетерогенных системCaO(тв) + CO2(г)
1
K
p (CO 2 )
CaCO3(тв)
7. Факторы, влияющие на константу и положение равновесия
• Принцип Ле Шателье — Брауна (1884 г.) —если на систему, находящуюся в устойчивом
равновесии, воздействовать извне, изменяя
какое-либо из условий равновесия
(температура, давление, концентрация и др.), то в
системе усиливаются процессы, направленные
на компенсацию внешнего воздействия.
8. Анри Луи Ле Шателье (Henri Louis Le Chatelier) (1850 — 1936)
Анри Луи Ле Шателье (Henri Louis LeChatelier) (1850 — 1936)
В 1884 г. Ле Шателье
сформулировал принцип
динамического равновесия
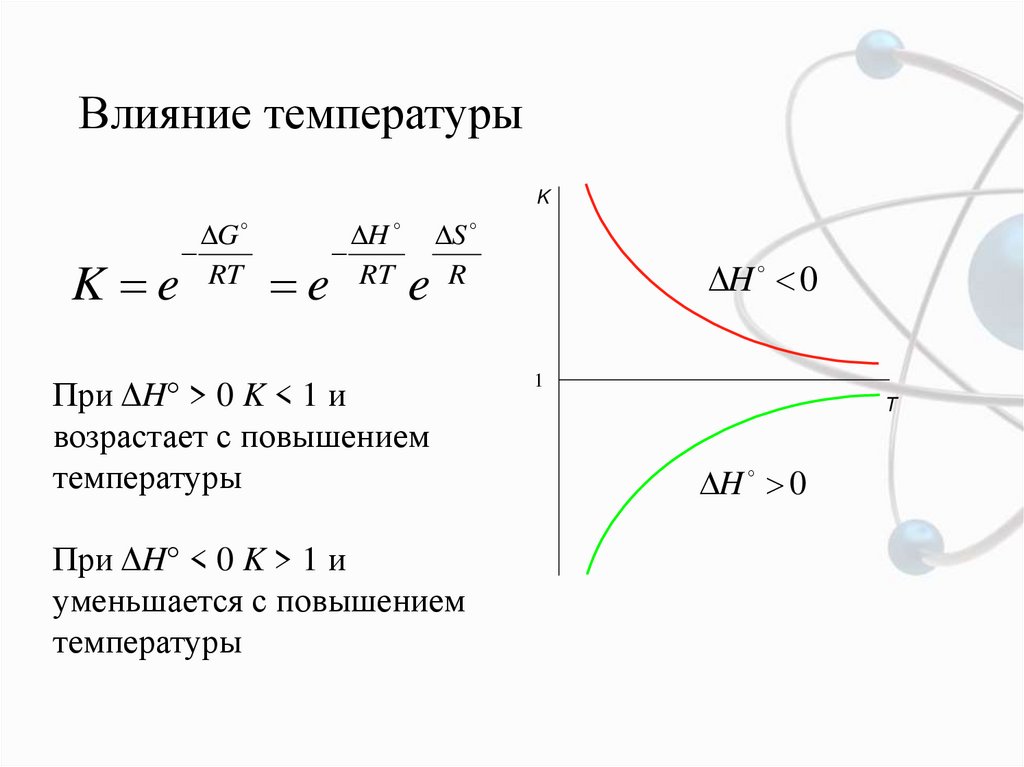
9. Влияние температуры
KK e
G
RT
e
H
RT
e
S
R
При ΔH° > 0 K < 1 и
возрастает с повышением
температуры
При ΔH° < 0 K > 1 и
уменьшается с повышением
температуры
H 0
1
T
H 0
10. Влияние давления
• Давление на K не влияет, но может влиять наположение равновесия
c
C
a
A
d
D
b
B
c d
C D
a b
A B
p p
x x
K
p0
p p
x x
xA, xB, xC, xD – мольные доли веществ;
p0 = pA + pB + pC + pD – общее давление в системе;
Δν = c + d – a - b
1. Δν < 0;
2. Δν > 0;
3. Δν = 0
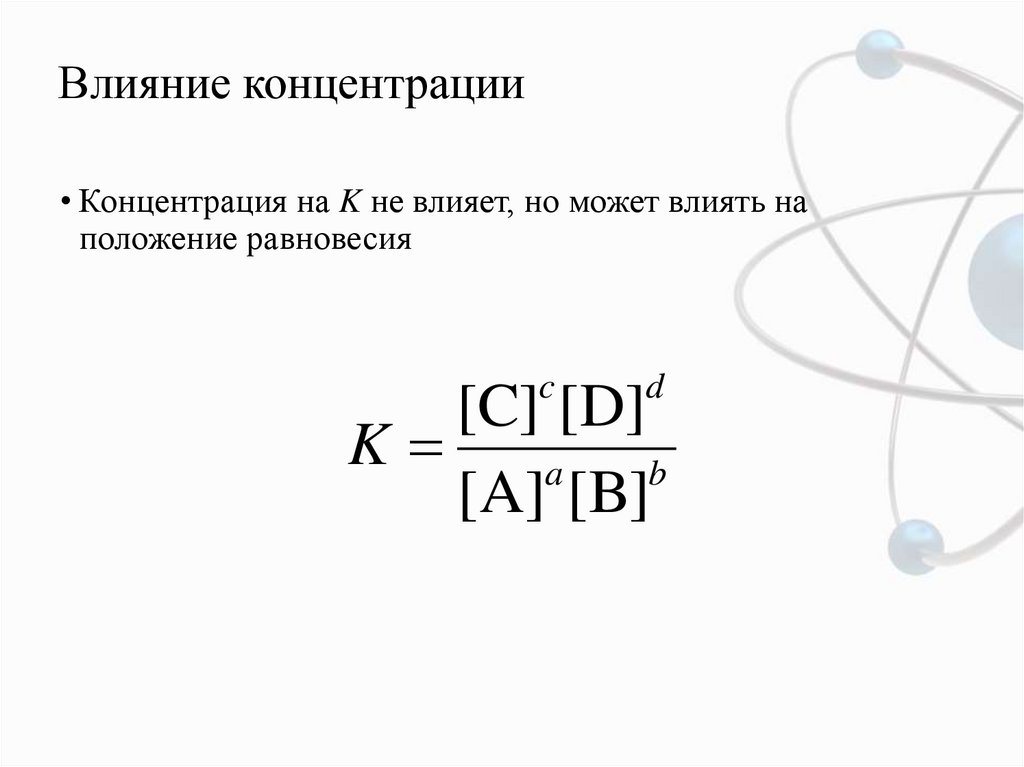
11. Влияние концентрации
• Концентрация на K не влияет, но может влиять наположение равновесия
c
d
[C] [D]
K
a
b
[A] [B]
12. Влияние катализатора
•Катализатор на K и положение равновесияне влияет, так как ускоряет и прямую и
обратную реакции






 chemistry
chemistry








