Similar presentations:
Скорость химических реакций. Химическое равновесие
1. Скорость химических реакций. Химическое равновесие
2. Основные понятия химической кинетики
Химическая кинетика изучает скорости и механизмы химическихпроцессов, а также факторы, влияющие на них
Скорость реакции равна числу элементарных актов взаимодействия,
происходящих за единицу времени в единице реакционного
пространства
Элементарный акт - каждое непосредственное взаимодействие
частиц, приводящее к изменению их химического строения
Элементарная стадия химического превращения - сумма всех
однотипных элементарных актов
Механизм химической реакции - совокупность элементарных стадий,
из которых складывается данная реакция
3. Типы химических реакций
• I.
-
Элементарные реакции
(одностадийные, простые)
протекают в одну стадию:
2NO + O2 → 2NO2
Уравнение таких реакций
отражает механизм их
протекания.
В природе насчитывается 4-6
элементарных реакций.
Сложные реакции протекают в
несколько стадий:
4Fe +3O2 = 2Fe2O3
Fe → Fe2+ =2eO2 +2H2O+4e- → 4OHFe2+ +2OH- → Fe(OH)2
4Fe(OH)2+O2+2H2O →4Fe(OH)3
2Fe(OH)3 →Fe2O3+3H2O
Уравнение таких реакций
представляет собой
суммарный результат
нескольких элементарных
процессов и не отражает их
реальных механизм.
Большинство химических процессов
в природе - сложные реакции
4. II
Гомогенные реакции – протекают вобъеме одной фазы:
NaOH (раствор)+ НCl (раствор) =
= NaCl (раствор)+H2O
Гетерогенные реакции –
протекают на границе раздела
фаз:
СaH2 (тв) +2H2O(ж) →
2H2(г) + Ca(OH)2(раствор)
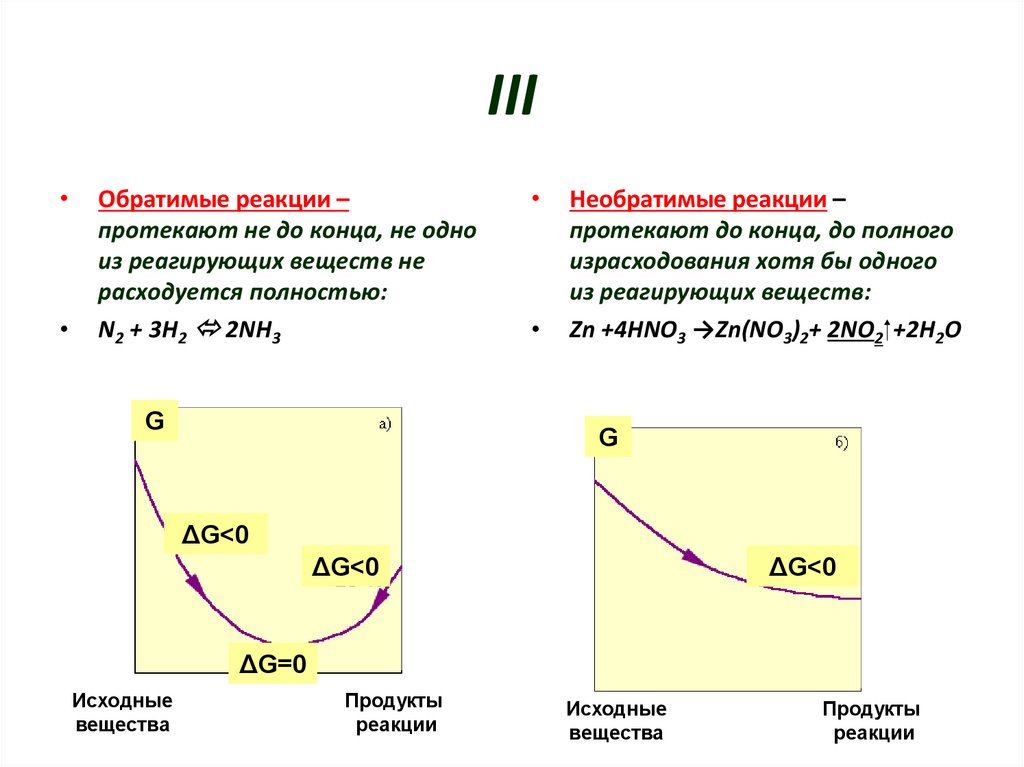
5. III
Обратимые реакции –
протекают не до конца, не одно
из реагирующих веществ не
расходуется полностью:
N2 + 3H2 2NH3
G
Необратимые реакции –
протекают до конца, до полного
израсходования хотя бы одного
из реагирующих веществ:
Zn +4HNO3 →Zn(NO3)2+ 2NO2 +2H2O
G
ΔG<0
ΔG<0
ΔG<0
ΔG=0
Исходные
вещества
Продукты
реакции
Исходные
вещества
Продукты
реакции
6. скорость химической реакции
Подскоростью
гомогенной
химической реакции ( ) понимают vгомоген
изменение количества вещества (∆n) за
единицу времени ( ) в единице объема
системы (V)
Скоростью
химической
реакции
называют
изменение
концентрации
реагирующих веществ в единицу времени.
Под
скоростью
гетерогенной
химической реакции ( ) понимают
изменение количества вещества (∆n)
за единицу времени ( ) на единице
поверхности раздела фаз (S)
n
V
с
v
n
vгетероген
S
7.
8. Зависимость скорости от концентрации Закон действующих масс (П.Вааге, К.М.Гульдберг, 1864 г.)
Закон: Скорость химической реакции прямопропорциональна произведению концентраций реагирующих
веществ в степенях их стехиометрических коэффициентов.
aA + bB cC +dD
V=k[A]a[B]b
- кинетическое уравнение
V – скорость химической реакции,
k – константа скорости химической реакции
[A], [B] – молярные концентрации веществ А и В
соответственно
В приведенном виде закон действующих масс справедлив лишь
для гомогенных процессов
9. константа скорости реакции
k – коэффициент пропорциональности,константой скорости реакции
называемый
физический смысл
Константа скорости численно равна скорости реакции, при
концентрации реагирующих веществ равной единице
Константа скорости реакции зависит от природы
реагирующих веществ, температуры и присутствия
катализаторов, но не зависит от концентрации веществ
10. кинетические уравнения
Кинетическое уравнение – это математическоевыражение,
связывающие
скорость
реакции
с
концентрацией реагирующих веществ.
vпр k1 A B
a
b
vобр k 2 C D
c
d
Для гомогенной реакции: 3H2(г) + N2(г) = 2NH3(г)
=k [H2]3 [N2]
Для гетерогенной реакции: С(к) + O2(г) = СО2(г)
=k [O2]
11. Зависимость скорости от температуры Правило Вант-Гоффа
При повышении температуры на каждые 100 скоростьбольшинства реакций увеличивается в 2 4 раза:
T2 T1 (T2 -T1)/10
1 и 2 - скорость реакции при температурах
Т1 и Т2 (Т2 > Т1)
- температурный коэффициент
скорости, равный 2 4
Например, при повышении температуры с 20 до 400С
скорость реакции (γ = 2) увеличивается в 4 раза:
Т2 4010 20 2
2
2 4
Т1
12. катализатор
Вещества, не расходующиеся в результате протеканияреакции, но влияющие на ее скорость называются
катализаторами.
Явление изменения скорости реакции под действием
катализаторов называют катализом.
1 стадия:
2 стадия:
Механизм действия катализатора:
А + К → А … К → АК
акт. комп.
АК + В → В … АК → АВ + К
акт. комп.
В ходе реакции катализатор не расходуется
Катализатор изменяет путь реакции и тем самым влияет
на энергию активации
13.
14. Химическое равновесие
ХИМИЧЕСКОЕ РАВНОВЕСИЕ15. обратимые и необратимые реакции
Обратимые реакции - это реакции, которые при одних и техже условиях протекают в прямом и обратном направлении.
Необратимыми реакциями называются реакции, которые
протекают только в одном направлении, т.е. продукты этих
реакций не взаимодействуют друг с другом с образованием
исходных веществ.
16. химическое равновесие
Состояние обратимой реакции, при котором скоростьпрямой реакции равна скорости обратной реакции,
называется химическим равновесием.
vпр kпр A B
a
b
vобр kобр C D
c
d
kпр A B kобр C D
a
b
c
d
17.
18. константа химического равновесия
Константа химического равновесия - это отношениепроизведения равновесных концентраций продуктов
реакции к произведению равновесных концентраций
исходных веществ, при чем все вещества находятся в
степенях численно равных их стехиометрическим
коэффициентам.
c
d
C
D
kпр
p
p
Kс
a
b
kобр
A p B p
Для гомогенных реакций:
2SO2(г)+ O2(г) = 2SO3(г)
Для гетерогенных реакций:
ZnO(тв)+H2(г)=Zn(тв)+H2O(г)
2
SO3
Kс
SO2 2 O2
Kс
H 2O
H 2
19.
Анри ЛуиЛе Шателье (1884)
20. факторы, влияющие на смещение химического равновесия
1. Концентрация. При увеличении концентрацииисходных веществ химическое равновесие смещается
вправо. При увеличении концентрации продуктов – влево.
2. Давление. При увеличении давления равновесие
смещается в сторону уменьшения объёма газов. При
понижении давления – в сторону увеличения объёма
газов
3. Температура. Повышение температуры приводит к
смещению
химического
равновесия
в
сторону
эндотермической реакции. Понижение температуры – в
сторону экзотемической реакции



















 chemistry
chemistry








