Similar presentations:
Химическое равновесие
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 4
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Основные понятия
Закон действующих масс
Влияние температуры на константу химического
равновесия
Влияние различных факторов на состояние
химического равновесия. Принцип Ле Шателье
Влияние концентраций (парциальных давлений)
компонентов системы
Влияние давления
Влияние температуры
Влияние катализатора
Выбор оптимального технологического режима.
Кажущееся равновесие
Модуль I. Лекция 4. Химическое равновесие
3.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАНеобратимые и обратимые реакции
Необратимые реакции – реакции, проходящие только в
одном направлении до конца, т.е. до полного
превращения одного или всех исходных веществ в
продукты реакции
2KClO3 = 2KCl + 3O2
Обратимые реакции – реакции, идущие в
противоположных направлениях, не проходят до конца,
исходные вещества полностью не расходуются
H2 + I2
Модуль I. Лекция 4. Химическое равновесие
2HI
4. Химическое равновесие - состояние системы, характеризующееся равными скоростями прямой и обратной реакций
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАХимическое равновесие состояние системы, характеризующееся равными
скоростями прямой и обратной реакций
Система H2 + I2
2HI при Т = const
пр k прCH CI
2
2
0:
0 равн :
равн :
2
k
C
обр
обр HI
обр 0
СH , CI
пр
обр
СHI
пр обр 0
СHI = 0
2
k пр [H2 ][I2 ] = k обр [HI]
υ
υпр= υобр
2
2
k пр
k обр
τравн
[HI]2
const K
[H2 ][I2 ]
H2 , I2 , HI - равновесные концентрации, моль/л
Модуль I. Лекция 4. Химическое равновесие
τ
5. Закон действующих масс
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗакон действующих масс
В закрытой системе в состоянии равновесия при постоянных
температуре и давлении отношение произведений концентраций
продуктов реакции и исходных веществ в степенях, равных
стехиометрическим коэффициентам, является
постоянной
[C]c [D
]d
величиной
KC =
a
b = const
[ A ] [B]
В закрытой системе для обратимой реакции (T, p = const)
Kp =
d
рсС рD
рaA
рBb
aA + bB
= const
KC =
cC + dD
[C]c [D]d
a
b
[ A ] [B]
= const
Для реакции с участием газообразных веществ
Kp
р сС рDd
р aA
рBb
const
K p K c (RT ) n ,
n (c d) (a b).
pA, pB, pC, pD – равновесные парциальные давления
Модуль I. Лекция 4. Химическое равновесие
6. Константы равновесий в гомогенных и гетерогенных системах
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКонстанты равновесий
в гомогенных и гетерогенных системах
Гомогенная система
N2(г) + 3H2(г)
Kc
[NH3 ]
2
[N2 ][H2 ]3
Kp
2
pNH
3
pN2 pH3 2
2NH3(г)
K p K c (RT) 2
Kc
R2T 2
Гетерогенная система
MgCO3(к)
K c = [CO2 ]
MgO(к) + CO2(г)
K p = pCO2
концентрации твердых веществ считают неизменными и в
выражение константы равновесия не включают
Модуль I. Лекция 4. Химическое равновесие
7. Константа равновесия - мера глубины прохождения реакции
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКонстанта равновесия мера глубины прохождения реакции
Константа равновесия зависит от природы веществ, образующих
систему и от температуры, но не зависит от концентрации веществ
Равновесие
смещено в
сторону
обратной
реакции
K 1
Модуль I. Лекция 4. Химическое равновесие
Отсутствие
взаимодействия
K →0
Равновесие
смещено в
сторону
прямой
реакции
K 1
8. Расчет равновесных концентраций реагентов по известным исходным концентрациям
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет равновесных концентраций
реагентов по известным исходным концентрациям
CO(г) + H2O(г)
КС = 1 при Т=1023 К,
Исходные концентрации веществ
ССО CH2O 3 моль / л
CO2(г) + H2(г)
[CO2 ] ? [H2 ] ?
[CO] ?
[H2O] ?
В начальный момент времени CCO2 = CH2 = 0.
Обозначаем х (моль/л) увеличение концентрации CO2 в ходе реакции
увеличение концентрации Н2
[CO2 ] [H2 ] 0 x x
уменьшение концентрации СО
=х
[CO] [H2O] 3 x
уменьшение концентрации Н2О
x x
[CO2 ][H2 ]
2
2
1
Kc
x 1,5
9
6
x
+
x
=
x
(3 x )(3 x )
[CO][H2O]
[CO 2 ] [H2 ] 1,5 моль / л
Модуль I. Лекция 4. Химическое равновесие
[CO] [H2O] 3 1,5 1,5 моль / л
9. Определение возможного направления реакции при известном значении константы равновесия
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОпределение возможного направления реакции
при известном значении константы равновесия
2SO2(г) + O2(г)
При Т = 950 К значение КС = 83,88
Исходные концентрации
CSO2 0,5 моль/л
CO2 0,4 моль/л
2SO3(г)
Определить направление
возможной реакции
при данном составе системы
CSO3 1 моль/л
В исходной газовой смеси
2
C SO
3
2
C SO
C
2 O2
12
0,5
2
2
C SO
3
2
C SO
C
2 O2
0,4
В состоянии равновесия
10
Kc
[SO3 ]2
2
[SO 2 ] [O 2 ]
83,88 10
В ходе достижения равновесия
Kc
C SO3
C SO2
CO2
при данном составе системы возможна прямая реакция
Модуль I. Лекция 4. Химическое равновесие
10. Влияние температуры на константу химического равновесия
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние температуры на константу
химического равновесия
G0T -RT ln K
K e
K e
HoT - T SoT
RT
G0T
RT
HoT SoT
e RT R
G0T H0T - T S0T
HoT SoT
e RT e R .
H0T S0T
ln K
RT
R
зависимость lnK = f(T) близка к линейной
При увеличении температуры
для экзотермических реакций
К
Модуль I. Лекция 4. Химическое равновесие
для эндотермических реакций
К
11. Расчет Н0 и ∆S0 реакции 4NO(г) 2N2O(г) + O2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет Н0 и ∆S0 реакции
4NO(г)
2N2O(г) + O2(г)
Вещество
NO(г)
N2O(г)
H0обр, кДж/моль
90,4
81,6
S0 , Дж /(моль К )
210,6
Н0 < 0
220,0
O2(г)
0
205,0
реакция экзотермическая
Δ Н0 nпродΔ H0обр.прод nисх Δ Н0обр.исх
0
0
0
2 НN
Н
4
Н
O2
NO 2 82,0 4 90,4 197,6 кДж
2O
ΔS0 < 0
в ходе реакции система переходит в более
упорядоченное состояние
0
0
0
0
0
Δ S0 nпродSпрод
nисх Sисх
2SN
S
4S
O2
NO
2О
2 220,0 205,0 4 210,6 197,4 Дж/К 197,4 10 3 кДж/K
Модуль I. Лекция 4. Химическое равновесие
12. Расчет и K298 реакции 4NO(г) 2N2O(г) + O2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет G0298 и K298 реакции
4NO(г)
2N2O(г) + O2(г)
Стандартная энергия Гиббса реакции
0 T S0 197,6 298 ( 197,4 10 3 ) 138,8 кДж
Δ G0
Δ
H
298
G0298 0 – при Т = 298 К возможна самопроизвольная
прямая реакция
Константа равновесия
lgK 298
Δ G0298
138,8
24,4
3
2,3RT
2,3 8,31 10 298
K298 ≈ 1024
Модуль I. Лекция 4. Химическое равновесие
13. Расчет и K1500 реакции 4NO(г) 2N2O(г) + O2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА0
Расчет G1500
и K1500 реакции
4NO(г)
2N2O(г) + O2(г)
Энергия Гиббса реакции при температуре 1500 К
0
ΔG1500
Δ H0 T S0 197,6 1500 ( 197,4 10 3 ) 98,5 кДж
0
>> 0 – при Т = 1500 К возможна самопроизвольная
Δ G1500
обратная реакция
Константа равновесия при температуре 1500 К
lgK 1500
0
Δ G1500
98,5
3,44 3
3
2,3RT
2,3 8,31 10 1500
K1500 = 10-3
Модуль I. Лекция 4. Химическое равновесие
14. График зависимости для реакции 4NO(г) 2N2O(г) + O2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА0
GT
f (T )
График зависимости
для реакции 4NO(г)
2N2O(г) + O2(г)
G0T ,
Температура, при которой
кДж
G0T 0 (К = 1)
200
Δ G0Т Δ H0 T S0 0
100
Т, К
0
500
1000 1500
2000
-100
-200
Модуль I. Лекция 4. Химическое равновесие
Т
Δ H0
ΔS
0
197,6
197,4 10
3
1000 К
15. Температурная зависимость константы равновесия реакции 4NO(г) 2N2O(г) + O2(г)
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАТемпературная зависимость константы
равновесия реакции 4NO(г)
2N2O(г) + O2(г)
ΔG0Т
Т, K
, кДж/моль
К
298
1000
1500
-138,8
0
98,5
1024
0
10-3
298 К
К >> 1
в системе преобладают продукты реакции
1500 К
К << 1
в системе преобладают исходные
вещества, реакция практически не идет
1000 К
равновероятны оба направления реакции
При повышении температуры равновесие смещается в сторону
обратной (эндотермической) реакции
Модуль I. Лекция 4. Химическое равновесие
16. Влияние различных факторов на состояние химического равновесия. Принцип Ле Шателье
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние различных факторов
на состояние химического равновесия.
Принцип Ле Шателье
Если на систему, находящуюся в равновесии,
оказать внешнее воздействие, равновесие сместится
в направлении, ослабляющем это воздействие
смещение равновесия в
сторону прямой реакции
означает увеличение
равновесных
концентраций продуктов
реакции
Модуль I. Лекция 4. Химическое равновесие
смещение равновесия в
сторону обратной
реакции означает
увеличение равновесных
концентраций
исходных веществ
17.
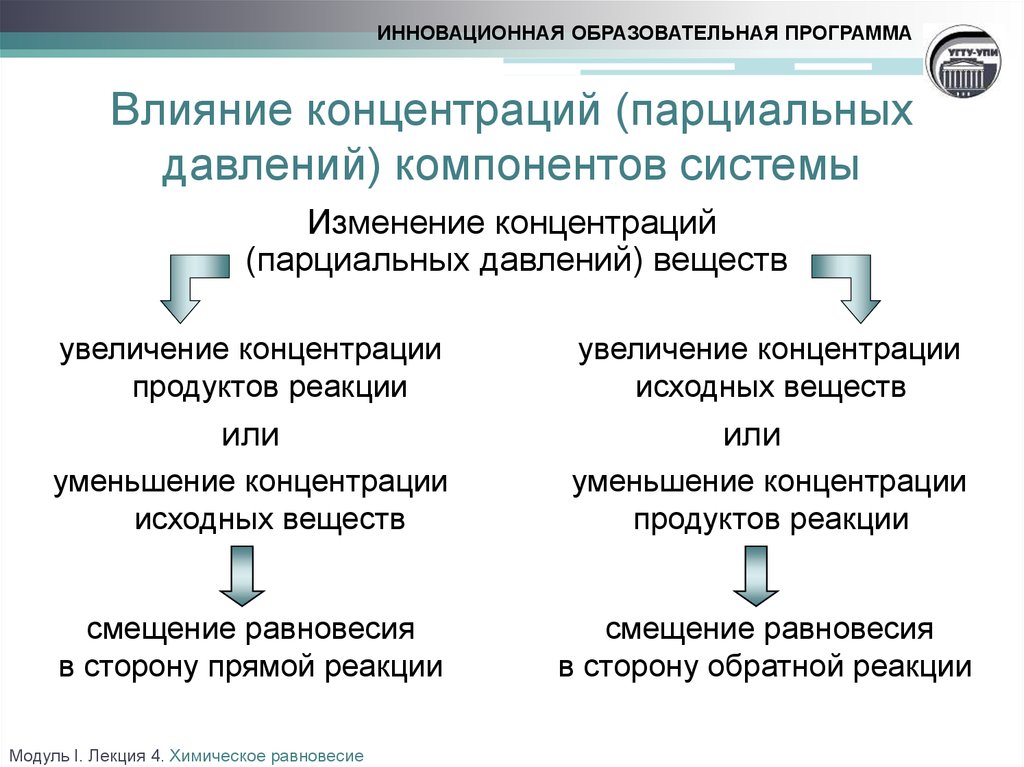
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние концентраций (парциальных
давлений) компонентов системы
Изменение концентраций
(парциальных давлений) веществ
увеличение концентрации
продуктов реакции
или
увеличение концентрации
исходных веществ
или
уменьшение концентрации
исходных веществ
уменьшение концентрации
продуктов реакции
смещение равновесия
в сторону прямой реакции
смещение равновесия
в сторону обратной реакции
Модуль I. Лекция 4. Химическое равновесие
18.
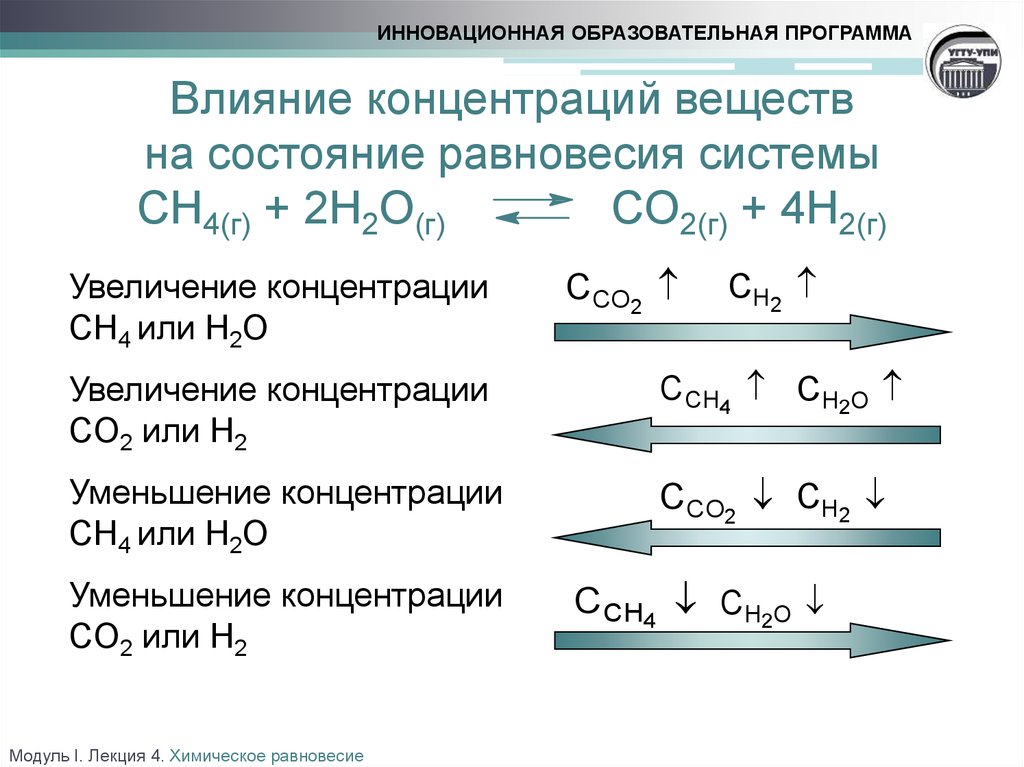
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние концентраций веществ
на состояние равновесия системы
CH4(г) + 2H2O(г)
CO2(г) + 4H2(г)
Увеличение концентрации
CH4 или H2O
CCO2
CH2
Увеличение концентрации
CO2 или H2
C CH4 CH2O
Уменьшение концентрации
CH4 или H2O
CCO2 CH2
Уменьшение концентрации
CO2 или H2
Модуль I. Лекция 4. Химическое равновесие
C CH4 CH2O
19. Влияние общего давления в системе
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние общего давления в системе
Давление оказывает влияние на равновесие реакций,
сопровождающихся изменением количеств газообразных
веществ
увеличение общего
давления
смещение равновесия в
сторону уменьшения
количества газообразных
веществ
p :
CH4(г) + 2H2O(г)
3 моль
Модуль I. Лекция 4. Химическое равновесие
понижение общего
давления
смещение равновесия в
сторону увеличения
количества газообразных
веществ
CO2(г ) + 4H2(г)
5 моль
p :
20. Влияние температуры на состояние равновесия
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВлияние температуры
на состояние равновесия
Нагревание
смещение равновесия в
сторону эндотермических
реакций
CH4(г) + 2H2O(г)
Охлаждение
смещение равновесия в
сторону экзотермических
реакций
CO2(г) + 4H2(г), H>0
прямая реакция эндотермическая
обратная реакция экзотермическая
нагревание
охлаждение
Модуль I. Лекция 4. Химическое равновесие
21. Выбор оптимального режима синтеза аммиака
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВыбор оптимального режима
синтеза аммиака
3Н2(г) + N2(г)
Температура,
0С
2NH3(г), H<0
Объемное содержание аммиака (%)
при давлении, МПа
400
450
500
550
600
р = 30-80 МПа
Модуль I. Лекция 4. Химическое равновесие
0,1
10
30
0,40
0,21
0,12
0,07
0,05
25,37
16,10
14,87
6,82
4,53
48,18
35,87
25,80
18,23
12,84
Т = 450-5500С
катализатор – Fe(к)
22. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Все самопроизвольные реакции можно разделить на необратимые
(идущие в одном направлении) и обратимые (идущие в
противоположных направлениях)
В ходе обратимых реакций наступает состояние химического
равновесия, характеризующееся равными скоростями прямой и
обратной реакций
Количественной характеристикой химического равновесия
является константа равновесия (КС или КР), величина которой
зависит от природы реагирующих веществ и от температуры
Константа равновесия экзотермических реакций уменьшается с
повышением температуры; эндотермических - увеличивается.
Химическое равновесие при изменении внешних условий (р, Т, С)
может смещаться. Согласно принципу Ле Шателье при внешнем
воздействии на систему равновесие смещается в направлении,
ослабляющем это воздействие
Модуль I. Лекция 4. Химическое равновесие
23. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Гаршин А.П. Неорганическая химия в схемах, рисунках,
таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш.
шк., 1994
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.:
Академия, 2004
Модуль I. Лекция 4. Химическое равновесие





















 chemistry
chemistry








