Similar presentations:
Коррозия металла
1. КОРРОЗИЯ МЕТАЛЛА
2. ПЛАН УРОКА
1.2.
3.
4.
5.
6.
Понятие коррозии
Значение коррозии
Виды коррозии
Условия, способствующие
коррозии
Химизм процесса коррозии
Способы защиты от коррозии
3. ЭТАПЫ УРОКА
практическийэкспериментальный
информационный
исторический
4. ИСТОРИЧЕСКИЙ ЭТАП
5.
6. ЭТАПЫ УРОКА
практическийэкспериментальный
информационный
исторический
7. ИНФОРМАЦИОННЫЙ ЭТАП
КОРРОЗИЯ – самопроизвольное разрушениеметаллов и сплавов в результате химического
или электрохимического взаимодействия их с
окружающей средой.
Это окислительно-восстановительная реакция,
при которой атомы металла превращаются в
ионы. Чем активнее металл, тем он больше
подвержен коррозии.
В роли окислителя выступают атмосферный
кислород и катионы водорода.
8. ЗНАЧЕНИЕ КОРРОЗИИ
1. Вызывает серьезные экологическиепоследствия: утечка нефти, газа, других
химических продуктов.
2. Недопустима во многих отраслях
промышленности: авиационной,
химического, нефтяного и атомного
машиностроения.
3. Отрицательно влияет на жизнь и
здоровье людей.
9. ФАКТОРЫ, ВЫЗЫВАЮЩИЕ КОРРОЗИЮ
1.2.
3.
4.
Кислород и влага атмосферы
Углекислый и сернистый газы,
содержащиеся в атмосфере
Морская вода
Грунтовые воды
10.
Коррозияметаллов
По виду
коррозионной среды
По
процессам
По
характеру
разрушения
газовая
атмосферная
химическая
равномерная
почвенная
жидкостная
электрохими
ческая
неравномерная
(избирательная
(кислотная,
щелочная)
солевая,
или местная)
11. ВИДЫ КОРРОЗИИ
ХИМИЧЕСКАЯ – это разрушениеметаллов и сплавов в результате их
химического взаимодействия с
веществами окружающей среды.
Защитная оксидная пленка на
поверхности алюминия
Рыхлая пленка на поверхности железа,
приводящая к разрушению металла
12. ХИМИЧЕСКАЯ КОРРОЗИЯ
13. ВИДЫ КОРРОЗИИ
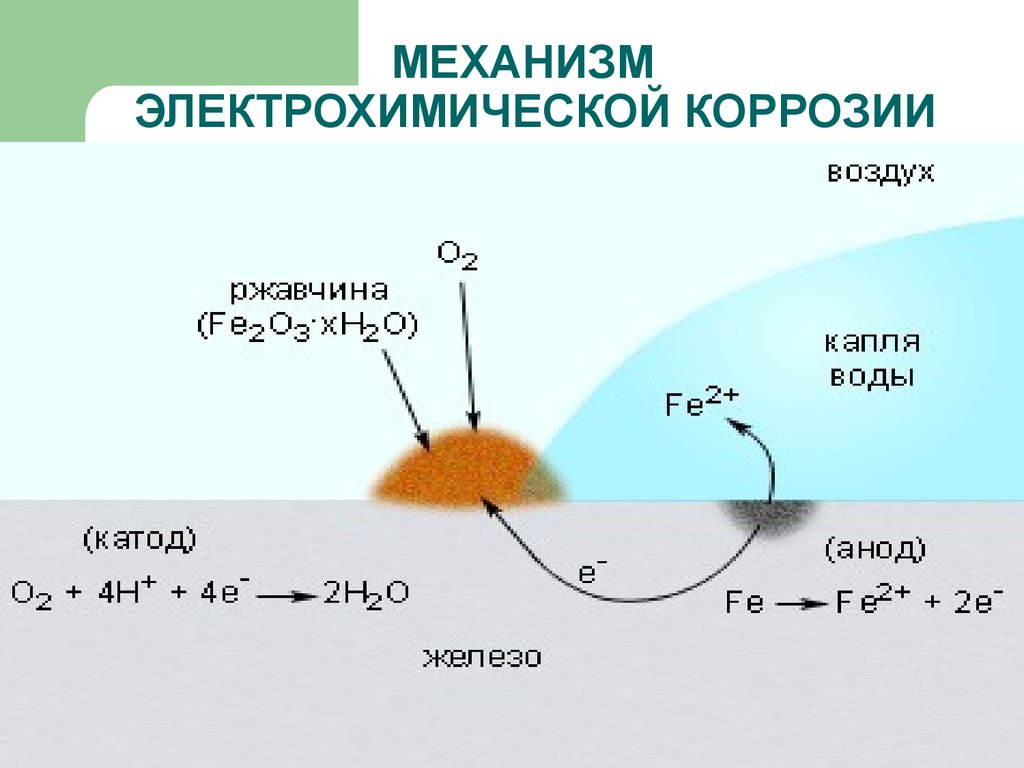
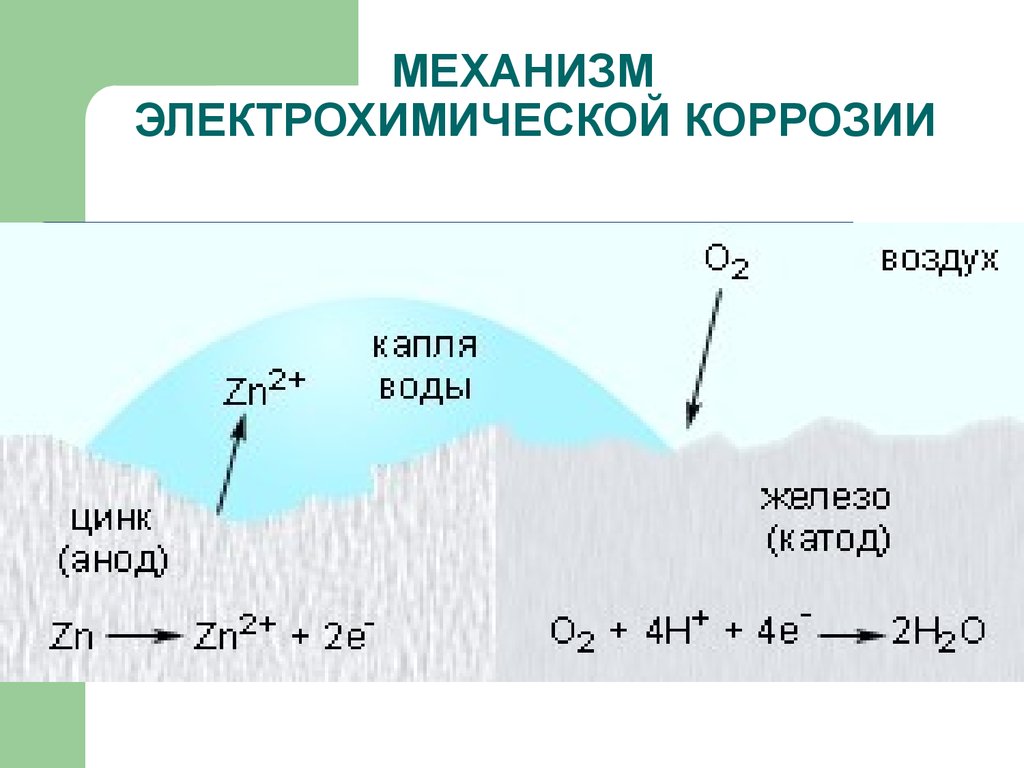
ЭЛЕКТРОХИМИЧЕСКАЯ – это разрушениеметаллов, которое сопровождается
возникновением электрического тока в
воде или среде другого электролита.
Химические процессы – это окисление
корродируемого металла, отдача
электронов.
Электрические процессы – перенос
электронов с одного участка изделия к
другому.
14. УСЛОВИЯ, СПОСОБСТВУЮЩИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
1.2.
3.
4.
5.
6.
Положение металла в ряду активности металлов:
чем они дальше расположены друг от друга, тем
быстрее происходит коррозия.
Чистота металла: примеси ускоряют коррозию.
Неровности поверхности металла, трещины.
Грунтовые воды, морская вода, среда
электролита.
Повышение температуры.
Действие микроорганизмов (грибы, бактерии и
лишайники воздействуют на металл с высокой
коррозионной стойкостью).
15. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
16. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
17. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
18.
1 группа – щелочные металлы –наименьшая коррозийная
стойкость.(побочная подгруппа
– весьма стойкие металлы)
2 группа – главная подгруппа –
малоустойчивы, побочная – более
устойчивы( в присутствии
кислорода образуют прочные
пленки оксидов, предохраняющие
от дальнейшего разрушения)
19.
3 группа – Алюминий – образуетсяпрочная оксидная пленка ( но она
разрушается в растворах кислот и
щелочей) В концентрированной
азотной и серной кислотах
алюминий пассивируется.
4 группа – Олово и свинец –
стойкие к коррозии металлы,
благодаря прочным оксидным
пленкам.
20.
5,6,7,8 группы – металлы побочныхподгрупп обладают высокой
способностью к пассивации, а
следовательно, большой
коррозионной стойкостью.
Осмий, Иридий, Платина –
самые стойкие к коррозии
Железо пассивируется
концентрированной серной и
азотной
21. СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ
1.2.
3.
4.
5.
Нанесение защитных покрытий
(лаки, краски, эмали);
Покрытие другим металлом (позолота,
серебрение, хромирование, цинкование);
Создание и использование
антикоррозионных сплавов
Введение в среду ингибиторов,
снижающих агрессивность среды;
Протекторная защита
22. ЭТАПЫ УРОКА
практическийэкспериментальный
информационный
исторический
23. ЭТАПЫ УРОКА
практическийэкспериментальный
информационный
исторический





















 chemistry
chemistry








