Similar presentations:
Статистическое описание равновесных состояний микрочастиц
1. Лекция № 15
СТАТИСТИЧЕСКОЕОПИСАНИЕ
РАВНОВЕСНЫХ
СОСТОЯНИЙ
Лекции Веретимус Н.К. и Веретимус Д.К.
2. Литература:
•Глаголев К.В., Морозов А.Н. Физическаятермодинамика: Учеб. пособие. – М.: Изд-во
МГТУ им. Н.Э.Баумана, 2004. – 368 с./Под
ред. Л.К.Мартинсона, А.Н.Морозова.
•Иродов И.Е. Физика макросистем. Основные
законы. – М.: Лаборатория Базовых Знаний,
2001
3.
Статистическийметод
описания
состояний
макроскопических
тел
(термодинамических систем) основывается
на
определении
статистических
закономерностей случайного (теплового)
движения отдельных микрочастиц тела.
Координаты и скорости отдельных,
взаимодействующих
между
собой
микрочастиц
(атомов
и
молекул),
изменяются
случайным
образом,
и
предсказать их значение в следующий момент
времени невозможно.
4.
Однакосредние
значения
координат,
скоростей, а также средние значения любых
функций
переменных,
характеризующих
движение (например, квадрата или модуля
скорости
поступательного
движения
молекулы) изменяются закономерно.
Параметры
термодинамической
системы (температура, давление и др.)
определяют,
как
средние
значения
соответствующих
функций
переменных,
описывающих движение микрочастиц.
5.
Нахождениесреднего
квадрата
случайных
изменений
этих
функций
позволяет
описывать
равновесные
флуктуации параметров системы.
Статистическая физика занимается
разработкой методов определения свойств
макроскопических тел через переменные,
описывающие движение и взаимодействие
микрочастиц этих тел.
6. Функция распределения
Пустьсостояние
некоторой
макроскопической
системы
определяет
параметр x, принимающий K дискретных
значений: x1, x2 , x3 , , xK .
При проведении над системой N
измерений значение x1 наблюдалось при N1
измерениях, значение x2 – при N2 и т.д. Тогда
K
N Ni
i 1
7.
Вероятность измерения значения xiNi
P xi lim
,
N N
0 P xi 1
P xi 0 – ни при одном измерении не
наблюдается значение xi, и, следовательно,
система не может иметь состояние,
характеризующееся этим параметром.
P xi 1 –
при всех измерениях
наблюдалось только значение xi система
находится в детерминированном состоянии,
характеризующемся параметром xi.
8.
Если набор возможных дискретных значенийxi, i = 1, 2, …K, является полным (т.е.
включает все возможные значения x согласно
условиям физической задачи), то сумма
вероятностей нахождения системы во всех
состояниях с параметрами xi
K
K
P xi
i 1
Ni
i 1
N
N
1
N
(15.1)
9.
Рассмотрим статистическое описаниедля случая, когда измеренный параметр x
может иметь любые значения в интервале
давление,
a x b (температура,
внутренняя энергия и другие параметры
термодинамических систем, координата и
скорость
в
классической
механике
принимают непрерывный ряд значений).
10.
Пусть величина x с вероятностью dP(x)попадает в интервал от x до x + dx. Тогда
функция распределения f(x) случайной
величины x, характеризующая плотность
распределения вероятностей:
d P x
f x
,
dx
где f(x) ≥ 0, т.к. вероятность dP(x) попадания
измеренного значения в интервал от x до
x + dx – неотрицательна.
11.
Вероятность попадания измеренногозначения в интервал
x1 x x2
P x1 x x2
x2
f x d x
x1
Условие нормировки ф-кции распределения
– вероятность попадания измеренного
значения в интервал значений a ≤ x ≤ b (т.е.
измеренное значение наверняка попадает в
весь интервал возможных значений)
b
a
f x d x 1
(15.2)
12.
Среднее значение любой функции φ(x)b
x x f x d x
(15.3)
a
Согласно (15.3) среднее значение параметра x
b
x xf x d x
(15.4)
a
Если состояние системы характеризуется
параметрами x и y, то вероятность того, что
значения находятся в интервалах x1 ≤ x ≤ x2 и
y1 ≤ y ≤ y2 соответственно: x y
P x1 x x2 , y1 y y2
f x, y d x d y,
2 2
x1 y1
13.
где f(x,y) – двумерная функция распределения(например, для координат и скоростей
молекул газа).
Для бесконечно малых интервалов dx и
dy
d P x, y f x, y d x d y
(15.5)
В случае статистической независимости
значений x и y
f x, y f x f y
(15.6)
14. Барометрическая формула
Пристатистическом
описании
распределения микрочастиц в пространстве
координат x и y обычно используют
концентрацию n(x,y,z)
n x, y, z N 0 f x, y, z ,
где N0 – полное число микрочастиц в объеме
системы.
15.
Если на систему не действуют внешниесилы и она находится в состоянии
термодинамического равновесия, то
n x, y, z const
При воздействии на микрочастицы
внешнего
силового
поля,
например
гравитационного, концентрация различна в
разных точках пространства. При этом
состояние термодинамического равновесия
должно сохраняться.
16.
Молекулы газа находятся в поле силтяжести (в результате чего не разлетаются
по всему мировому пространству) и
совершают хаотическое тепловое движение
(без которого каждая молекула газа под
действием силы тяжести должна была бы
падать вниз и все молекулы газа скопились
бы у поверхности Земли, где их
потенциальная энергия минимальна).
17.
Пусть идеальный газ находится вовнешнем
гравитационном
поле
(поле
однородно).
Предполагаем, что любой бесконечно
малый объем газа находится в состоянии
механического
равновесия,
а
его
температура T= const (изотермическая
атмосфера).
Только при выполнении этих условий
состояние
газа
можно
считать
равновесным, иначе возникли бы потоки
вещества и энергии и состояние стало бы
неравновесным.
18.
Выделим на высоте z над уровнем Землималый объем воздуха высотой dz и площадью
основания dS.
p – давление воздуха на высоте z,
p+dp – давление воздуха на
высоте z+dz.
z
dS
z+dz
z
dS
0
p+dp
p p d p
p
y
19.
Условие механического равновесия объемагаза dV d S d z :
d F g d m z g dV ,
d F p p d p d S z g d S d z ,
где dF – сила, действующая на выделенный
малый объем воздуха,
p p d p z g d z,
где ρ(z) – плотность газа на высоте z,
d p z g d z n z m0 g d z ,
m0 – масса одной молекулы газа.
20.
Из основногоконцентрацию
тогда
уравнения
МКТ
выразим
p
p nkT n
,
kT
p
d p m0 g d z,
kT
dp
m0 g
d z,
p
kT
m0 gz
Ce kT
Ep
m0 gz
ln p
ln C ,
p
Ce kT .
kT
Здесь Ep = mgz – потенциальная энергия
одной молекулы в однородном поле силы
тяжести в зависимости от координаты z.
21.
Из Н.У.:z 0
p p0
p p 0 p0 C ,
m0 gz
e kT
p0 e
Ep
kT
(15.7)
– барометрическая формула, справедлива
для идеального газа. С ее помощью можно
рассчитать давление атмосферы на различной
высоте при условиях изотермичности
атмосферы
и
однородности
гравитационного поля. Несмотря на то, что
температура атмосферы Земли зависит от
высоты над уровнем моря, по (15.7) можно
достаточно точно определить высоту по
результатам измерения давления.
22. Распределение Больцмана
Подставив основное уравнение МКТp nkT
в (15.7), получим распределение Больцмана
n x, y, z n0e
E p x, y ,z
kT
,
(15.8)
где n0 – концентрация газа в точке,
соответствующей началу координат, при
E p x, y , z
x y z 0
0
23.
Формула (15.8) впервые полученаЛ.Больцманом в 1866 г. и позволяет
рассчитать
концентрацию
газа,
находящегося в равновесном состоянии во
внешнем силовом поле. Причем поле не
обязательно должно быть гравитационным.
Больцман показал, что распределение
(15.8)
справедливо
для
любого
потенциального поля.
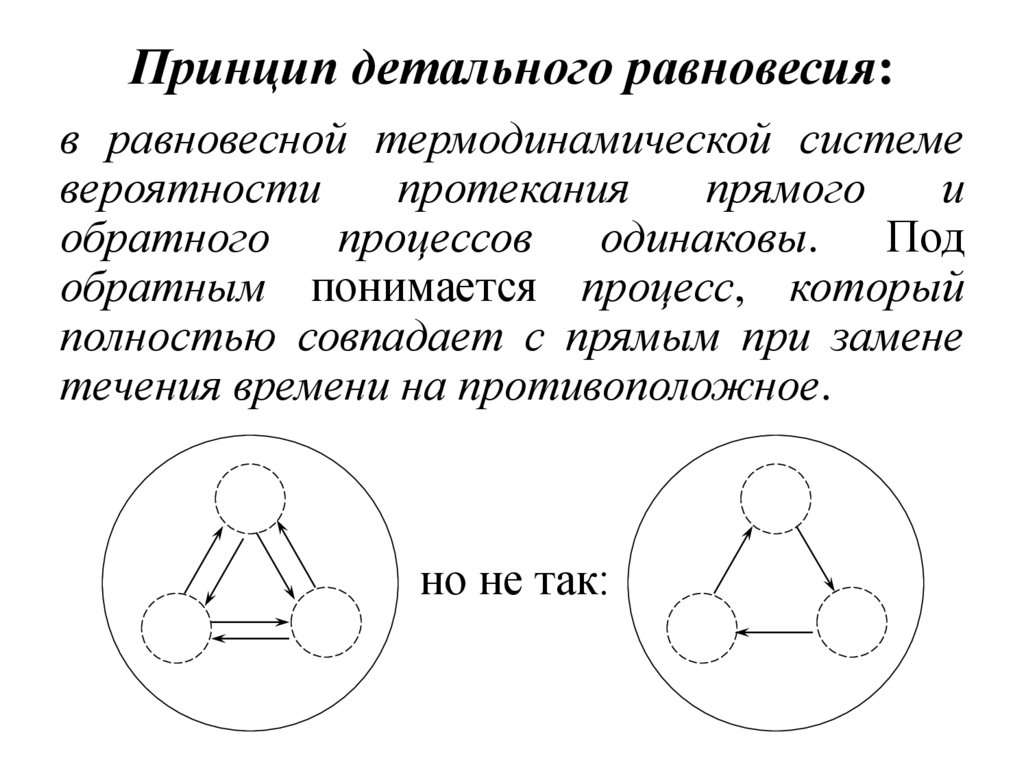
24. Принцип детального равновесия:
в равновесной термодинамической системевероятности
протекания
прямого
и
обратного процессов одинаковы. Под
обратным понимается процесс, который
полностью совпадает с прямым при замене
течения времени на противоположное.
но не так:
25.
Самостоятельно:Глаголев
К.В.,
Морозов
А.Н.
Физическая
термодинамика:
Учеб.
пособие. – М.: Изд-во МГТУ им.
Н.Э.Баумана, 2004. – 368 с./Под ред.
Л.К.Мартинсона, А.Н.Морозова. Параграф
5.3, стр. 162–165.
26. Распределение Максвелла
РассмотримМаксвелловское
распределение молекул по скоростям. Газ
находится в равновесном состоянии. Введем
пространство скоростей.
y
d
d x
d y
d z
x
z
Т.к. все направления
движения равноправны,
распределение
будет
сферически
симметричным.
f(υ)
–
ф-кция
распределения модуля
скорости.
27.
Получение функции распределенияМаксвелла – самостоятельно.
Глаголев К.В., Морозов А.Н. Физическая
термодинамика: Учеб. пособие. – М.: Изд-во
МГТУ им. Н.Э.Баумана, 2004. – 368 с./Под
ред.
Л.К.Мартинсона,
А.Н.Морозова.
Параграф 5.4, стр. 166 – 169.
28.
Функцияскорости υx:
распределения
1
2
2
m0 x
m0
x
exp
2
kT
2 kT
Аналогично
1
2
2
m
m0
0
y
y
exp
2kT
2 kT
1
2
2
m
m
0
0
z
z
exp
2
kT
2 kT
проекции
(15.16а)
(15.16б)
(15.16в)
29.
Проекции скорости молекул на оси координат– статистически независимые величины.
Тогда функция распределения молекул газа по
скоростям
f x y z ,
3
2
2
m
m0
0
f
exp
2kT
2 kT
или
3
2
2
2
2
m
m0
0
x
y
z
f x , y , z
exp
2kT
2 kT
(15.17а)
(15.17б)
30.
Функции(15.16)
–
(15.17)
–
распределения Максвелла.
Вероятность того,
что значения проекций
скорости лежат внутри
( x)
элементарного объема
пространства скоростей
dV d x d y d z :
0
d P f d V
(15.18)
31.
Т.к. эта вероятность зависит только отабсолютного значения скорости и не зависит
от направления ее вектора в пространстве,
можно считать, что элементарный объем dVυ
имеет форму шарового слоя со средним
радиусом υ и толщиной dυ.
Связано это с тем, что в любой точке на
поверхности сферы, центр которой совпадает
с началом координат пространства скоростей,
абсолютные значения υ, а, следовательно и
f(υ) одинаковы.
32.
Считаяшаровой
элементарный объем
слой
тонким,
2
dV 4 d .
его
Тогда (15.18): d P f 4 d
2
Функция F(υ)
3
2
F
2
m
m
0
F 4 2 f 4 0 2 exp
2kT
2 kT
F( )
0
m < > кв
33.
называется распределением Максвелла поабсолютным значениям скоростей и
характеризует вероятность того, что
скорость молекулы имеет значения от υ до
υ+dυ.
F(υ)→0 при υ=0 и υ→∞; максимуму ф-кции
распределения
наиболее вероятная
скорость.
Исследуем функцию на экстремум:
3
2
d F
m0
4
2 m
d
2 kT
m0 2m
e 2 kT
2 2 2m
m0 2m
2 m m0 2 kT
e
2
m
2
kT
m0
0,
2kT
0,
34.
наиболее вероятная скорость:2kT
2 RT
m в
m0
(15.19)
Площадь под всей кривой распределения =1
(т.е. частица имеет какую-либо скорость).
В статистической физике:
средняя скорость
3
2
m
m0
0
3
d
F d 4
exp
2
kT
2
kT
0
0
8RT
8kT
m0
2
(15.20)
35.
Средний квадрат скорости3
2
2
m
m
0
4
2
d ,
2 F d 4 0 exp
2kT
2
kT
0
0
3RT 3kT
,
m0
2
средняя квадратичная скорость
кв
3kT
m0
(15.21)
36.
Значения скоростей υm, <υ> и υкв численноотличаются незначительно, причем
m кв
Все
полученные
распределения
справедливы только для равновесного
состояния термодинамической системы.
Вследствие достаточно общего метода их
получения они применимы не только для
газов, но и для любых систем, движение
микрочастиц
которых
описывается
уравнениями классической механики.
37. Экспериментальная проверка распределения Максвелла
Опыт Штерна (рассматривался в лекции 11).38. Фазовое пространство
Фазовое пространство 6-ти мерное.Элементарный объем ячейки фазового
пространства:
dw d x d y d z d x d y d z
39. Распределение Максвелла-Больцмана
Считая координаты и компонентыскорости статистически независимыми друг
от друга величинами, на основании (15.6)
можно записать ф-кцию распределения в
шестимерном пространстве
n f x, y, z, x , y , z n x, y, z f x , y , z
40.
Распределения Максвелла и Больцманаможно объединить в закон распределения
Максвелла-Больцмана, который определяет
число молекул dN, проекции скорости
которых и их координаты лежат в
интервалах
x , x d x , y , y d y , z , z d z
x, x d x , y, y d y , z, z d z
одновременно.
41.
Распределение Максвелла-Больцмана:2
m
3
Ep
2
m
2
n f x, y, z, x , y , z n0
exp
kT
2 kT
2
m
3
Ep
2
m
2
d N n0
exp
kT
2 kT
где
2 2x 2y 2z ;
(15.22)
d x d y d z d x d y d z,
E p E p x, y, z
42. Равновесные флуктуации
В любой, даже равновесной, системесуществуют случайные отклонения от
средних
значений
макроскопических
параметров ее состояния. Эти отклонения
можно экспериментально наблюдать при
долговременных
измерениях
термодинамических параметров.
43.
Случайные отклонения значений какоголибопараметра
термодинамической
системы от его среднего значения
называются флуктуациями. Возникают
флуктуации
вследствие
хаотического
теплового
движения
частиц
термодинамической системы.
Равновесные
флуктуации
флуктуации в равновесной системе.
–
44. Статистическое обоснование второго начала термодинамики
Флуктуации возникаюттермодинамических системах.
в
любых
Для равновесных систем вероятность
возникновения тех или иных флуктуаций
зависит от их величины – чем больше
флуктуация, тем меньше вероятность ее
возникновения.
45.
Состояние макросистемы может бытьохарактеризовано
заданием
таких
макропараметров, как объем V, давление p,
температура T и др. В этом случае задано
макросостояние.
Состояние
макросистемы,
охарактеризованное настолько детально, что
заданы состояния всех молекул, называют
микросостоянием.
Любое макросостояние может быть
реализовано различными способами или
различными микросостояниями.
46.
Макроскопическое состояние газа снекоторыми
значениями
параметров
представляет собой смену микроскопических
состояний, которые отличаются одно от
другого нахождением одних и тех же молекул
в
разных
частях
объема
и
перераспределением
энергии
между
молекулами.
Рассмотрим пример, когда в сосуде,
мысленно разделенном на две одинаковые
половины A и B, находится N = 4 молекул
(молекулы 1, 2, 3, 4 на рис.).
47.
Каждая молекула с равной вероятностьюможет находиться в любой половине сосуда.
A
B
2
4
1
3
В таблице приведены все возможные
распределения
четырех
молекул
по
половинам A и B сосуда.
48.
Способы реализациимакросостояний
A
B
1
2
3
4
1, 2
1, 3
1, 4
2, 3
2, 4
3, 4
1, 2, 3, 4
2, 3, 4
1, 3, 4
1, 2, 4
1, 2, 3
3, 4
2, 4
2, 3
1, 4
1, 3
1, 2
Число
способов
G
1
Вероятность
P
4
1/16
4/16
6
6/16
49.
1, 2, 31, 2, 4
1, 3, 4
2, 3, 4
1, 2, 3, 4
4
3
2
1
4
1
4/16
1/16
Всего микросостояний 24 = 16
50.
Статистическимвесом
данного
макросостояния называется количество
равновесных
микросостояний
G,
соответствующих этому макросостоянию.
G ~ P.
Статистический
вес
характеризует
степень
неупорядоченности
макроскопического состояния.
51. Формула Больцмана для статистической энтропии
ФормулаБольцмана.
энтропия системы
S k ln G,
Статистическая
(15.23)
где k – постоянная Больцмана.
Второе
начало
термодинамики
(Людвиг
Больцман):
все
замкнутые
макросистемы стремятся переходить от
состояний менее вероятных к более
вероятным.
52.
Третье начало термодинамики (13.19)связано с формулой Больцмана (15.23).
Действительно, при T→0, G→1 (все
молекулы замерзли и могут находиться в
одном микросостоянии, так как не могут
двигаться, S →0).



















































 physics
physics








