Similar presentations:
Статистический метод описания
1. Термодинамика и статистическая физика
2. Лекция № 4
Статистический метод описания.1. Основная задача статистической физики.
Микросостояние системы частиц.
2. Элементарные сведения из теории вероятностей.
3.Функция распределения. Среднее значение.Дисперсия
Закон распределения Максвелла.
1. Пространство скоростей. Принцип детального
равновесия.
2. Распределение молекул газа по скоростям
в условиях термодинамического равновесия.
3. Закон распределения скоростей Максвелла.
Характерные скорости молекул.
3.
Состояние системы детально охарактеризованное на уровне каждой частицыназывается микросостоянием.
Микросостояния системы описываются
заданием в каждый момент времени координат и скоростей всех молекул, атомов, а также электронов, атомных ядер и прочих частиц, из которых построены тела системы.
Состояние системы описанное с помощью
макроскопических параметров, характеризующих систему в целом (P ,V ,T, n, m)
называется макросостоянием.
4.
Детальное описание состояний макроскопических систем, ввиду колоссальности числачастиц в них, не только невозможно осуществить фактически, но оно не представляет
никакого интереса. В термодинамике имеют
смысл средние значения, которые принимают при определённых условиях какие-то
функции микросостояния системы. Про
величины такого рода говорят, что они имеют статистический характер или являются
статистическими. Например, давление,
плотность, температура, средний квадрат
смещения частицы.
5.
Основная задача статистическойфизики: найти наиболее
вероятные распределения
молекул по скоростям, энергиям,
импульсам и т.д. И средние
значения соответствующих
параметров.
6. Элементарные сведения из теории вероятностей.
С точки зрения атомно-молекулярногостроения
вещества
величины,
встречающиеся
в
макроскопической
физике, имеют смысл средних значений,
которые принимают некоторые функции от
микроскопических переменных системы.
Величины такого рода называются
статистическими.
Примерами таких величин являются
давление, температура, плотность и др.
7.
Статистические закономерностиизучаются теорией вероятностей.
Событиями или случаями в теории
вероятностей называют всякие
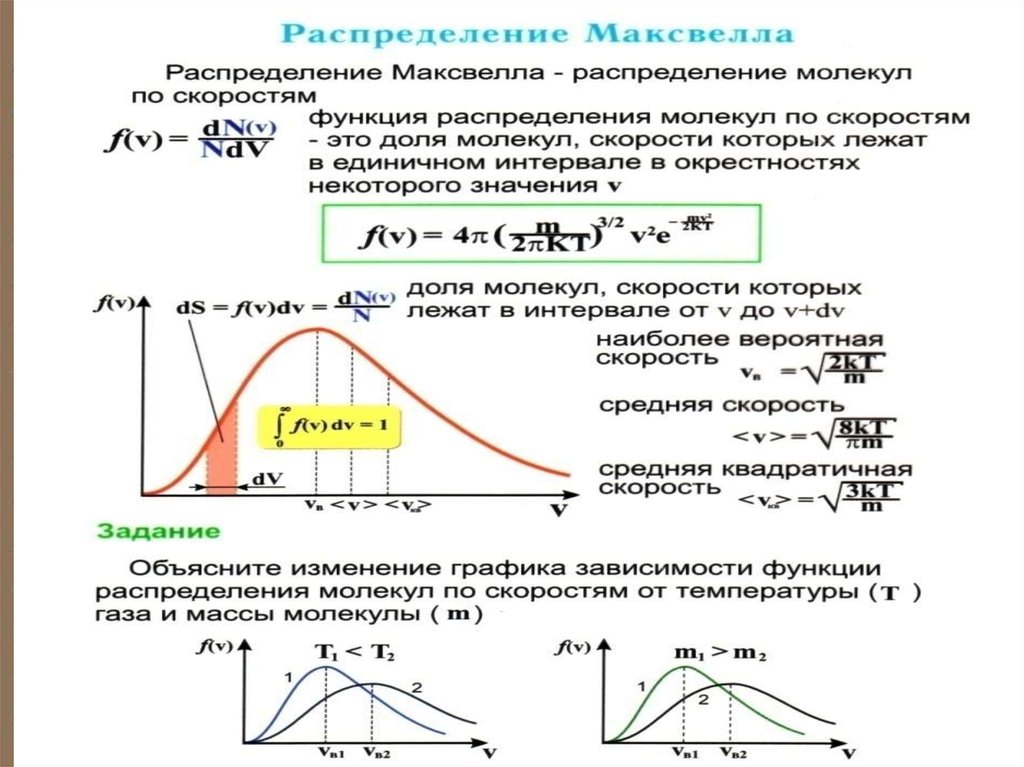
явления, относительно которых имеет
смысл ставить вопрос, могут они
происходить или нет. Опыт в теории
вероятностей называется испытанием.
Если при данных условиях событие
обязательно произойдёт, то оно называется достоверным событием.
8.
Если событие произойти не может,то его называют невозможным.
Событие называют случайным, если в
результате испытания оно может как
произойти, так и не произойти.
Например, при игре в орлянку, может
выпасть либо орёл, либо решка. Этослучайное событие. Но бросая много
раз монету приблизительно в половине
случаев будет герб. В этом случае
вероятность выпадения герба равна ½.
9. Математическое определение вероятности: вероятность какого-либо события – это предел, к которому стремится отношение числа
случаев,приводящих к осуществлению события,
к общему числу случаев, при бесконечном
увеличении последних:
n
P lim
n n
Здесь n число раз, когда событие
произошло, а n общее число опытов.
Отсюда следует, что Р может принимать
значения от нуля до единицы.
10.
По определению Лапласа,вероятность отношение числа благоприятных
случаев к числу возможных
случаев.
n
P lim
n n
Если событие достоверно, то P = 1. Если событие не может произойти вообще, то P = 0.
11.
События несовместимы, если появлениеодного из них исключает появление
любого из остальных.
Теорема сложения вероятностей.
Вероятность суммы несовместных событий равна сумме вероятностей этих событий
P А В Р А Р В
Событие, состоящее в появлении либо
события А , либо события В. Например,
в ящике красные, зелёные и белые шары.
Вероятность вынуть цветной шар:
Pцветн Ркрасн Рзелён
12.
Сумма вероятностей всех единственновозможных и несовместимых событий
равна единице:
P1 P2 ... Pn 1 - это утверждение является следствием теоремы сложения вероятностей. Т.к. события единственно возможны, то появление одного из них
(безразлично какого) есть событие достоверное. Вероятность такого события равна
единице. Но по теореме о сложении вероятностей вероятность этого события может
быть представлена суммой P1 P2 ... Pn
13.
P1 P2 ... Pn 1Это соотношение часто называют
условием нормировки вероятностей.
Теорема умножения вероятностей.
Вероятность произведения двух событий
А и В равна произведению вероятности
одного из них Р(А) на вероятность другого,
вычисленную в предположении, что первое
событие произошло Р(В/А) – это условная
вероятность события В, при условии, что
событие А произошло.
P АВ Р А Р В / А
14.
Если события А и В независимы (ихвероятности не зависят от того, произошло второе событие или нет), то
P АВ Р А Р В
вероятность произведения 2-х независимых событий равна произведению их
вероятностей. Например, есть три шара:
красный, зелёный и белый. Какова вероятность того, что при последовательном
вынимании 2-х шаров они окажутся зелёным и красным? Если вынуть один
шар, то вероятность, что он окажется
15.
либо зелёным, либо красным (событие А),равна по теореме сложения вероятностей:
1 1 2
P А
3 3 3
Если событие А произошло, то осталось
два шара один из которых будет либо зелёный, либо красный. Вероятность вынуть такой шар (событие В) равна:
Р В / А 1 / 2. Искомая вероятность
по теореме умножения равна:
2 1 1
P АВ Р А Р В / А
3 2 3
16.
Существует ещё одна интерпретациявероятности, применяющаяся в физике.
Пусть в закрытом сосуде имеется одна молекула. Сталкиваясь со стенками, молекула
беспорядочно отражается от них и побывает
в различных местах сосуда. Если наблюдать
за молекулой в течение длительного времени
Т и при этом часть времени t она провела в
объёме V. Отношение t / T называется относительным временем пребывания молекулы в объёме V. Предел этого отношения
t - вероятность нахождения
P lim
T T
молекулы в объёме V.
17.
Важным понятием в теории вероятностей иеё приложениях является понятие среднего
значения. Пусть произведено N однотипных измерений одной и той же величины x
при неизменных условиях. Пусть в n1 случаях измеренное значение величины x оказалось равным x1 , в n2 случаях – x2,…, в nm
случаях – xm , ( n1 + n2 + n3 + …+ nm = N ).
Среднее значение измеряемой величины
определяется выражением:
n1 x1 n2 x2 ... nm xm
ni xi
x x
N
i 1 N
m
18.
n1N
Отношение
, т.е. отношение числа наблюдений при которых величина x имеет
значение x1 , к общему числу наблюдений N,
есть вероятность появления при измерениях
n1
x
значений 1 , т.е.
Р1 ( подразумевается,
N
n1
что lim N Р1 - вероятность события) и
N
т.д. для упрощения вместо lim пишут
n2
Р2 и получаем среднее значение:
N
m
x x P1 x1 P2 x2 ... Pm xm Pi xi
i 1
19.
Введём понятие отклонения результатовотдельных измерений от среднего значения
< x > , т.е. xi xi x , где i = 1,2,…,N
Дисперсия есть среднее арифметическое
квадратов отклонений наблюдаемых
значений (x1, x2,...,xm) случайной величины
N
2
от их среднего значения:
( xi x )
2
2
2
( x1 x ) ( x2 x ) ... ( xN x ) i 1
2
N
N
Среднее квадратичное отклонение:
N
xср.кв .
2
(
x
x
)
i
1
i 1
N ( N 1)
N
N
2
(
x
x
)
i
i 1
20.
Распространим полученные результаты наслучай когда характеризующая систему величина x может принимать непрерывный
ряд значений от 0 до ∞ . В этом случае говорят, что величина x имеет сплошной (или
непрерывный) спектр значений (в предыдущем случае спектр значений был дискретным).
Возьмём очень малую величину а ( скажем,
а = 10‾¹º ) и получим ∆no измерений, при
которых 0< x < a , ∆n1, при которых а< x < 2a,
…, ∆nx , при которых результат измерений
находится в интервале от x до x + а и т.д.
21.
Вероятность того, что результат измеренийокажется в интервале от нуля до а , равна:
nо
,
Р
о
N
в интервале от а до 2а:
n1
Р1
N
,…,
в интервале от x до x + а :
nx
Рx
N .
Начертим ось x и отложим вверх от неё
полоски шириной а и высотой Рx .
Получим столбчатую диаграмму, а
которая называется гистограмма.
22.
Столбчатая диаграмма илигистограмма.
Рx
а
Площадь = ∆Рx
0 а 2а
x x+a
Площадь полоски, левый край которой
имеет координату x , равна ∆Рx ,а площадь
P 1
всей гистограммы – единице.
m
i 1
i
23.
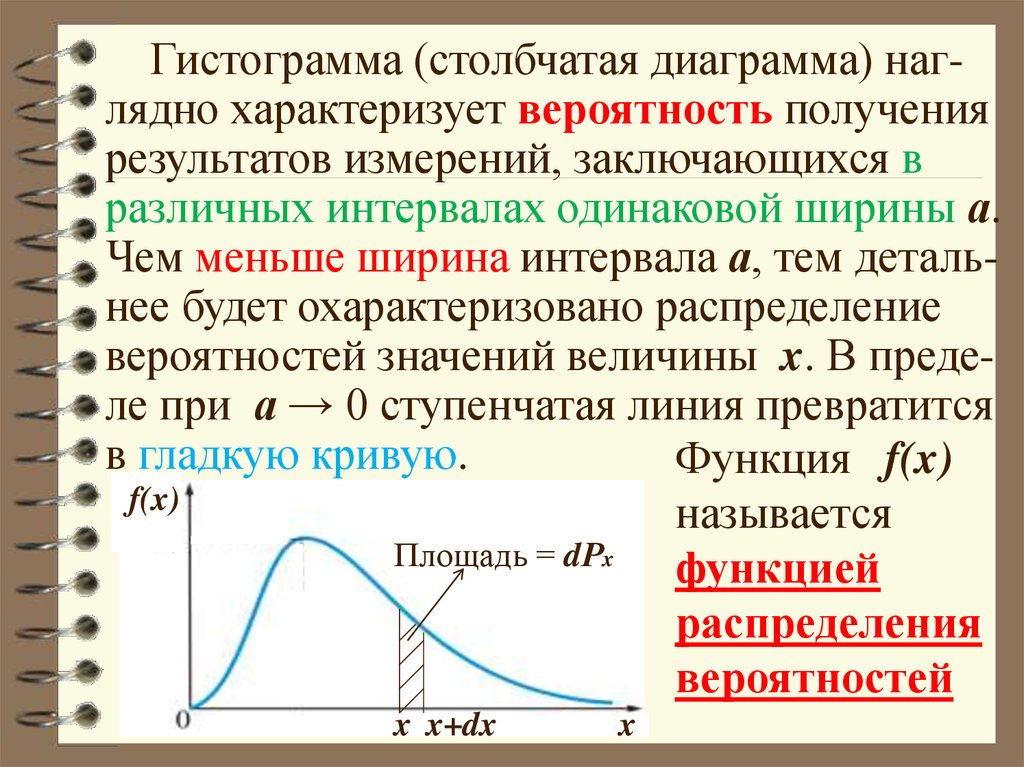
Гистограмма (столбчатая диаграмма) наглядно характеризует вероятность получениярезультатов измерений, заключающихся в
различных интервалах одинаковой ширины а.
Чем меньше ширина интервала а, тем детальнее будет охарактеризовано распределение
вероятностей значений величины x. В пределе при а → 0 ступенчатая линия превратится
в гладкую кривую.
Функция f(x)
f(x)
называется
Площадь = dРx
функцией
распределения
вероятностей
x x+dx
x
24. ФУНКЦИЯ РАСПРЕДЕЛЕНИЯ ВЕРОЯТНОСТЕЙ
В пределе вместо ступенек будет гладкая кривая, котораяназывается функцией распределения вероятностей.
25.
Площадь столбика ширины dx равна вероятности того, что результат измеренияокажется в пределах от x до x+dx. Обозначив эту вероятность через dPx , получим:
dPx = f(x)∙dx
Индекс “x” при dP указывают на то, что
имеется в виду вероятность для интервала,
левый край которого лежит в точке с координатой x . Площадь, ограниченная кривой
распределения, так же как и площадь гистограммы, равна единице. Это означает:
f ( x)dx dP 1 - условие нормировки
x
26.
Зная функцию распределения f(x) , можнонайти среднее значение результатов измерения величины x . В dN x N dPx случаях
получается результат, равный x. Сумма таких
результатов определяется выражением:
x dN x x N dPx . Сумма всех возможных
результатов равна:
x
dN
x
N
dP
x
x
Разделив это на число измерений N, получим среднее значение величины x.
x x dPx f ( x) x dx
27.
Аналогичные рассуждения дают, что среднее значение некоторой функции φ(x)можно вычислить по формуле:
( x) ( x) f ( x) dx
Например:
x x f ( x) dx
2
2
28. Закон распределения Гаусса.
Нормальное распределение, также называемое гауссовским распределением или распределением Гаусса — распределение вероятностей, которое задается функцией плотностираспределения:
где параметр μ — среднее значение (математическое ожидание) случайной величины и
указывает координату максимума кривой
плотности распределения, а σ² — дисперсия.
29.
30.
31.
Гаусс (Gauss) КарлФридрих (30.4.1777,
Брауншвейг, 23.2.1855, Гёттинген),
немецкий математик,
внёсший
фундаментальный
вклад также в
астрономию и
геодезию.
32.
33. Закон распределения скоростей молекул при тепловом равновесии
Возьмём газ, состоящий из очень большогочисла
N
тождественных молекул,
находящихся в состоянии беспорядочного
теплового движения при определённой
температуре Т ( т.е. в условиях
термодинамического
равновесия
).
Предполагается, что силовые поля,
действующие на газ, отсутствуют.
В газе в состоянии хаотического
движения должны компенсировать
34.
друг друга всякие два противоположнонаправленные
процесса. Скорости
таких противоположно направленных
процессов должны быть одинаковыми.
Это положение называется принципом
детального равновесия. Если бы оно не
выполнялось, то тепловое движение
молекул в какой-то мере устранило бы
беспорядочный характер и приобрело бы
черты, свойственные упорядоченному.
Принцип детального равновесия справедлив для любых систем в состоянии хаоса.
35. Закон распределения скоростей Максвелла.
Возьмём в воображаемом пространстве,которое назовём υ – пространством
(пространством скоростей), прямоугольные координатные оси, по которым
будем откладывать значения x , y , z
отдельных молекул (имеются в виду
компоненты скорости по осям x, y, z,
взятым в обычном пространстве).
36.
Скорости каждой молекулы будет соответствовать точка в этом пространстве.Из-за столкновений положение точек будет
непрерывно меняться, но их плотность в
каждом месте будет оставаться неизменной
(т.к. у нас равновесное состояние газа).
37.
Вследствие равноправности всех направлений движения расположение точек относительно начала координат будет сферическисимметричным. Плотность точек в υ – пространстве будет зависеть только от модуля
скорости υ ( или от υ² ).
38. Молекулы движутся хаотически. Среди них есть и очень быстрые, и очень медленные. Благодаря беспорядочному движению и случайному
характеру ихвзаимных
столкновений,
молекулы
определённым образом распределяются
по скоростям. Это распределение
оказывается однозначным и единственно
возможным, и не только не противоречит
хаотическому движению, но именно им и
обусловлено.
39. Мы будем искать число частиц (n) скорости которых лежат в определён-ном интервале значения скорости υ ( т.е. от υ до ). Здесь
Мы будем искать число частиц ( n)скорости которых лежат в определённом интервале значения скорости υ
( т.е. от υ до υ Δυ ).
Здесь n – число благоприятных
частиц, попавших в этот интервал.
Очевидно, что в единице объёма
число таких благоприятных частиц
тем больше, чем больше υ.
40. Ясно так же, что n должно быть пропорционально концентрации молекул n . Число n зависит и от самой скорости, так как в
Ясно так же, что n должно бытьпропорционально концентрации
молекул n . Число n зависит и от
самой скорости, так как в одинаковых
по величине интервалах, но при разных
абсолютных значениях скорости, число
молекул будет различным.
Смысл сказанного легко понять из
простого примера: неодинаково, число
людей в возрасте от 20 до 21 года и от
90 до 91 года.
И так: Δn f ( υ)nΔυ
41. Здесь f (υ) – функция распределения молекул по скоростям, n – концентрация молекул и υ - интервал значений скоростей. В
Δn f ( υ)nΔυЗдесь f (υ) – функция распределения
молекул по скоростям, n – концентрация
молекул и υ - интервал значений скоростей.
В пределе, получим: dn f ( υ)ndυ
Физический смысл f(υ) в том, что
это отношение числа молекул, скорости
которых лежат в определенном интервале скоростей, к общему числу молекул в
единичном интервале
d
n
скоростей:
f ( υ)
n
42. Таким образом, f(υ) – имеет смысл вероятности, то есть показывает, какова вероятность любой молекулы газа в единице объёма
иметь скорость, заключённую в единичном интервале, включающем заданную скорость υ.В данном случае f(υ) называют
плотностью вероятности.
43. Функция распределения Максвелла
Пусть имеется n тождественныхмолекул, находящихся в состоянии
беспорядочного теплового движения при
определенной температуре. После каждого
акта столкновения между молекулами,
их скорости меняются случайным
образом.
В результате невообразимо большого
числа
столкновений
устанавливается
стационарное равновесное состояние,
когда число молекул в заданном интервале
скоростей сохраняется постоянным.
44. В результате каждого столкно-вения проекции скорости молекулы испытывают случайное изменение на υx, υy, υz, причем изменения
В результате каждого столкновения проекции скорости молекулыиспытывают случайное изменение
на υx, υy, υz, причем изменения
каждой проекции скорости независимы друг от друга.
Найдем в этих условиях, каково
число частиц dn из общего числа n
имеет скорость в интервале
от υ до υ dυ.
45. При этом, мы не можем ничего определенного сказать о точном значении скорости той или иной частицы υi, поскольку за
столкновениями и движениями каждой измолекул невозможно проследить ни в опыте,
ни в теории. Такая детальная информация
вряд ли имела бы практическую ценность.
Распределение молекул идеального
газа по скоростям впервые было получено
знаменитым английским ученым
Дж. Максвеллом в 1860 году с
помощью методов теории вероятностей.
46. Максвелл Джеймс Клерк (1831 – 1879) – английский физик. Работы посвящены электродинамике, молекулярной физике, общей статике,
оптике,механике, теории упругости. Установил статистический закон,
описывающий распределение молекул
газа по скоростям.
47. Скорость – векторная величина. Для проекции скорости на ось х (x-ой составляющей скорости ), имеем: или где А1 из условия
Скорость – векторная величина.Для проекции скорости на ось х (xой составляющей скорости x), имеем:
dnx f ( υ x )ndυ x ,
1
2
dnx
m
f (υ x )
e
n dυx 2 kT
или
dnx
f (υ x )
A1e
n dυx
mυ 2x
2 kT
mυ 2x
2 kT
,
где А1 из условия нормировки.
,
48.
Видно, что доля молекул со скоростьюυ x 0 не равна нулю.
При υ x 0 , f ( υ x ) A1
(в этом физический смысл постоянной А1).
49. Приведённое выражение и график справедливы для распределения молекул газа по x-ым компонентам скорости. Очевидно, что и по y–ым
иz–ым компонентам скорости также
можно получить:
mυ 2y
dn y
f y
A1e 2 kT
n dυ y
и
dn z
f z
A1e
n dυ z
mυ 2z
2 kT
.
50. Вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям: x – компонента скорости лежит в интервале от
υх до υ x dυ x ; y –компонента, в интервале от υy до υ y dυ y;
z – компонента, в интервале от υz до υ z dυ z
будет равна произведению вероятностей
каждого из условий в отдельности:
dnxyz
mυ 2
3
A1 e 2 kT dυ x dυ y dυ z ,
n
2
2
2
2
где υ υ x υ y υ z ,
m
А
2 kT
3
1
3
2
51. Или Этой формуле можно дать геометричес-кое истолкование: dnxyz – это число моле-кул в параллелепипеде со сторонами dυx, dυy,
3/ 2mυ 2
2 kT
m
Или dnxyz n
dυ x dυ y dυ z
e
2 kT
Этой формуле можно дать геометрическое истолкование: dnxyz – это число молекул в параллелепипеде со сторонами dυx,
dυy, dυz, то есть в объёме dV d x d y d z ,
находящемся на
расстоянии υ от
начала координат
в пространстве
скоростей.
52. Величина dnxyz не может зависеть от направления вектора скорости. Поэтому надо получить функцию распределения молекул по
скоростям независимо от ихнаправления, то есть по абсолютному
значению скорости.
Если собрать вместе все молекулы в
единице объёма, скорости которых
заключены в интервале от υ до υ dυ по
всем направлениям, и выпустить их, то
они окажутся через одну секунду в шаровом слое толщиной dυ и радиусом υ.
53. Шаровой слой толщиной dυ и радиусом от υ до υ+ dυ.
54.
55. Этот шаровой слой складывается из тех параллелепипедов, о которых говорилось выше. Объём этого шарового слоя: Общее число
Этот шаровой слой складываетсяиз тех параллелепипедов, о которых
говорилось выше.
Объём этого шарового слоя:
dΩ 4πυ dυ
2
Общее число молекул в слое:
m
dn n
2 kT
3/ 2
e
mυ 2
2 kT
d .
56. Отсюда следует закон Максвелла – распределение молекул по абсолютным значениям скоростей: где – доля всех частиц единичного
Отсюда следует закон Максвелла– распределение молекул по
абсолютным значениям скоростей:
dn
m
4
n
2 kT
3/ 2
e
mυ 2
2 kT
υ dυ,
2
dn
где
– доля всех частиц единичного
n
объёма, скорости которых лежат в
интервале от υ до υ dυ.
57. При получаем плотность вероятности, или функцию Максвелла распределения молекул по скоростям: Эта функция обозначает долю
При dυ 1 получаем плотностьвероятности, или функцию Максвелла
распределения молекул по скоростям:
3
2
dn
m
F ( υ)
4
e
n dυ
2 kT
mυ 2
2 kT
υ.
2
Эта функция обозначает долю молекул
единичного объёма газа, абсолютные
скорости которых заключены в
единичном интервале скоростей,
включающем данную скорость.
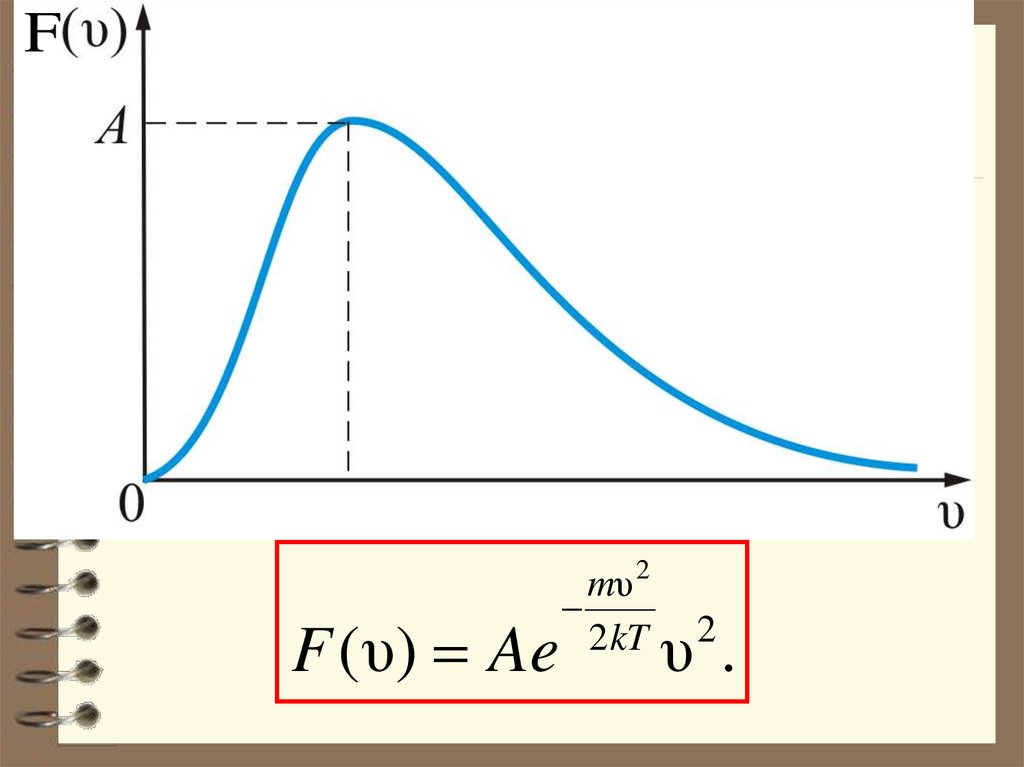
58. Обозначим тогда получим: График этой функции показан на рис.
Обозначим3
2
m
A 4
,
2 кT
тогда получим:
F ( υ) Ae
mυ 2
2 kT
υ .
2
График этой функции показан на рис.
59.
FF ( υ) Ae
mυ 2
2 kT
υ.
2
60. Выводы: - Вид распределения молекул газа по скоростям, для каждого газа зависит от рода газа (m) и от параметра состояния (Т).
Давление P и объёмгаза V на распределение молекул не
2
влияют.
mυ
- В показателе степени стоит 2kT
отношение, кинетической энергии,
соответствующей данной скорости υ
к средней энергии теплового движения
молекул при данной температуре:
61. Распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то есть показывает, какова
вероятность при даннойтемпературе иметь именно такое
значение кинетической энергии).
3
2
m
F ( υ) 4
e
2 kT
mυ 2
2 kT
υ
2
62. Характерные скорости (наиболее вероятная, среднеквадратичная и средняя скорости молекул газа).
Рассмотрим,как
изменяется
с
абсолютной величиной скорости число
частиц, приходящихся на единичный
интервал скоростей, при единичной
концентрации частиц.
2
F ( υ) Ae
mυ
2 kT
υ .
2
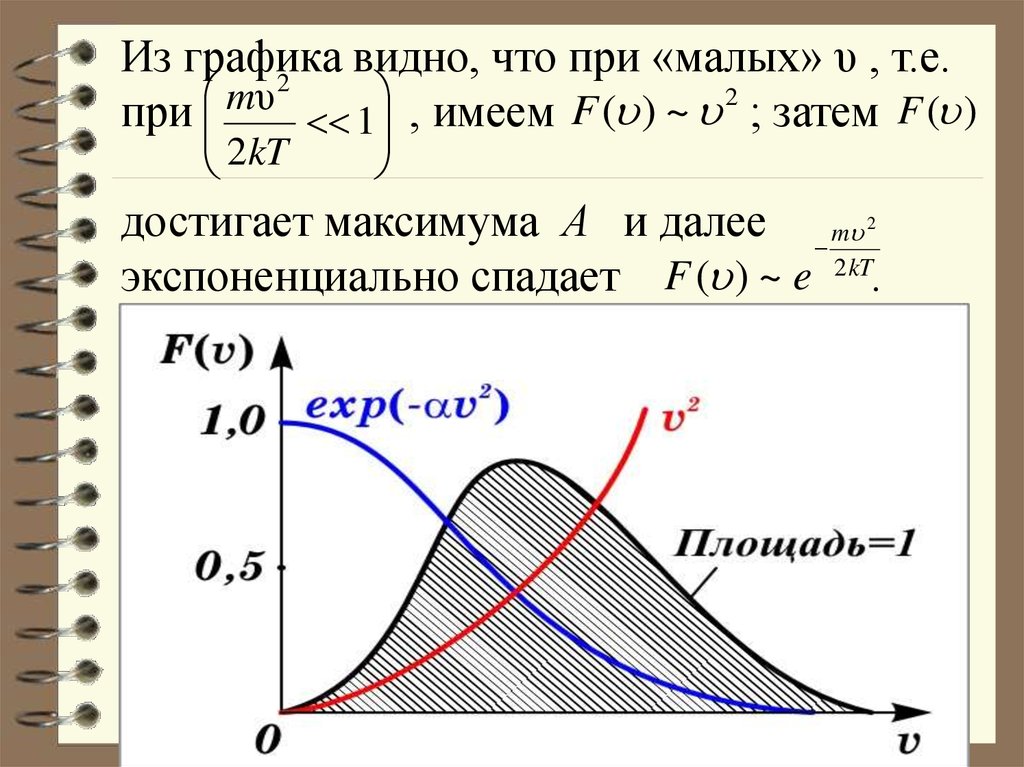
63.
Из графикавидно,
что
при
«малых»
υ
,
т.е.
2
mυ 2
при
1 , имеем F ( ) ~ ; затем F ( )
2kT
достигает максимума А и далее m
экспоненциально спадает F ( ) ~ e 2 kT.
2
64. НАИБОЛЕЕ ВЕРОЯТНАЯ СКОРОСТЬ
Наиболее вероятной называют такуюскорость молекул Vв, для которой F(V)
функция распределения F(V) принимает максимальное значение,
т.е. F΄(Vв)=0.
Т1 < Т2
32
2
m
m
V
F (V ) 4 0 V 2 exp 0
2 kT
2kT
m0
F (V ) 4
2 kT
32
m0V 2
m0V 2 2m0V
2
V exp
2V exp
2kT
2kT 2kT
m0V 2
m0
m0V 2
F (V ) 4
2
; F (Vв ) 0
V exp
kT
2 kT
2kT
32
2kT
2kN AT
2 RT
Vв
.
m0
m0 N A
M
65. Величина скорости, на которую при-ходится максимум зависимости называют наиболее вероятной скоростью . Величину этой скорости
Величина скорости, на которую приходится максимум зависимости F ( )называют наиболее вероятной
скоростью в ер . Величину этой
скорости находят из условия равенства
нулю производной:
dF ( )
'
F
0
d
υ вер
2kT
2 RT
m
66. СРЕДНЯЯ СКОРОСТЬ
Найдем среднюю скорость молекул Vcс помощью функции распределения:
c
0
0
Vc VF (V )dV VF (V )dV
m0V 2 3
m0
m0
Vc
4
exp
V
dV
2
0 2kT
2 kT
2 kT
32
m0V 2
2kT
m0
Vc 2
2
kT
2kT
V
m0
2
32
2kT 2kT
2
0 e m0 m0 d
32
m0V 2 2
2
exp
V
d
(
V
).
0 2kT
d (V 2 )
2kT
d
m0
2kT
8kT
8RT
e d
.
m0 0
m0
M
67. Средняя скорость υср где – число молекул со скоростью от υ до . Если подставить сюда F(υ) и вычислить, то получим: или
Средняя скорость υсрυср
1
n F ( )d ,
n0
где n F ( υ)dυ dn – число молекул со
скоростью от υ до υ dυ . Если подставить
сюда F(υ) и вычислить, то получим:
8kT
2,25kT
υ ср
πm
m
или
8RТ
2,25 RT
υср
πμ
μ
68. СРЕДНЯЯ КВАДРАТИЧНАЯ СКОРОСТЬ
Средней квадратичной скоростью молекул Vкв называетсяквадратный корень из среднего значения квадрата скорости
Vкв V 2 ,. то есть по теореме о равнораспределении энергии
c
по степеням свободы:
3kT 3RT
m0 (V 2 )c 3
2
kT V
Vкв
c
2
2
m0 M
3kT
m0
3RT
.
M
Нахождении (V2)c с помощью функции распределения:
V
2
c
m0
2
V F V dV 4
2
kT
0
32
m0V 2 4
3kT
0 exp 2kT V dV m0 .
Vв : Vc : Vкв 2 : 8 : 3.
Vв : Vc : Vкв 1:1,13:1,22.
вер
69. Среднюю квадратичную скорость находят используя соотношение :
2mυ кв
2
3
kT
2
3kT
3RT
υ кв
m
70. Полезно знать, что
Fυкв
1,22
υвер
υср
υвер
1,13;
вер ср кв
71.
вер ср кввер
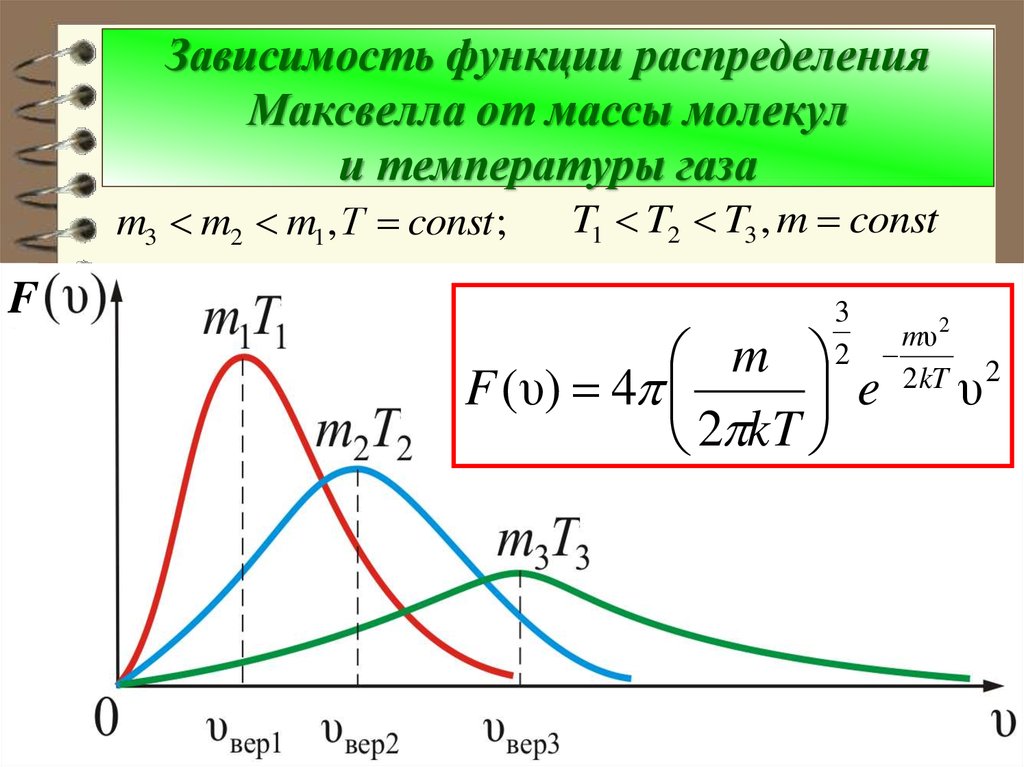
72. Зависимость функции распределения Максвелла от массы молекул и температуры газа
m3 m2 m1 , Т const ;F
T1 T2 T3 , m const
3
2
m
F ( υ) 4
e
2 kT
mυ 2
2 kT
υ
2
73. Из рис. можно проследить за измене-нием при изменении m и T: (при ) или (при ). Площадь под кривой величина посто-янная, равная
Из рис. можно проследить за изменением F ( ) при изменении m и T: m3 m2 m1(при T const ) или T1 T2 T3 (при
m const ).
Площадь под кривой величина постоянная, равная единице ( F ( ) const 1 ),
поэтому важно знать как будет изменяться
положение максимума кривой:
m
F (υвер ) ~
,
T
υ вер ~
T
.
m






































































 physics
physics








