Similar presentations:
Альдегиды и кетоны (часть 2)
1.
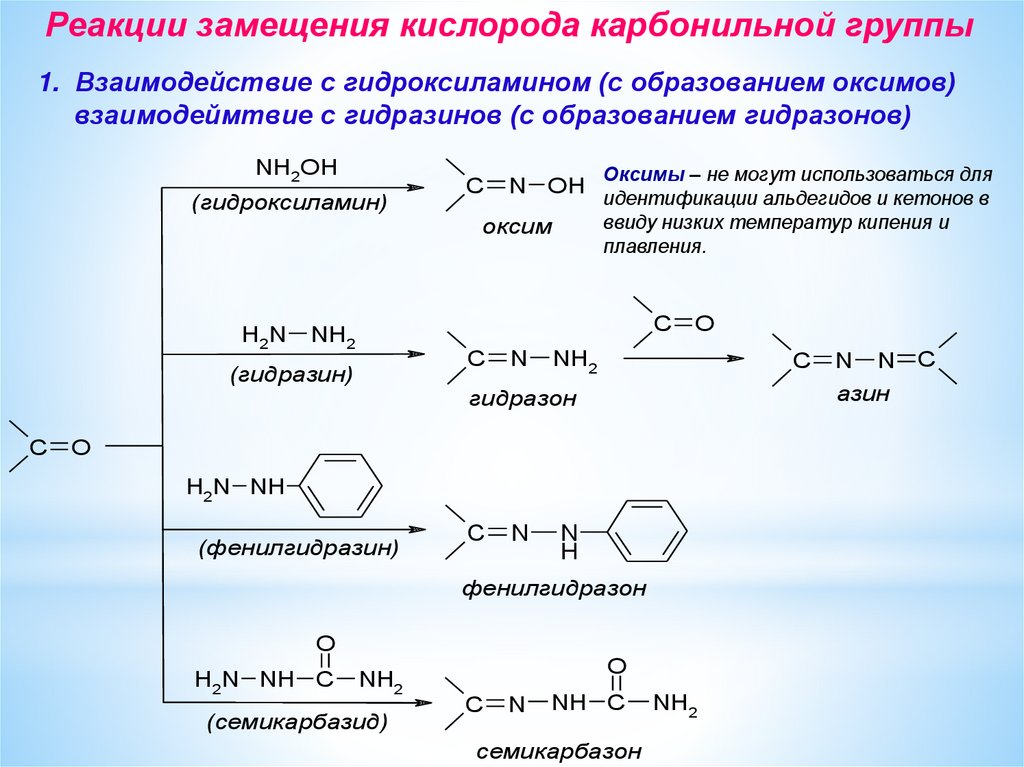
Реакции замещения кислорода карбонильной группы1. Взаимодействие с гидроксиламином (с образованием оксимов)
взаимодеймтвие с гидразинов (с образованием гидразонов)
NH2OH
(гидроксиламин)
H2N
N OH
оксим
Оксимы – не могут использоваться для
идентификации альдегидов и кетонов в
ввиду низких температур кипения и
плавления.
C
NH2
C
(гидразин)
C
C
N
O
NH2
C
O
H2N NH
C
N
N
H
фeнилгидразон
O
H2N NH C
NH2
(сeмикарбазид)
O
C
N
N
азин
гидразон
(фeнилгидразин)
N
NH C
сeмикарбазон
NH2
C
2.
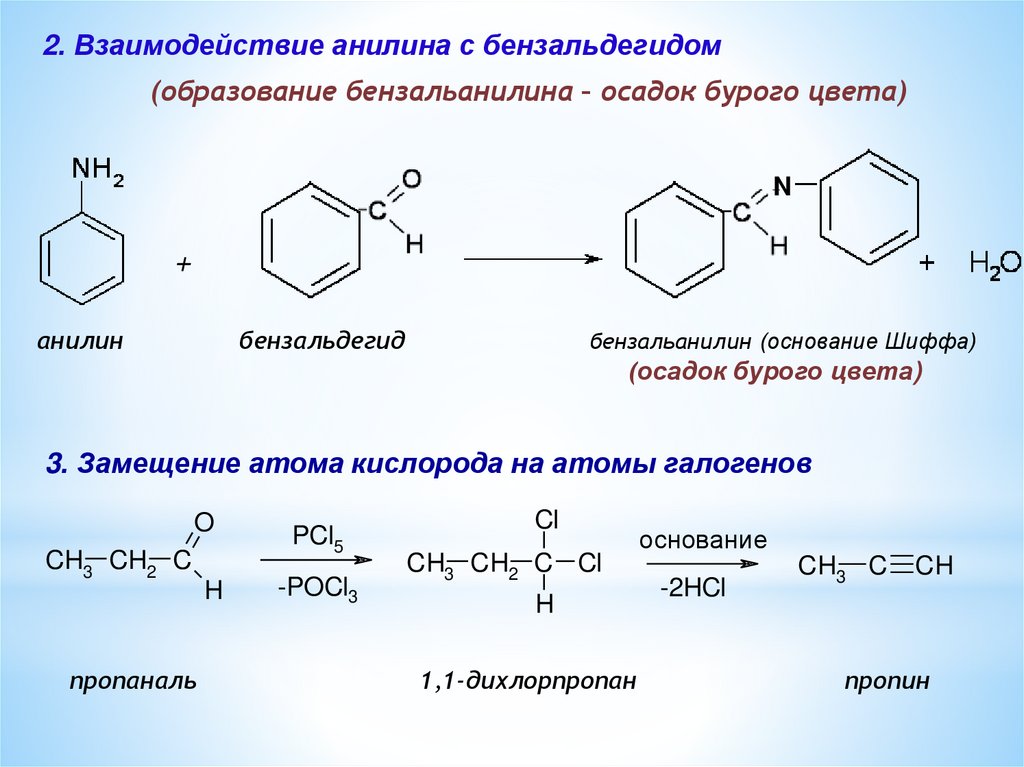
2. Взаимодействие анилина с бензальдегидом(образование бензальанилина – осадок бурого цвета)
N
+
анилин
бензальдегид
бензальанилин (основание Шиффа)
(осадок бурого цвета)
3. Замещение атома кислорода на атомы галогенов
O
CH3 CH2 C
пропаналь
H
PCl5
-POCl3
Cl
CH3 CH2 C Cl
H
1,1-дихлорпропан
основаниe
-2HCl
CH3 C
CH
пропин
3.
Реакции полимеризации(характерны только низших альдегидов)
1. Линейная полимеризация
При испарении или длительном хранении раствора формальдегида присходит
образование полимера – парафармальдегида.
HO CH2 O CH2 O
CH2 O
n
CH2 O CH2 OH
параформальдегид
Полимеризация безводного альдегида в присутствии катализатора –
пентакорбонила железа Fe(CO)5 приводит к образованию высокомолекулярного
соединения – полифармальдегида.
4.
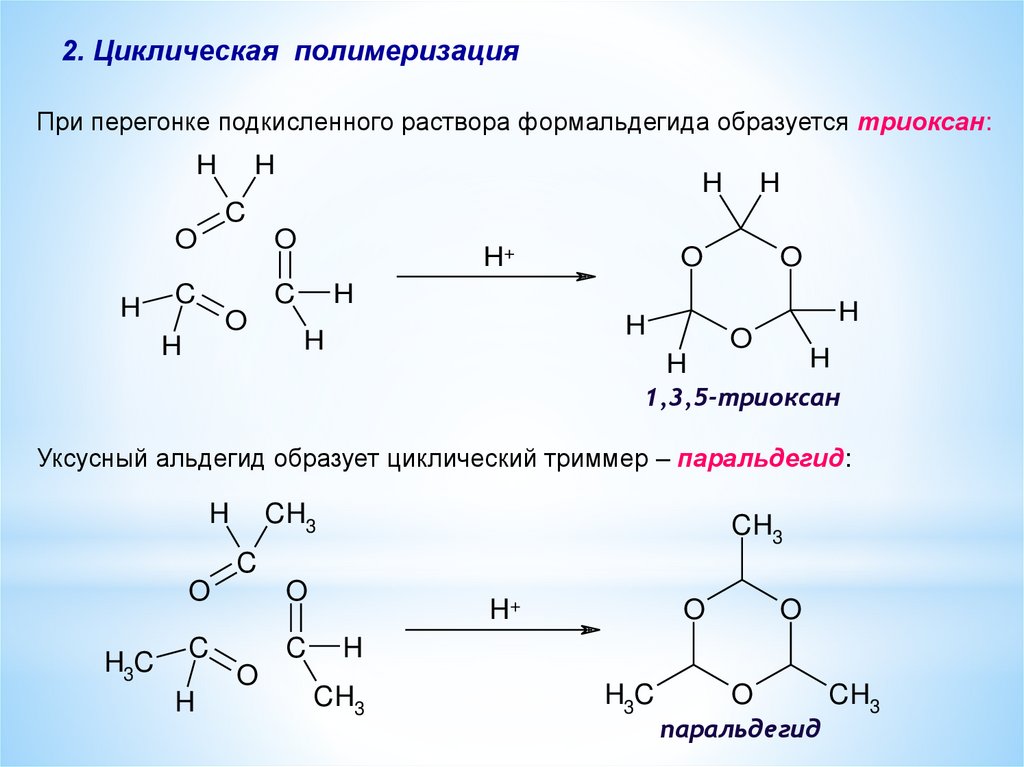
2. Циклическая полимеризацияПри перегонке подкисленного раствора формальдегида образуется триоксан:
H
H
H
H
C
H
O
O
C
C
O
H
H+
O
O
H
H
H
H
O
H
H
1,3,5-триоксан
Уксусный альдегид образует циклический триммер – паральдегид:
H
CH3
CH3
C
H3C
O
O
C
C
O
H
H+
O
O
H
CH3
H3C
O
паральдегид
CH3
5.
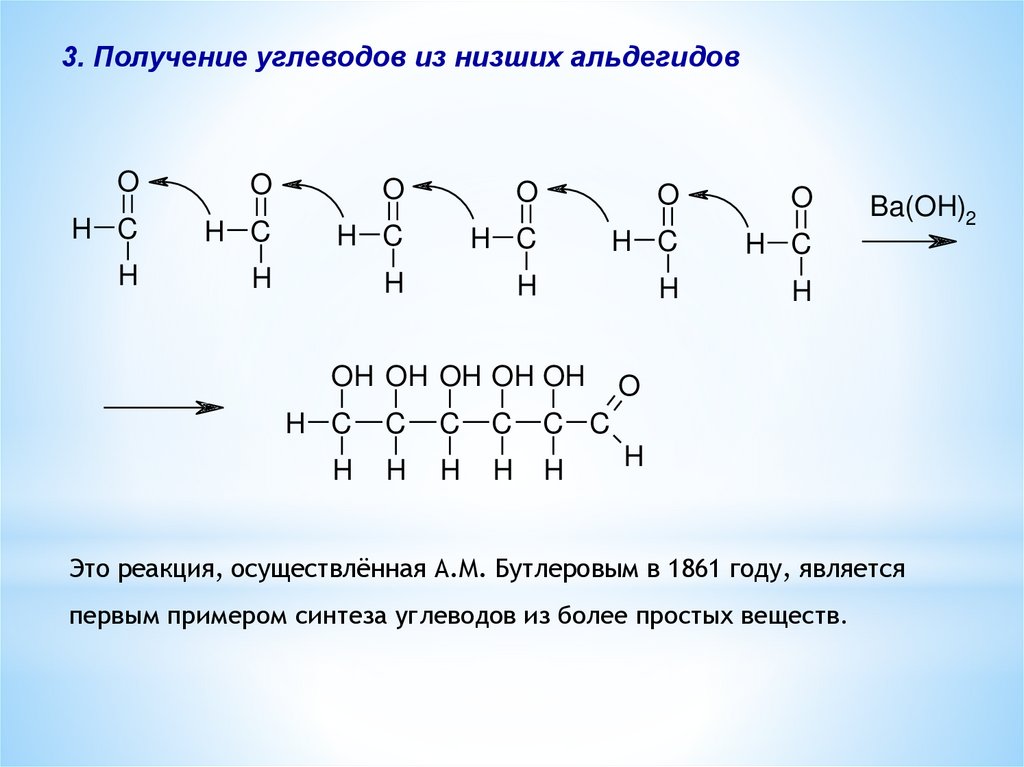
3. Получение углеводов из низших альдегидовO
O
O
O
O
O
H C
H C
H C
H C
H C
H C
H
H
H
H
H
H
OH OH OH OH OH
H C
C
C
C
C C
H
H
H
H
H
Ba(OH)2
O
H
Это реакция, осуществлённая А.М. Бутлеровым в 1861 году, является
первым примером синтеза углеводов из более простых веществ.
6.
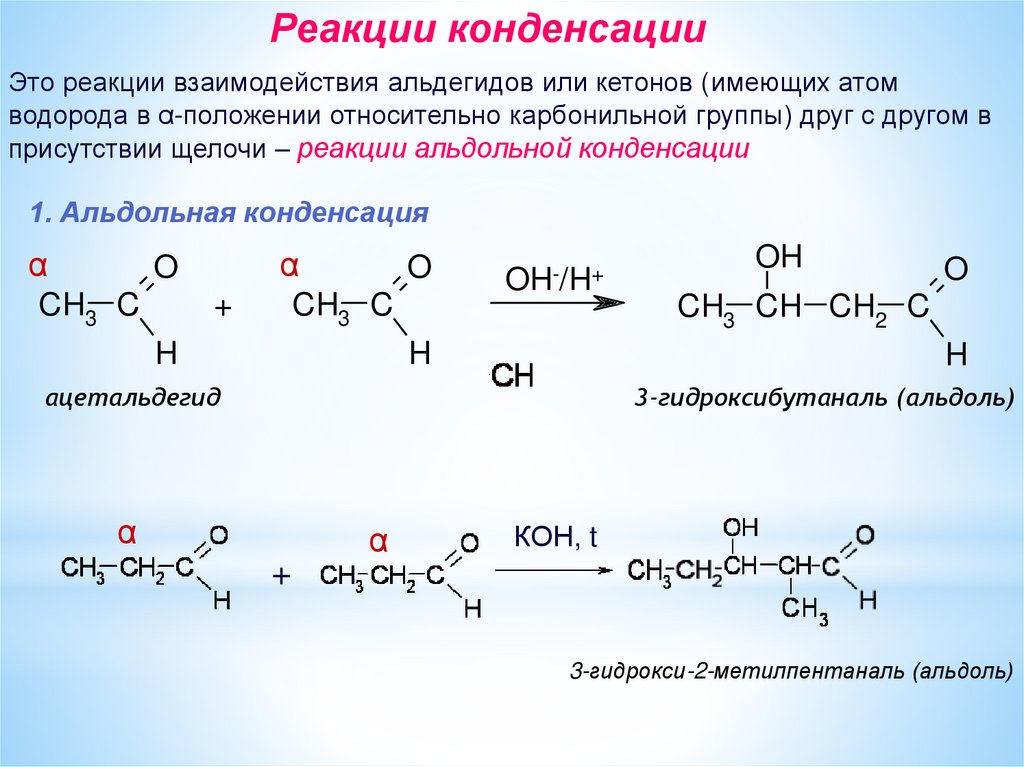
Реакции конденсацииЭто реакции взаимодействия альдегидов или кетонов (имеющих атом
водорода в α-положении относительно карбонильной группы) друг с другом в
присутствии щелочи – реакции альдольной конденсации
1. Альдольная конденсация
α
α
O
CH3 C
O
CH3 C
+
H
OH-/H+
H
OH
O
CH3 CH CH2 C
H
ацетальдегид
3-гидроксибутаналь (альдоль)
α
α
КОН, t
+
3-гидрокси-2-метилпентаналь (альдоль)
7.
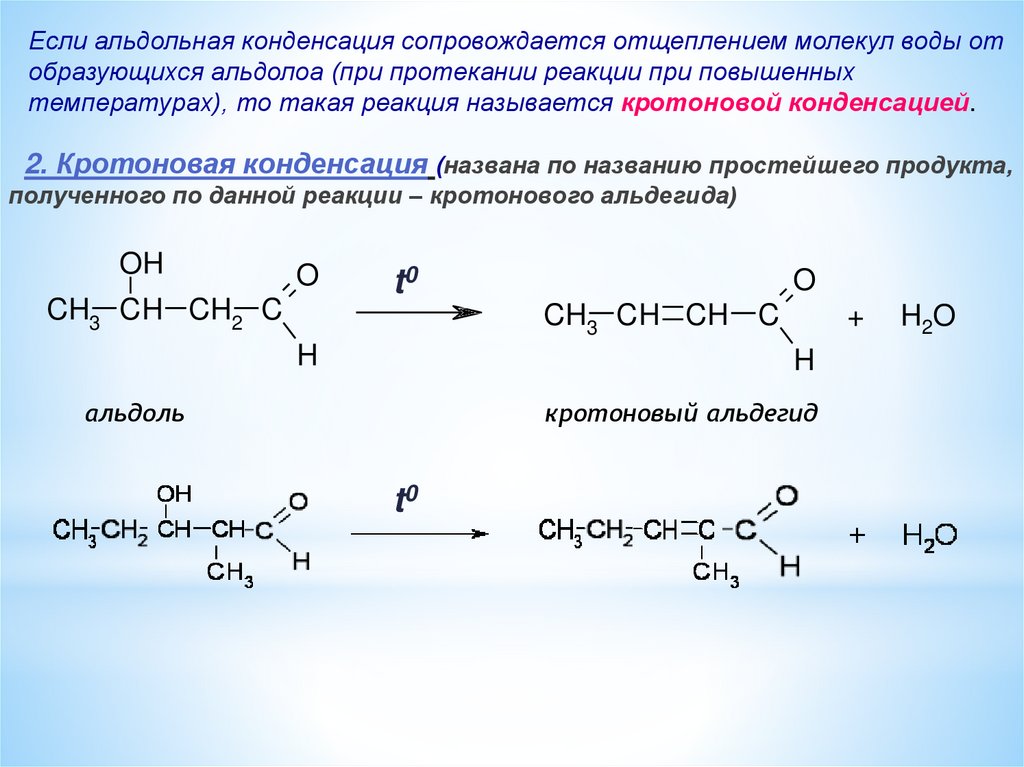
Если альдольная конденсация сопровождается отщеплением молекул воды отобразующихся альдолоа (при протекании реакции при повышенных
температурах), то такая реакция называется кротоновой конденсацией.
2. Кротоновая конденсация (названа по названию простейшего продукта,
полученного по данной реакции – кротонового альдегида)
OH
O
CH3 CH CH2 C
t0
O
CH3 CH CH C
H
+
H
альдоль
кротоновый альдегид
t0
H2O
8.
Альдольная конденсация была открыта практическиодновременно в 1872 году французским химиком Ш.А. Вюрцем
и русским химиком и композитором А.П. Бородиным.
Шарль-Адольф Вюрц
(1817 – 1884)
Александр Порфирьевич Бородин
(1833 —1887)
9.
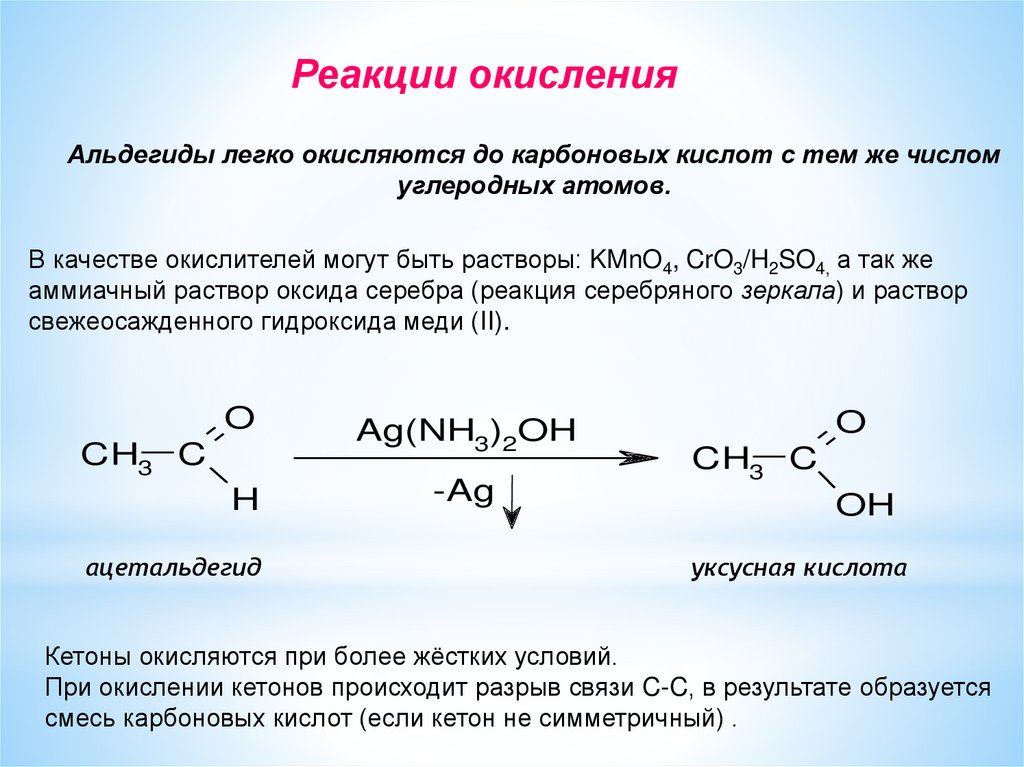
Реакции окисленияАльдегиды легко окисляются до карбоновых кислот с тем же числом
углеродных атомов.
В качестве окислителей могут быть растворы: KMnO4, CrO3/H2SO4, а так же
аммиачный раствор оксида серебра (реакция серебряного зеркала) и раствор
свежеосажденного гидроксида меди (II).
O
CH3 C
H
ацетальдегид
Ag(NH3)2OH
-Ag
O
CH3 C
OH
уксусная кислота
Кетоны окисляются при более жёстких условий.
При окислении кетонов происходит разрыв связи C-C, в результате образуется
смесь карбоновых кислот (если кетон не симметричный) .
10.
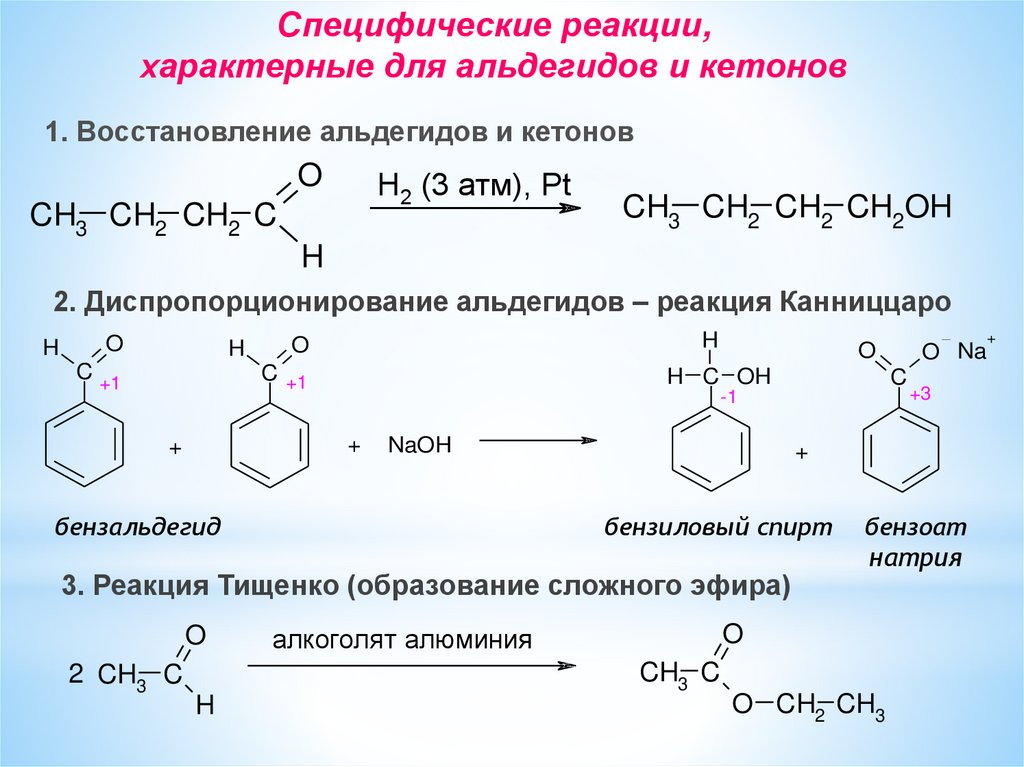
Специфические реакции,характерные для альдегидов и кетонов
1. Восстановление альдегидов и кетонов
O
H2 (3 атм), Pt
CH3 CH2 CH2 C
CH3 CH2 CH2 CH2OH
H
2. Диспропорционирование альдегидов – реакция Канниццаро
H
O
H
C +1
H
O
C +1
H C OH
NaOH
бензальдегид
2 CH3 C
бензиловый спирт
бензоат
натрия
O
алкоголят алюминия
я
CH3 C
H
+3
+
3. Реакция Тищенко (образование сложного эфира)
O
O Na
C
-1
+
+
O
O CH2 CH3
+


 chemistry
chemistry








