Similar presentations:
Альдегиды и кетоны
1. Альдегиды и кетоны
2.
I Номенклатура и изомерияНоменклатура альдегидов
1.
Тривиальная (эмпирическая):
H – CН = O муравьиный альдегид
СН3 – СН = О уксусный альдегид
СН3 – СН2 – СН = О пропионовый альдегид
СН3 – СН2 – СН2 – СН = О масляный альдегид
СН3 – СН2 – СН2 – СН2 – СН = О валериановый альдегид
СН3 – СН2 – СН2 – СН2 – СН2 – СН = О капроновый альдегид
2
28.03.2019
3.
2. Рациональная:Н – С = О формальдегид
|
Н
СН3 – С = О ацетальдегид
|
Н
СН3 – СН2 – С = О метилуксусный альдегид
|
Н
δ
γ
β
α
СН3 – СН – СН2 – СН – С = О α, γ – диметилвалериановый альдегид
|
|
|
СН3
СН3 Н
3
28.03.2019
4.
3. Систематическая (ИЮПАК):Н – С = О метаналь
|
Н
СН3 – С = О
|
Н
этаналь
СН3 – СН2 – С = О пропаналь
|
Н
5
4
3
2
1
СН3 – СН – СН2 – СН – С = О 2, 4 - диметилпентаналь
|
|
|
СН3
СН3 Н
4
3
2
1
СН3 – СН = СН – С = О бутен - 2 - аль
|
4
Н
28.03.2019
5.
Номенклатура кетонов1. Тривиальная:
СН3 – С – СН3 ацетон
||
О
2. Рациональная:
СН3 – С – СН3 диметилкетон
||
О
СН3 – СН2 – С – СН3 метилэтилкетон
||
О
СН3 – СН2 – С – СН2 – СН3
||
О
5
диэтилкетон
СН3 – С – СН – СН3 метилизопропилкетон
||
|
О СН3
28.03.2019
6.
3. Систематическая (ИЮПАК):СН3 – С – СН3 пропанон
||
О
СН3 – СН2 – С – СН3 бутанон
||
О
5
4
3
2
1
СН3 – СН2 – СН2 – С – СН3 пентанон - 2
||
О
1
2
3
4
СН3 – С – СН – СН3 3 – метилбутанон - 2
|| |
О СН3
6
28.03.2019
7.
ІІ Способы получения1.Окисление или каталитическое дегидрирование:
СН3 – СН2
|
ОН
[O]
СН3 – СН2
|
ОН
200°C
СН3 – СН – СН3
|
OH
Cu
[O]
СН3 – С = О
|
Н
СН3 – С = О
|
H
СН3 – С – СН3
||
О
+
+
+
H2
Н2
H2
28.03.2019
7
8.
2. Гидролиз геминальных дигалогенпроизводных:Cl
|
СН3 – СН
|
Cl
+ 2NaOH
Cl
|
СН3 – С – СН3 + 2NaOH
|
Cl
OH
|
[ СН3 – СН ]
|
OH
OH
|
[CH3 – C – CH3]
|
OH
CH3 – C = O
|
H
+ H2O
CH3 – C – CH3 + H2O
||
O
28.03.2019
8
9.
3. Пиролиз карбоновых кислот и их солей:CH3 – C = O
|
400-500°C
+ OH
CuO
CH3 – C = O
|
OH
CH3 – C = O
\
O
\
Ca
/
О
/
CH3 – C = О
CH3 – C – CH3 + CO2 + H2O
||
O
CH3 – C – CH3 + CaCO3
||
O
кальциевая соль
уксусной кислоты (ацетат кальция)
9
28.03.2019
10.
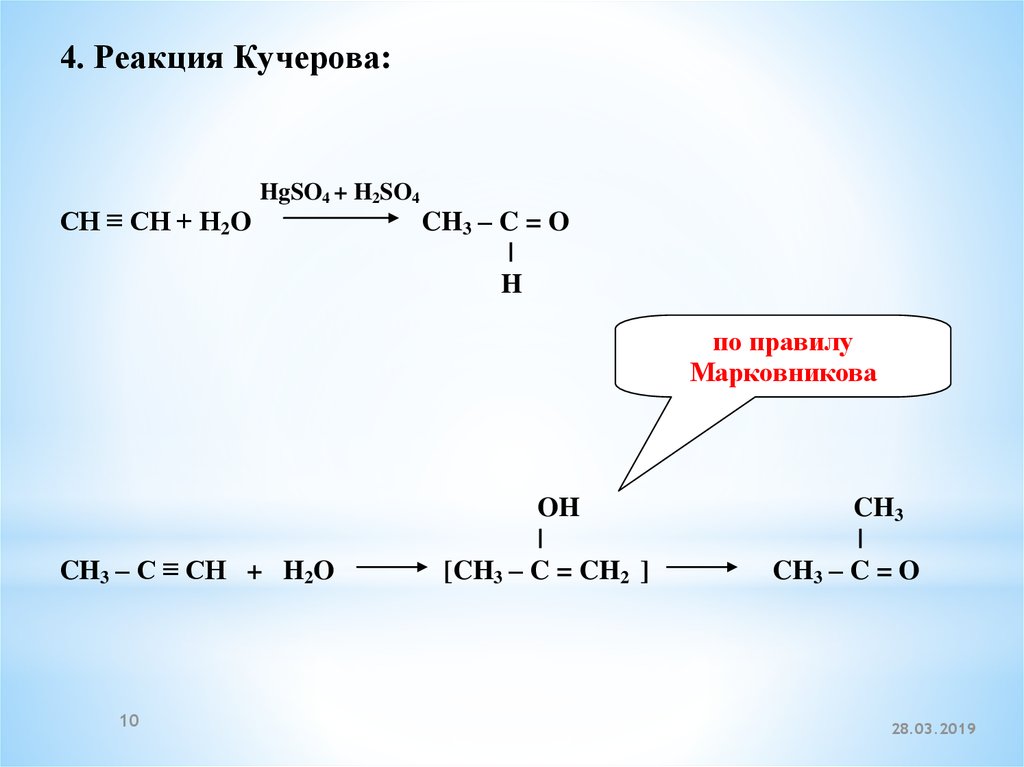
4. Реакция Кучерова:CH ≡ CH + H2O
HgSO4 + H2SO4
CH3 – C = O
|
H
по правилу
Марковникова
CH3 – C ≡ CH + H2O
10
OH
|
[CH3 – C = CH2 ]
CH3
|
CH3 – C = O
28.03.2019
11.
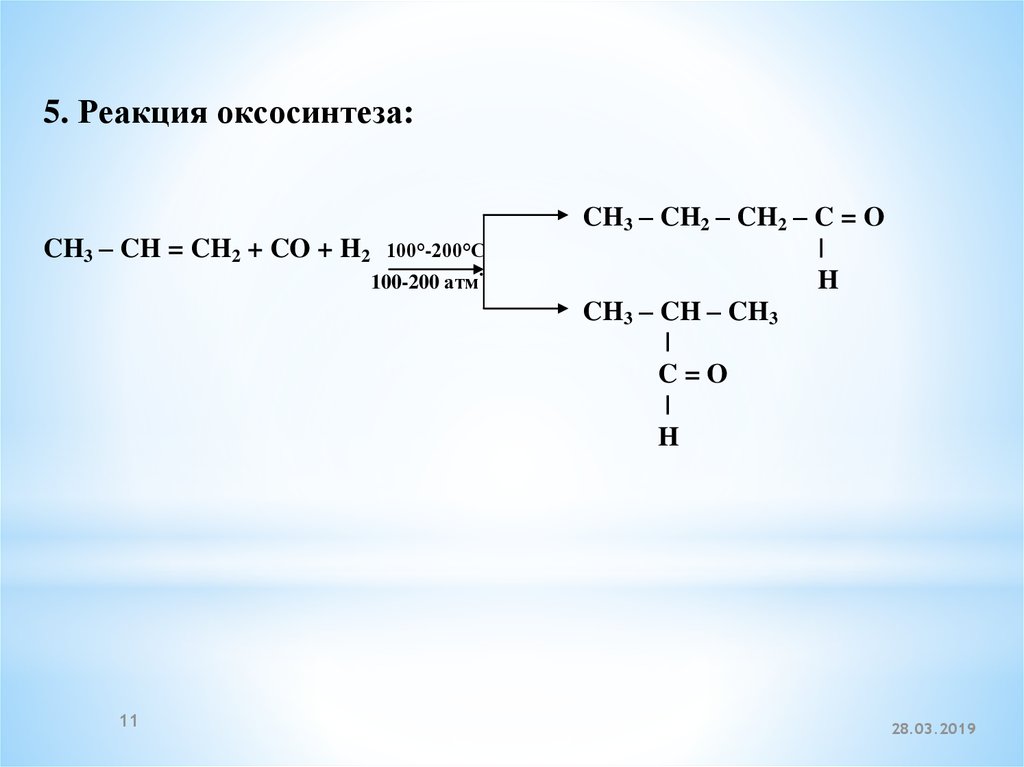
5. Реакция оксосинтеза:CH3 – CH = CH2 + CO + H2
100°-200°C
100-200 атм
11
.
CH3 – CH2 – CH2 – C = O
|
H
CH3 – CH – CH3
|
C=O
|
H
28.03.2019
12.
6. реакция Гаттермана – Коха:- CН = O
AlCl 3
+ CO + HCl
12
+
HCl
28.03.2019
13.
III Химические свойства1. Реакции нуклеофильного присоединения :
Механизм реакции
H
\ δ+ δC=O
/
H
13
+
Z:
H
\
δ-
O
δ+
/
C
/ δH Z
H O–
\ /
С
/ \
H Z
+H2O
H
|
H – C – OH
|
Z
28.03.2019
14.
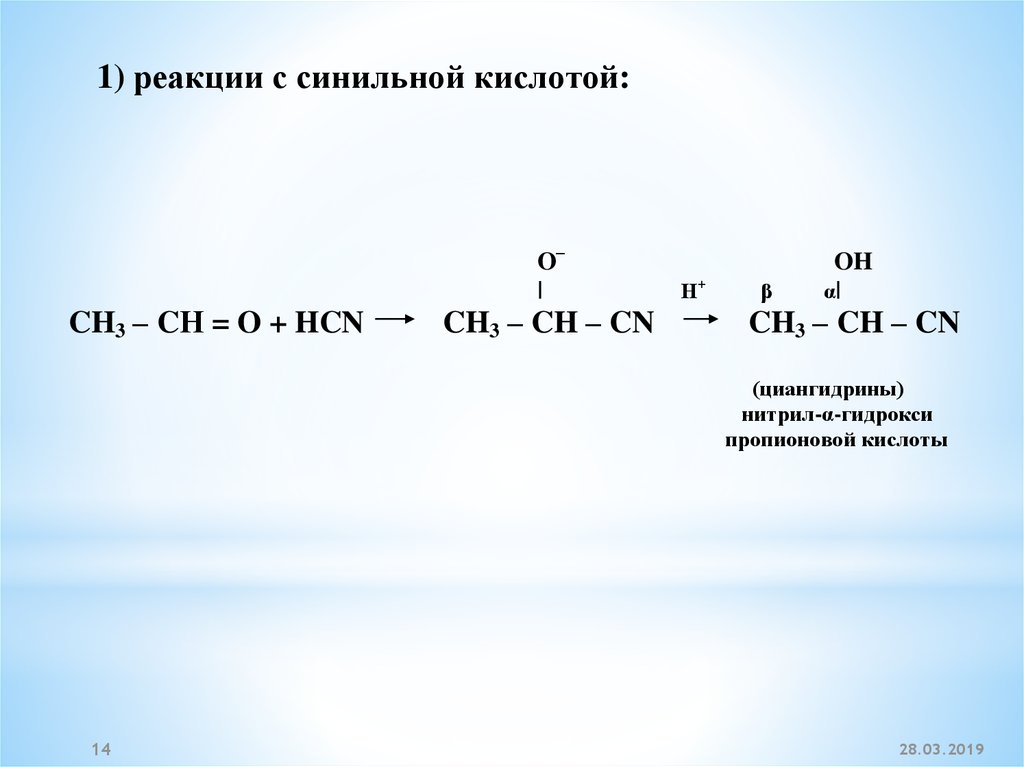
1) реакции с синильной кислотой:O–
|
CH3 – CН = O + HCN
CH3 – CH – CN
+
Н
β
OH
α|
CH3 – CH – CN
(циангидрины)
нитрил-α-гидрокси
пропионовой кислоты
14
28.03.2019
15.
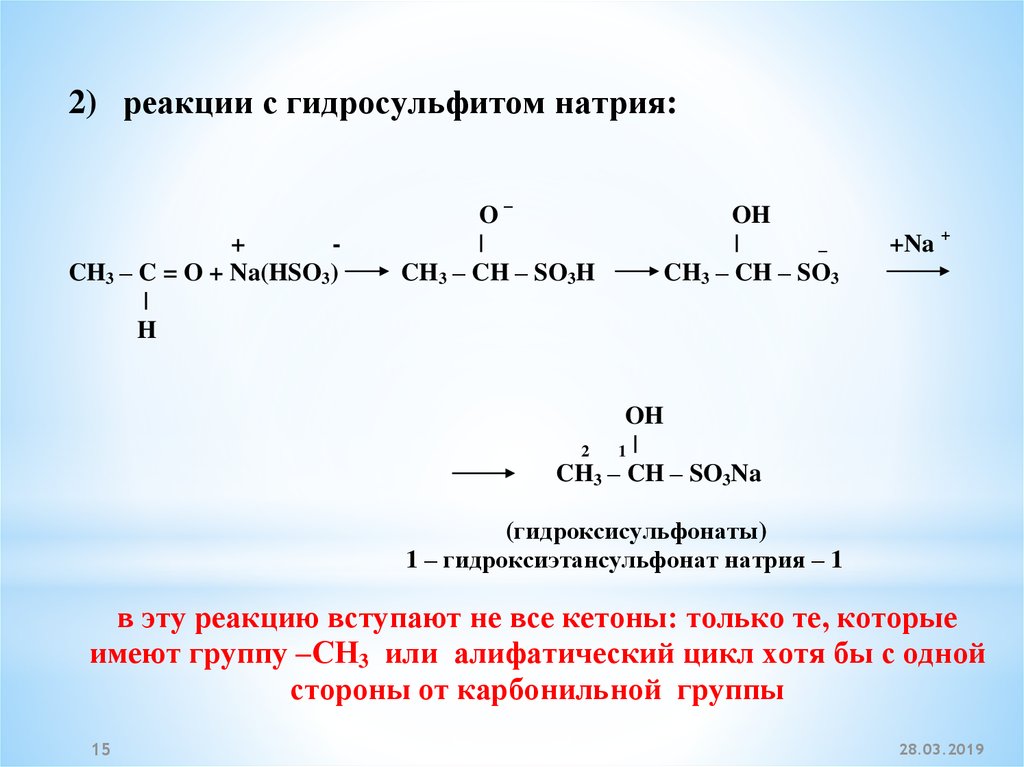
2) реакции с гидросульфитом натрия:+
CH3 – C = O + Na(HSO3)
|
H
O–
|
CH3 – CH – SO3H
OH
|
–
CH3 – CH – SO3
+Na +
OH
2
1|
CH3 – CH – SO3Na
(гидроксисульфонаты)
1 – гидроксиэтансульфонат натрия – 1
в эту реакцию вступают не все кетоны: только те, которые
имеют группу –СН3 или алифатический цикл хотя бы с одной
стороны от карбонильной группы
15
28.03.2019
16.
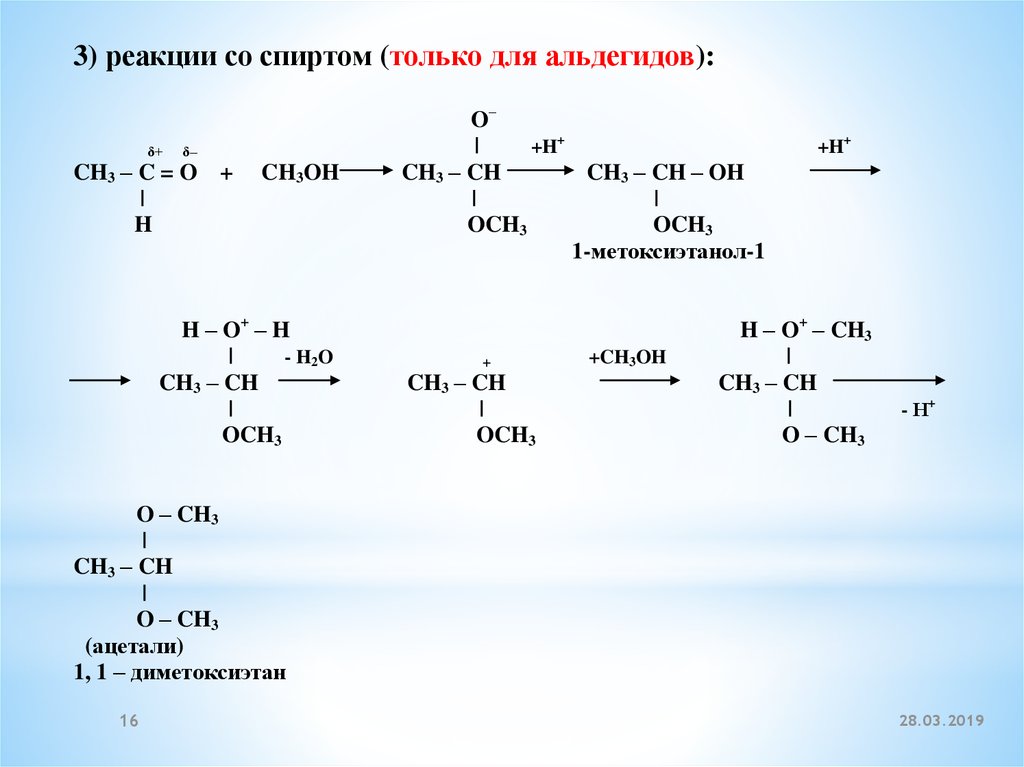
3) реакции со спиртом (только для альдегидов):δ+
δ–
CH3 – C = O +
|
H
CH3OH
H – O+ – H
|
- H2 O
CH3 – CH
|
OCH3
O–
|
+H+
CH3 – CH
CH3 – CH – OH
|
|
OCH3
OCH3
1-метоксиэтанол-1
+
CH3 – CH
|
OCH3
+CH3OH
+H+
H – O+ – CH3
|
CH3 – CH
|
O – CH3
- Н+
O – CH3
|
CH3 – CH
|
O – CH3
(ацетали)
1, 1 – диметоксиэтан
16
28.03.2019
17.
4) реакции с реактивом Гриньяра:OMgCl
δ+ δ-
CH3 – C = O
|
H
17
δ- δ+
+
CH3MgCl
|
CH3 – CH
|
CH3
+Н2О
OH
|
CH3 – CH – CH3
28.03.2019
18.
5) реакции с аммиаком:реакции с аммиаком у альдегидов и кетонов идут по разному
а) альдегиды
CH3 – C = O + NH3
|
H
O–
|
CH3 – CH
|
NH3+
OH
|
CH3 – CH
|
NH2
- H2O
CH3 – CH = NH
имины,
этанальдимин,
ацетальдимин
(NH – имино группа)
18
28.03.2019
19.
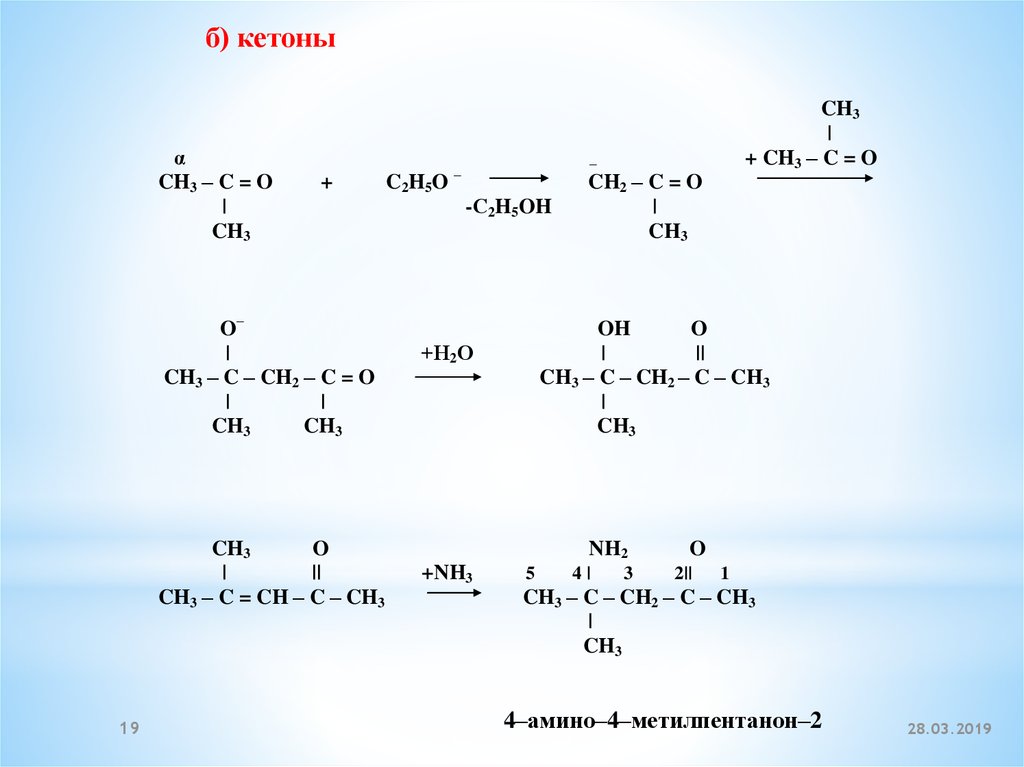
б) кетоныα
CH3 – C = O
|
CH3
+
O–
|
CH3 – C – CH2 – C = O
|
|
CH3
CH3
CH3
O
|
||
CH3 – C = CH – C – CH3
19
C2H5O
CH3
|
+ CH3 – C = O
–
–
-С2H5OH
CH2 – C = O
|
CH3
OH
O
|
||
CH3 – C – CH2 – C – CH3
|
CH3
+Н2О
NH2
+NH3
5
4|
3
O
2||
1
CH3 – C – CH2 – C – CH3
|
CH3
4–амино–4–метилпентанон–2
28.03.2019
20.
6) реакции с производными аммиака:CH3–C=O + NH2–OH
| гидроксиламин
H
CH3–C=O + NH2–NH2
|
гидразин
Н
O–
OH
|
| - H2 O
CH3–CH
CH3–CH
CH3–CH=N–OH
|
(оксимы)
+|
NH2 – OH
NH – OH этанальдоксим
+CH3–CН=O
CH3–CH=N–NH2
этанальгидразон
CH3 – C = O+ NH2 – NH – C6H5
|
фенилгидразин
H
CH3–CH=N–N=CH–CH3
азины
(этанальдазин)
CH3 – CH = N – NH
|
этанальфенилгидразон
20
28.03.2019
21.
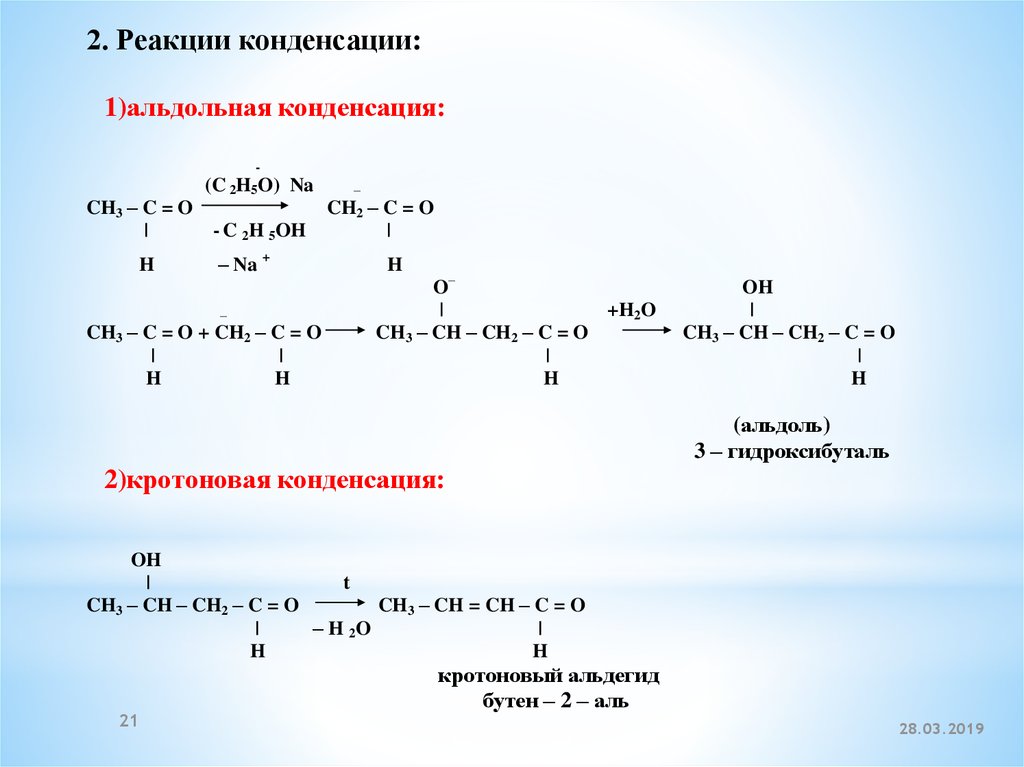
2. Реакции конденсации:1)альдольная конденсация:
-
(C 2H5O) Na
CH3 – C = O
|
- C 2H 5OH
H
– Na +
–
CH3 – C = O + CH2 – C = O
|
|
H
H
–
CH2 – C = O
|
H
O–
|
+H2O
CH3 – CH – CH2 – C = O
|
H
OH
|
CH3 – CH – CH2 – C = O
|
H
(альдоль)
3 – гидроксибуталь
2)кротоновая конденсация:
OH
|
t
CH3 – CH – CH2 – C = O
CH3 – CH = CH – C = O
|
– H 2O
|
H
H
21
кротоновый альдегид
бутен – 2 – аль
28.03.2019
22.
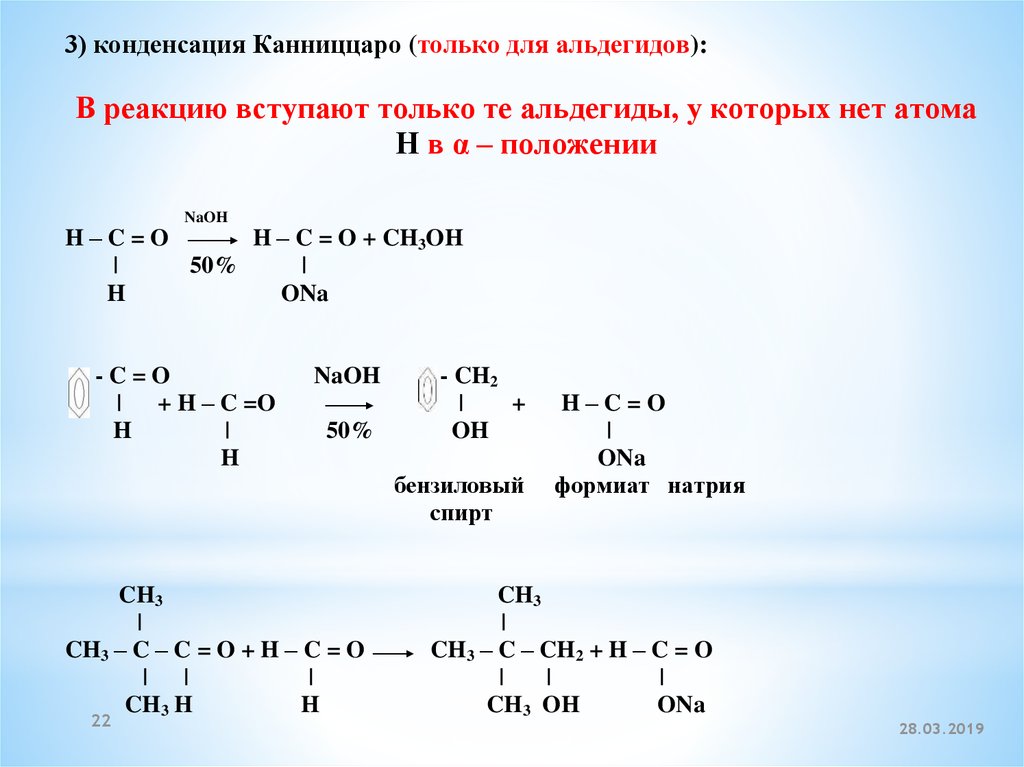
3) конденсация Канниццаро (только для альдегидов):В реакцию вступают только те альдегиды, у которых нет атома
Н в α – положении
NaOH
H–C=O
H – C = O + CH3OH
|
50%
|
H
ONa
-C=O
| + H – C =O
H
|
H
NaOH
50%
- CH2
|
+
OH
бензиловый
спирт
CH3
|
CH3 – C – C = O + H – C = O
| |
|
CH3 H
H
22
H–C=O
|
ONa
формиат натрия
CH3
|
CH3 – C – CH2 + H – C = O
|
|
|
CH3 OH
ONa
28.03.2019
23.
4) конденсация Тищенко (только для альдегидов):CH3 – C = O + CH3 – C = O
|
|
H
H
(C2H5O) 3Al
CH3 – C = O
|
O – CH2 – CH3
этилацетат (этиловый эфир уксусной кислоты)
23
28.03.2019
24.
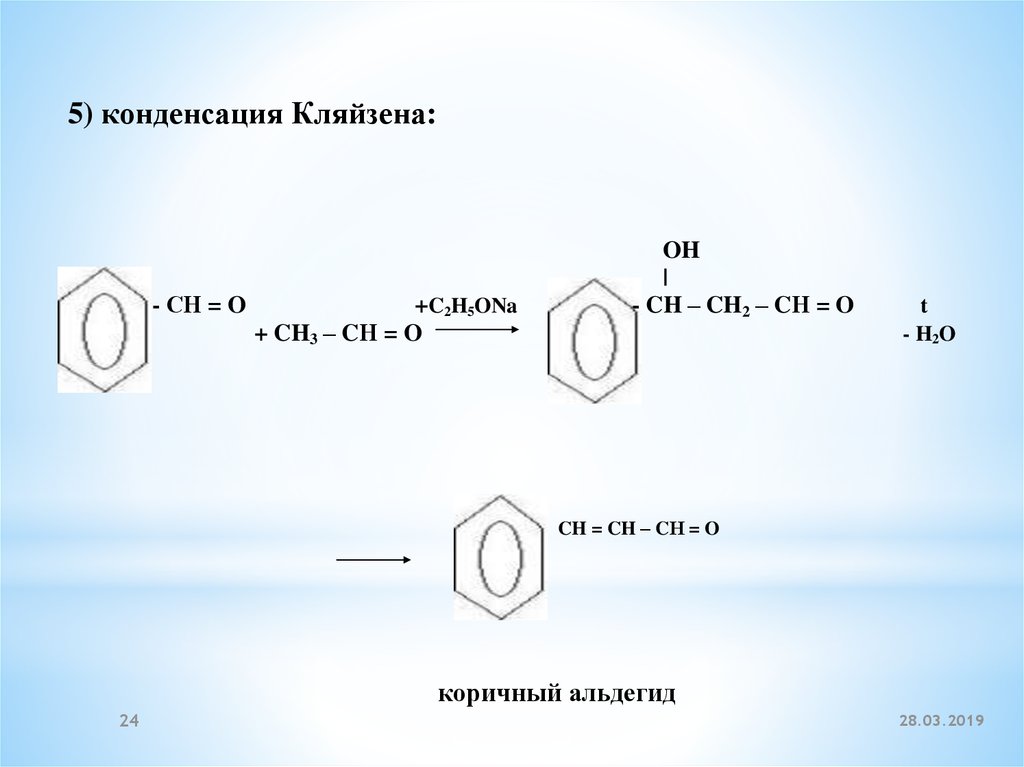
5) конденсация Кляйзена:- СН = O
+C2H5ONa
+ CH3 – CН = O
OH
|
- CH – CH2 – CН = O
t
- H2O
CH = CH – CН = O
коричный альдегид
24
28.03.2019
25.
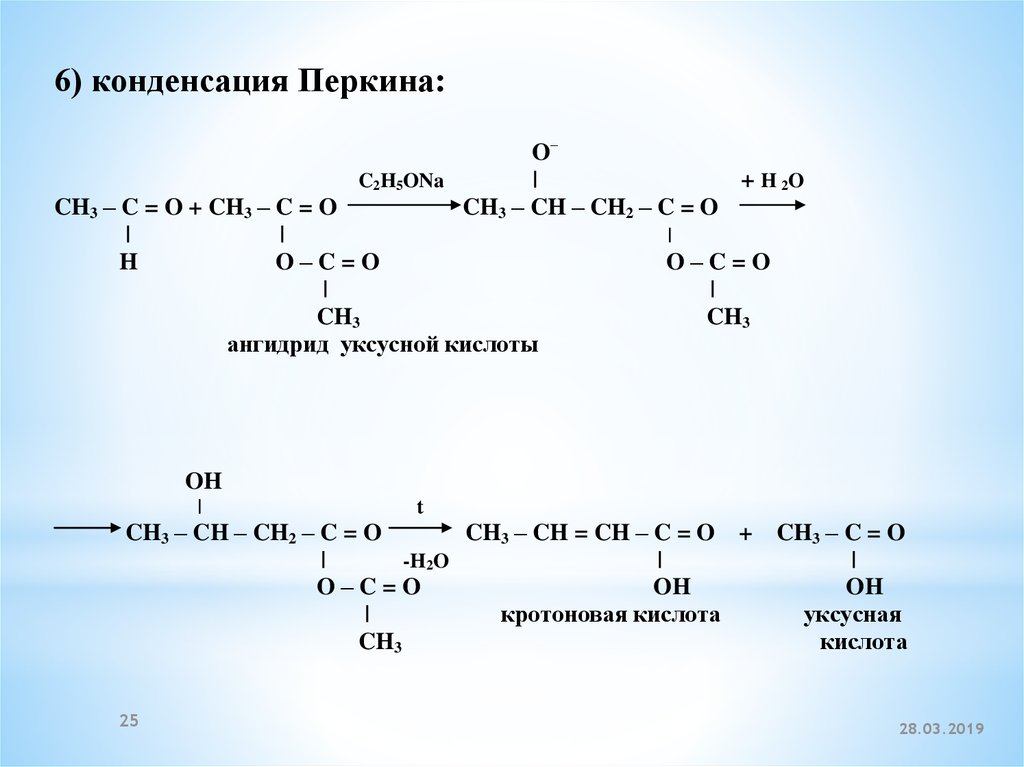
6) конденсация Перкина:O–
C2H5ONa
|
+ H 2O
CH3 – C = O + CH3 – C = O
CH3 – CH – CH2 – C = O
|
|
|
H
O–C=O
O–C=O
|
|
CH3
CH3
ангидрид уксусной кислоты
OH
|
t
CH3 – CH – CH2 – C = O
CH3 – CH = CH – C = O + CH3 – C = O
|
-H2O
|
|
O–C=O
OH
OH
|
кротоновая кислота
уксусная
CH3
кислота
25
28.03.2019
26.
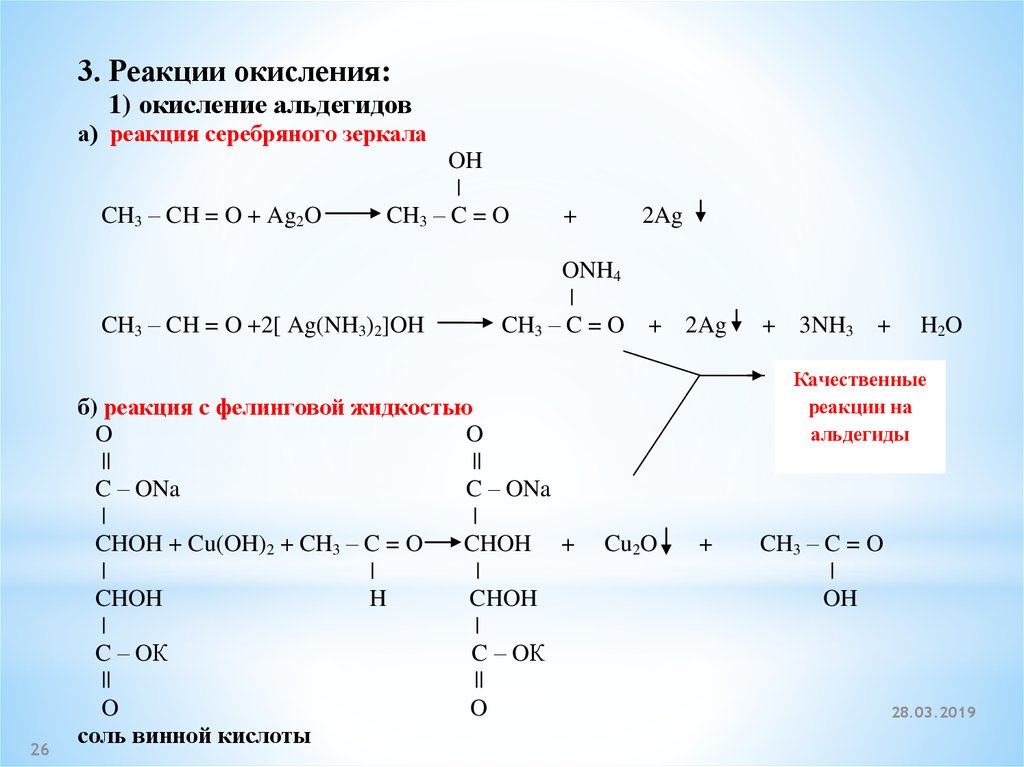
3. Реакции окисления:1) окисление альдегидов
а) реакция серебряного зеркала
CH3 – CH = O + Ag2O
OH
|
CH3 – C = O
CH3 – CH = O +2[ Ag(NH3)2]OH
26
+
2Ag
ONH4
|
CH3 – C = O + 2Ag
б) реакция с фелинговой жидкостью
O
O
||
||
C – ONa
C – ONa
|
|
CHOH + Cu(OH)2 + CH3 – C = O
CHOH +
|
|
|
CHOH
H
CHOH
|
|
C – OК
C – OК
||
||
O
O
соль винной кислоты
+ 3NH3 +
H2O
Качественные
реакции на
альдегиды
Cu2O
+
CH3 – C = O
|
OH
28.03.2019
27.
28.
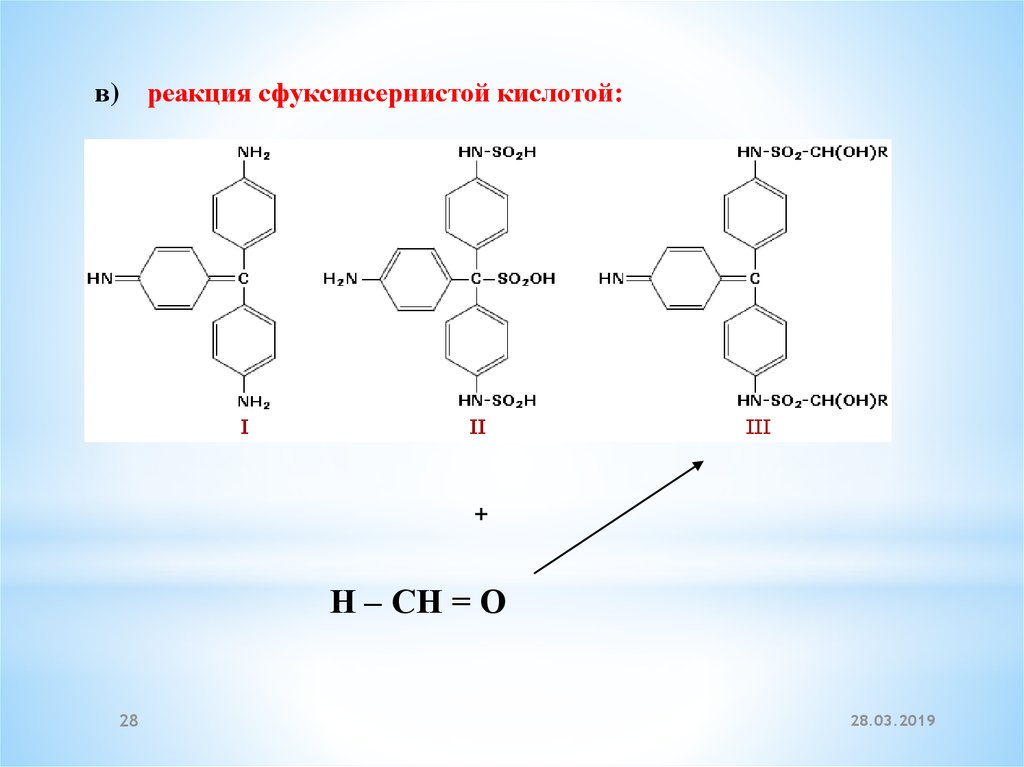
в)реакция сфуксинсернистой кислотой:
+
Н – СН = О
28
28.03.2019
29.
30.
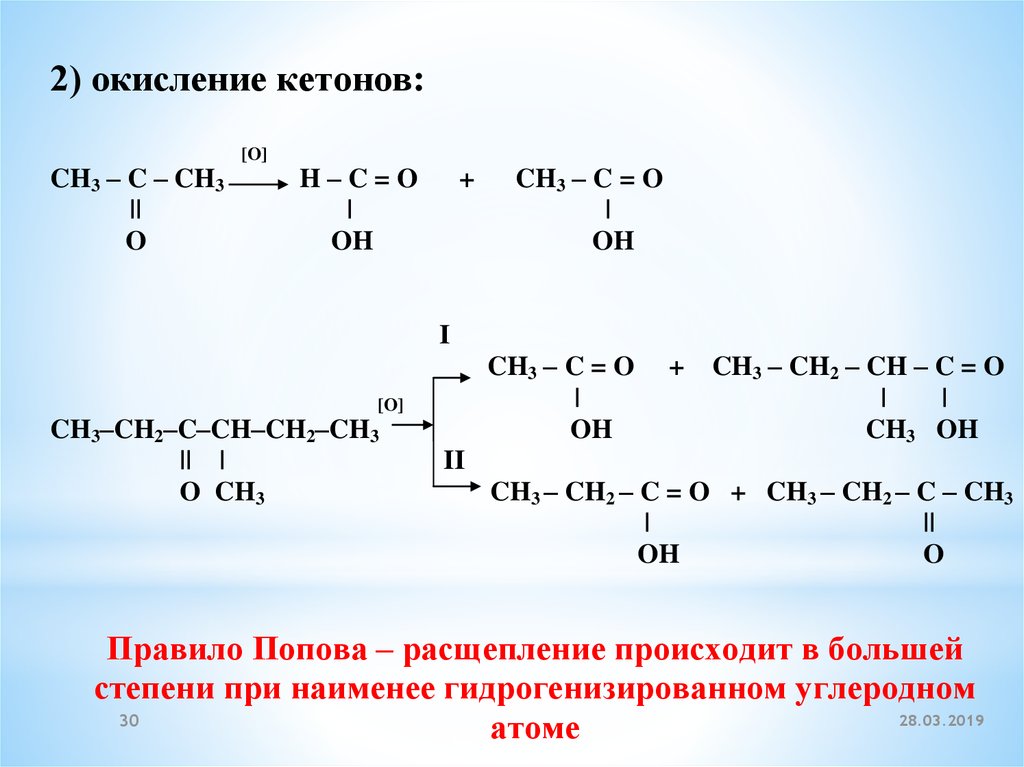
2) окисление кетонов:CH3 – C – CH3
||
O
[O]
H–C=O
|
OH
+
CH3 – C = O
|
OH
I
CH3 – C = O
|
OH
[O]
CH3–CH2–C–CH–CH2–CH3
|| |
O CH3
+
CH3 – CH2 – CH – C = O
|
|
CH3 OH
II
CH3 – CH2 – C = O + CH3 – CH2 – C – CH3
|
||
OH
O
Правило Попова – расщепление происходит в большей
степени при наименее гидрогенизированном углеродном
28.03.2019
30
атоме
31.
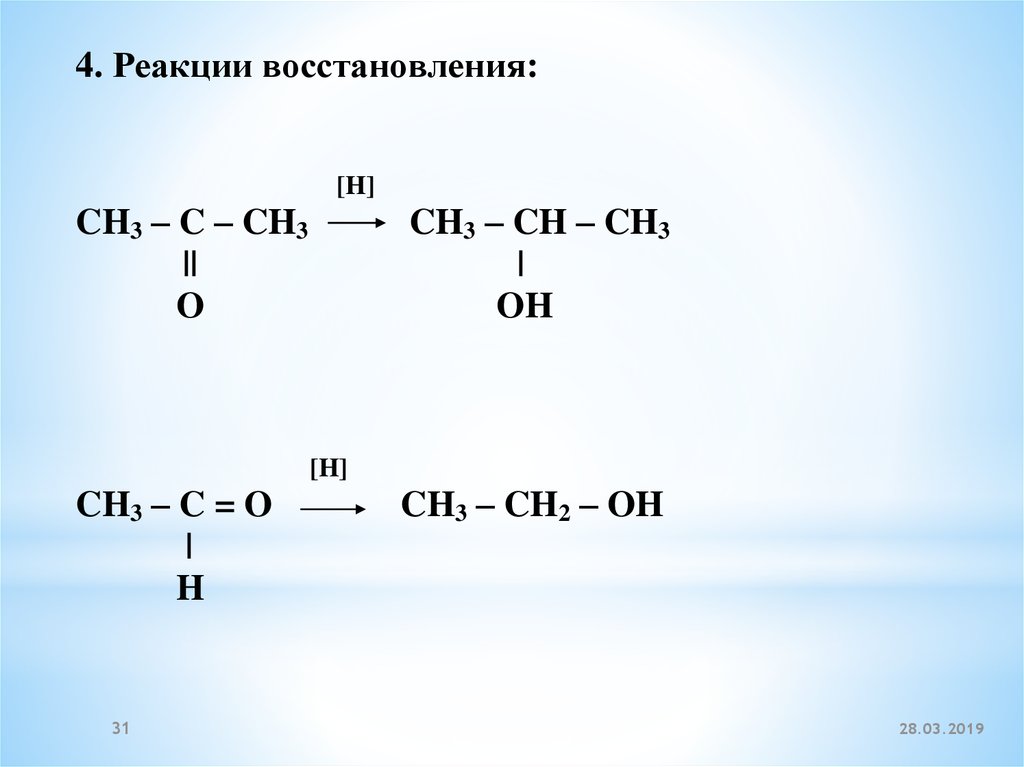
4. Реакции восстановления:[H]
CH3 – C – CH3
||
O
CH3 – CH – CH3
|
OH
[H]
CH3 – C = O
|
H
31
CH3 – CH2 – OH
28.03.2019
32.
5. Реакции полимеризации (только для альдегидов):nH–C=O
|
H
[ – CH2 – O – ]n
параформальдегид (полиформальдегид)
Могут образоваться циклические соединения
O
/
\
3H–C=O
CH2 CH2
|
|
|
H
O
O
\
/
CH2
триоксиметилен
32
или
CH2 – O
/
\
O
CH2
|
|
CH2
O
\
/
O – CH2
тетраоксиметилен
28.03.2019
33.
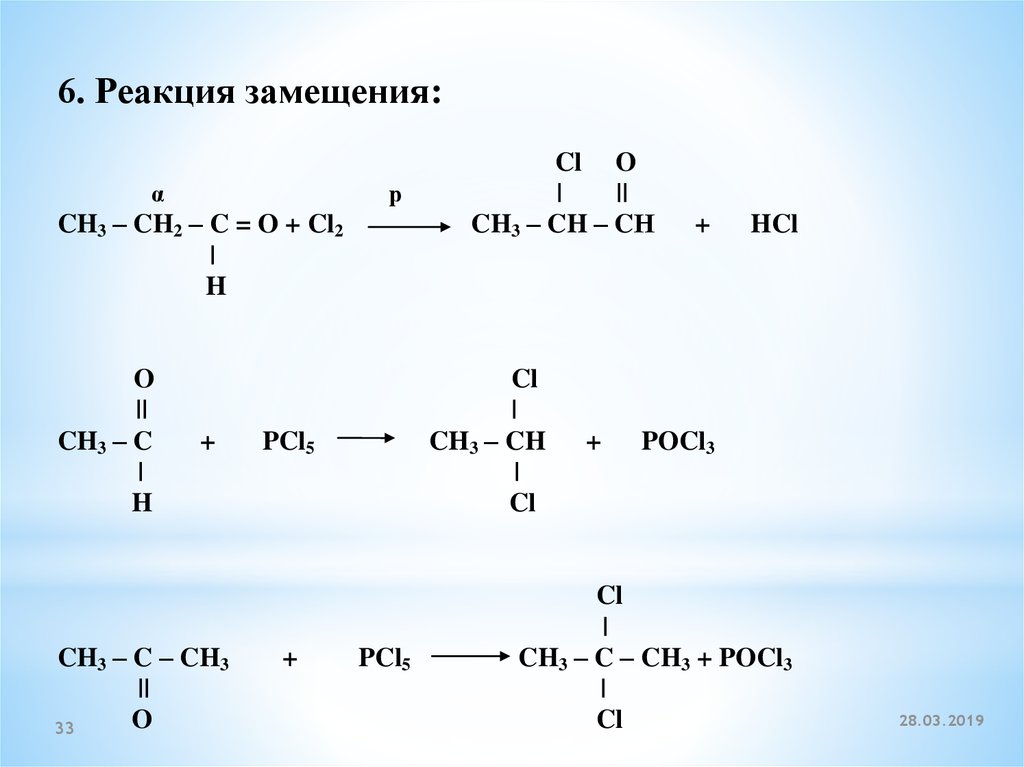
6. Реакция замещения:α
р
CH3 – CH2 – C = O + Cl2
|
H
O
||
CH3 – C
|
H
+
CH3 – C – CH3
||
O
33
Cl
|
CH3 – CH
|
Cl
PCl5
+
Cl O
|
||
CH3 – CH – CН
PCl5
+
+
HCl
POCl3
Cl
|
CH3 – C – CH3 + POCl3
|
Cl
28.03.2019
34. Спасибо за Ваше внимание!
3428.03.2019



















 chemistry
chemistry








