Similar presentations:
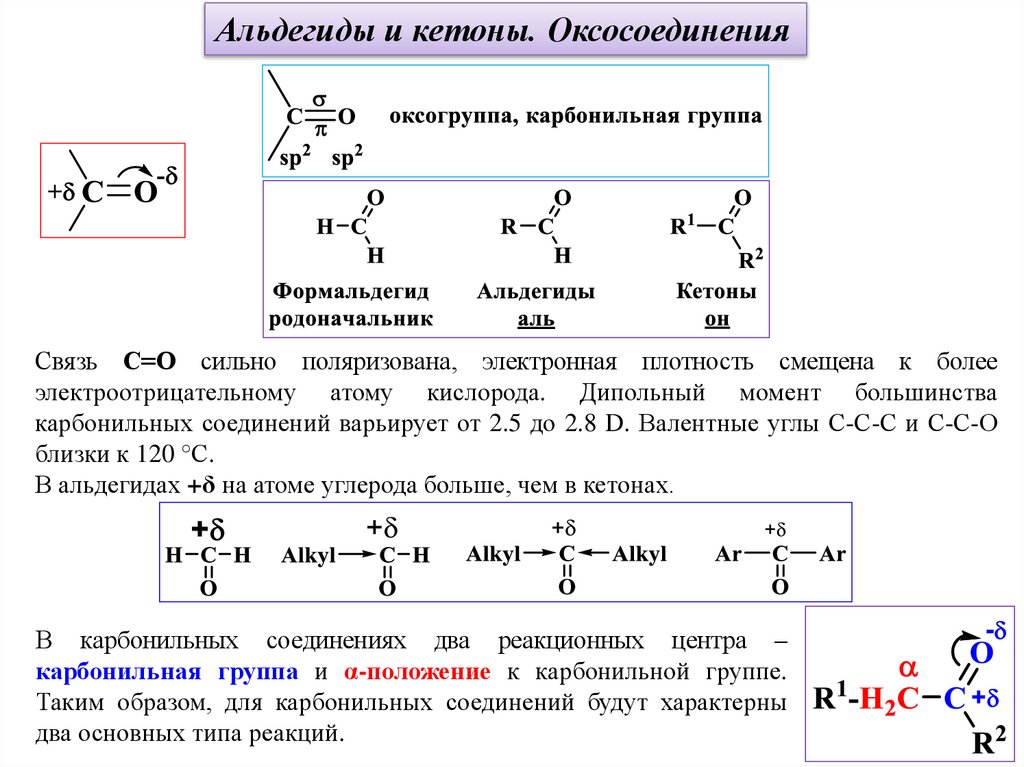
Альдегиды и кетоны. Оксосоединения
1.
Альдегиды и кетоны. ОксосоединенияСвязь С=О сильно поляризована, электронная плотность смещена к более
электроотрицательному атому кислорода. Дипольный момент большинства
карбонильных соединений варьирует от 2.5 до 2.8 D. Валентные углы С-С-С и С-С-О
близки к 120 °С.
В альдегидах +δ на атоме углерода больше, чем в кетонах.
В карбонильных соединениях два реакционных центра –
карбонильная группа и α-положение к карбонильной группе.
Таким образом, для карбонильных соединений будут характерны
два основных типа реакций.
2.
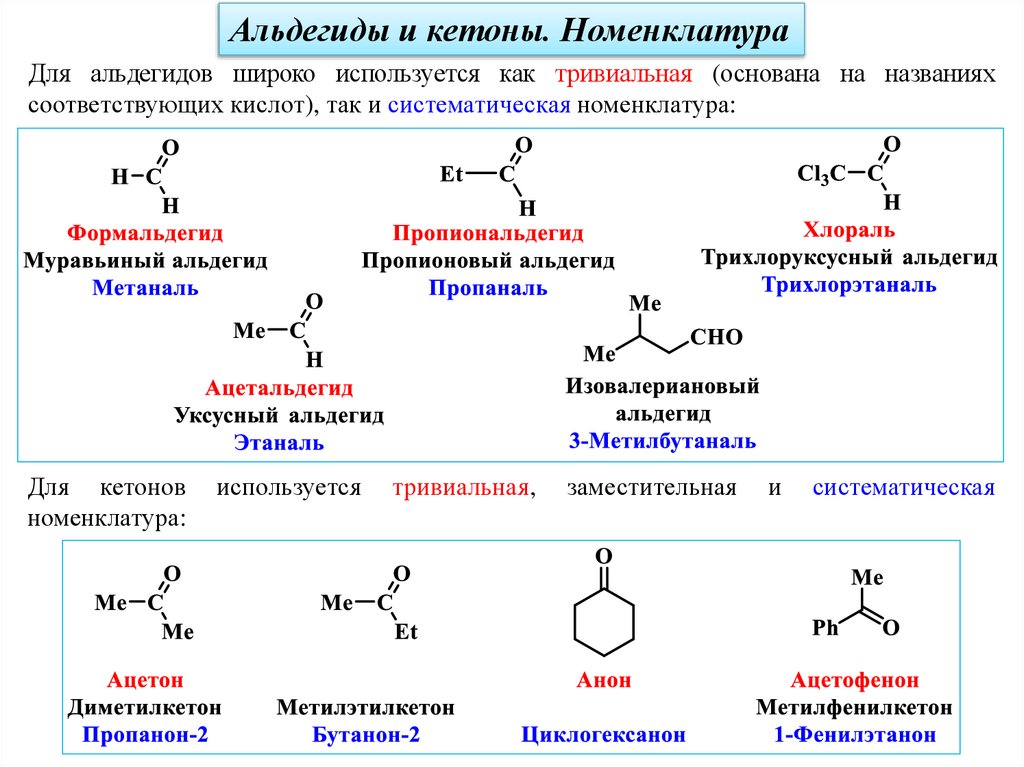
Альдегиды и кетоны. НоменклатураДля альдегидов широко используется как тривиальная (основана на названиях
соответствующих кислот), так и систематическая номенклатура:
Для кетонов
номенклатура:
используется
тривиальная,
заместительная
и
систематическая
3.
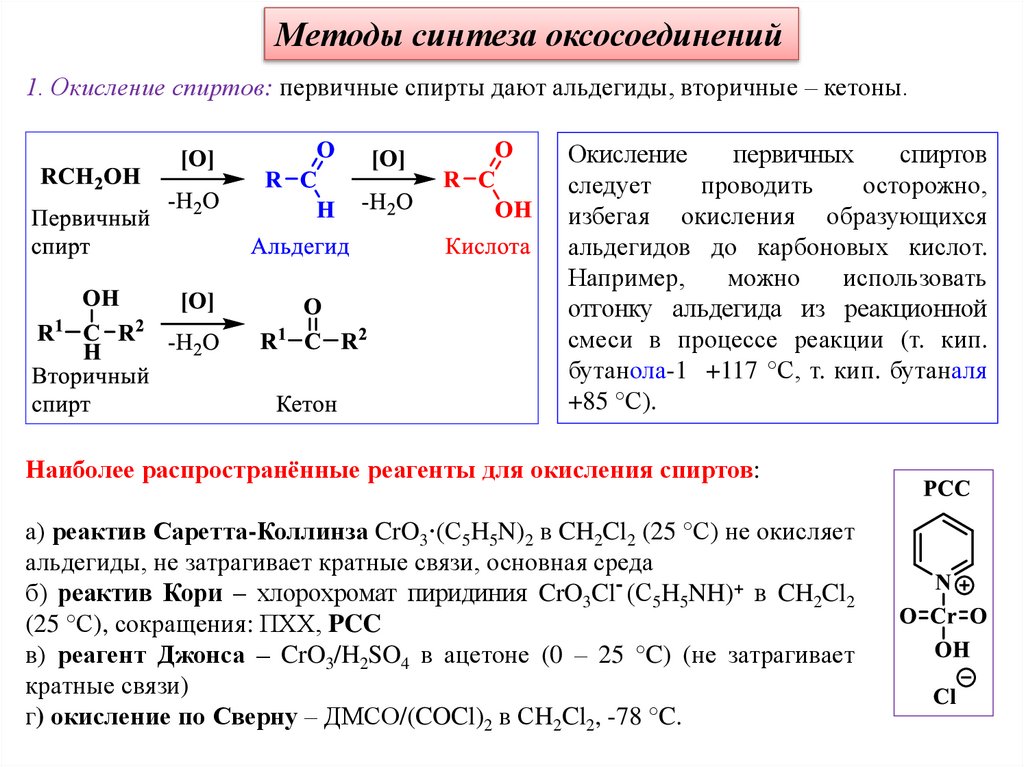
Методы синтеза оксосоединений1. Окисление спиртов: первичные спирты дают альдегиды, вторичные – кетоны.
Окисление
первичных
спиртов
следует
проводить
осторожно,
избегая окисления образующихся
альдегидов до карбоновых кислот.
Например,
можно
использовать
отгонку альдегида из реакционной
смеси в процессе реакции (т. кип.
бутанола-1 +117 °С, т. кип. бутаналя
+85 °С).
Наиболее распространённые реагенты для окисления спиртов:
а) реактив Саретта-Коллинза CrO3·(С5H5N)2 в CH2Cl2 (25 °С) не окисляет
альдегиды, не затрагивает кратные связи, основная среда
б) реактив Кори – хлорохромат пиридиния CrO3Cl- (С5H5NH)+ в CH2Cl2
(25 °С), сокращения: ПХХ, PCC
в) реагент Джонса – CrO3/H2SO4 в ацетоне (0 – 25 °C) (не затрагивает
кратные связи)
г) окисление по Сверну – ДМСО/(COCl)2 в СH2Cl2, -78 °C.
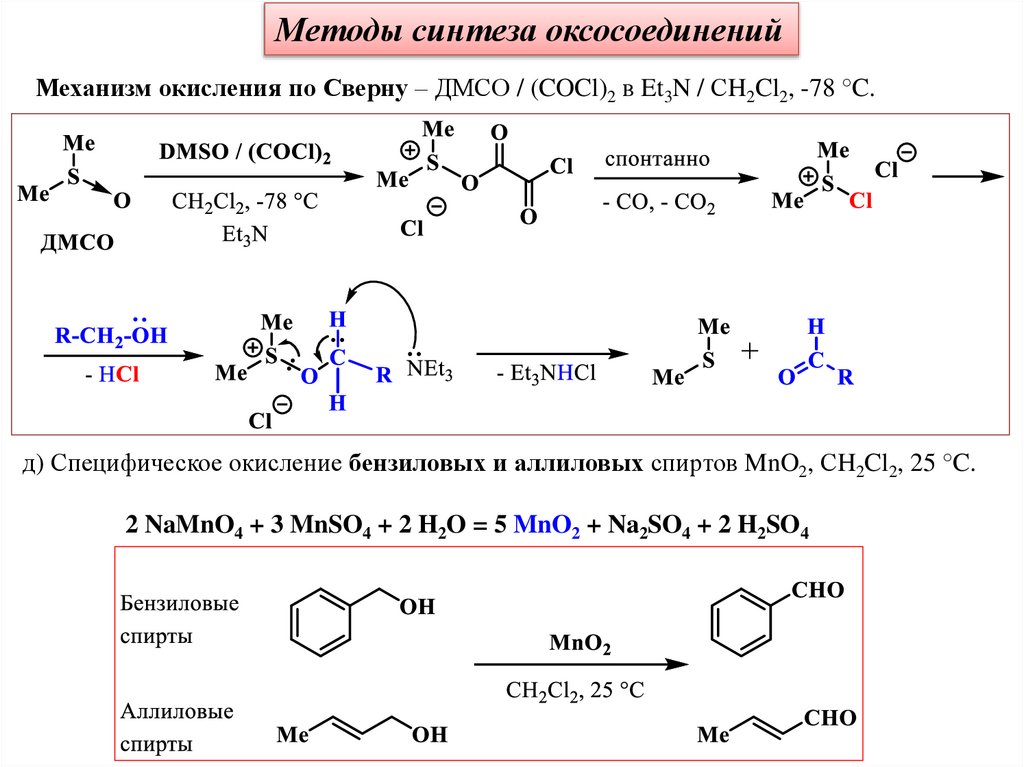
4.
Методы синтеза оксосоединенийМеханизм окисления по Сверну – ДМСО / (COCl)2 в Et3N / СH2Cl2, -78 °C.
д) Специфическое окисление бензиловых и аллиловых спиртов MnO2, СH2Cl2, 25 °C.
2 NaMnO4 + 3 MnSO4 + 2 H2O = 5 MnO2 + Na2SO4 + 2 H2SO4
5.
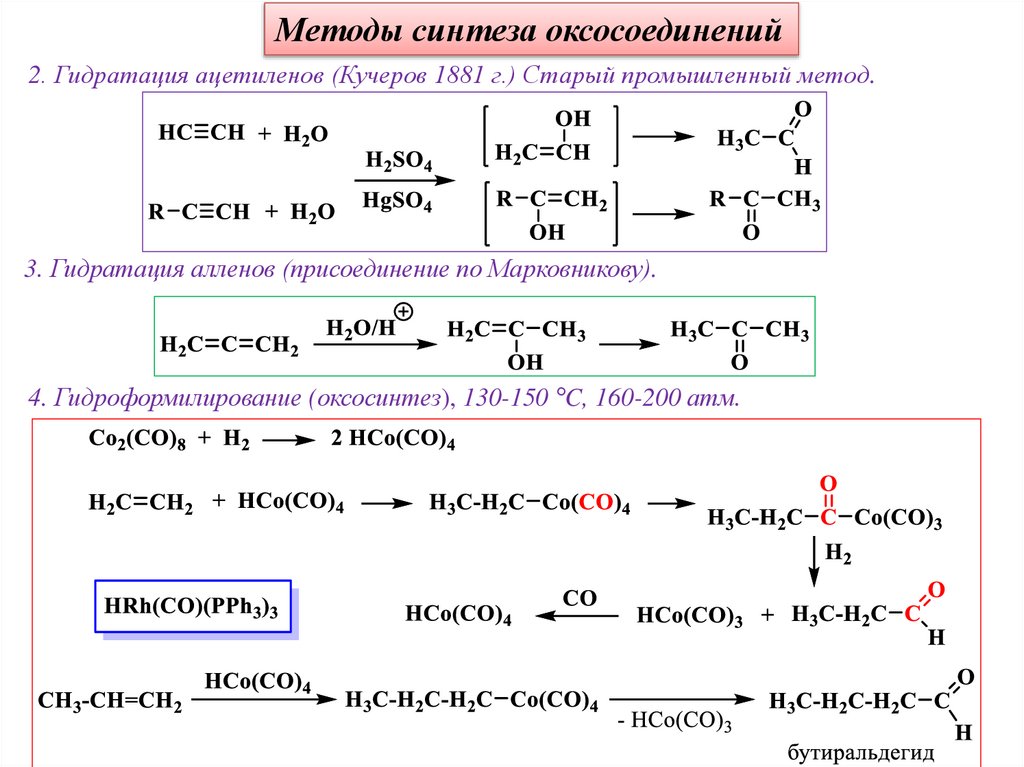
Методы синтеза оксосоединений2. Гидратация ацетиленов (Кучеров 1881 г.) Старый промышленный метод.
3. Гидратация алленов (присоединение по Марковникову).
4. Гидроформилирование (оксосинтез), 130-150 °C, 160-200 атм.
6.
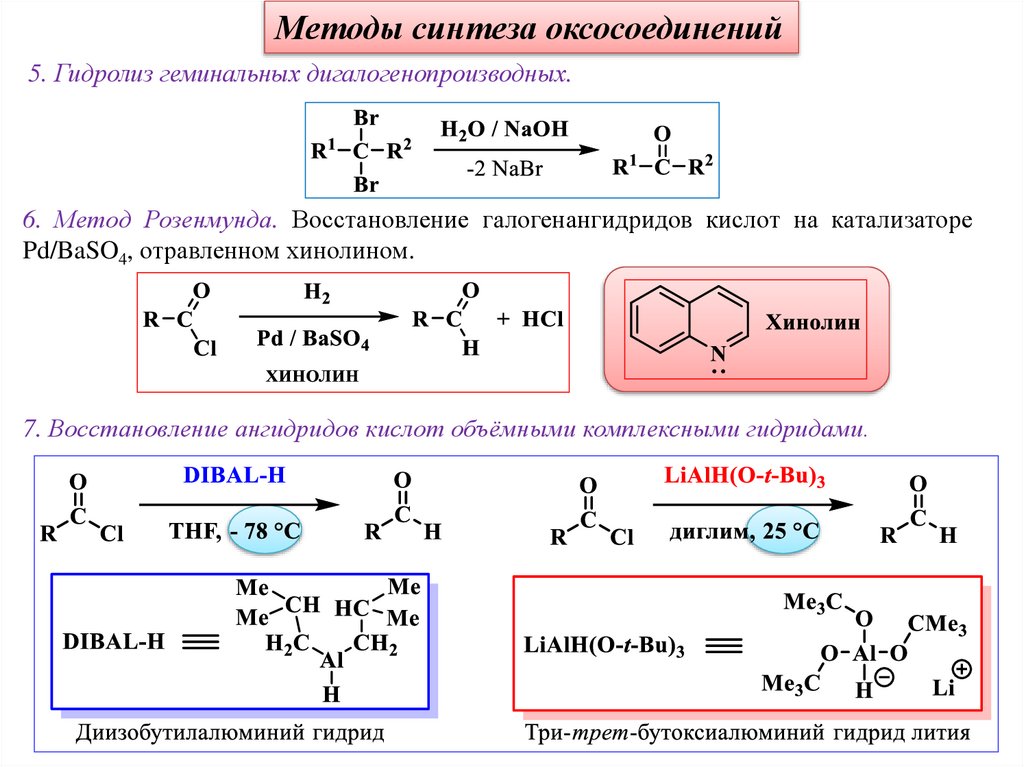
Методы синтеза оксосоединений5. Гидролиз геминальных дигалогенопроизводных.
6. Метод Розенмунда. Восстановление галогенангидридов кислот на катализаторе
Pd/BaSO4, отравленном хинолином.
7. Восстановление ангидридов кислот объёмными комплексными гидридами.
7.
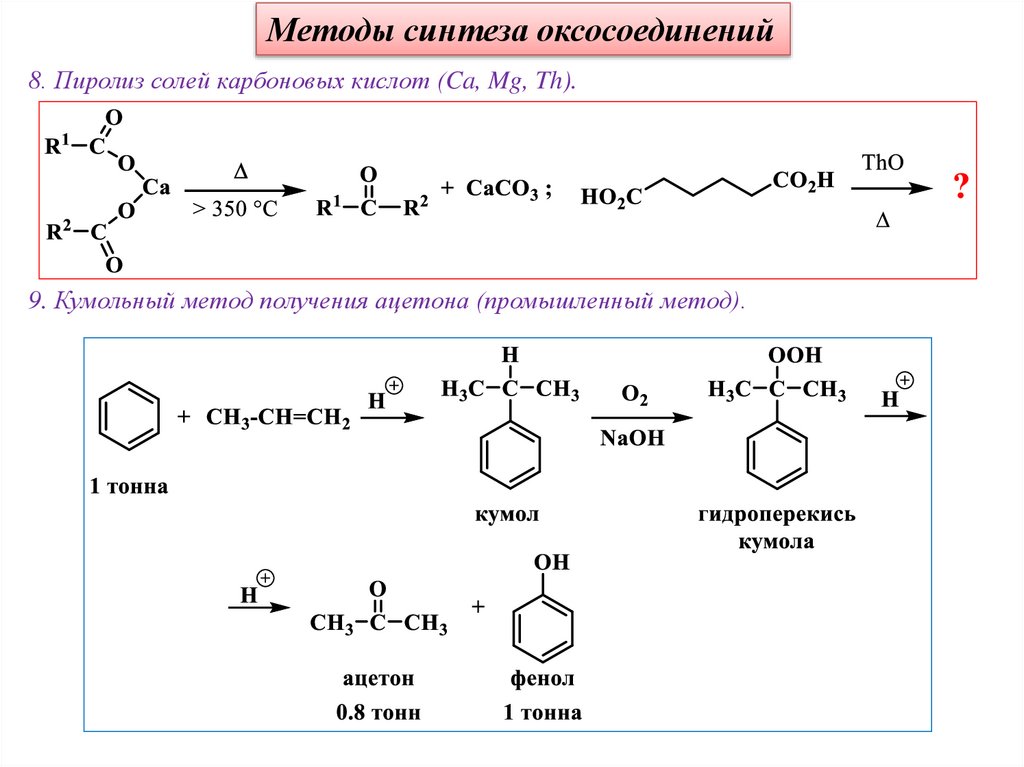
Методы синтеза оксосоединений8. Пиролиз солей карбоновых кислот (Ca, Mg, Th).
9. Кумольный метод получения ацетона (промышленный метод).
8.
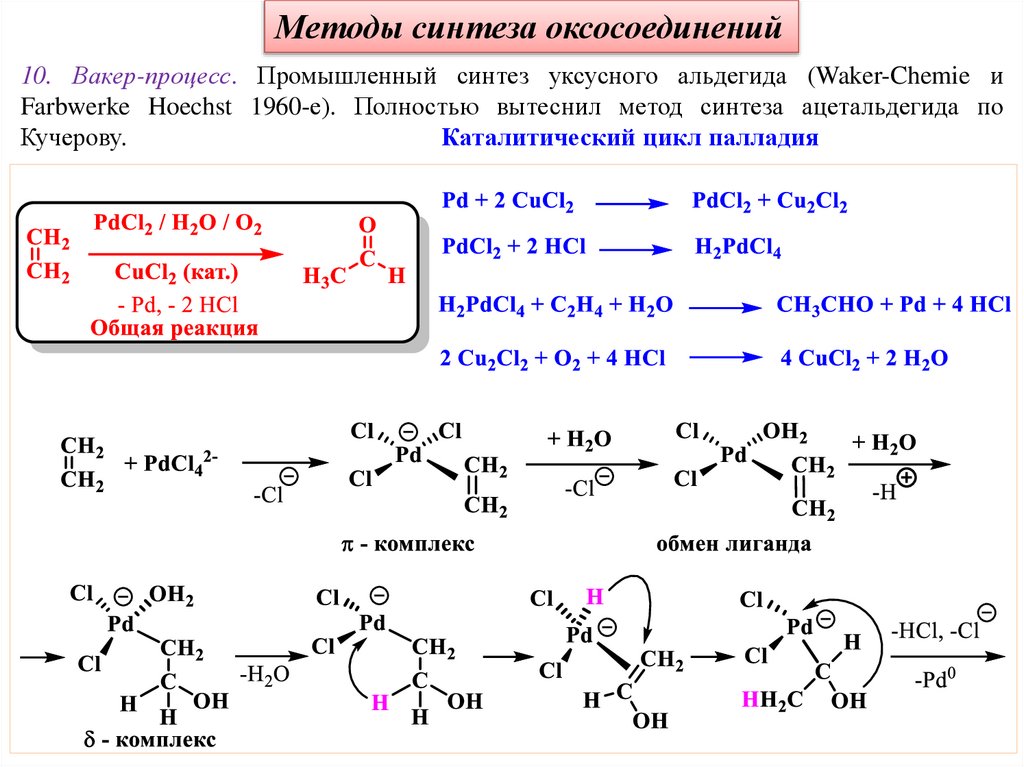
Методы синтеза оксосоединений10. Вакер-процесс. Промышленный синтез уксусного альдегида (Waker-Chemie и
Farbwerke Hoechst 1960-е). Полностью вытеснил метод синтеза ацетальдегида по
Кучерову.
Каталитический цикл палладия
9.
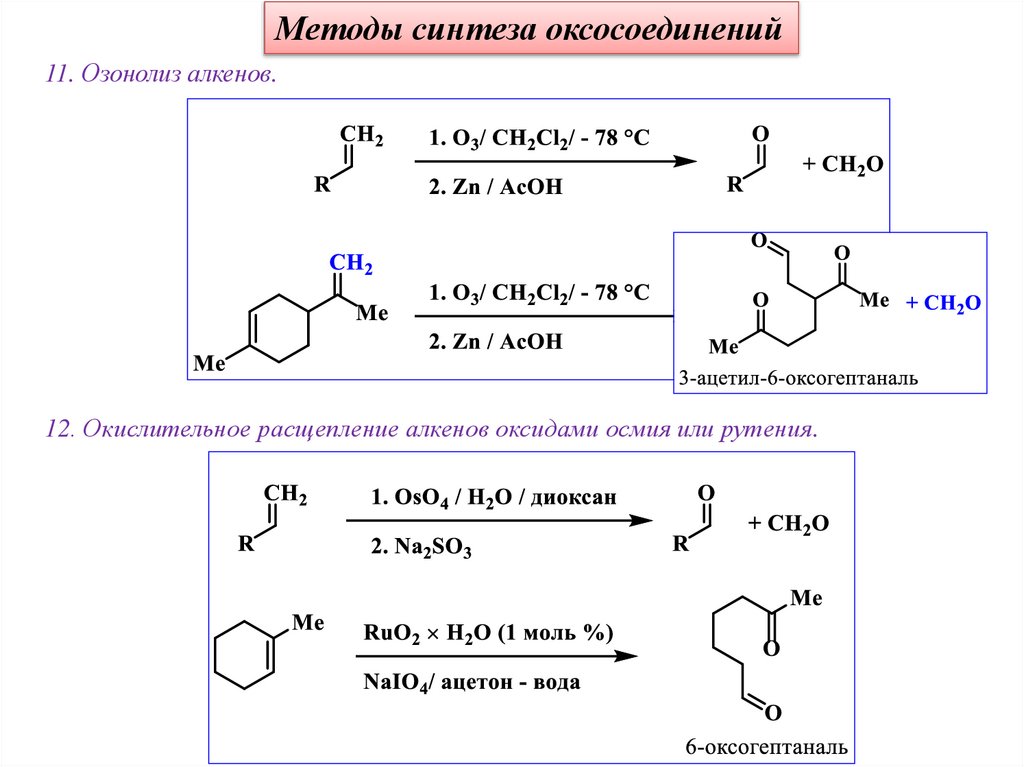
Методы синтеза оксосоединений11. Озонолиз алкенов.
12. Окислительное расщепление алкенов оксидами осмия или рутения.
10.
Формула успехаМногие альдегиды обладают приятным запахом, что
обуславливает их использование в парфюмерии.
Духи Chanel №5 стали прорывом в индустрии, потому
что их формула была сложной, что давало результат в
виде чарующего искрящегося аромата. Создание такого
аромата по старым технологиям с применением
природных эфирных масел было бы технически
невозможно. Основное преимущество альдегидов –
возможность с их помощью имитировать природные
запахи, что значительно упрощает и удешевляет процесс
создания формулы аромата.
Мирценаль альдегид - цветочный запах.
Фенилацетальдегид - запах гиацинта.
Цитраль (октаналь, каприловый) – аромат
лимона и апельсина.
Додеканаль - хвойных аромат.
Пропаналь - фруктовая сладость и сочность.
Бензальдегид - аромат миндаля.
Пеларгоновый альдегид - запах розы.
11.
Формула успеха12.
Формула успеха13.
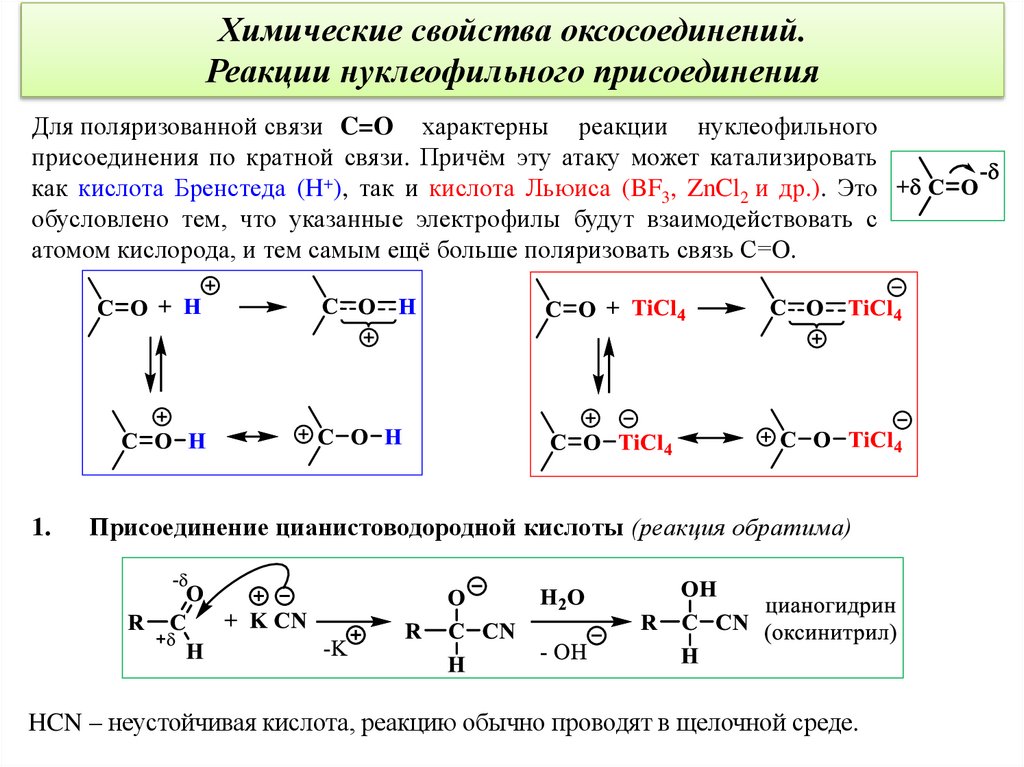
Химические свойства оксосоединений.Реакции нуклеофильного присоединения
Для поляризованной связи C=O характерны реакции нуклеофильного
присоединения по кратной связи. Причём эту атаку может катализировать
как кислота Бренстеда (H+), так и кислота Льюиса (BF3, ZnCl2 и др.). Это
обусловлено тем, что указанные электрофилы будут взаимодействовать с
атомом кислорода, и тем самым ещё больше поляризовать связь С=O.
1.
Присоединение цианистоводородной кислоты (реакция обратима)
HCN – неустойчивая кислота, реакцию обычно проводят в щелочной среде.
14.
Реакции нуклеофильного присоединения2. Присоединение бисульфита натрия (образование бисульфитных производных,
метод очистки и выделения альдегидов и низших кетонов).
После фильтрации и очистки бисульфитного производного проводят процесс
регенерации исходного карбонильного соединения в основной или кислой среде.
15.
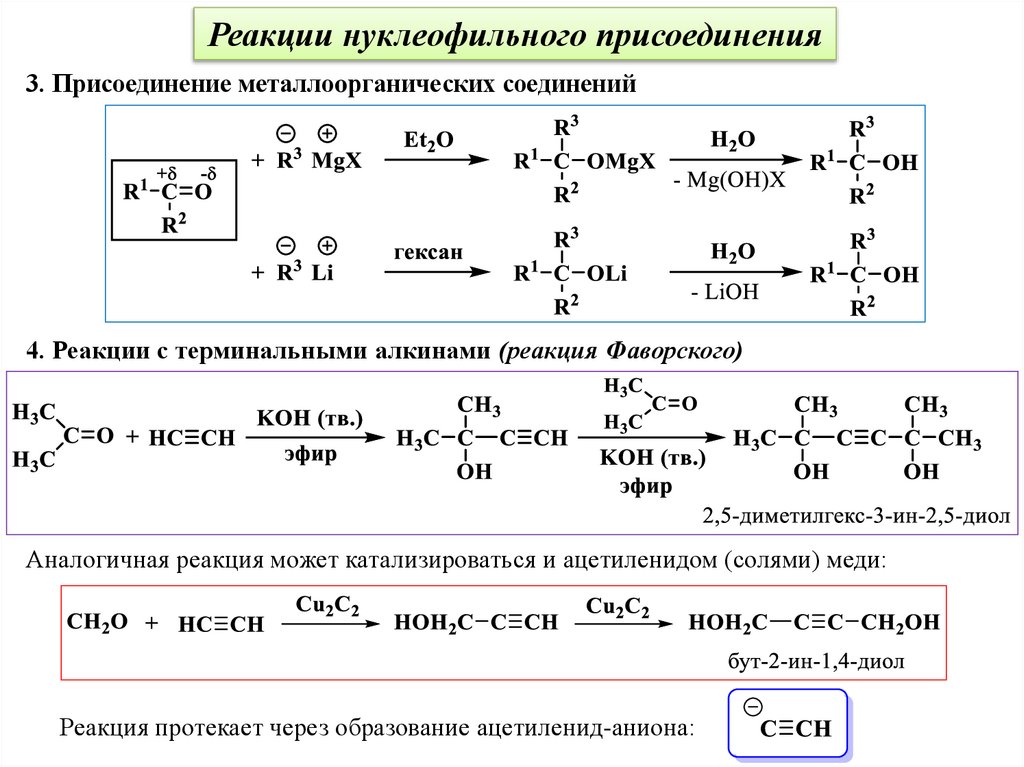
Реакции нуклеофильного присоединения3. Присоединение металлоoрганических соединений
4. Реакции с терминальными алкинами (реакция Фаворского)
Аналогичная реакция может катализироваться и ацетиленидом (солями) меди:
Реакция протекает через образование ацетиленид-аниона:
16.
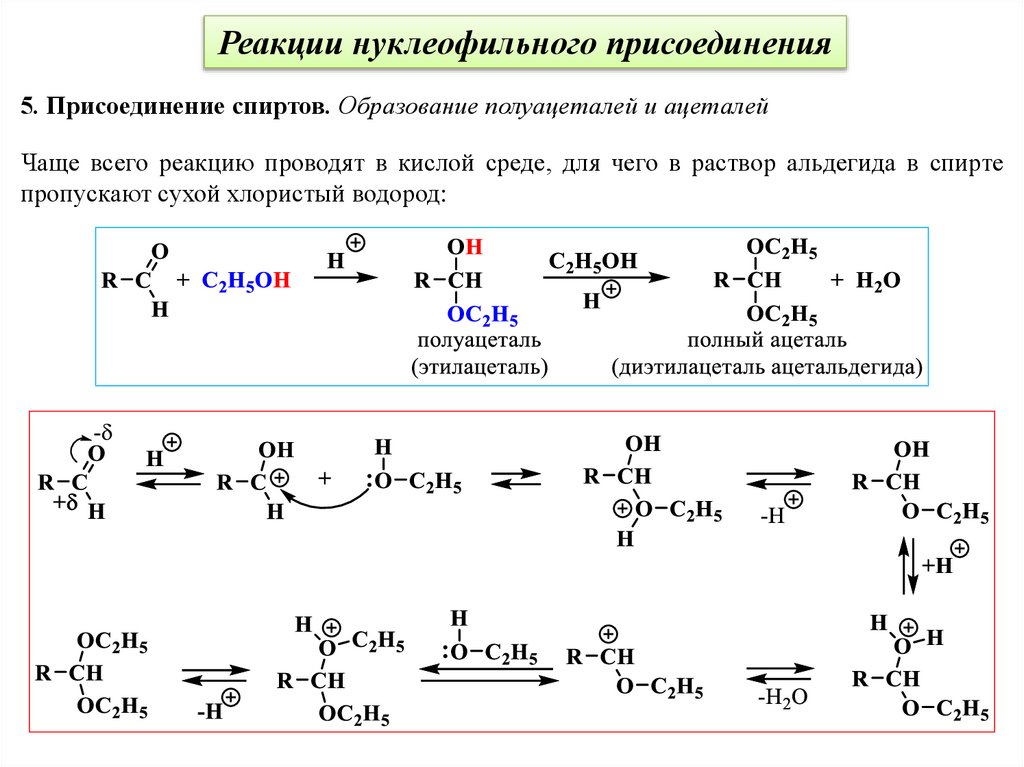
Реакции нуклеофильного присоединения5. Присоединение спиртов. Образование полуацеталей и ацеталей
Чаще всего реакцию проводят в кислой среде, для чего в раствор альдегида в спирте
пропускают сухой хлористый водород:
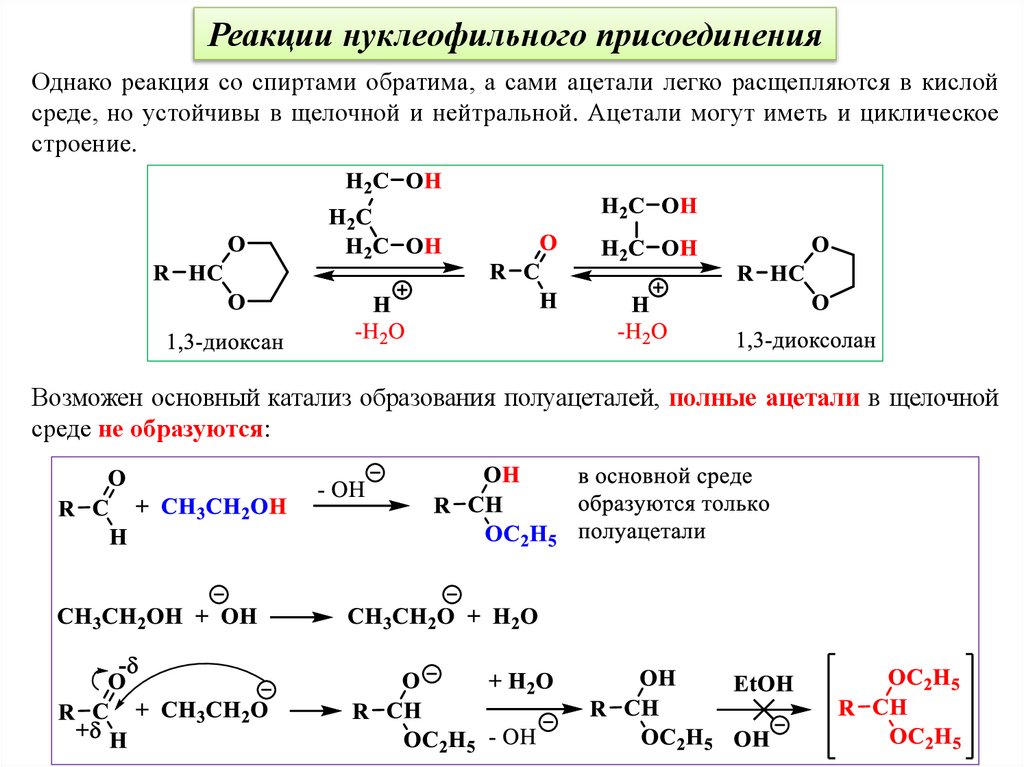
17.
Реакции нуклеофильного присоединенияОднако реакция со спиртами обратима, а сами ацетали легко расщепляются в кислой
среде, но устойчивы в щелочной и нейтральной. Ацетали могут иметь и циклическое
строение.
Возможен основный катализ образования полуацеталей, полные ацетали в щелочной
среде не образуются:
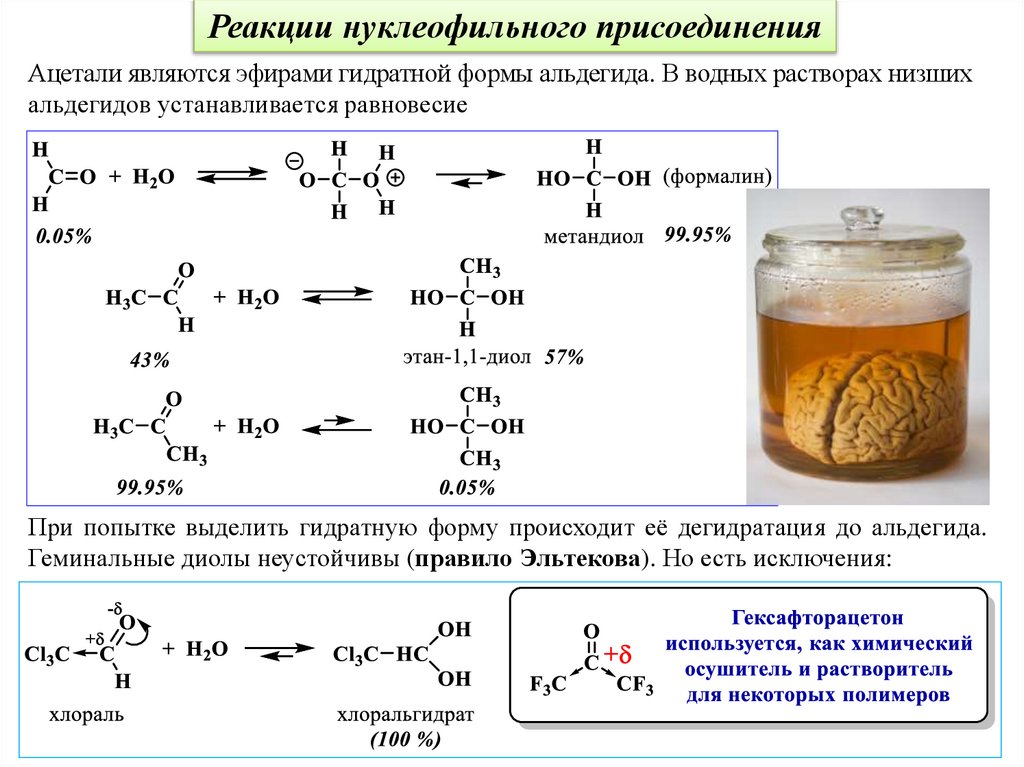
18.
Реакции нуклеофильного присоединенияАцетали являются эфирами гидратной формы альдегида. В водных растворах низших
альдегидов устанавливается равновесие
При попытке выделить гидратную форму происходит её дегидратация до альдегида.
Геминальные диолы неустойчивы (правило Эльтекова). Но есть исключения:
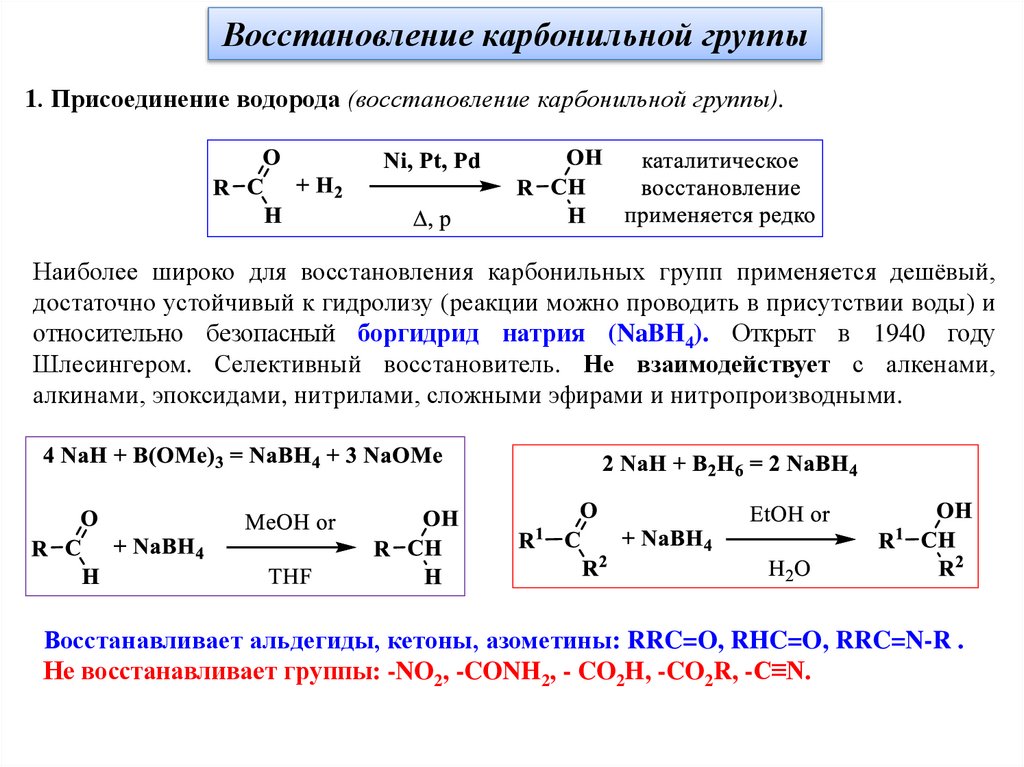
19.
Восстановление карбонильной группы1. Присоединение водорода (восстановление карбонильной группы).
Наиболее широко для восстановления карбонильных групп применяется дешёвый,
достаточно устойчивый к гидролизу (реакции можно проводить в присутствии воды) и
относительно безопасный боргидрид натрия (NaBH4). Открыт в 1940 году
Шлесингером. Селективный восстановитель. Не взаимодействует с алкенами,
алкинами, эпоксидами, нитрилами, сложными эфирами и нитропроизводными.
Восстанавливает альдегиды, кетоны, азометины: RRC=O, RHC=O, RRC=N-R .
Не восстанавливает группы: -NO2, -CONH2, - CO2H, -CO2R, -C≡N.
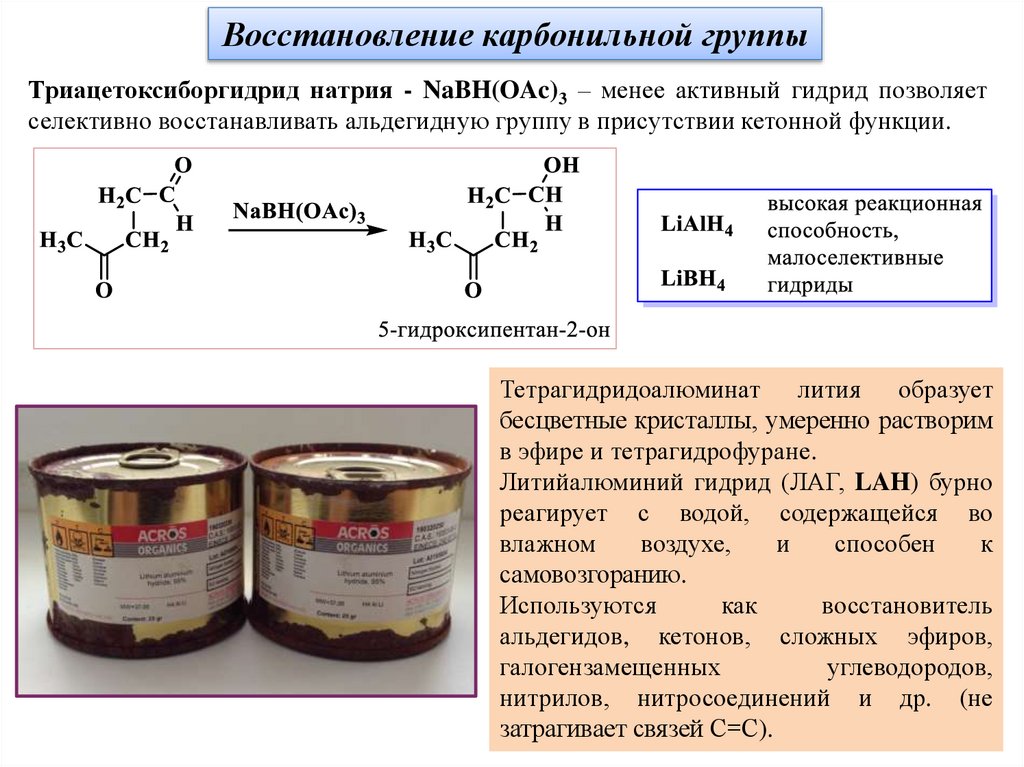
20.
Восстановление карбонильной группыТриацетоксиборгидрид натрия - NaBH(OAc)3 – менее активный гидрид позволяет
селективно восстанавливать альдегидную группу в присутствии кетонной функции.
Тетрагидридоалюминат лития образует
бесцветные кристаллы, умеренно растворим
в эфире и тетрагидрофуране.
Литийалюминий гидрид (ЛАГ, LAH) бурно
реагирует с водой, содержащейся во
влажном
воздухе,
и
способен
к
самовозгоранию.
Используются
как
восстановитель
альдегидов, кетонов, сложных эфиров,
галогензамещенных
углеводородов,
нитрилов, нитросоединений и др. (не
затрагивает связей С=С).
21.
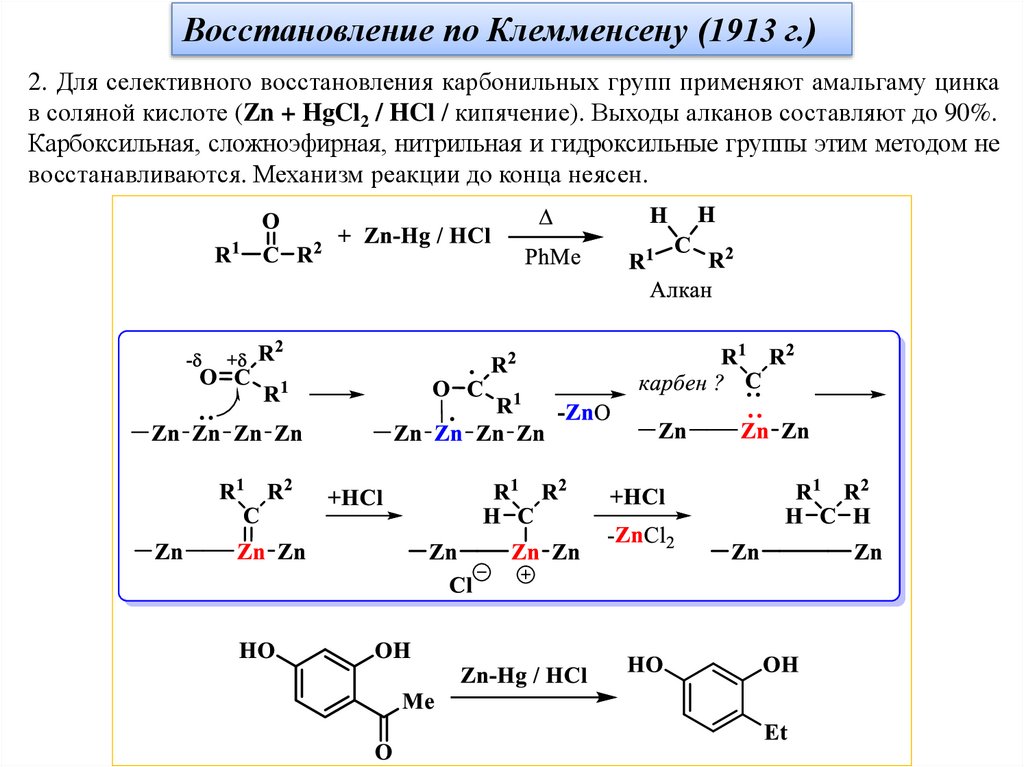
Восстановление по Клемменсену (1913 г.)2. Для селективного восстановления карбонильных групп применяют амальгаму цинка
в соляной кислоте (Zn + HgCl2 / HCl / кипячение). Выходы алканов составляют до 90%.
Карбоксильная, сложноэфирная, нитрильная и гидроксильные группы этим методом не
восстанавливаются. Механизм реакции до конца неясен.
22.
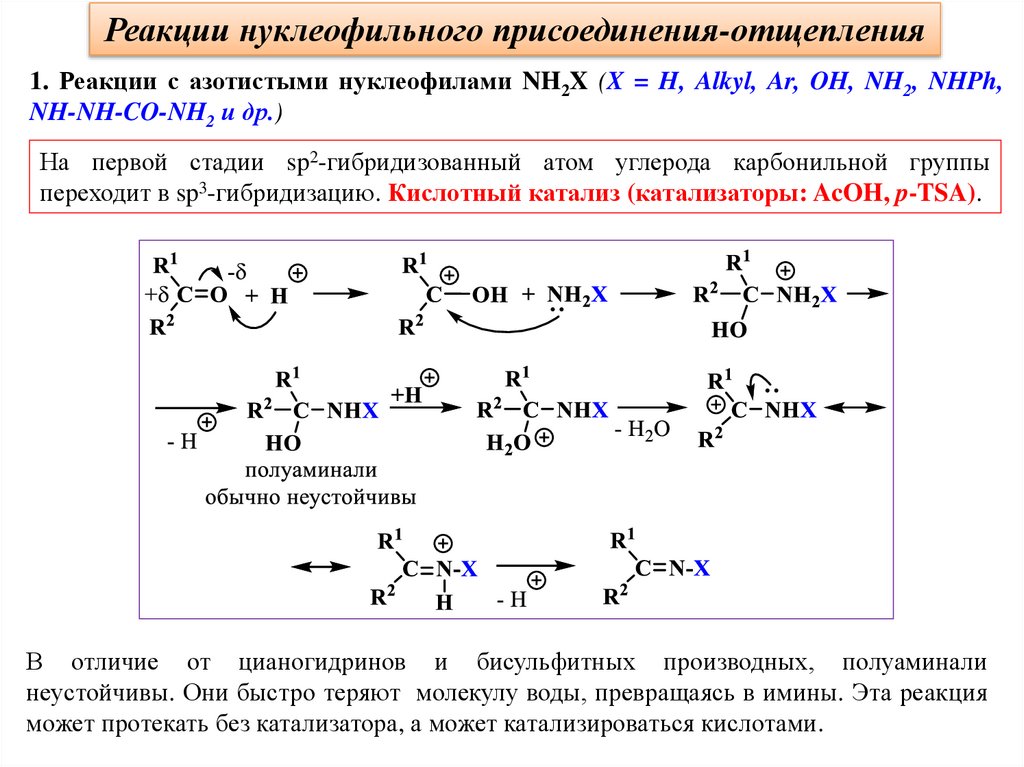
Реакции нуклеофильного присоединения-отщепления1. Реакции с азотистыми нуклеофилами NH2X (X = H, Alkyl, Ar, OH, NH2, NHPh,
NH-NH-CO-NH2 и др.)
На первой стадии sp2-гибридизованный атом углерода карбонильной группы
переходит в sp3-гибридизацию. Кислотный катализ (катализаторы: AcOH, p-TSA).
В отличие от цианогидринов и бисульфитных производных, полуаминали
неустойчивы. Они быстро теряют молекулу воды, превращаясь в имины. Эта реакция
может протекать без катализатора, а может катализироваться кислотами.
23.
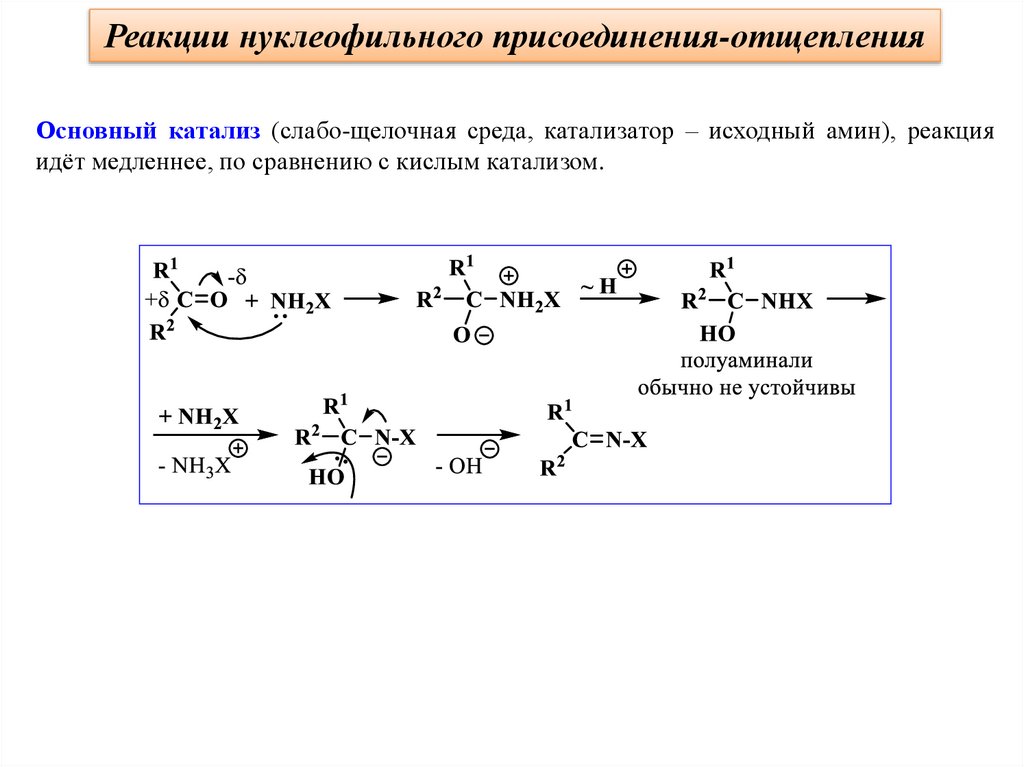
Реакции нуклеофильного присоединения-отщепленияОсновный катализ (слабо-щелочная среда, катализатор – исходный амин), реакция
идёт медленнее, по сравнению с кислым катализом.
24.
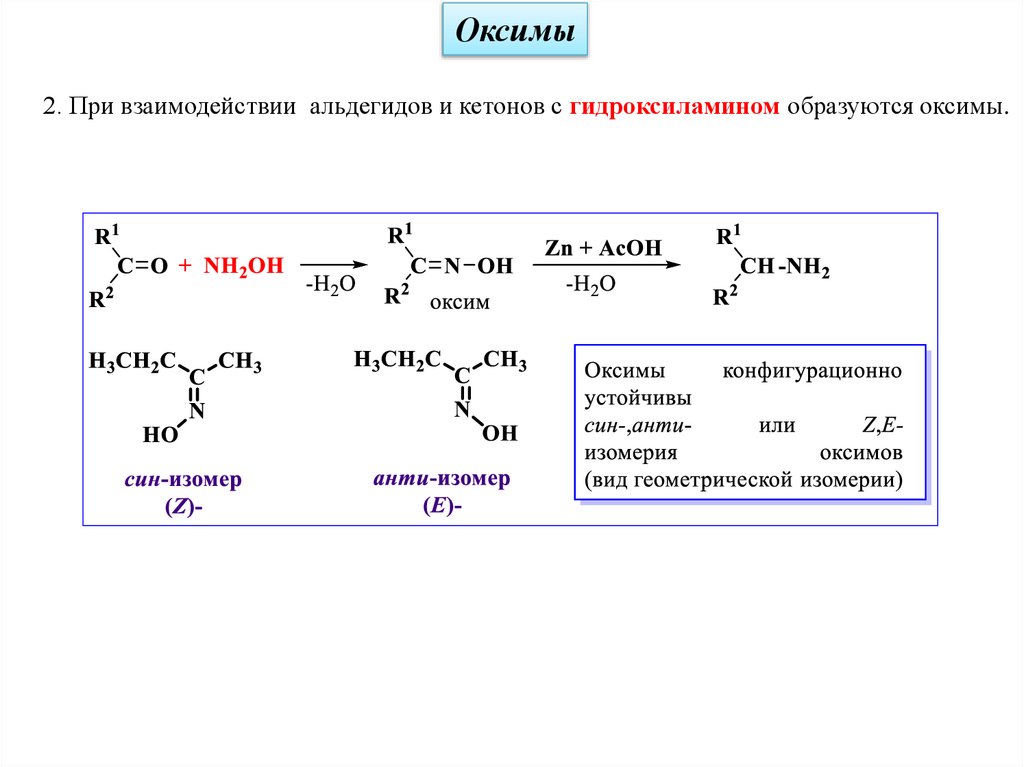
Оксимы2. При взаимодействии альдегидов и кетонов с гидроксиламином образуются оксимы.
25.
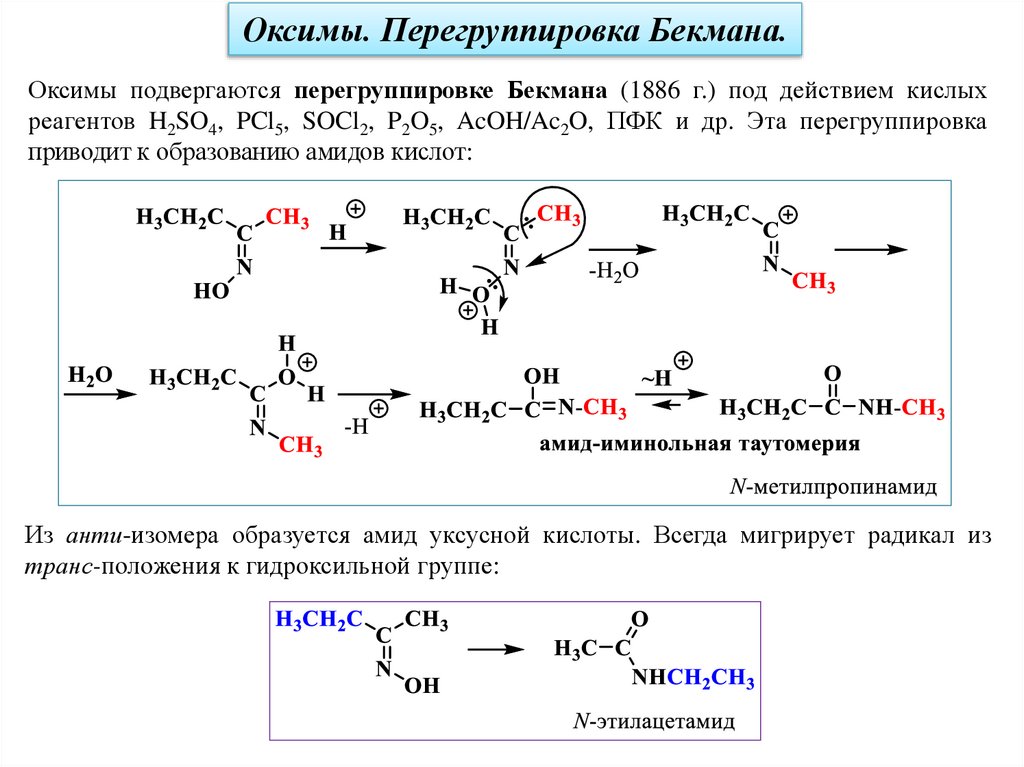
Оксимы. Перегруппировка Бекмана.Оксимы подвергаются перегруппировке Бекмана (1886 г.) под действием кислых
реагентов H2SO4, PCl5, SOCl2, P2O5, AcOH/Ac2O, ПФК и др. Эта перегруппировка
приводит к образованию амидов кислот:
Из анти-изомера образуется амид уксусной кислоты. Всегда мигрирует радикал из
транс-положения к гидроксильной группе:
26.
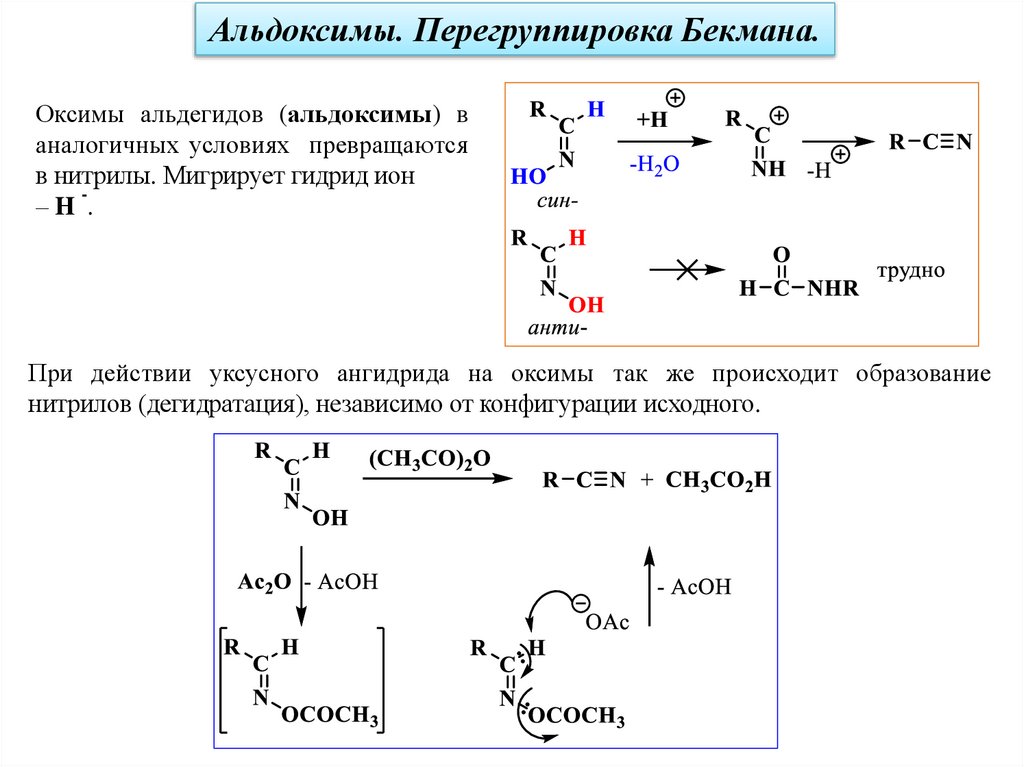
Альдоксимы. Перегруппировка Бекмана.Оксимы альдегидов (альдоксимы) в
аналогичных условиях превращаются
в нитрилы. Мигрирует гидрид ион
–H .
При действии уксусного ангидрида на оксимы так же происходит образование
нитрилов (дегидратация), независимо от конфигурации исходного.
27.
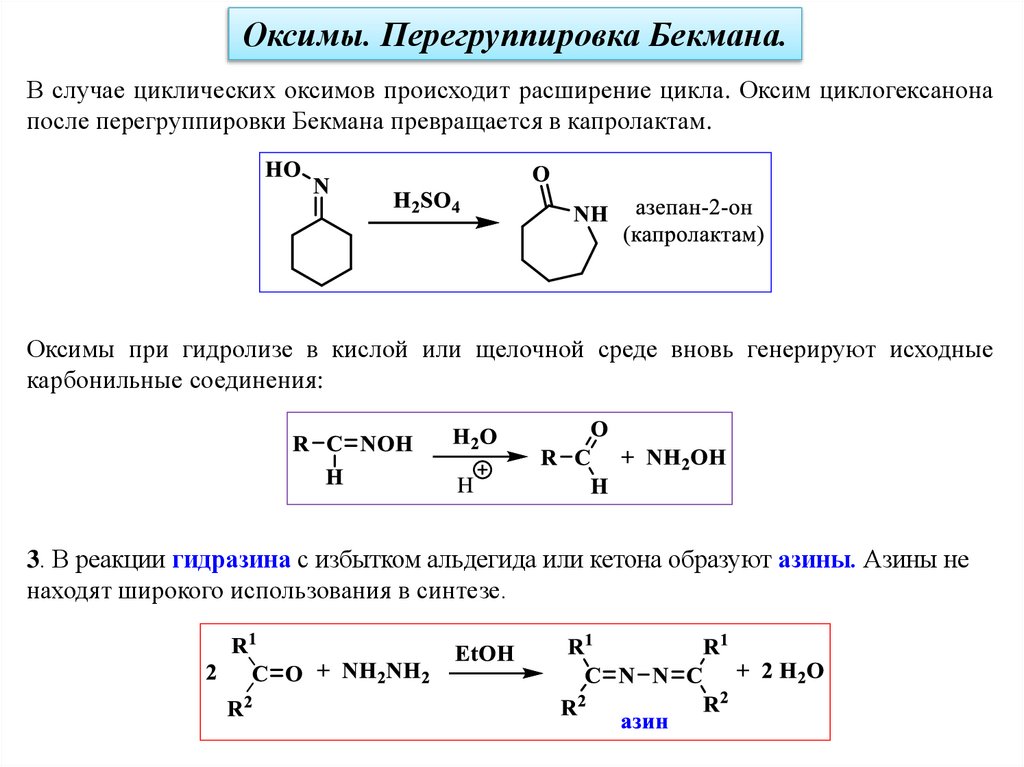
Оксимы. Перегруппировка Бекмана.В случае циклических оксимов происходит расширение цикла. Оксим циклогексанона
после перегруппировки Бекмана превращается в капролактам.
Оксимы при гидролизе в кислой или щелочной среде вновь генерируют исходные
карбонильные соединения:
3. В реакции гидразина с избытком альдегида или кетона образуют азины. Азины не
находят широкого использования в синтезе.
28.
Гидразоны. Реакция Кижнера-Вольфа.3. При использовании большого избытка гидразина удается получить гидразон –
продукт взаимодействия эквимолярных количеств гидразина и карбонильного
соединения.
Гидразоны под действием оснований в высококипящих гидроксилсодержащих
растворителях (этиленгликоль, диэтиленгликоль) или BuLi в эфире при пониженных
температурах превращаются в углеводороды. Реакция Кижнера-Вольфа (1911 г).
29.
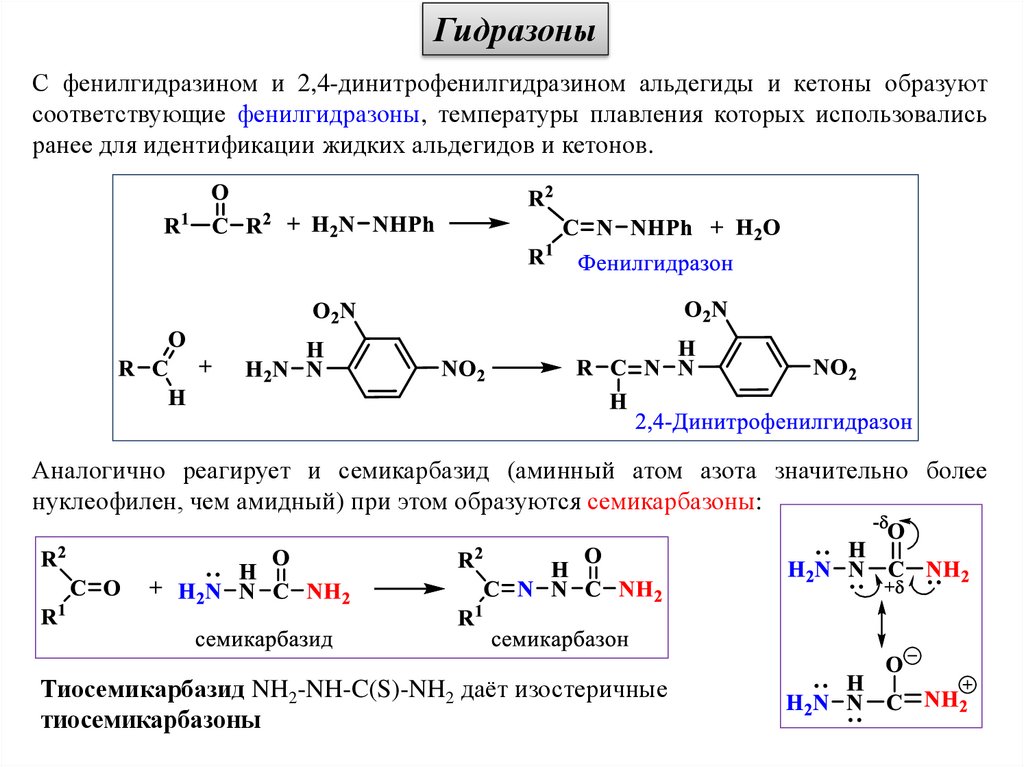
ГидразоныС фенилгидразином и 2,4-динитрофенилгидразином альдегиды и кетоны образуют
соответствующие фенилгидразоны, температуры плавления которых использовались
ранее для идентификации жидких альдегидов и кетонов.
Аналогично реагирует и семикарбазид (аминный атом азота значительно более
нуклеофилен, чем амидный) при этом образуются семикарбазоны:
Тиосемикарбазид NH2-NH-C(S)-NH2 даёт изостеричные
тиосемикарбазоны
30.
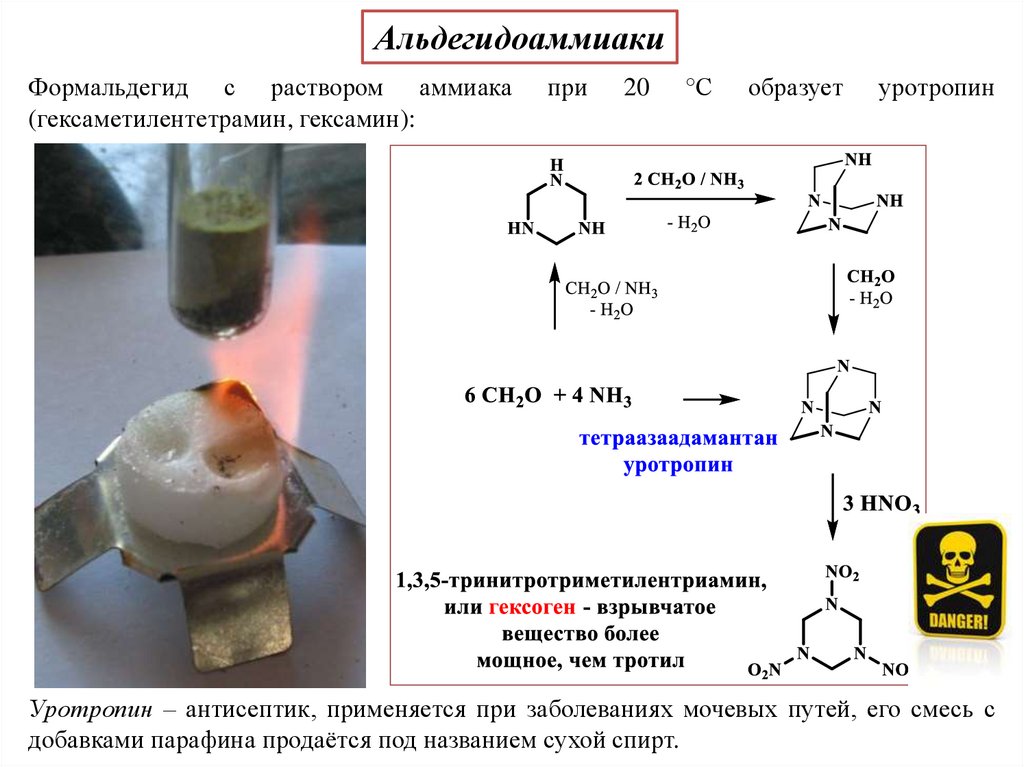
Альдегидоаммиаки4. Специфически реагируют альдегиды и кетоны с аммиаком, который также является
нуклеофильным реагентом. При этом на первой стадии образуются
альдегидоаммиаки, которые легко отщепляют воду, превращаясь в имины.
Альдимин далее полимеризуется (тримеризуется):
31.
АльдегидоаммиакиФормальдегид с раствором аммиака
(гексаметилентетрамин, гексамин):
при
20
°С
образует
уротропин
Уротропин – антисептик, применяется при заболеваниях мочевых путей, его смесь с
добавками парафина продаётся под названием сухой спирт.
32.
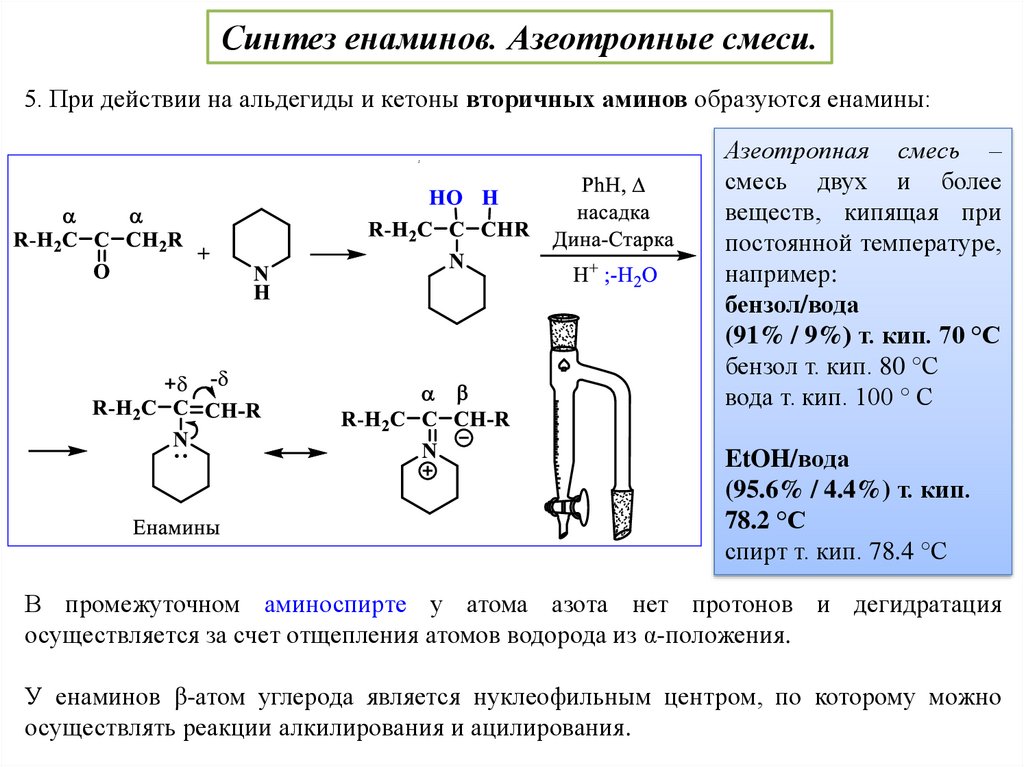
Синтез енаминов. Азеотропные смеси.5. При действии на альдегиды и кетоны вторичных аминов образуются енамины:
Азеотропная смесь –
смесь двух и более
веществ, кипящая при
постоянной температуре,
например:
бензол/вода
(91% / 9%) т. кип. 70 °С
бензол т. кип. 80 °С
вода т. кип. 100 ° С
EtOH/вода
(95.6% / 4.4%) т. кип.
78.2 °С
спирт т. кип. 78.4 °С
В промежуточном аминоспирте у атома азота нет протонов и дегидратация
осуществляется за счет отщепления атомов водорода из α-положения.
У енаминов β-атом углерода является нуклеофильным центром, по которому можно
осуществлять реакции алкилирования и ацилирования.
33.
Взаимодействие с галогенидами фосфораПри действии пентагалогенидов фосфора кислород карбонильной группы замещается
на два атома галогена с образованием геминальных дигалогенопроизводных.
лат. gemini - близнец
Реакция Виттига (1954 г.). Из альдегидов и кетонов, используя реакцию
нуклеофильного присоединения, могут быть получены олефины. Для этой цели
используют илиды фосфора.
34.
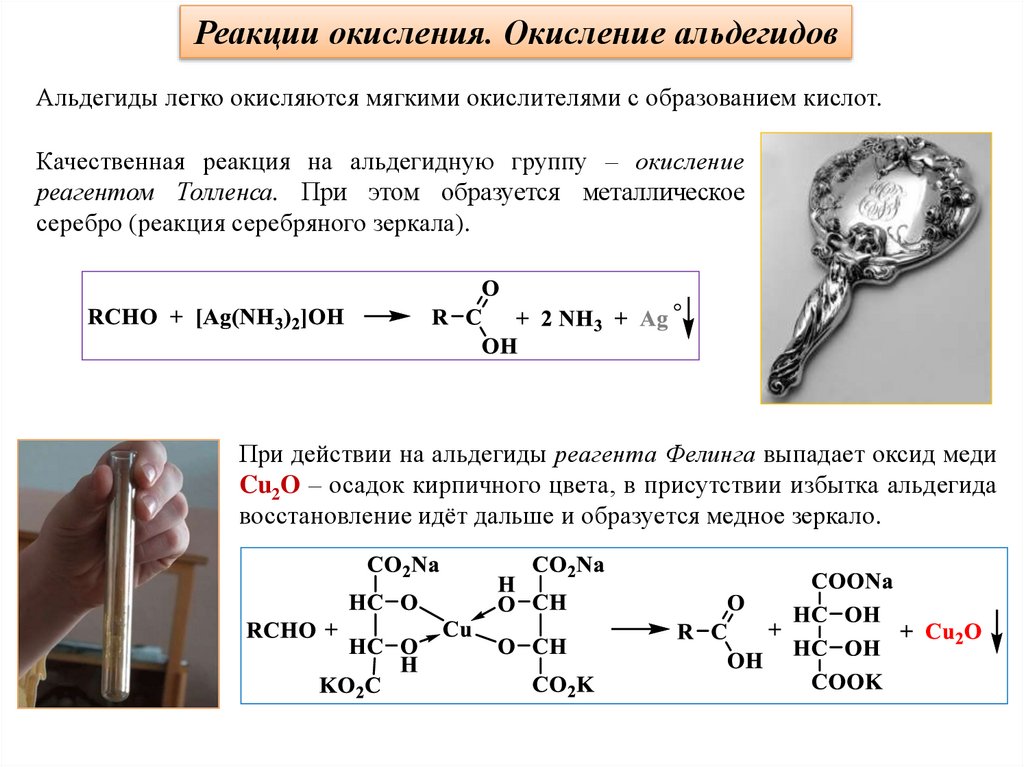
Реакции окисления. Окисление альдегидовАльдегиды легко окисляются мягкими окислителями с образованием кислот.
Качественная реакция на альдегидную группу – окисление
реагентом Толленса. При этом образуется металлическое
серебро (реакция серебряного зеркала).
При действии на альдегиды реагента Фелинга выпадает оксид меди
Cu2O – осадок кирпичного цвета, в присутствии избытка альдегида
восстановление идёт дальше и образуется медное зеркало.
35.
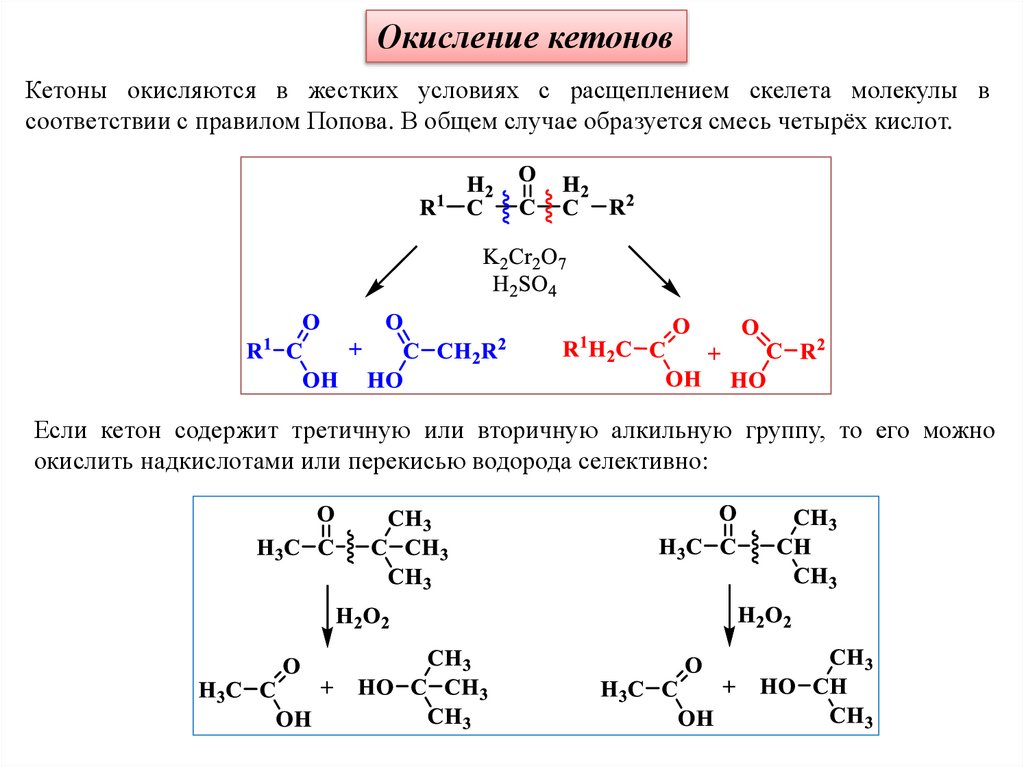
Окисление кетоновКетоны окисляются в жестких условиях с расщеплением скелета молекулы в
соответствии с правилом Попова. В общем случае образуется смесь четырёх кислот.
Если кетон содержит третичную или вторичную алкильную группу, то его можно
окислить надкислотами или перекисью водорода селективно:
36.
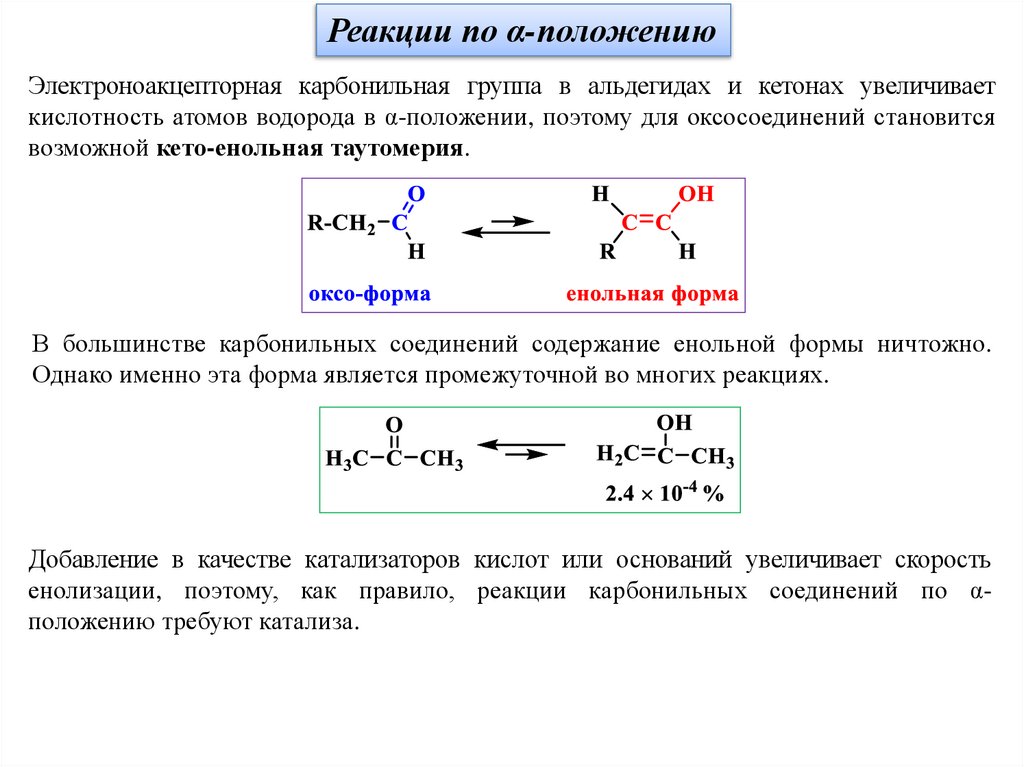
Реакции по α-положениюЭлектроноакцепторная карбонильная группа в альдегидах и кетонах увеличивает
кислотность атомов водорода в α-положении, поэтому для оксосоединений становится
возможной кето-енольная таутомерия.
В большинстве карбонильных соединений содержание енольной формы ничтожно.
Однако именно эта форма является промежуточной во многих реакциях.
Добавление в качестве катализаторов кислот или оснований увеличивает скорость
енолизации, поэтому, как правило, реакции карбонильных соединений по αположению требуют катализа.
37.
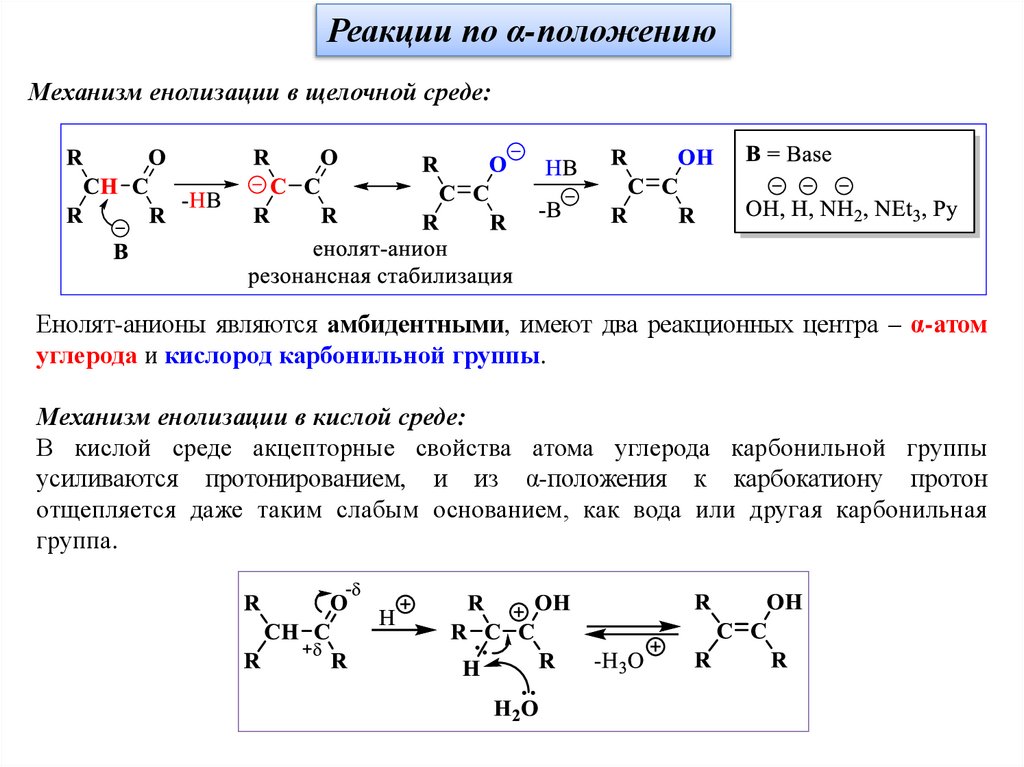
Реакции по α-положениюМеханизм енолизации в щелочной среде:
Енолят-анионы являются амбидентными, имеют два реакционных центра – α-атом
углерода и кислород карбонильной группы.
Механизм енолизации в кислой среде:
В кислой среде акцепторные свойства атома углерода карбонильной группы
усиливаются протонированием, и из α-положения к карбокатиону протон
отщепляется даже таким слабым основанием, как вода или другая карбонильная
группа.
38.
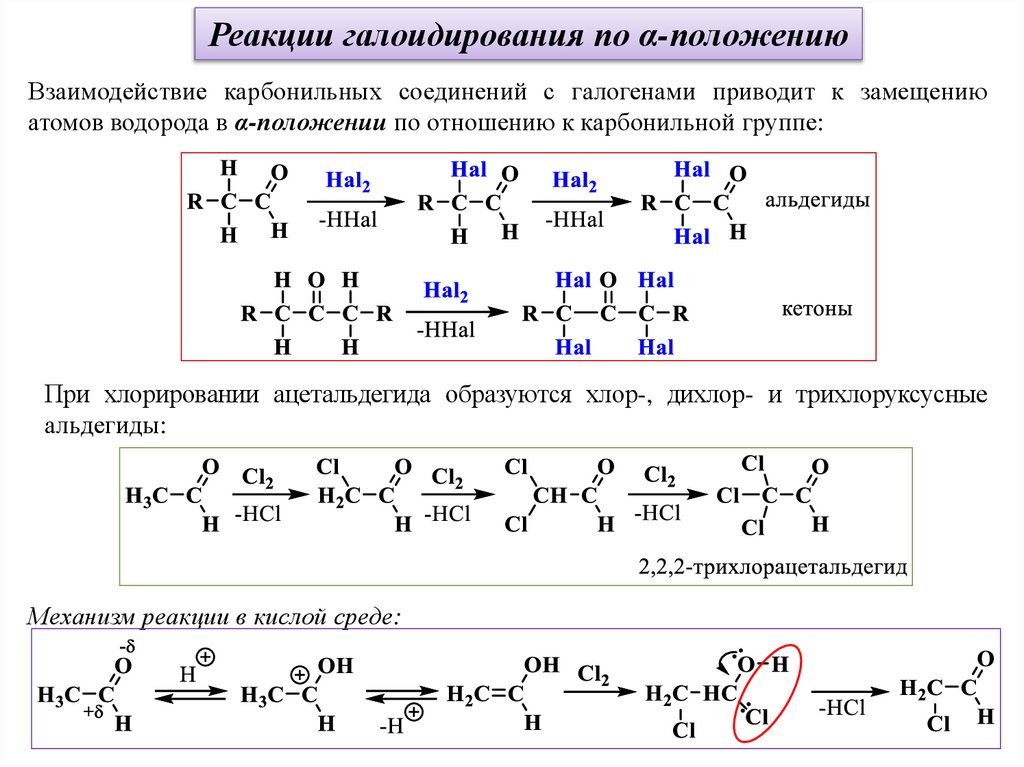
Реакции галоидирования по α-положениюВзаимодействие карбонильных соединений с галогенами приводит к замещению
атомов водорода в α-положении по отношению к карбонильной группе:
При хлорировании ацетальдегида образуются хлор-, дихлор- и трихлоруксусные
альдегиды:
Механизм реакции в кислой среде:
39.
Реакции галоидирования по α-положениюМеханизм реакции в щелочной среде:
Метилкетоны в щелочной среде енолизуются по метильной группе, в кислой –
преимущественно, по метиленовой группе.
40.
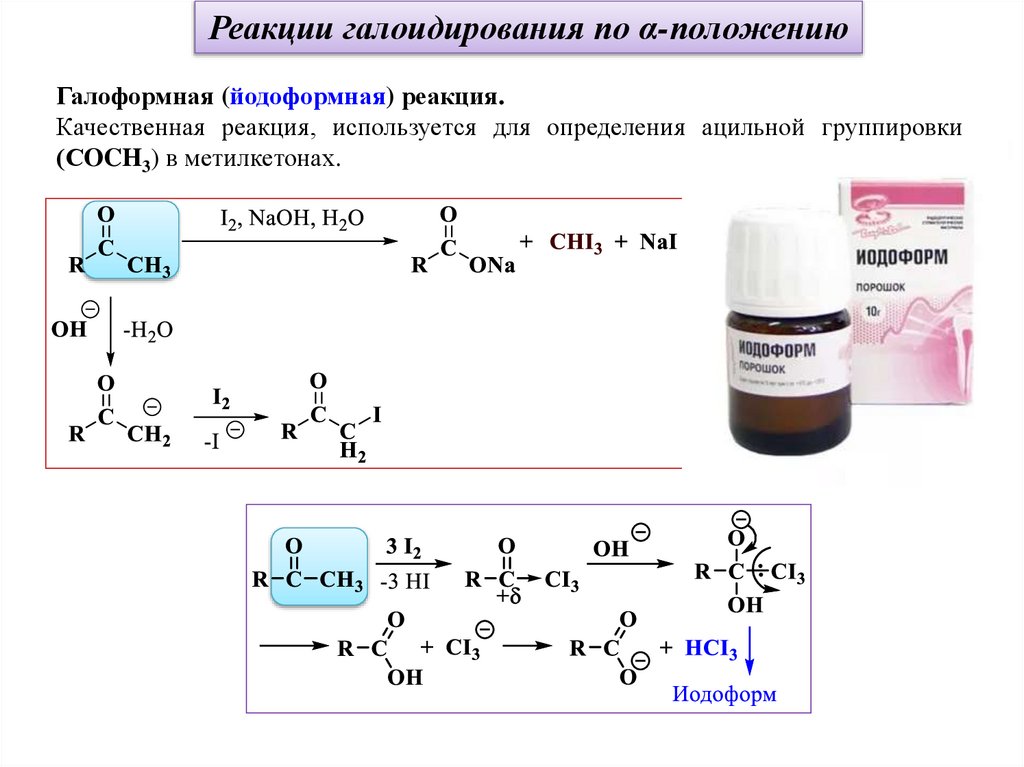
Реакции галоидирования по α-положениюГалоформная (йодоформная) реакция.
Качественная реакция, используется для определения ацильной группировки
(СOCH3) в метилкетонах.
41.
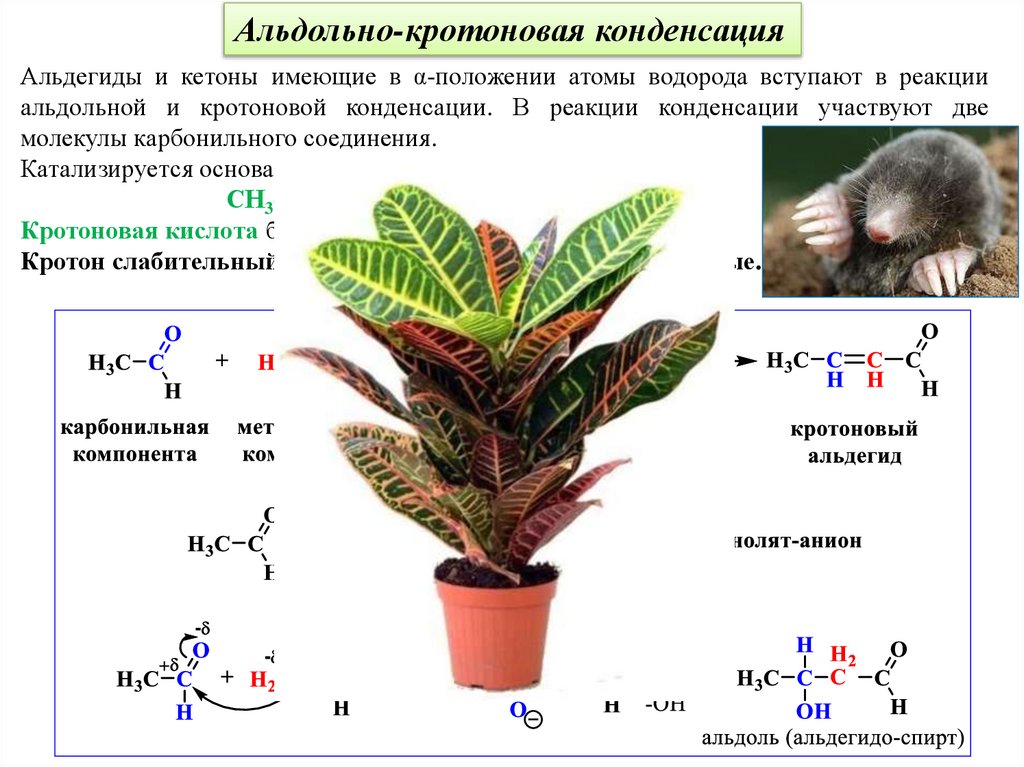
Альдольно-кротоновая конденсацияАльдегиды и кетоны имеющие в α-положении атомы водорода вступают в реакции
альдольной и кротоновой конденсации. В реакции конденсации участвуют две
молекулы карбонильного соединения.
Катализируется основанием или кислотой.
СН3-СH=CH-CO2H
Кротоновая кислота была выделена из масла растения
Кротон слабительный (Croton tiglium), семейство Молочайные.
42.
Альдольно-кротоновая конденсацияВ присутствии сильного основания возможно протекание второй стадии альдольнокротоновой конденсации.
Продукт альдольной конденсации, альдоль, на ряду с гидроксильной группой может
отщеплять ещё один протон от метиленовой группы с образованием α,βнепредельного альдегида – продукта кротоновой конденсации:
43.
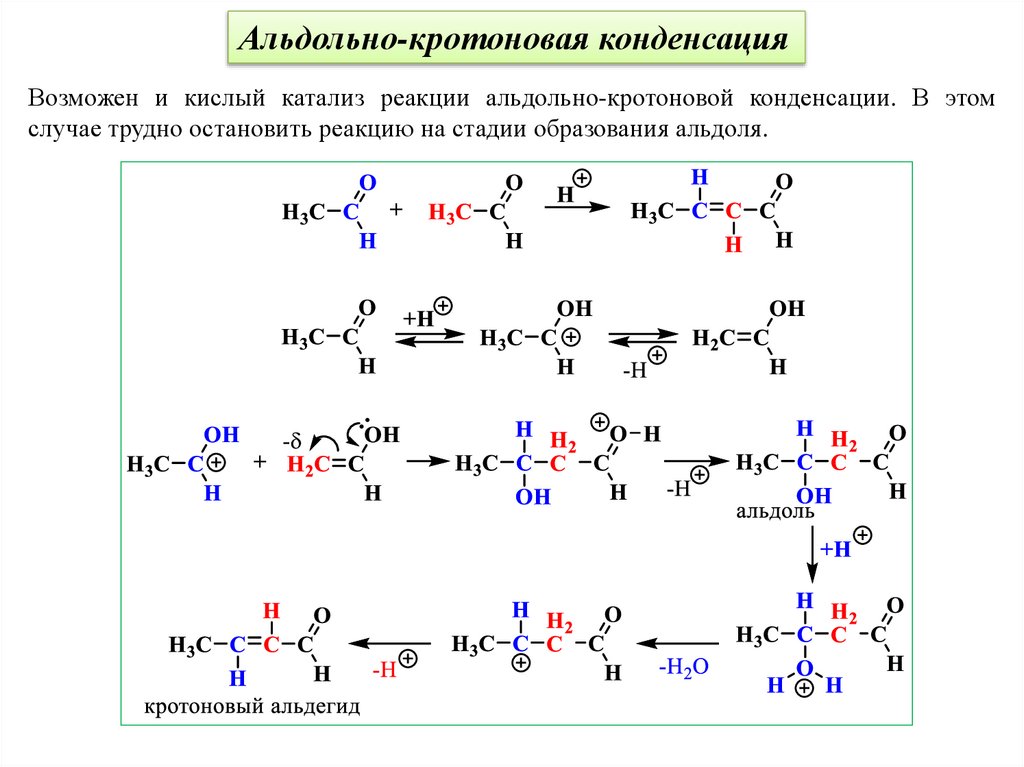
Альдольно-кротоновая конденсацияВозможен и кислый катализ реакции альдольно-кротоновой конденсации. В этом
случае трудно остановить реакцию на стадии образования альдоля.
44.
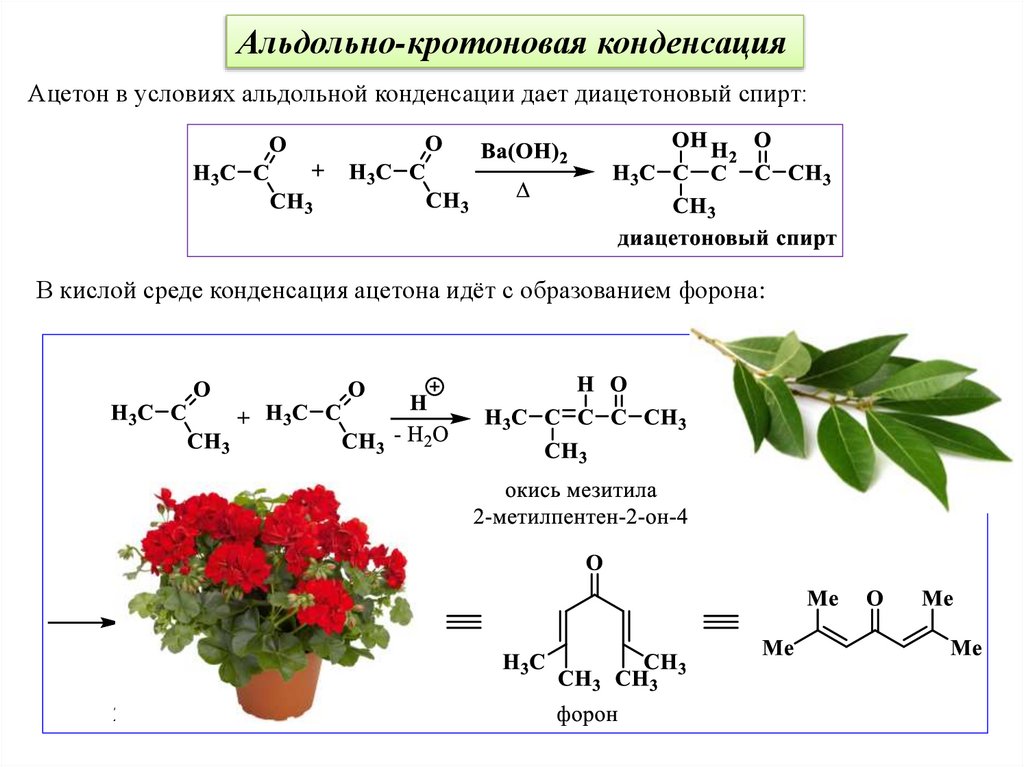
Альдольно-кротоновая конденсацияАцетон в условиях альдольной конденсации дает диацетоновый спирт:
В кислой среде конденсация ацетона идёт с образованием форона:
45.
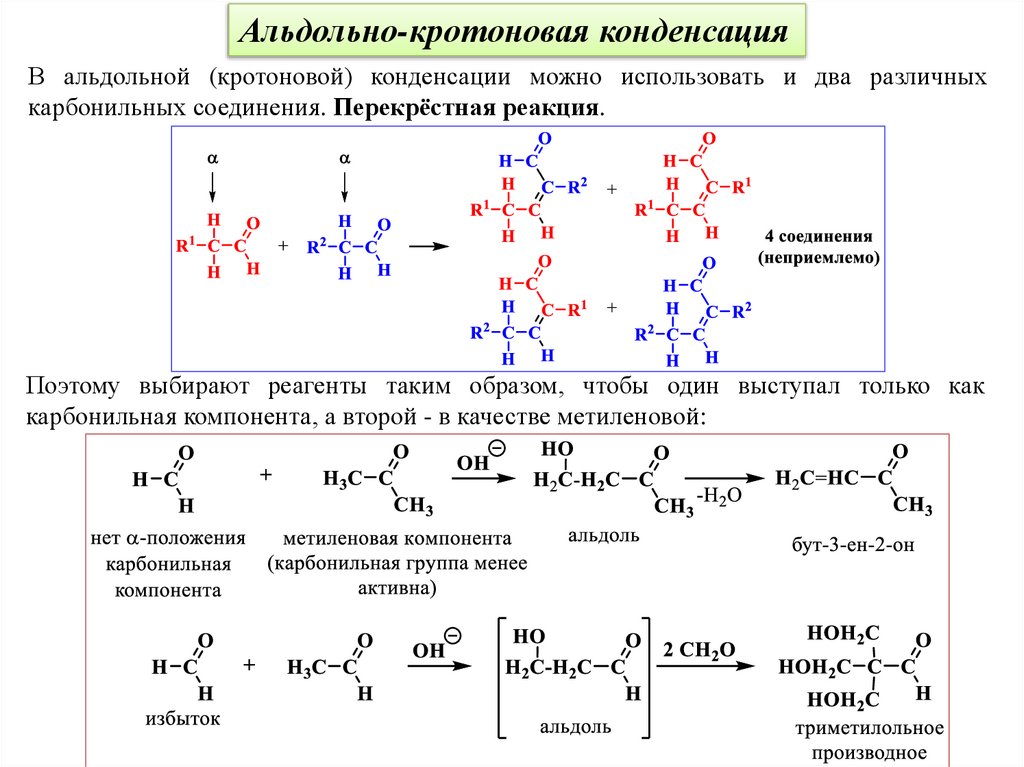
Альдольно-кротоновая конденсацияВ альдольной (кротоновой) конденсации можно использовать и два различных
карбонильных соединения. Перекрёстная реакция.
Поэтому выбирают реагенты таким образом, чтобы один выступал только как
карбонильная компонента, а второй - в качестве метиленовой:
46.
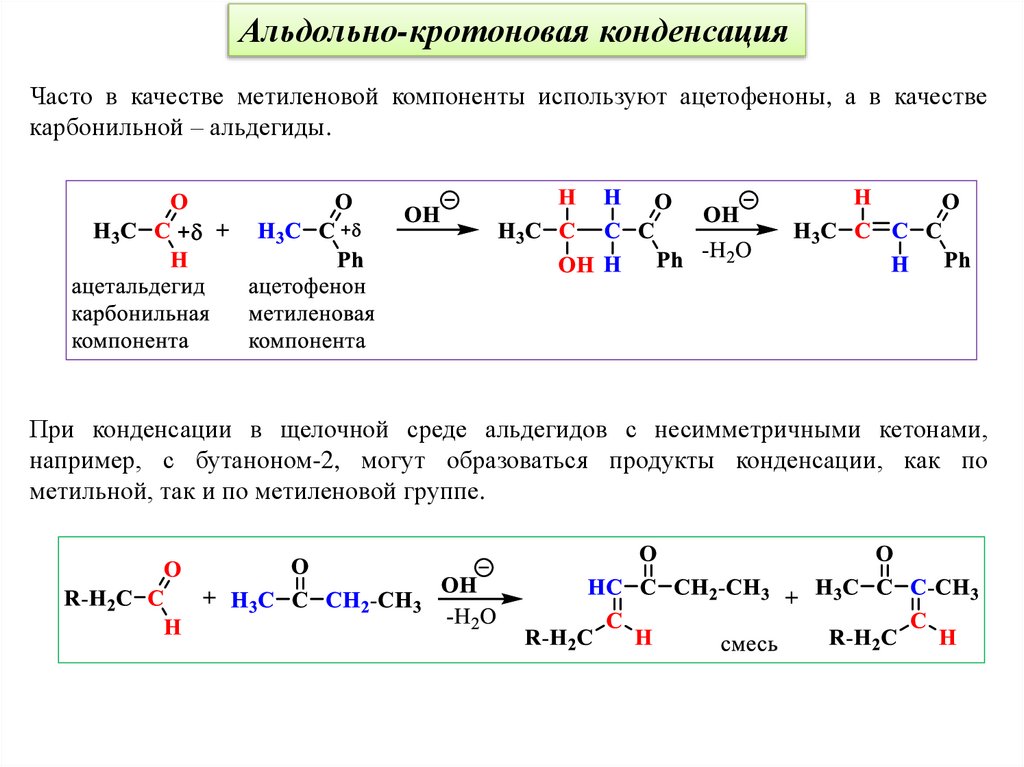
Альдольно-кротоновая конденсацияЧасто в качестве метиленовой компоненты используют ацетофеноны, а в качестве
карбонильной – альдегиды.
При конденсации в щелочной среде альдегидов с несимметричными кетонами,
например, с бутаноном-2, могут образоваться продукты конденсации, как по
метильной, так и по метиленовой группе.
47.
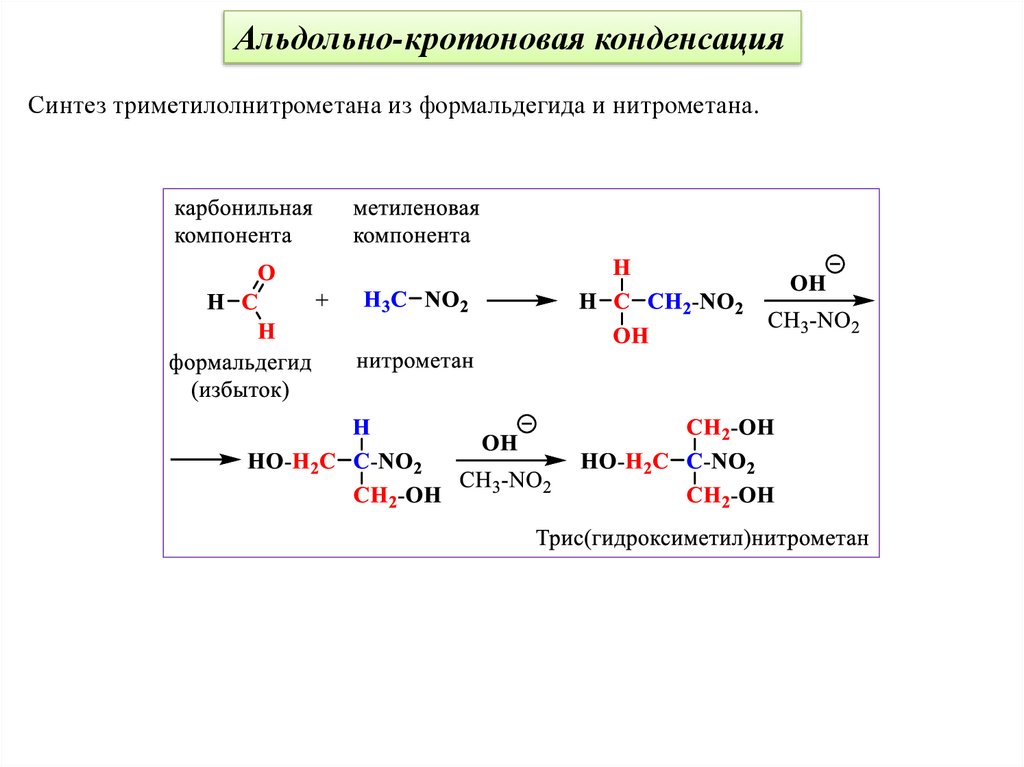
Альдольно-кротоновая конденсацияВ качестве метиленовой компоненты можно использовать и другие активные СНкислоты, например, нитроалканы. Реакция Анри (нитроальдольная конденсация).
48.
Альдольно-кротоновая конденсацияСинтез триметилолнитрометана из формальдегида и нитрометана.
49.
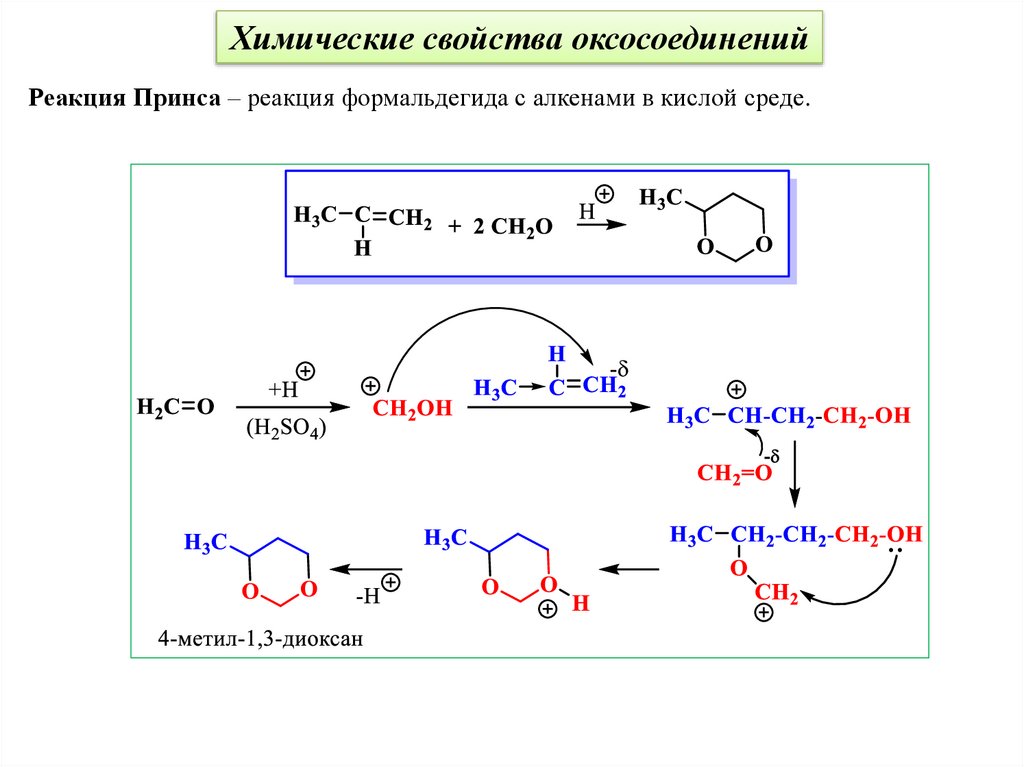
Химические свойства оксосоединенийРеакция Принса – реакция формальдегида с алкенами в кислой среде.
50.
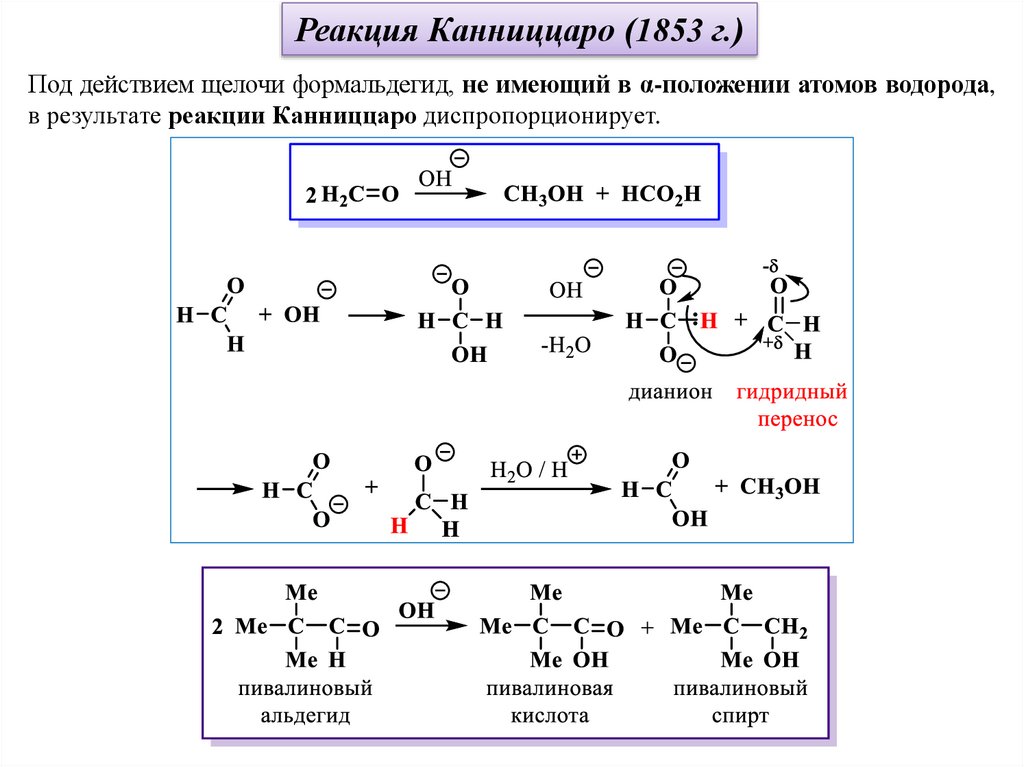
Реакция Канниццаро (1853 г.)Под действием щелочи формальдегид, не имеющий в α-положении атомов водорода,
в результате реакции Канниццаро диспропорционирует.
51.
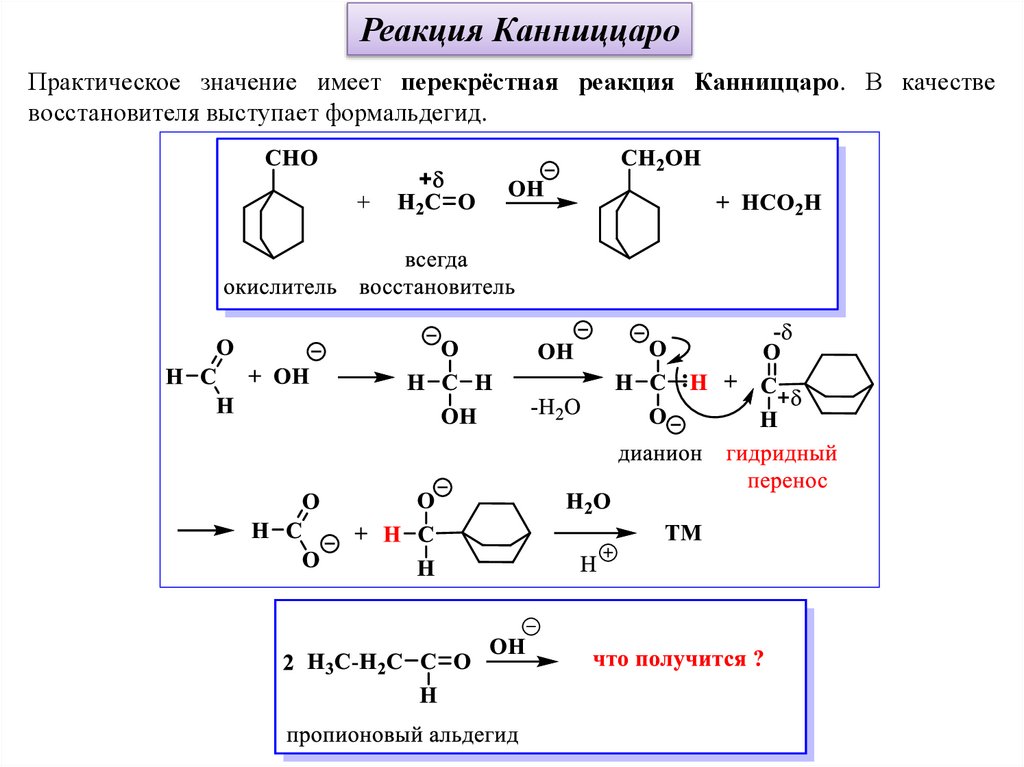
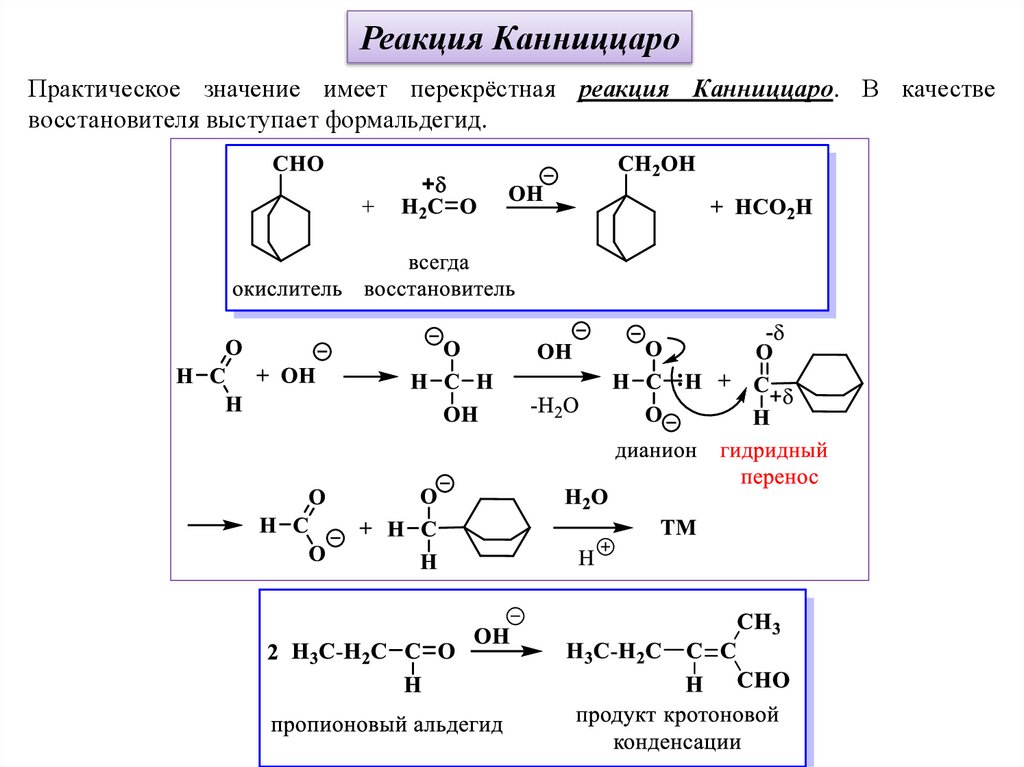
Реакция КанниццароПрактическое значение имеет перекрёстная реакция Канниццаро. В качестве
восстановителя выступает формальдегид.
52.
Реакция КанниццароПрактическое значение имеет перекрёстная реакция Канниццаро. В качестве
восстановителя выступает формальдегид.
53.
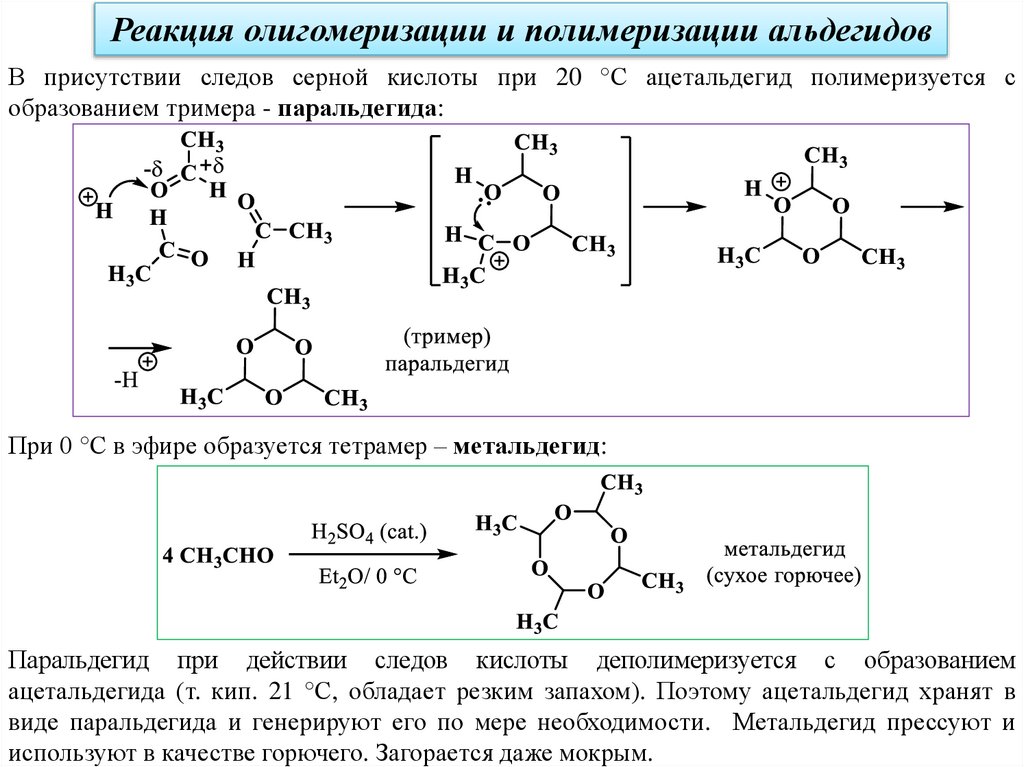
Реакция олигомеризации и полимеризации альдегидовВ присутствии следов серной кислоты при 20 °С ацетальдегид полимеризуется с
образованием тримера - паральдегида:
При 0 °С в эфире образуется тетрамер – метальдегид:
Паральдегид при действии следов кислоты деполимеризуется с образованием
ацетальдегида (т. кип. 21 °С, обладает резким запахом). Поэтому ацетальдегид хранят в
виде паральдегида и генерируют его по мере необходимости. Метальдегид прессуют и
используют в качестве горючего. Загорается даже мокрым.
54.
Реакция олигомеризации и полимеризации альдегидовАналогично тримеризуется и формальдегид в триоксиметилен
При действии следов кислоты также происходит деполимеризация.
Формальдегид образует и линейные полимеры, так называемые полиоксиметилены:
Параформ кристаллизуется при стоянии из формалина (40%
раствор CH2O в воде). Конденсация идет через образование
CH2(OH)2. В промышленности - получают анионной или
катионной полимеризацией газообразного формальдегида. На
концах макромолекул находятся гидроксильные группы,
которые дестабилизируют полимер, поэтому их превращают,
например, в сложные эфиры. Полиоксиметилен устойчив в
щелочной среде, не изменяется в воде и других растворителях.
Из него изготавливают, например, подшипники, которые
работают без смазки. Следы кислоты или других
электрофилов
разлагают
(деполимеризуют)
его
до
формальдегида.
55.
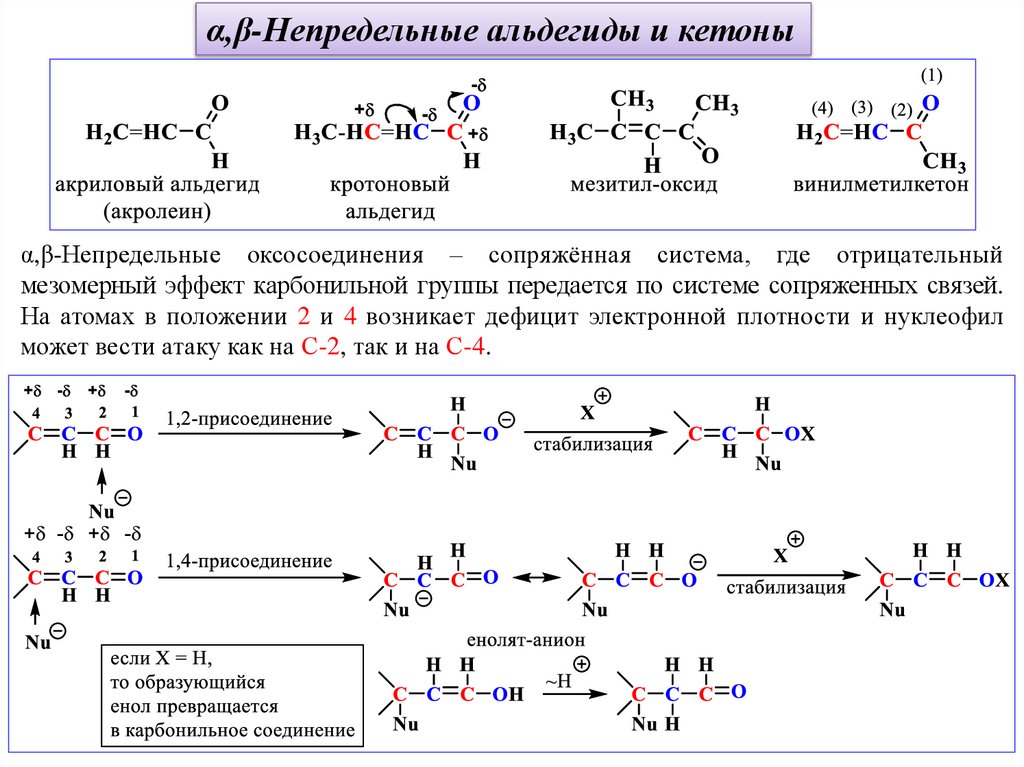
α,β-Непредельные альдегиды и кетоныα,β-Непредельные оксосоединения – сопряжённая система, где отрицательный
мезомерный эффект карбонильной группы передается по системе сопряженных связей.
На атомах в положении 2 и 4 возникает дефицит электронной плотности и нуклеофил
может вести атаку как на С-2, так и на С-4.
56.
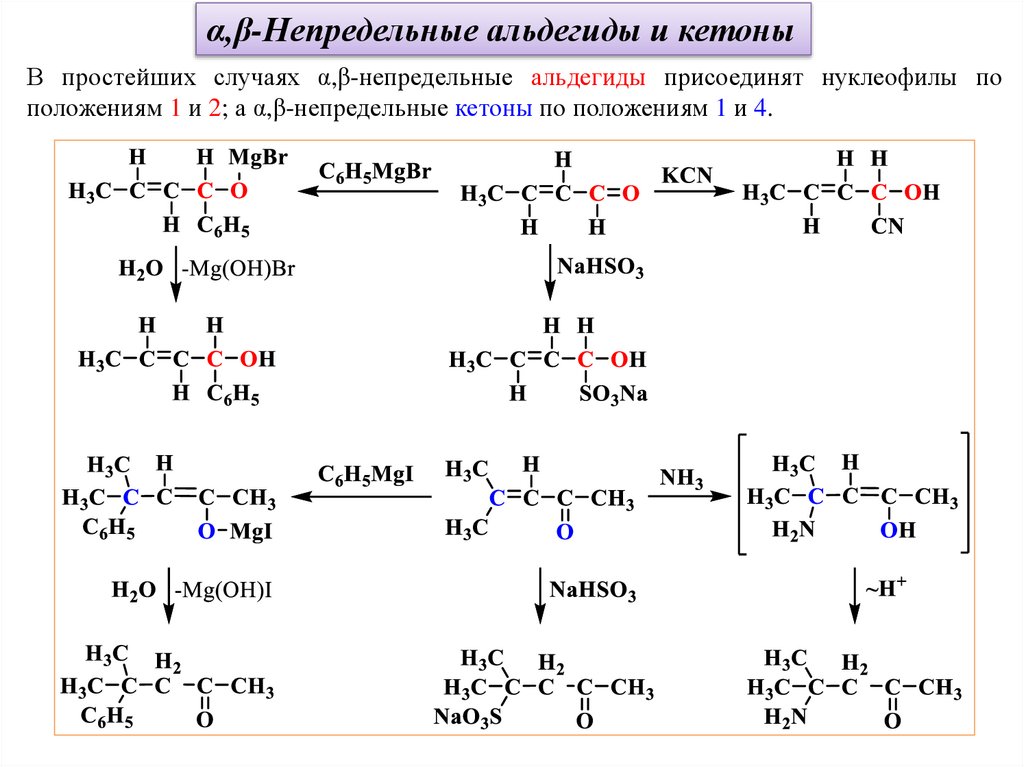
α,β-Непредельные альдегиды и кетоныВ простейших случаях α,β-непредельные альдегиды присоединят нуклеофилы по
положениям 1 и 2; а α,β-непредельные кетоны по положениям 1 и 4.
57.
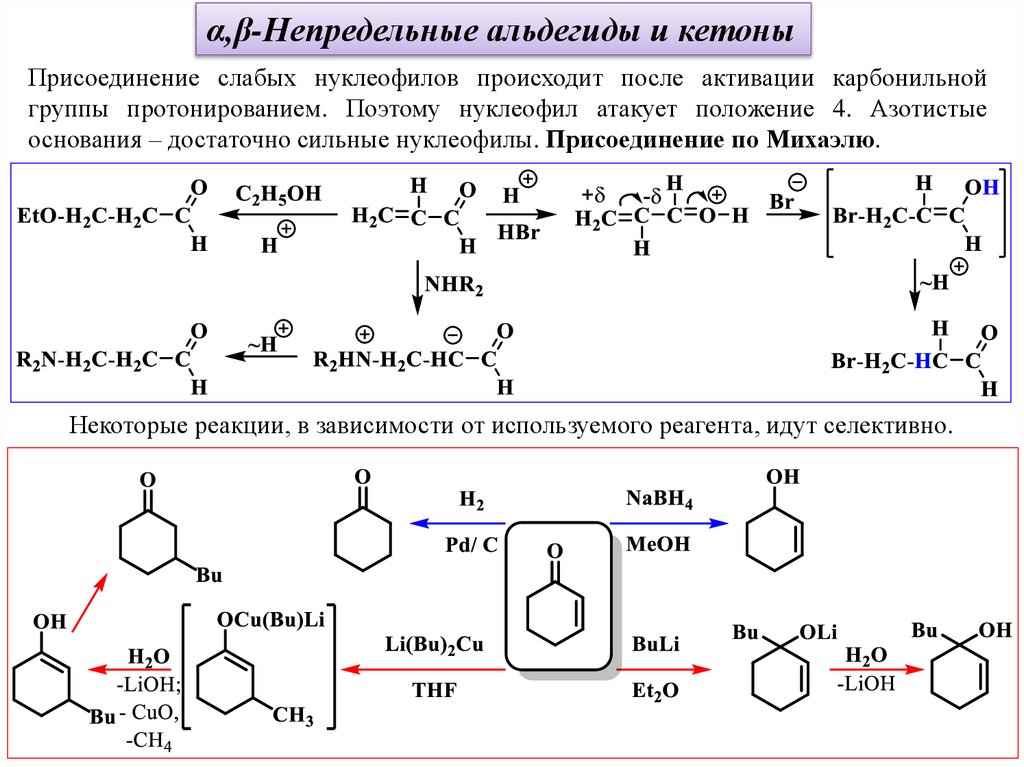
α,β-Непредельные альдегиды и кетоныПрисоединение слабых нуклеофилов происходит после активации карбонильной
группы протонированием. Поэтому нуклеофил атакует положение 4. Азотистые
основания – достаточно сильные нуклеофилы. Присоединение по Михаэлю.
Некоторые реакции, в зависимости от используемого реагента, идут селективно.
58.
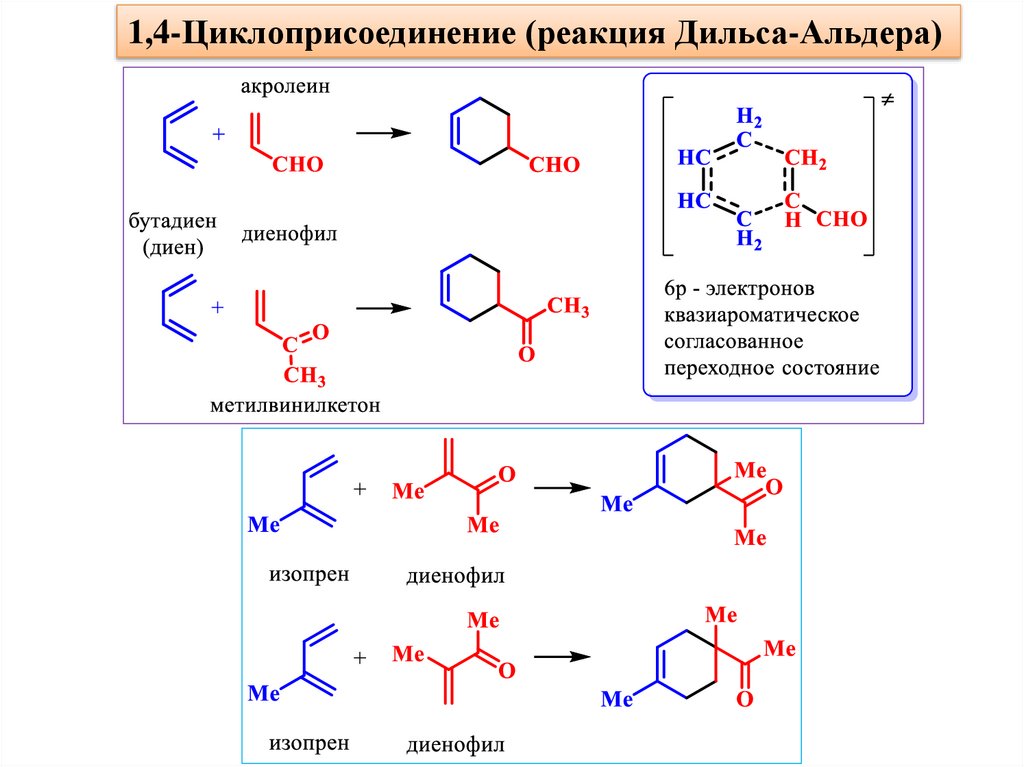
1,4-Циклоприсоединение (реакция Дильса-Альдера)59.
Только носитель языка сможет прочитатьЕщё немного русского












 chemistry
chemistry








