Similar presentations:
Альдегиды и кетоны (часть 1)
1.
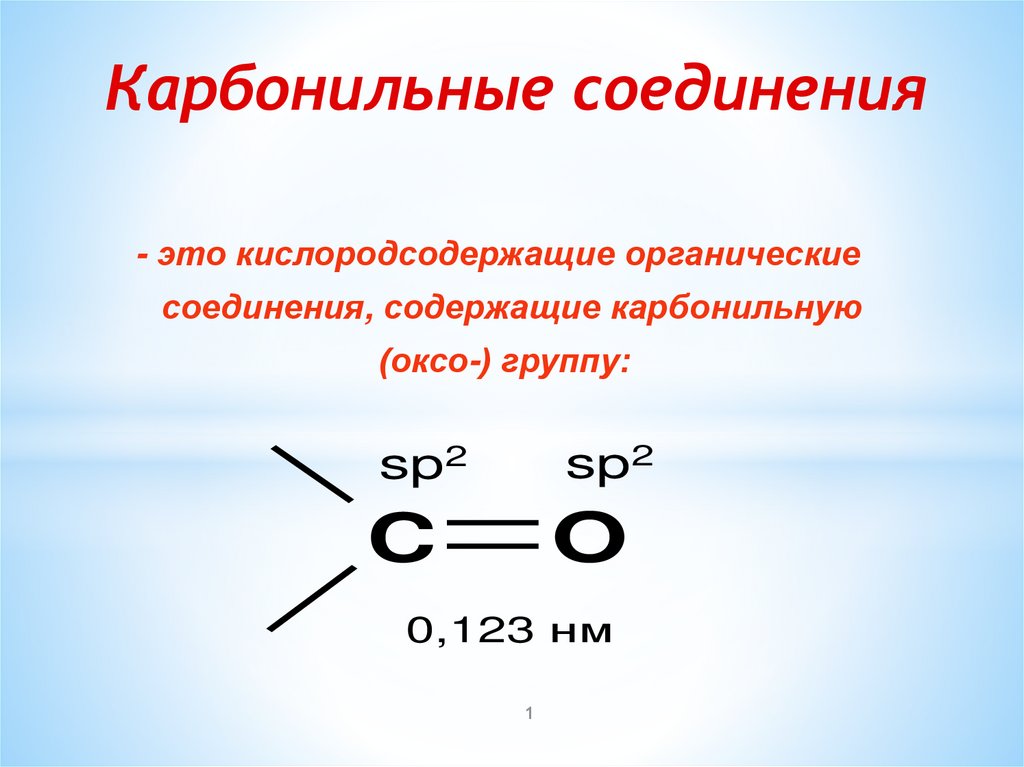
Карбонильные соединения- это кислородсодержащие органические
соединения, содержащие карбонильную
(оксо-) группу:
sp2
sp2
O
C
0,123 нм
1
2.
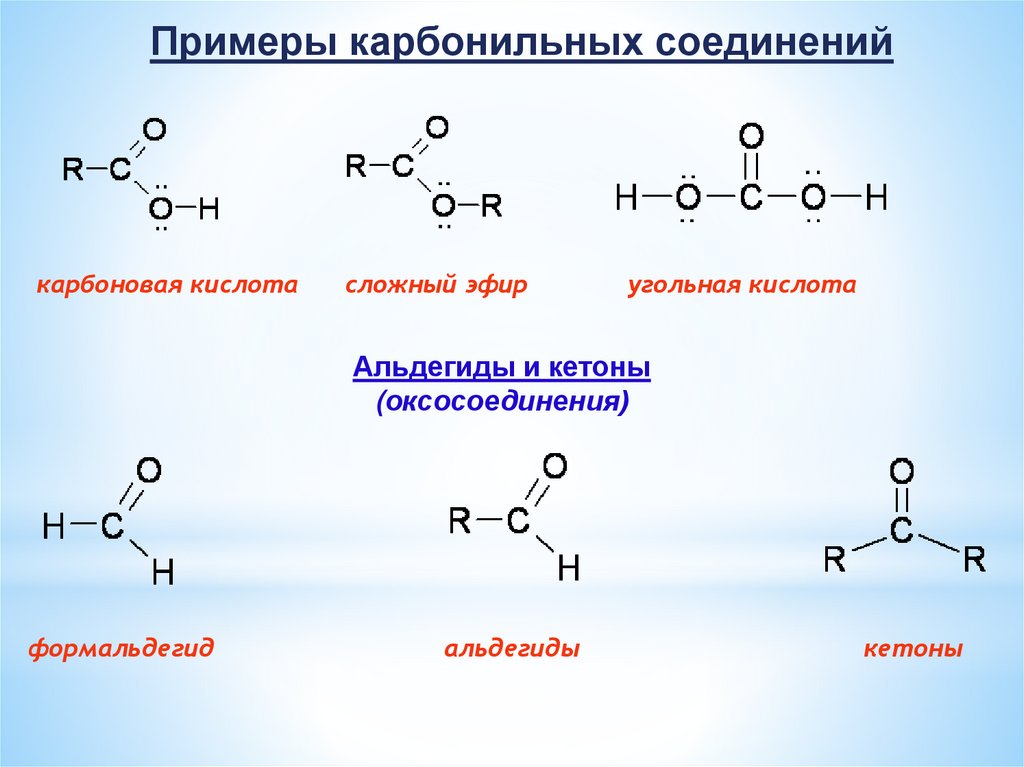
Примеры карбонильных соединенийкарбоновая кислота
сложный эфир
угольная кислота
Альдегиды и кетоны
(оксосоединения)
формальдегид
альдегиды
кетоны
3.
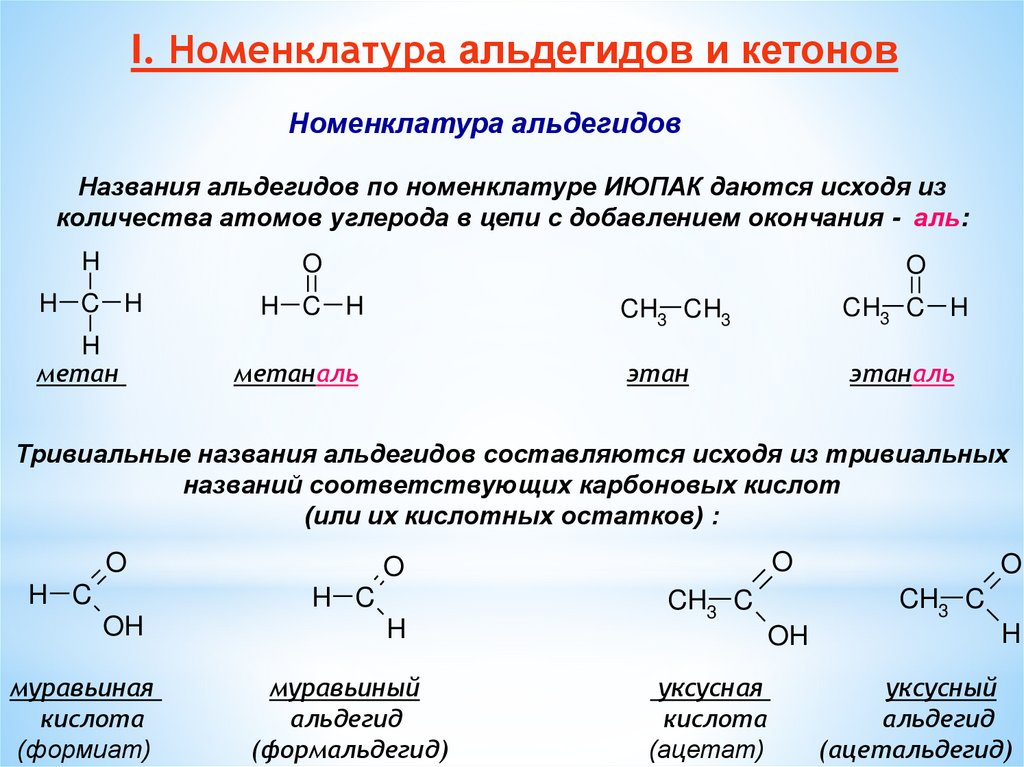
I. Номенклатура альдегидов и кетоновНоменклатура альдегидов
Названия альдегидов по номенклатуре ИЮПАК даются исходя из
количества атомов углерода в цепи с добавлением окончания - аль:
H
O
H C H
H C H
H
метан
O
метаналь
CH3 CH3
CH3 C H
этан
этаналь
Тривиальные названия альдегидов составляются исходя из тривиальных
названий соответствующих карбоновых кислот
(или их кислотных остатков) :
O
H C
H C
OH
муравьиная
кислота
(формиат)
O
O
H
муравьиный
альдегид
(формальдегид)
CH3 C
CH3 C
OH
уксусная
кислота
(ацетат)
O
H
уксусный
альдегид
(ацетальдегид)
4.
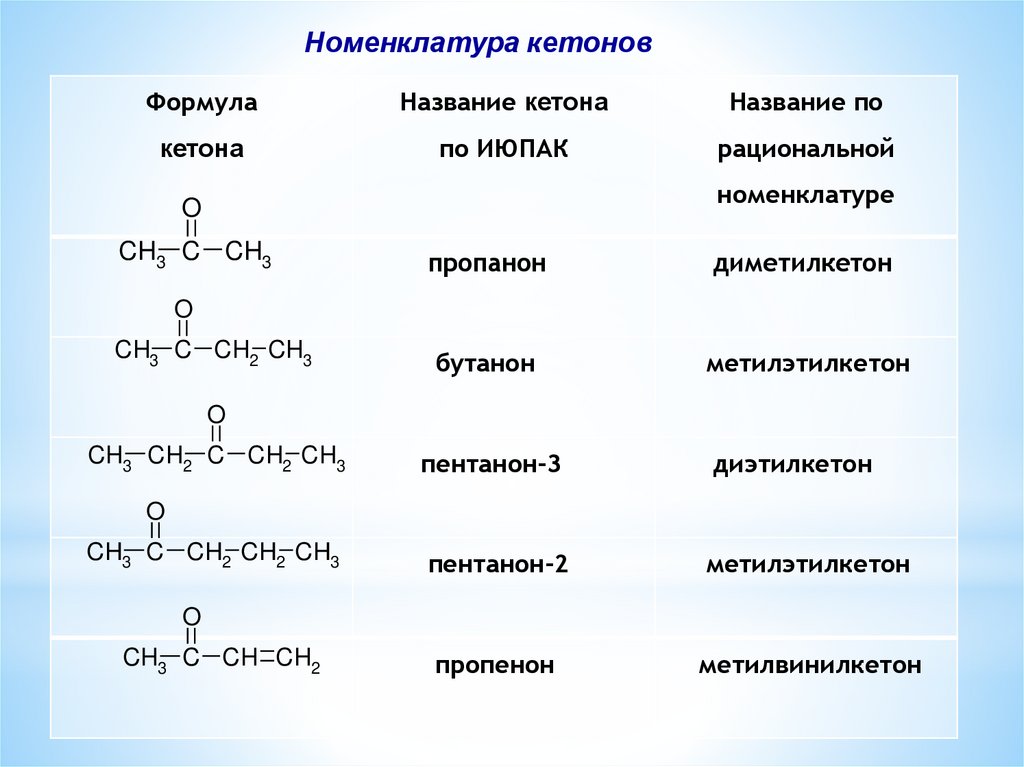
Номенклатура кетоновФормула
Название кетона
Название по
кетона
по ИЮПАК
рациональной
номенклатуре
O
CH3 C CH3
пропанон
диметилкетон
бутанон
метилэтилкетон
O
CH3 C CH2 CH3
O
CH3 CH2 C CH2 CH3
пентанон-3
диэтилкетон
пентанон-2
метилэтилкетон
пропенон
метилвинилкетон
O
CH3 C CH2 CH2 CH3
O
CH3 C CH CH2
5.
II. Виды изомерии1.Структурная изомерия
* Изомерия положения оксогруппы (только для кетонов)
O
O
CH3 C CH2 CH2 CH3
пентанон-2
CH3 CH2 C CH2 CH3
пентанон-3
* Изомерия углеродного скелета
O
CH3 C CH2 CH2 CH3
O
CH3 C CH CH3
CH3
пентанон-2
3-метилбутанон-2
6.
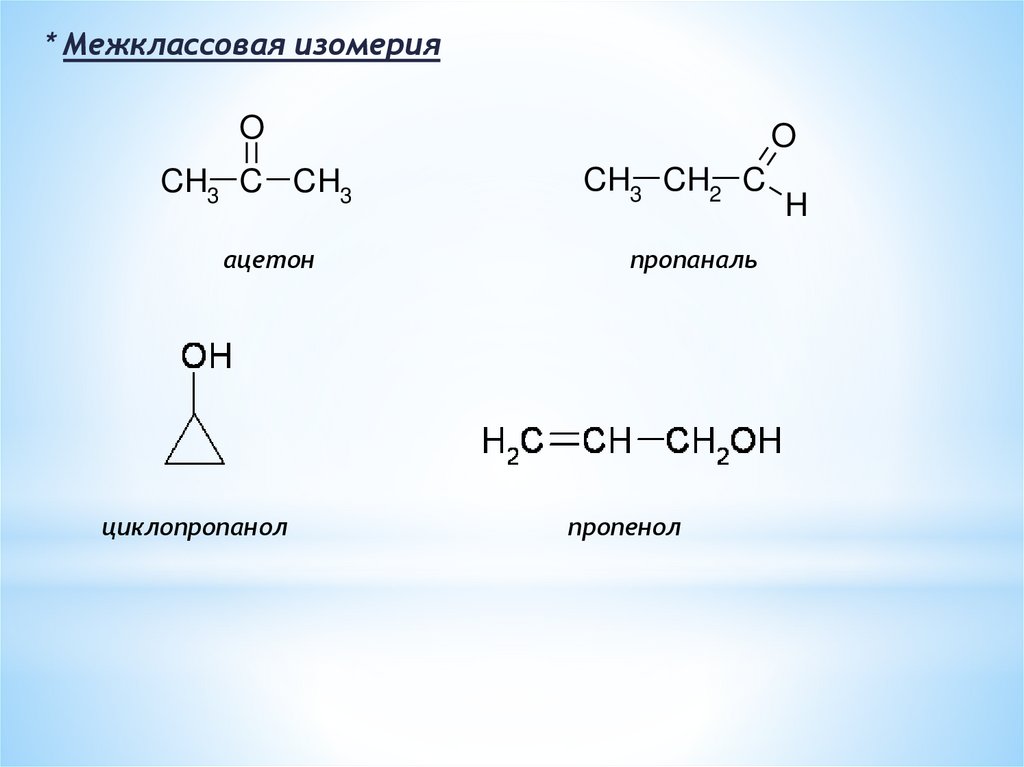
* Межклассовая изомерияO
CH3 C CH3
ацетон
циклопропанол
O
CH3 CH2 C
пропаналь
пропенол
H
7.
III. Физические свойстваНизшие алифатические альдегиды и кетоны (кроме формальдегида)
– это жидкости. Формальдегид (метаналь) является газом с резким
неприятным запахом. Запах ацетальдегида (этаналя) напоминает
запах яблок.
По мере удлинения цепи запах альдегидов всё более напоминает
запах цветов и фруктов – это свойство альдегидов используются
в парфюмерии. Низшие кетоны являются подвижными жидкостями
с освежающим запахом.
Низшие кетоны и альдегиды хорошо смешиваются с водой. Однако,
с увеличением углеводородной цепи их растворимость в воде
уменьшается.
Формалин – раствор, содержащий 40% формальдегида, 8% метанола,
52 % воды. Используется для бальзамирования и консервации
биологических объектов и для дубления кож.
8.
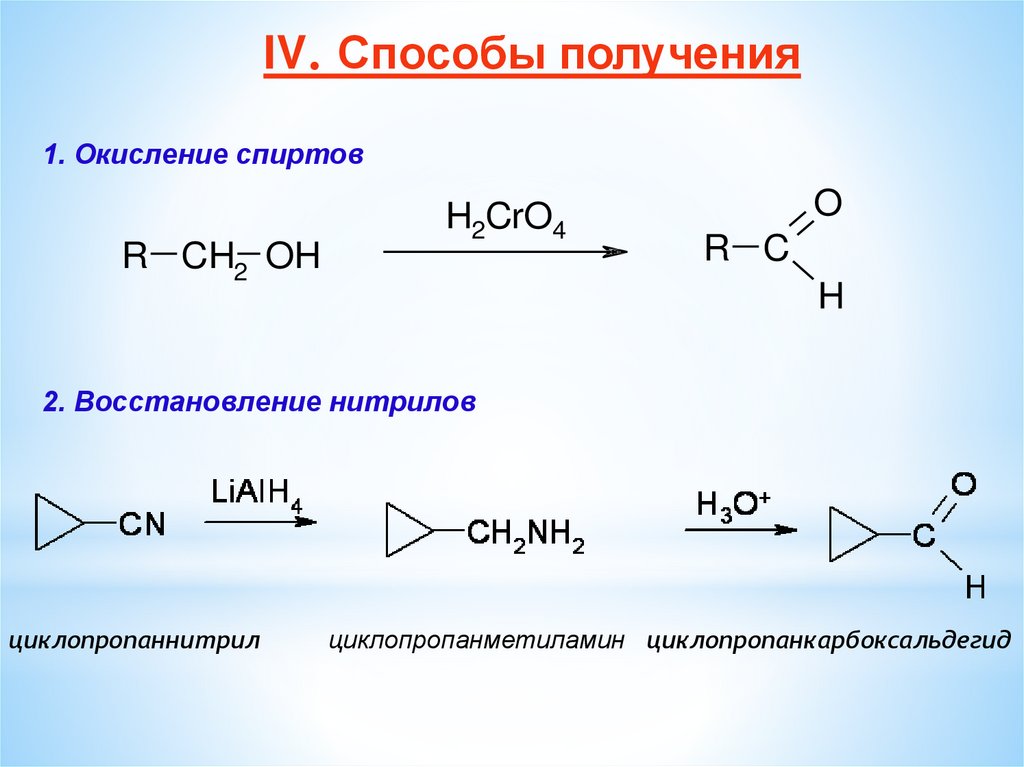
IV. Способы получения1. Окисление спиртов
R CH2 OH
H2CrO4
O
R C
H
2. Восстановление нитрилов
циклопропаннитрил
циклопропанметиламин циклопропанкарбоксальдегид
9.
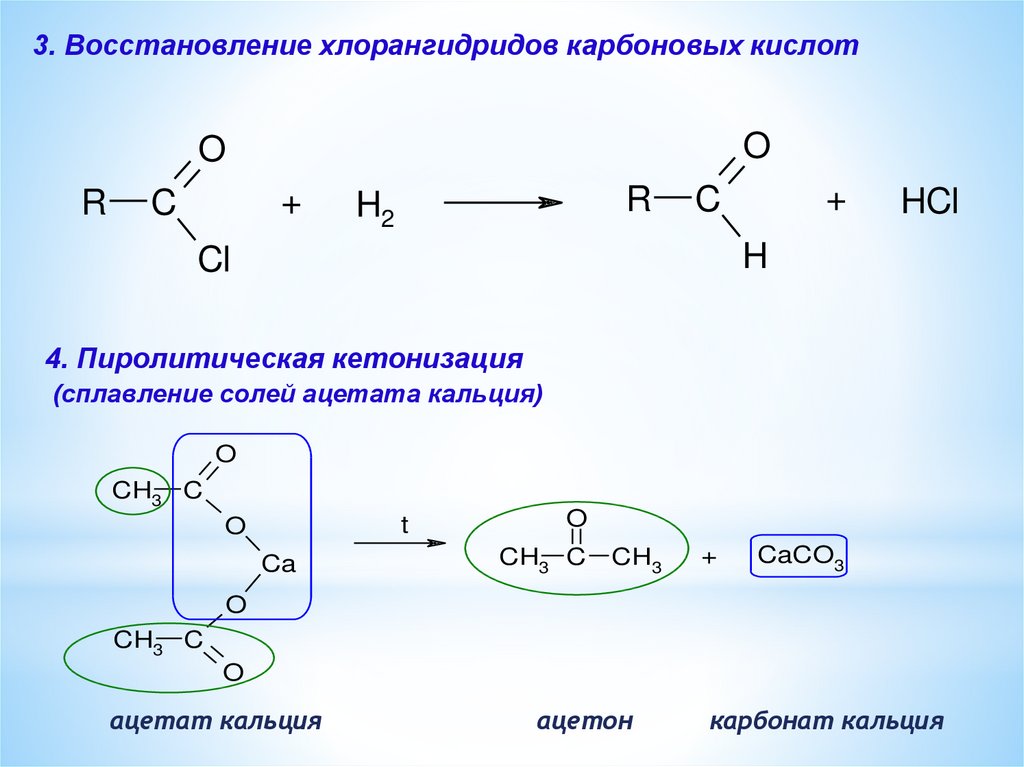
3. Восстановление хлорангидридов карбоновых кислотO
O
R
+
C
R
H2
+
C
HCl
H
Cl
4. Пиролитическая кетонизация
(сплавление солей ацетата кальция)
O
CH3 C
t
O
Ca
O
CH3 C
CH3
+
CaCO3
O
CH3 C
O
ацетат кальция
ацетон
карбонат кальция
10.
5. Оксосинтез (гидроформилирование)Присоединение угарного газа и водорода к алкенам в присутствии
кобальтовых катализаторов при нагревании 140-180oC и давлении 3-8 МПа:
O
H2C
CH2 +
CO
+
H3C
H2
CH2 C
H
6. Реакция Кучерова
H
C
C
H + H2O
HgSO4
O
H2C
C
H
H3C
C
H
OH
виниловый спирт
этаналь
7. Получение уксусного альдегида (путем окисления этилена)
O
PdCl2, CuCl2
2 H2C CH2 + O2
2 CH3 C
H
8. Получение формальдегида (путем окисления метана)
СН4
+
О2
t, Mn2+, Cu2+
Н2О
11.
9. ОксосинтезR
R
R
O
O3
2R
C
R
R
10. Дегидратация двухатомных спиртов
(протекает с разрывом связи С-С)
R
R C
R
C R
O
HIO4
2R
C
R
OH OH
11. Гидролиз дигалогеналканов
Br
R C
C H
+
2 HBr
R C
Br
CH3
KOH, H2O
O
R C
CH3
12.
IV. Химические свойстваОксосоединения являются одними из наиболее реакционоспособых классов
соединений, что связано с наличием в их молекулах высокополяризованной
карбонильной группы:
.. O ..
.. _
.. O ..
C
C+
Согласно представленной схеме атом углерода карбонильной группы ввиду
недостатка электронной плотности приобретает свойства электрофила,
следовательно, для оксосоединения будут характерны реакции нуклеофильного
присоединения.
Кроме того, оксосоединения проводят реакции окисления, полимеризации и
конденсации.
Общую схему механизма протекания реакции нуклеофильного присоединения
рассмотрим на примере присоединения синильной кислоты (НСN)
CH3
N C:
цианид-ион
C O
CH3
ацетон
CH3
N C C O
CH3
+
H
CH3
N C C OH
CH3
циангидрин ацетона
13.
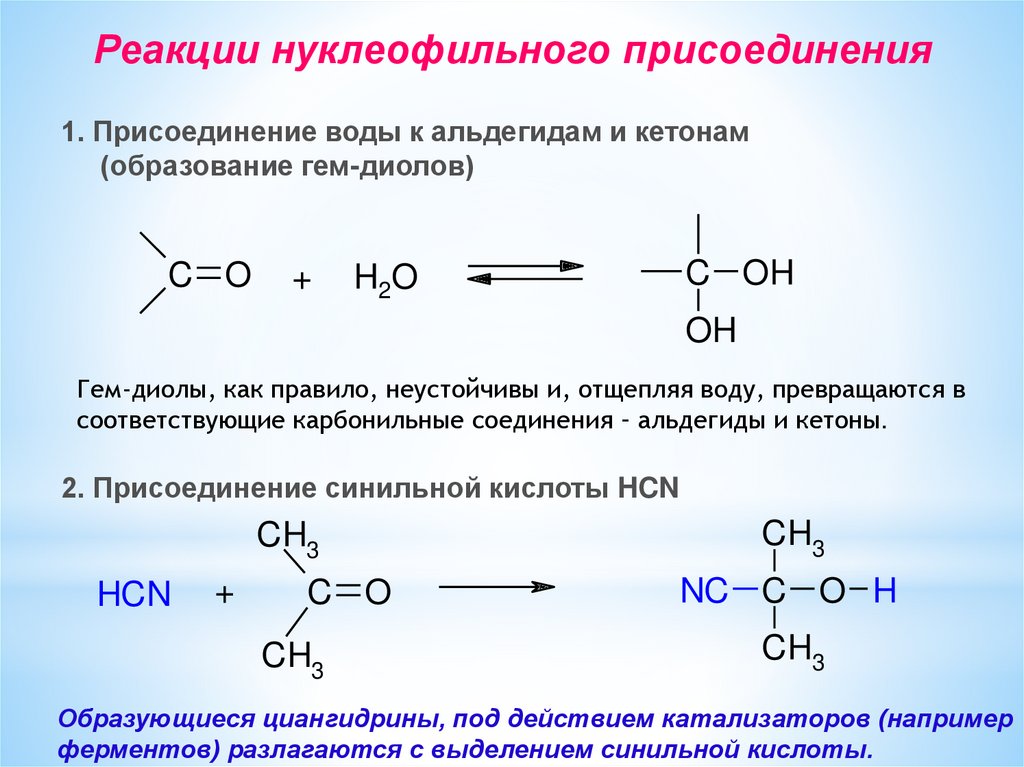
Реакции нуклеофильного присоединения1. Присоединение воды к альдегидам и кетонам
(образование гем-диолов)
C O
+
H2O
C OH
OH
Гем-диолы, как правило, неустойчивы и, отщепляя воду, превращаются в
соответствующие карбонильные соединения – альдегиды и кетоны.
2. Присоединение синильной кислоты HCN
CH3
HCN
+
C O
CH3
CH3
NC C O H
CH3
Образующиеся циангидрины, под действием катализаторов (например
ферментов) разлагаются с выделением синильной кислоты.
14.
3. Присоединение спиртов к альдегидам и кетонам(образование полуацеталей)
O H
O
CH3 C
+
C2H5OH
CH3 C OC2H5
H
H
альдегид
спирт
полуацеталь
При избытке спирта из полуацеталей образуются ацетали:
O
CH3 C
H
альдегид
C2H5OH
H+
или
OH-
O H
CH3 C O C2H5
H
полуацеталь
C2H5OH
O C2H5
CH3 C O C2H5
H
ацеталь
15.
4. Присоединение гидросульфита натрия (NaHSO3)Na+ O
R
Na+ O
R
Na+ O
R
HO S :
C O
HO S
C O
O
S
C OH
O
H
O
O
H
H
NaHSO3
или
SO3Na
5. Присоединение металлоорганических соединений (р-в Гриньяра)
O
OMgBr
H C
H
C2H5
C H
H
вода
-MgBrOH
OH
C2H5
C H
H
пeрвичный
спирт
O
R C
H
C2H5 Mg Br
OMgBr
C2H5
R
O
R
C
C H
OMgBr
R
C2H5
C R
R
вода
-MgBrOH
вода
-MgBrOH
OH
C2H5
C H
R
вторичный
спирт
OH
C2H5
C R
R
трeтичный
спирт
16.
6. Присоединение к альдегидам и кетонам алкинов(имеющих кислотный водород) - реакция Фаворского
O
O
H C
H C
C
H C
H
H
ацетилен
H C
C CH2OH
H
HOCH2 C
пропинол
C CH2OH
бутиндиол
7. Присоединение аммиака и аминов
присоединение
элиминирование
H
H
C O
R N
H
амин
R
альдегид
(кетон)
N C
N C OH
+
H2O
R
альдимин
(кетимин)
основание Шиффа
При последующем гидрировании образующихся альдеминов (кетаминов)
образуются амины.








 chemistry
chemistry








