Similar presentations:
Белоктар классификациясы, ас қорыту ференттері
1. Белоктардың классификациясы, ас қорыту ферменттері
Орындаған:Қабылдаған:
2. ЖОСПАР
КіріспеНегізгі бөлім
• Белоктар
• Белоктардың классификациясы
• Ферменттер
• Ас қорыту ферменттері
Қорытынды
Пайдаланылған әдебиеттер
3. КІРІСПЕ
• Белок — молекулалары өте күрделіболатын аминқышқылдарынан құралған орган
икалық зат; тірі организмдерге тән азотты
күрделі органикалық қосылыс.
• Ферменттер — барлық тірі организмдер
құрамына кіретін арнайы ақуыздар. Химиялық
реакцияларды жеделдетеді.
• Ас қорыту ферменттері – тағамдық күрделі
компоненттерді одан әрі абсорбциялануы үшін
қарапайым заттарға дейін ыдырататын
ферменттер.
4. Негізгі бөлім
НЕГІЗГІ БӨЛІМБелоктар
Белоктардың классификациясы
5. Белоктар туралы жалпы түсінік
• Жер жүзіндегі тірі ағзалардың негізгіқұрамды бөлігі – белок. Ф. Энгельс
өзінің «Табиғат диалектикасы»
еңбегінде: «Өмір дегеніміз – белокты
денелердің тіршілік ету тәсілі» деген.
Демек белок барлық тірінің негізі, ал
олардың тіршілік ету тәсілі – өмір
болып табылады.
• Тірі ағзаның құрамына кіретін
белоктар немесе протеиндер (protos –
бірінші, алғашқы, маңызды деген грек
сөзі) органикалық қосылыстардың 5085% құрайды.
6.
• 1871 ж. орыс химигі Н. Н. Любавинбелоктар амин қыш қылдарынан
тұратынын анықтады.
• Белоктар цитоплазма мен ядроның
негізін құрайды. Олар табиғатта
кездесетін органикалық заттардың
ішіндегі ең күрделісі.
• Белоктардың элементтік құрамы (К.
Сағатов бойынша):
Көміртегі – 50-55%
Оттегі – 21-24%
Азот – 15-18%
Сутегі – 6-7%
Күкірт – 0,3-2,5%
• Кейбір белоктік заттардың құрамына
фосфор кіреді, аз мөлшерде кейде
темір, мыс, йод, хлор, бром, кальций,
мырыш және т.б. элементтер де
кездесуі мүмкін.
7.
• Белоктардың басқа полимерлерден өзгешелігі – оларқұрылысы жағынан бір-біріне ұқсас болғанымен,
мүлдем басқа мономерлерден құралған.
• Белоктың молекулалық массасы оның құрамындағы
аминқышқылдарының санына байланысты. Мысалы,
инсулин белогінің құрамында 51 амин қышқылдарының
қалдығы бар, екі полипептидтік тізбектен тұрады,
молекулалық массасы 5733, ал гемоглобиннің
құрамында 574 амин қышқылдарының қалдығы бар,
молекулалық салмағы 64500. Əртүрлі белоктардың
құрамындағы амин қышқылдары қалдықтарының саны
әртүрліжүзден бірнеше мыңға дейін. Белоктың
молекулалық массасын әртүрлі физикалық және
химиялық әдістермен анықтауға болады, солардың
ішінде кең тарағаны: электрофорез, молекулалық тор
әдісі, ультрацентрифугалау т.б
8.
9. Қызметі:
1. Катализаторлық, ферментативтік қызмет атқарады.2. Тасымалдаушы қызмет атқарады.
3. Ағзаның қозғалуын қамтамасыз ететін белоктар, оларға бұлшық еттегі актин мен миозин белоктарын жатқызуға болады
4. Қорғаныштық қызметі
5. Көптеген белоктар биологиялық активті заттар
6. Белоктар құрылымдық қызмет атқарады
7. Қор ретінде жиналатын белоктар
8. Белоктардың рецепторлық қызметі.
10. Белоктардың физикалық жəне химиялық қасиеттері
Белоктардың физикалық жәнехимиялық қасиеттері
• Белоктар
үлкен
молекулалы
органикалық
қосылыстар,
олар
жартылай өткізгіш мембранадан өте
алмайды. Белоктарды басқа қоспадан
диализ арқылы тазарту осындай
қасиетіне негізделген. Молекуласының
пішіндеріне
қарай
белоктар
фибрилярлық
және
глобулярлық
болып екіге бөлінеді. Глобулярлық
белоктардың
құрылымы
шағын,
полипептидтік тізбектері сфера (шар)
немесе элипсоид сияқты бүктелген
болады.
11.
• Белоктарға тән физикалық қасиеттердің бірі молекулаларының бетіне кіші молекулалыорганикалық қосылыстар мен иондарды
адсорбциялау қабілеті. Белоктардың транспорттық
қабілеті осы қасиетімен тығыз байланысты.
• Белок ерітіндісі коллоидты ерітінді және
коллоидты ерітінділердің барлық қасиеттеріне ие.
Белоктардың коллоидты ерітінділері тұрақты
келеді, оған екі себеп бар: біріншіден, белок
бөлшектері электр заряд алып жүреді, екіншіден,
белок молекулаларының айнала сыртын бірнеше
қабаттан тұратын тығыз су қабықшасы қоршап
тұрады. Бұл фактор белок молекулаларының бірбірімен қосылып (коагуляцияланып), тұнбаға
түсуіне кедергі жасайды
12.
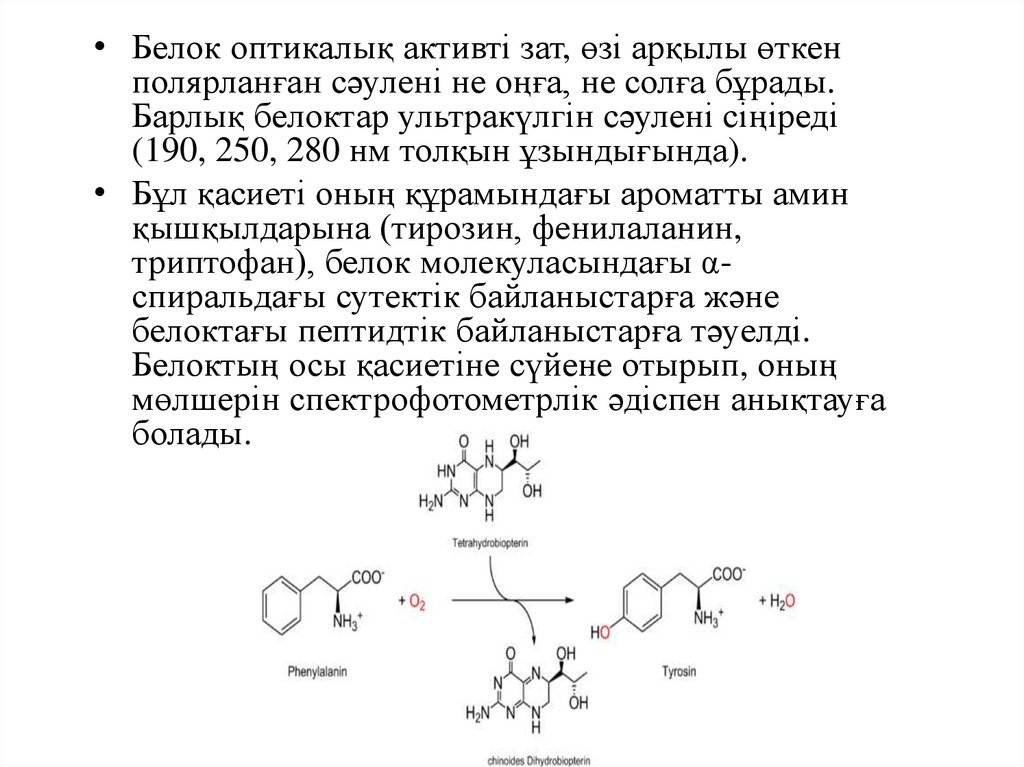
• Белок оптикалық активті зат, өзі арқылы өткенполярланған сәулені не оңға, не солға бұрады.
Барлық белоктар ультракүлгін сәулені сіңіреді
(190, 250, 280 нм толқын ұзындығында).
• Бұл қасиеті оның құрамындағы ароматты амин
қышқылдарына (тирозин, фенилаланин,
триптофан), белок молекуласындағы αспиральдағы сутектік байланыстарға және
белоктағы пептидтік байланыстарға тәуелді.
Белоктың осы қасиетіне сүйене отырып, оның
мөлшерін спектрофотометрлік әдіспен анықтауға
болады.
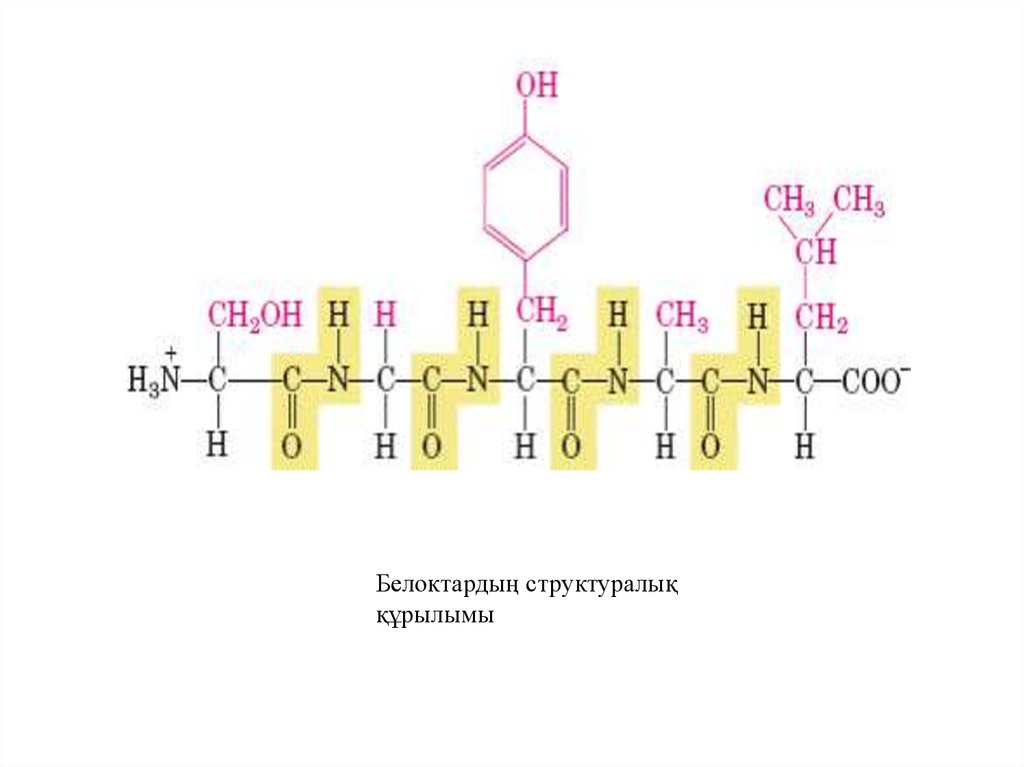
13. Белоктардың химиялық құрылысы
• Белок макромолекулалары қарапайым аминқышқылдарынан
• тұрады. Белоктарды түзетін амин қышқылдарының
құрылысын мынадай түрде көрсетуге болады:
• R – CH – COOH
|
NH2
• Амин қышқылдары түрлі белок молекулаларын түзетін
мономерлі жеке заттар. Адам ағзасында 300-ге жуық
амин қышқылдары бар екені белгілі, бірақ олардың 20сы ғана белок молекуласының құрамына кіреді. Бұлар
протеиногенді аминқыш қылдары.
14.
Белоктардың структуралыққұрылымы
15.
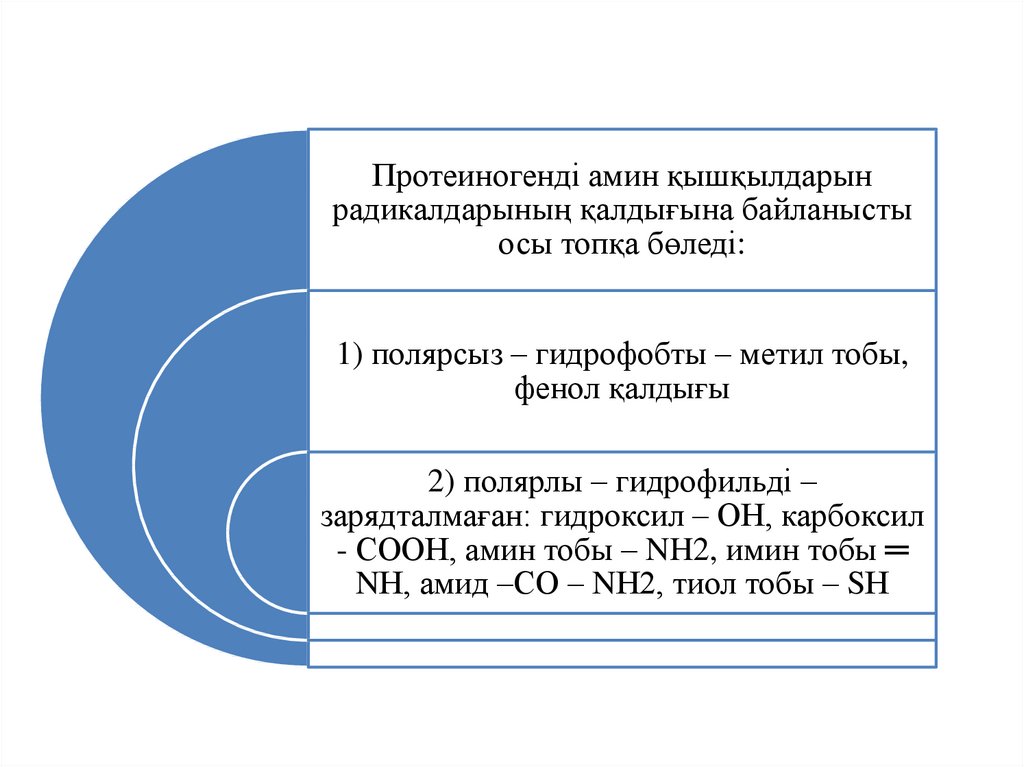
Протеиногенді амин қышқылдарынрадикалдарының қалдығына байланысты
осы топқа бөледі:
1) полярсыз – гидрофобты – метил тобы,
фенол қалдығы
2) полярлы – гидрофильді –
зарядталмаған: гидроксил – ОН, карбоксил
- СООН, амин тобы – NH2, имин тобы ═
NН, амид –СО – NН2, тиол тобы – SН
16.
• Амин қышқылдарының қышқылды-негізді қасиеттерібелоктардың көптеген физикалық, химиялық және
биологиялық қасиеттерін анықтайды. Амин
қышқылдарын бөлу және идентификациялау осы
қасиеттерге негізделген. Амин қышқылдары суда тез
ериді. Олар судың нейтрал ерітінділерінде, биполярлы
ион формасында кристалданады. Барлық амин
қышқылдары ортаға байланысты қышқылдық та, негіздік
те қасиет көрсетеді.
17.
• Екіжақты қасиет көрсетуіне байланыстыамин қышқылдары амфотерлі қосылыстар
немесе амфолиттер деп аталады.
Кристалды амин қышқылын еріткенде,
мысалы: аланинді суда еріткенде ол
қышқыл тәрізді (протон беруші донор)
немесе негіз сияқты (протон қосып алушы) қасиеттер көрсетеді:
18.
• Белоктың амин қышқылды құрамы XXгасырдың 30-шы жылдарында ғана
анықталды.
• 1871 жылы Н. Н. Любавин (орыс
оқымыстысы) өзінің зерттеулерінде ас қорыту
сөлі ферментінің әсерінен белоктардың амин
қышқылына дейін ыдырайтынын анықтады.
Осы жасалған тәжірибелер белок құрамын
анықтауда басты рөл атқарды. Осыдан кейін
А. Данилевский мен Э. Фишер амин
қышқылдарының бір-бірімен пептидті
байланысып, тізбектесіп тұратынын айтты.
• Осы зерттеулерден маңызды екі тұжырым
жасалған: біріншіден - белок құрамына амин
қышқылдары кіреді, ал екіншіден –гидролиз
әдісімен белоктардың химиялық және амин
қышқылды құрамын зерттеуге болады.
19. Белок молекуласының құрылымдары
• Белок молекуласының төрт деңгейлі құрылымыжөніндегі түсінікті ең бірінші ұсынған
Ландерстром-Ланг. Белок молекуласының
құрылымы басқа биополимерлерге қарағанда
әлдеқайда күрделі. Сонымен, белок
молекуласының төрт деңгейдегі құрылымдық
ұйымдасуы болады. Олар: бірінші, екінші, үшінші,
төртінші деңгейдегі құрылымдар.
20. Белоктың бірінші деңгейдегі құрылымы.
Белок молекуласының бірінші деңгейдегі құрылымы полипептидтік тізбектегі
аминқышқылдарының реттеліп орналасуы. Бірінші деңгейдегі құрылымға тән
пептидтік байланыс ұзындығы 0,132 нм, бұл –С–N- байланысынан (0,149 нм)
кіші, С = N қос байланысынан ұзын (0,127 нм) (3-сурет). Кейбір ғалымдар
пептидтік байланысты ішінара қос байланыс, ішінара дара байланыс деген
пікір айтуда. Л. Полинг пен Р. Кори рентген құрылымдық анализ әдісімен
пептидтік байланыс бұрышын анықтап, полипептидтік тізбек бір жазықтықта
орналасқанын дәлелдеді.
Дара байланыстардыңбұралу бұрыштары торсионды болып келеді де, N-Сα
бұрышы φ,ал С-Сα бұрышы – ψ деп белгіленеді. Əр амин қышқылының өзіне
тән бұралу бұрышы болады, бұл белоктардың екінші құрылымын сипаттайды.
21. Белок молекуласының екінші деңгейдегі құрылымы.
Белок молекуласының екінші деңгейдегі құрылымы
сутектік байланыспен бекітіледі. Белок
молекуласындағы полипептидтік тізбек ұзыннан-ұзақ
созылып жатқан түзу тізбек емес. Осындай
тұжырымға ғалымдар белокты рентгенограммасын
қарастыра отырып келген. Осы бағытта біраз
зерттеулер жүргізген америка ғалымдары Л. Полинг
пен Р. Кори. Олардың алға қойған мақсаты белоктағы
полипептидтік тізбектің конформациясын, яғни
кеңістікте орналасуын зерттеу болды.
Алынған нәтижелерге сүйене отырып, әрбір
молекуланың үш өлшемді құрылымының барын
айқындады, әсіресе, маңыздысы пептидтік
байланыстың құрылымын анықтау болды. Оның
ерекшеліктеріне сүйене отырып, полипептидтік
тізбектің шиыршықталып (спиральденіп)
жинақталатынын көрсетті. Сөйтіп екінші деңгейдегі
құрылымда полипептидік тізбек қайталанып
отыратын оң a-спираль, b–құрылым, b–иіліс түрінде
болатыны анықталды.
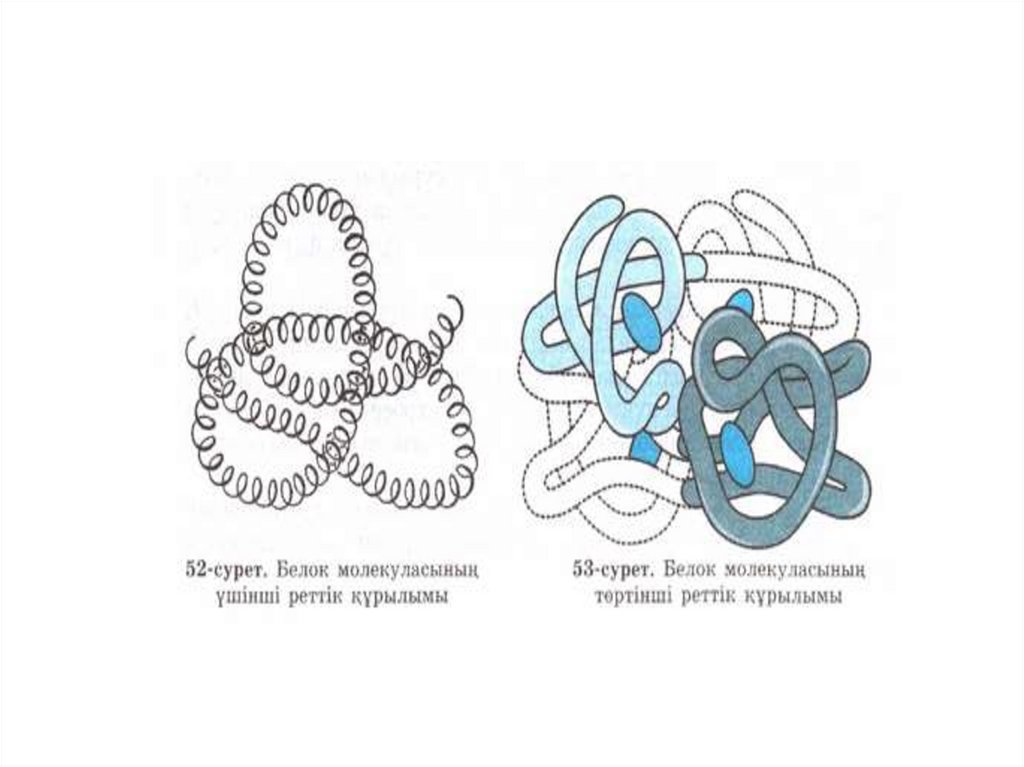
22. Белоктардың үшінші реттік құрылымы
• Белоктың үшінші реттік құрылымы деп полипептидті тізбектіңбелгілі бір көлемде кеңістікте орналасуын айтамыз. Үшінші реттік
құрылымның пішініне қарай, белоктарды глобулярлы және
фибрилярлы түрлерге бөледі. Белок молекуласы пішініндегі иіліп
бұралу, қат-қабат қатпарлар, қисық бұрылыстар негізінен
төмендегідей әрекеттесуге байланысты:
• 1. Амин қышқылдары қалдықтары арасындағы сутектік байланыс.
• 2. Қарама-қарсы зарядтары бар бүйірлік топтардың өзара
әрекеттесуінің электростатикалық күштері (лизин мен аргинин т.б.)
• 3. Амин қышқылдарындағы полярсыз радикалдар арасында ғы
гидрофобтық әрекеттесу.
• 4. Белок молекуласындағы металл иондарының және
аминқышқылдарындағы бүйірлік топтардың өзара әрекеттесуі
(мысалы, цистеин молекулалары арасындағы – S – S – дисульфидтік
байланыстар).
23.
24. Белок молекуласының төртінші деңгейдегі құрылымы.
• Төртінші деңгейдегі құрылым олигомерлі белоктардаболады.
• Мұндай белоктар екі немесе одан да көп
полипептидтік тізбектерден тұрады. Құрамына кіретін
полипептидтік тізбектер бірдей немесе әртүрлі болуы
мүмкін. Жеке полипептидтік тізбектерді суббөліктер
деп атайды. Суббөліктер (протомерлер) бірінші,
екінші, үшінші деңгейдегі құрылымдармен
сипатталады. Енді олардың бір-бірімен байланысып,
жинақталып оралуы сол белоктың табиғи кеңістіктегі
конформациясын, төртінші деңгейдегі құрылымын
түзеді. Олигомерлі белоктардың молекулалық салмағы
бір полипептидтік тізбекті белоктарға қарағанда
әлдеқайда жоғары және олар күрделі қызмет атқарады
25. Негізгі бөлім
НЕГІЗГІ БӨЛІМФерменттер
Ас қорытуға қатысатын ферменттер
26. Ферменттер
• Ферменттер клеткарда синтезделіп,биохимиялық реакцияларға қатысатын
глобурлы белокты табиғатты
биокатализатор болып табылады.
• Олар реакциялардың жылдамдығын
арттырады, алайда реакция кезінде өздері
жұмсалмайды, яғни реакция соңында
өзгеріссіз қалады.
27.
Ферменттердің көпшілігі белоктар болып табылады,бірақ ферментативті белсенділікке ақпаратты РНҚ да ие
(Томас Р. Чек, 1989 жылғы Нобель сыйлығы).
28. Ферменттердің химиялық табиғаты
• Ферменттердің ақуыз табиғатының дәлелі:қайнау кезіндегі белсенділіктің жоғалуы;
УК және рентгендік сәулелену, ультрадыбыстың,
қышқылдардың, сілтілердің, ауыр металдардың әсері
кезіндегі денатурация;
амин қышқылдарына дейінгі гидролиз;
каталитикалық қасиеттерін жоғалтпай тұздардың
әсерінен тұну;
жоғары молекулалық масса, амфотерлік қасиеттер,
электрофорезге қабілеттілік;
аминқышқылдарынан жасанды синтездеу мүмкіндігі
(алғаш рет рибонуклеаз синтезделді).
29. ФЕРМЕНТТЕРДІҢ ҚАСИЕТТЕРІ
Олар әлдеқайда белсенді, әдетте, ферментативтіреакциялар ұқсас химиялық каталитикалық
реакцияларға қарағанда мың есе жылдам өтеді.
Ферменттер таңдамалы. Реакциялардың белгілі бір
түрін катализдейтін ферменттер бар, мысалы,
пептидті байланыстар гидролизі.
Ферменттер өз белсенділігін тек температураның
тар диапазонында және ортаның рН-ында сақтайды.
Ферментативті белсенділіктің жоғалуы
(денатурация) белоктың үшінші құрылымының
бұзылуында орын алады, бұл ретте біріншілік және
тіпті екіншілік құрылымдар өзгеріссіз қалады.
30. ФЕРМЕНТТЕРДІҢ ЕРЕКШЕЛІКТЕРІ
Ферменттер, органикалық емес табиғаттыхимиялық катализаторлар сияқты, тек
энергетикалық пайдалы реакцияларды
катализдейді.
Ферменттер реакция бағытын өзгертпейді және
оның процесінде жұмсалмайды.
Ферменттердің қатысуымен биохимиялық
реакциялардың жылдамдығы бейорганикалық
катализаторларға қарағанда жоғары жылдамдықпен
өтеді.
Ферменттер химиялық реакцияларды бастамайды.
Олар тек реакциялардың жүру жылдамдығын
өзгертеді.
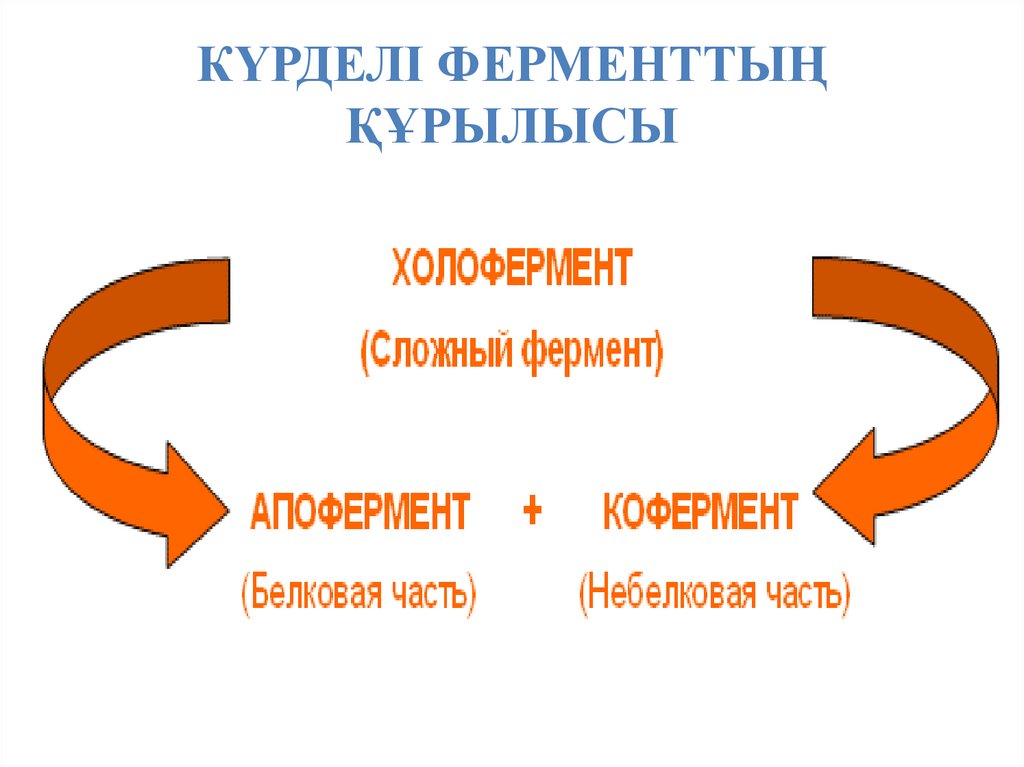
31. ФЕРМЕНТТЕРДІҢ ТҮРЛЕРІ
Барлық ферменттер белоктар және белоктардыңбарлық қасиеттеріне ие. Сондықтан, белоктар
сияқты ферменттер қарапайым және күрделі
болып бөлінеді.
Қарапайым ферменттер тек
амин қышқылдарынан тұрады
- мысалы, пепсин, трипсин,
лизоцим. Күрделі ферменттер
(холоферменттер) құрамында
амин қышқылдарынан
тұратын белокты бөлігі –
апофермент және белокты
емес бөлігі – кофактор бар.
Кофактор, өз кезегінде,
кофермент (НАД+, НАДФ+,
ФМН, ФАД, биотин) немесе
простетикалық топ (гем,
олигосахарид, металдардың
иондары Fe2+, Mg2+, Ca2+,
Zn2+) деп атала алады.
32.
Күрделіферменттер
Холофермент
Ферменттер
құрылысы және
құрылымдық
бөліктері
Қарапайым
ферменттер
(тек белок)
Кофактор,
Белокты
бөлігі
+ белкокты емес
=
немесе апофермент
молекулалар
Кофакторлар:
• Витамины,
• Металл иондары мен олардың комплекстері.
33. КҮРДЕЛІ ФЕРМЕНТТЫҢ ҚҰРЫЛЫСЫ
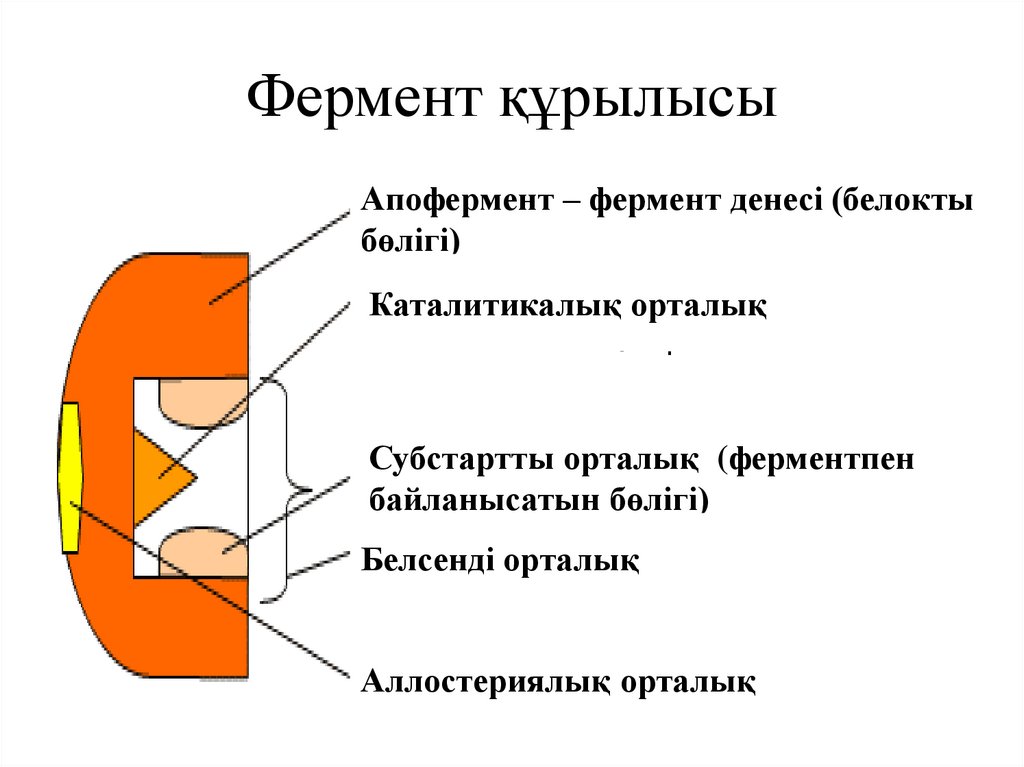
34. Фермент құрылысы
Апофермент – фермент денесі (белоктыбөлігі)
Каталитикалық орталық
Субстартты орталық (ферментпен
байланысатын бөлігі)
Белсенді орталық
Аллостериялық орталық
35.
• Ферменттің құрамында әр түрлі функциялардыорындайтын бөліктер бөлінеді:
Белсенді орталық – субстрат молекуласымен тікелей
байланыстыруды қамтамасыз ететін және катализді
жүзеге асыратын аминқышқыл қалдықтарының
комбинациясы (әдетте 12-16). Белсенді ортадағы
аминқышқылды радикалдар кез-келген үйлесімде болуы
мүмкін, сонымен қатар бір-бірінен желілік тізбекте
едәуір алыстатылған аминқышқылдары орналасады.
Аллостериялық орталық (allos– бөтен) – ферменттің
белсенділігін реттеу орталығы. Қандай да бір
молекуланың аллостериялық орталығымен байланысуы
белок-ферменттің (белсенді орталықтың) кеңістіктік
конфигурациясының және соның салдарынан
ферментативтік реакцияның жылдамдығының өзгеруін
тудырады.
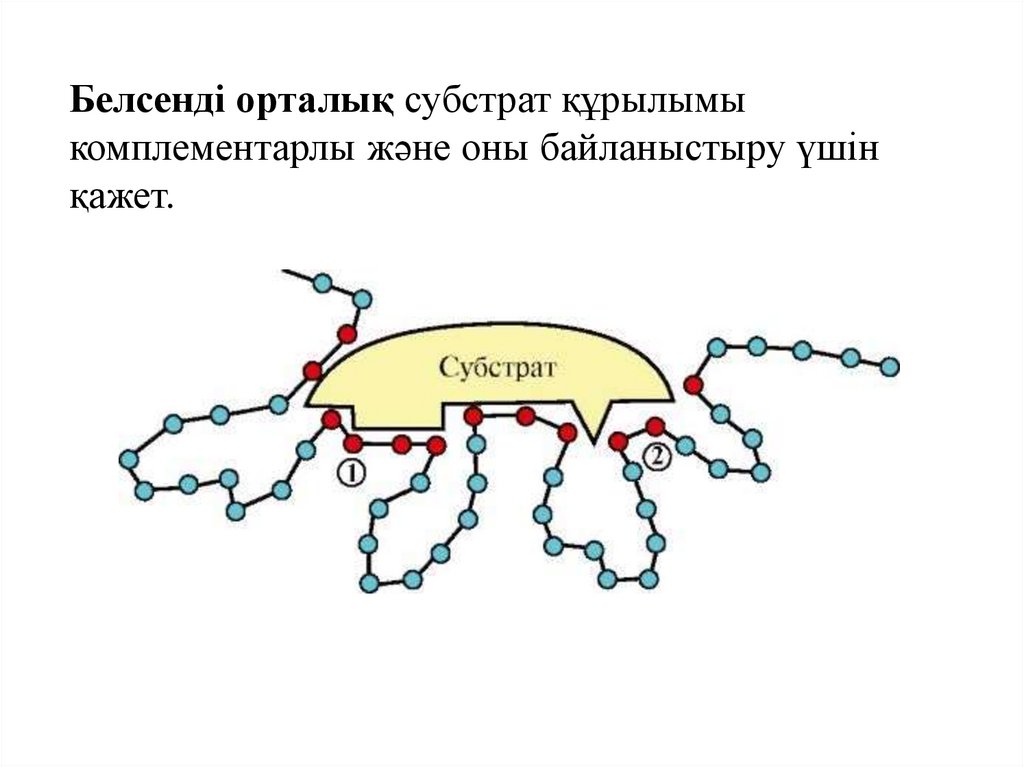
36.
Белсенді орталық субстрат құрылымыкомплементарлы және оны байланыстыру үшін
қажет.
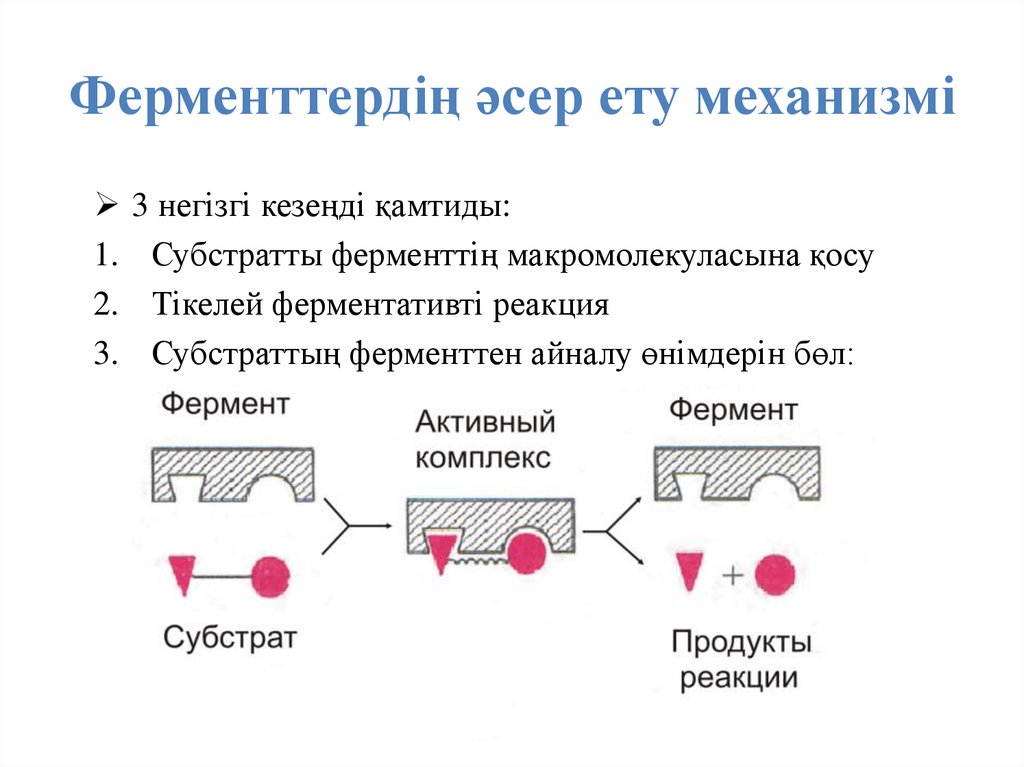
37. Ферменттердің әсер ету механизмі
1.2.
3.
3 негізгі кезеңді қамтиды:
Субстратты ферменттің макромолекуласына қосу
Тікелей ферментативті реакция
Субстраттың ферменттен айналу өнімдерін бөл:
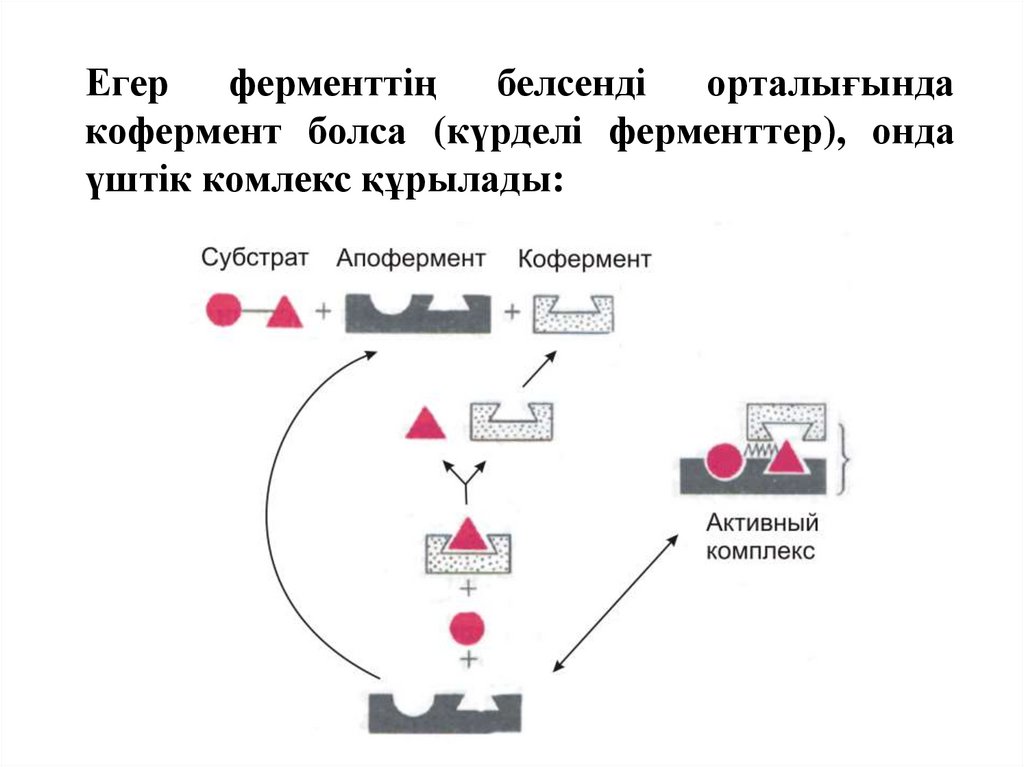
38.
Егер ферменттің белсенді орталығындакофермент болса (күрделі ферменттер), онда
үштік комлекс құрылады:
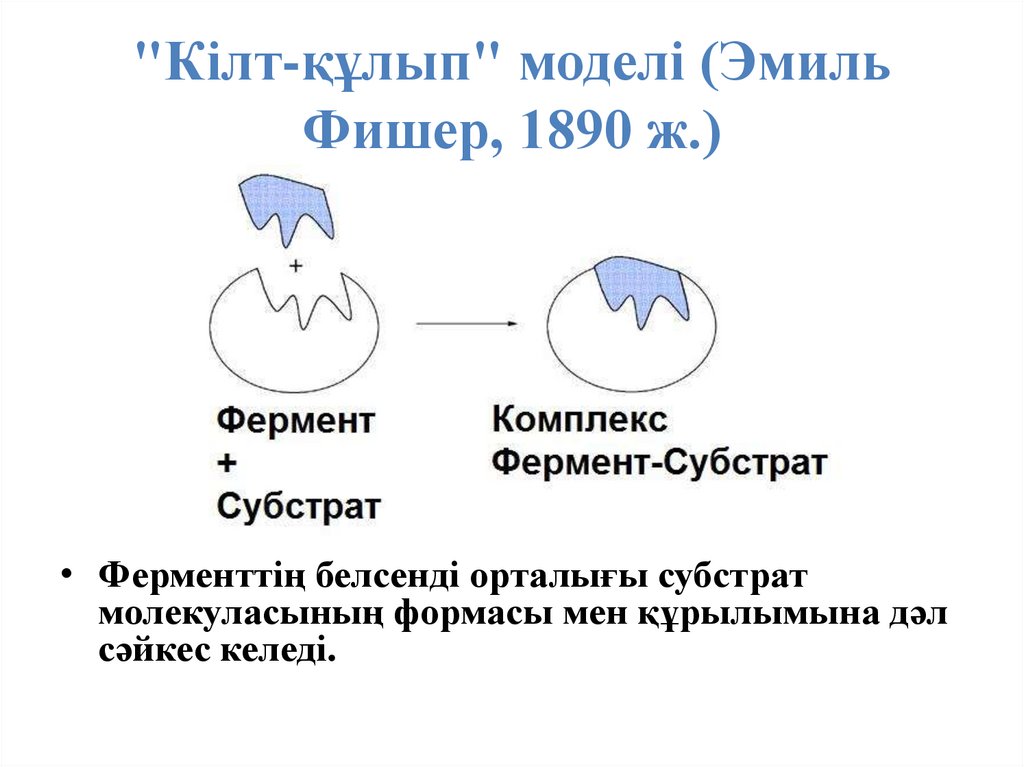
39. "Кілт-құлып" моделі (Эмиль Фишер, 1890 ж.)
"Кілт-құлып" моделі (ЭмильФишер, 1890 ж.)
• Ферменттің белсенді орталығы субстрат
молекуласының формасы мен құрылымына дәл
сәйкес келеді.
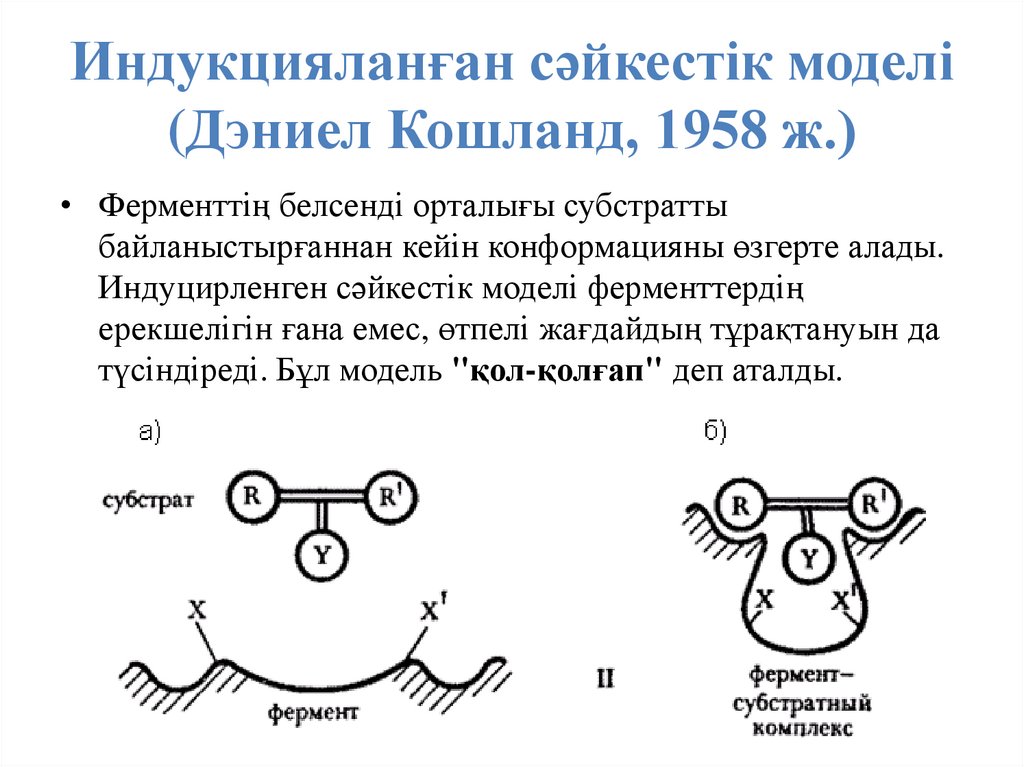
40. Индукцияланған сәйкестік моделі (Дэниел Кошланд, 1958 ж.)
• Ферменттің белсенді орталығы субстраттыбайланыстырғаннан кейін конформацияны өзгерте алады.
Индуцирленген сәйкестік моделі ферменттердің
ерекшелігін ғана емес, өтпелі жағдайдың тұрақтануын да
түсіндіреді. Бұл модель "қол-қолғап" деп аталды.
41. АС ҚОРЫТУ
• Ас қорыту жүйесінің 2 негізгі қызметі:Тамақ ретінде организмге түсетін
молекулаларды (полимерлер) кішірек
молекулаларға (мономерлер) бұзу.
Бұзылған, кішкене молекулаларды сіңіру
және әрі қарай организм мұқтаждықтарыңа
жұмсау.
42.
Майлар глицерин мен май қышқылына,крахмал моносахаридтерге, нуклеин
қышқылдары нуклеотидтерге және
белоктар амин қышқылдарына ыдырайды.
Витаминдар мен минералдар кішкентай
болғандықтан оңай қорытылады.
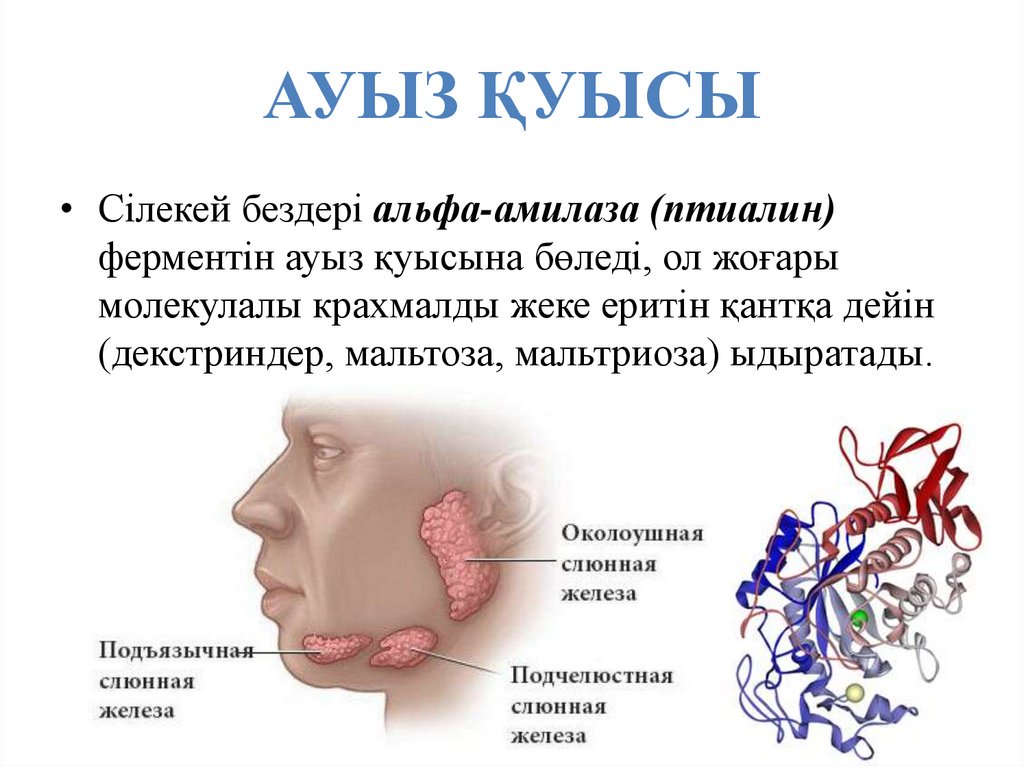
43. АУЫЗ ҚУЫСЫ
• Сілекей бездері альфа-амилаза (птиалин)ферментін ауыз қуысына бөледі, ол жоғары
молекулалы крахмалды жеке еритін қантқа дейін
(декстриндер, мальтоза, мальтриоза) ыдыратады.
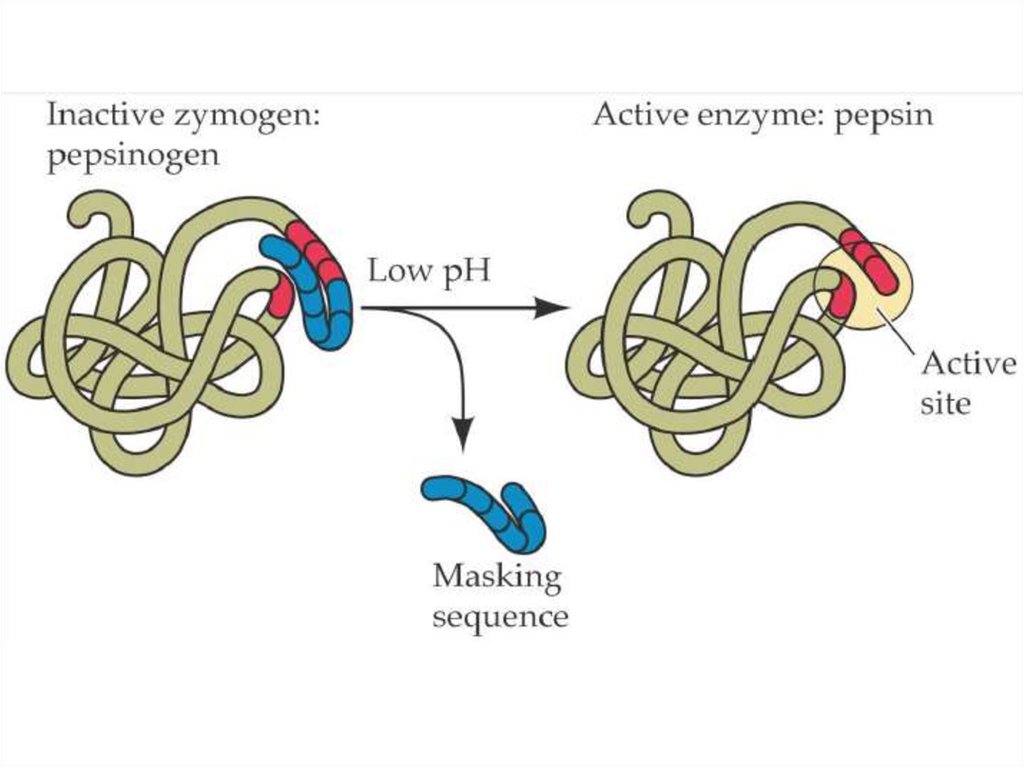
44. АСҚАЗАН
• Пепсин – асқазанның негізгі ферменті.Денатурацияланған белоктардың пептидті
байланыстарын пептидтерге шейін гидролиз
арқылы ыдыратады. Асқазанның шырышты
қабатының өздігінен қорытылуын болдырмау
үшін белсенді емес пепсиноген түрінде
синтезделеді. Асқазанда қышқыл ортада
(рН=1.5—2,5) пепсиногеннің белсенді пепсинге
айналуы орын алады.
• Желатиназа желатин мен коллагенді, негізгі ет
протеогликандарын ыдыратады.
45.
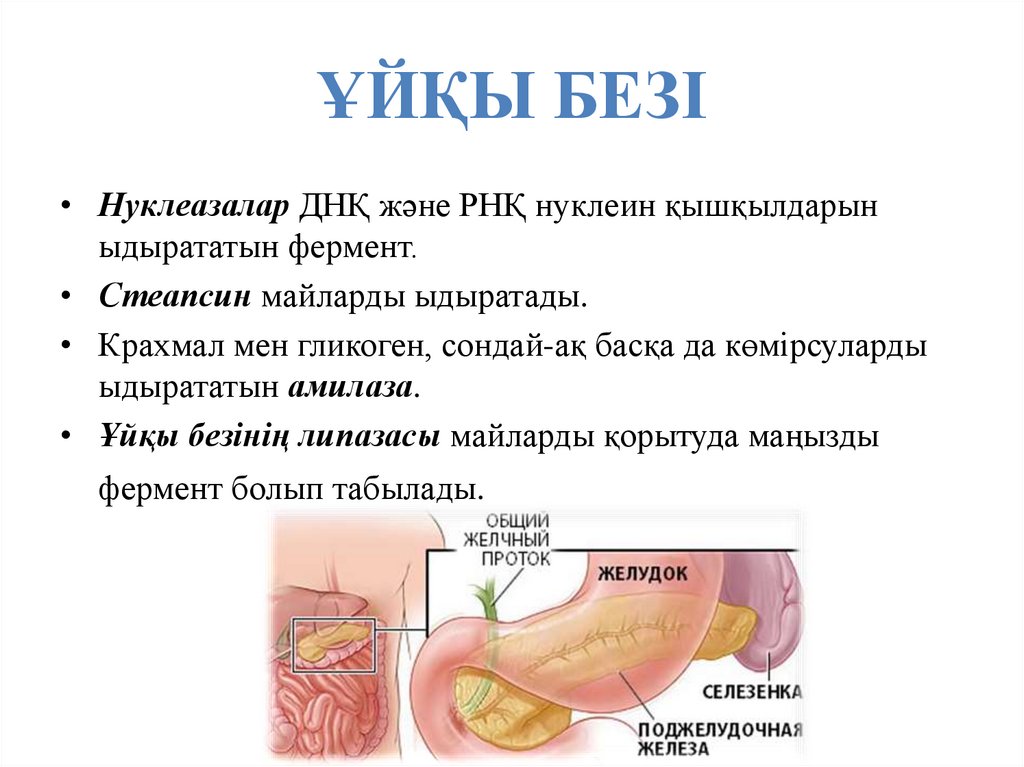
46. ҰЙҚЫ БЕЗІ
Протеазалар:• Трипсин – асқазан пепсиніне ұқсас
протеаза.
• Химотрипсин – сондай-ақ белокты
ыдырататын протеаза.
• Карбоксипептидаза
• Эластазалар – эластинді және кейбір басқа
белоктарды ыдырататын фермент.
47.
48. ҰЙҚЫ БЕЗІ
• Нуклеазалар ДНҚ және РНҚ нуклеин қышқылдарыныдырататын фермент.
• Стеапсин майларды ыдыратады.
• Крахмал мен гликоген, сондай-ақ басқа да көмірсуларды
ыдырататын амилаза.
• Ұйқы безінің липазасы майларды қорытуда маңызды
фермент болып табылады.
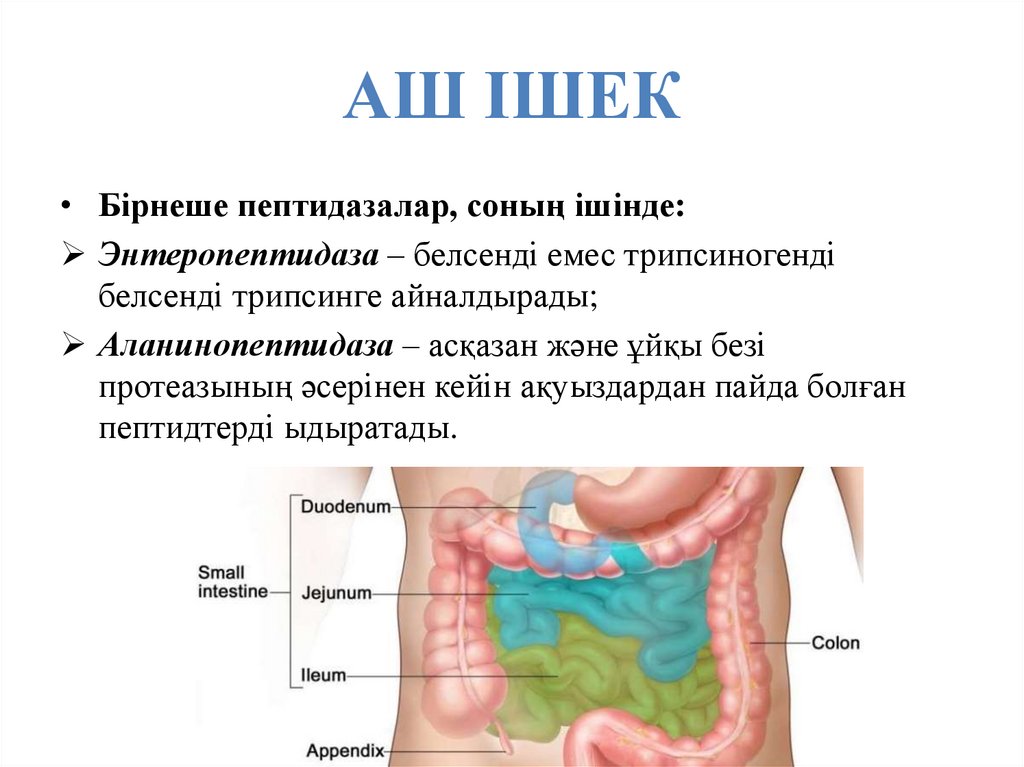
49. АШ ІШЕК
• Бірнеше пептидазалар, соның ішінде:Энтеропептидаза – белсенді емес трипсиногенді
белсенді трипсинге айналдырады;
Аланинопептидаза – асқазан және ұйқы безі
протеазының әсерінен кейін ақуыздардан пайда болған
пептидтерді ыдыратады.
50. АШ ІШЕК
Дисахаридтерді моносахаридтерге дейіныдырататын ферменттер:
• сахараза сахарозаны глюкоза мен фруктозаға дейін
ыдыратады;
• мальтаза мальтозаны глюкозаға дейін ыдыратады;
• мальтаза мальтоза мен изомальтозды глюкозаға дейін
ыдыратады;
• лактаза лактозаны глюкоза мен галактозаға дейін
ыдыратады.
Ішек липазасы триглицеридтерді глицерин мен май
қышқылдарына ыдыратады.
Эрепсин белокты ыдырататын фермент.
51. ІШЕК МИКРОФЛОРАСЫ
• Адамның тоқ ішегінде тіршілік ететінмикроорганизмдер тағамның кейбір түрлерін
қорытуға ықпал ететін ас қорыту ферменттерін
бөледі.
52.
• Ішек таяқшасы –лактозаның
қорытылуына ықпал
етеді.
• Лактобактериялар –
лактозаны және басқа
да көмірсуларды сүт
қышқылына
айналдырады.
53. ҚОРЫТЫНДЫ
Жер жүзіндегі тірі ағзалардың негізгі құрамды бөлігі – белок. Ф. Энгельс
өзінің «Табиғат диалектикасы» еңбегінде: «Өмір дегеніміз – белокты
денелердің тіршілік ету тәсілі» деген. Демек белок барлық тірінің негізі, ал
олардың тіршілік ету тәсілі - өмір болып табылады. Тірі ағзаның құрамына
кіретін белоктар немесе протеиндер (protos – бірінші, алғашқы, маңызды
деген грек сөзі) органикалық қосылыстардың 50-85% құрайды. 1871 ж. орыс
химигі Н. Н. Любавин белоктар амин қыш қылдарынан тұратынын анықтады.
Ферменттер деп ағзада жүретін алуан түрлі биохимиялық процестерге
катализатор ретінде әсер ететін белоктік табиғаты бар қосылыстарды айтады.
Əдетте химиялық реакциялардың жүру жылдамдығын шапшаңдататын
заттарды катализатор деп атайды. Ал ферменттер - өсімдіктер мен жануарлар
және микроағзалар жасушаларынан бөлінетін белок тектес, ағзадағы
биохимиялық реакцияларды шапшаңдататын қабілеті бар зат. Оның
қатысуынсыз қоректік заттардың ағзаға сіңуі мүмкін емес. Осыған сәйкес
ферменттерді биологиялық катализаторлар деп атайды, өйткені, олар тірі
ағзада өтетін зат алмасу процесіне тікелей атсалысады. Фермент (латынның
тілінде fermentum – ашу деген мағына береді) деген терминмен қатар
әдебиетте энзим (грек тілінде –enaym, en –ішкі, zyme ашытқы деген мағына
береді) деген сөз де қолданылады.
54. Пайдаланылған әдебиеттер
• Тұртабаев С. Қ. және т.б. Биохимия негіздері:Оқулық. /С. Қ. Тұртабаев, А. К. Кабдрахимова,
А. Ж. Еримова/ Биология мамандықтарының
студенттеріне арналған. – Алматы: ЖШС
РПБК «Дәуір», 2012. – 336 б.
• Сеитов З.С. Биологиялық химия. – Алматы,
1992
• Сейтмбетова А.Ж., Лиходий С.С. Биологиялық
химия. – Алматы: Білім, 1994 – 304 б.
• Сеитов З.С. Биохимия. – Алматы:
Агроуниверситет, 2000. – 897 с.



































 medicine
medicine








