Similar presentations:
Галогены (греч. «солеобразующие»)
1.
2.
• К элементам VII группы, главной подгруппы относятсяфтор F, хлор Cl, бром Br, иод I, астат At
• Общее название - галогены (греч. «солеобразующие») большинство их соединений с металлами представляют собой
типичные соли (KCl, NaCl и т.д.).
3.
• В свободном виде не встречаютсяФлюорит
CaF2
4. Галит NaCl
5.
CильвинитKCl NaCl
6.
• Иод — элемент редкий7.
F+9
))
2s22р5
)))
+17
3s23p5
2 8 7
Бром
Br
+35
))))
4s24p5
2 8 18 7
Иод
I
+53
)))))
5s25p5
))))))
6s26p5
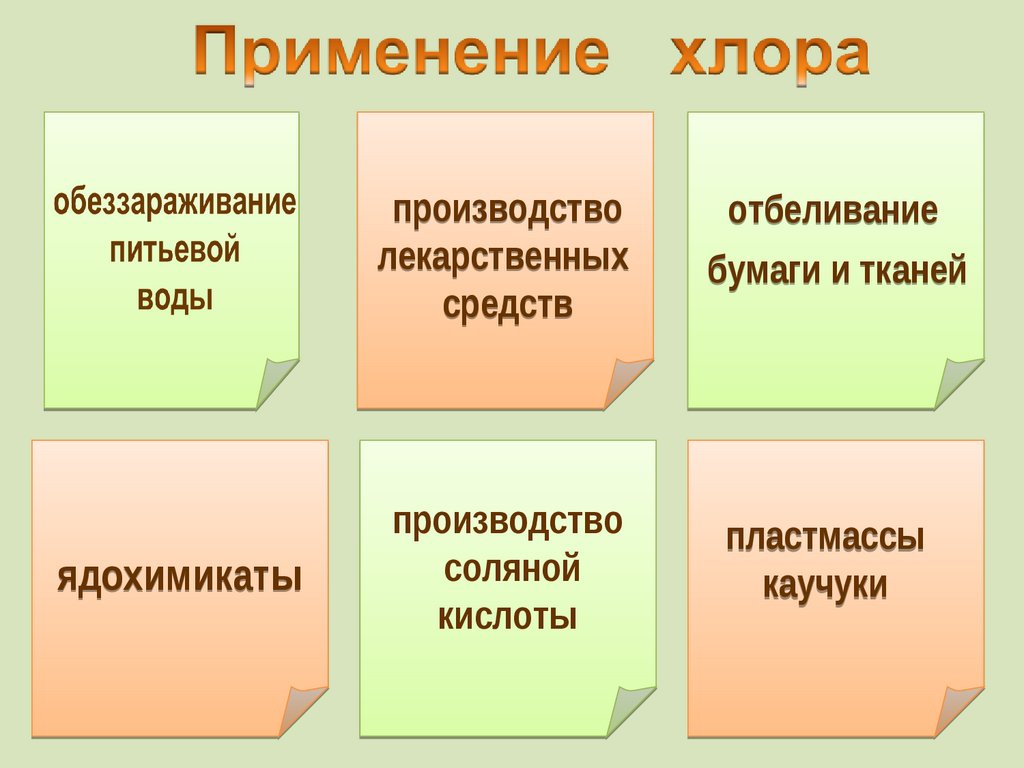
2 8 18 18 7
Астат
At
+85
2 8 18 32 18 7
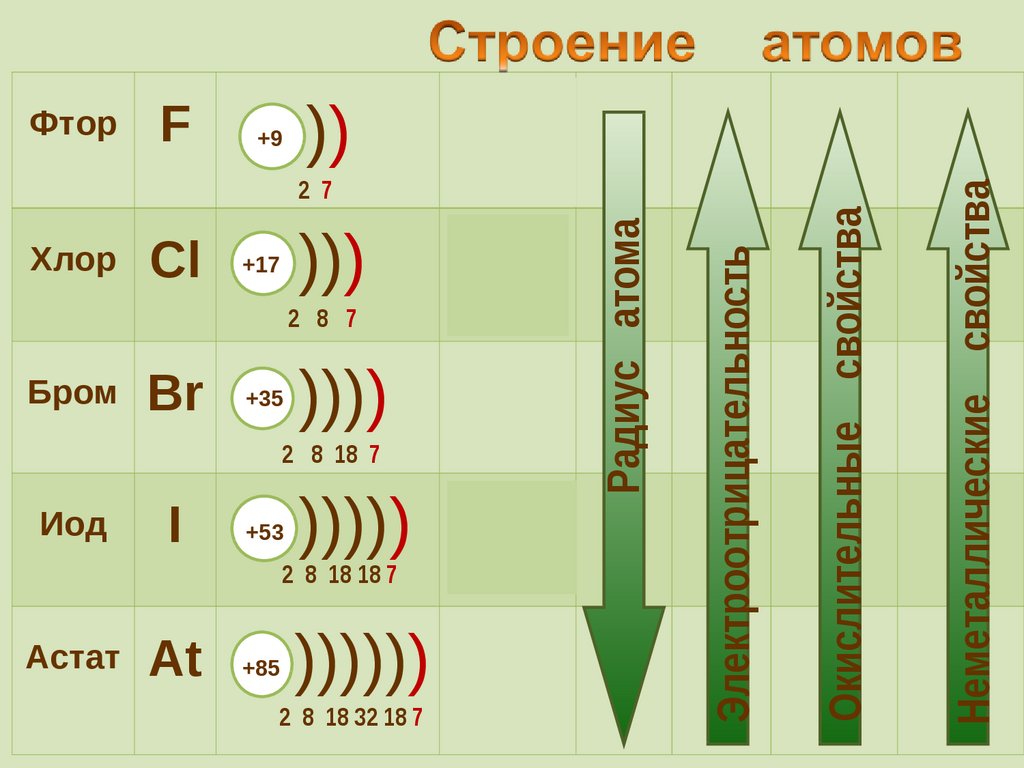
Окислительные свойства
Cl
Электроотрицательность
Хлор
Радиус атома
2 7
Неметаллические свойства
Фтор
8.
9. История открытия галогенов
ФторХлор
Бром
Йод
Астат
10. История открытия фтора
В 1886 году французский химик А.Муассан, используя электролиз жидкого
фтороводорода,
охлажденного
до
температуры –23°C (в жидкости должно
содержаться
немного
фторида
калия,
который
обеспечивает
ее
электропроводимость),
смог
на
аноде
получить первую порцию нового, газа. В
первых опытах для получения фтора Муассан
использовал очень дорогой электролизер,
изготовленный из платины и иридия. При
этом каждый грамм полученного фтора
«съедал» до 6 г платины.
Анри
Муассан
(1852 –
1907)
11. История открытия хлора
КарлВильгельм
Шееле
(1742 – 1786)
В 1774 году шведский ученый К.
Шееле открыл хлор, который принял
за сложное вещество и назвал
"дефлогистированной
соляной
кислотой".
В 1807 году английский химик
Гемфри Дэви получил тот же газ. Он
пришел к выводу, что получил новый
элемент и назвал его "хлорин" (от
"хлорос" - желто-зеленый).
В 1812 году Гей-Люсеок дал газу
название хлор.
12. История открытия брома
В 1825 году французский химикА.Ж.Балар
при изучении маточных
рассолов
выделил
темно-бурую
жидкость, который он назвал - "мурид"
(от латинского слова muria, означающего
"рассол"). Комиссия Академии, проверив
это сообщение, подтвердила открытие
Балара и предложила назвать элемент
бромом (от "бромос", с греческого
"зловонный").
Антуан Жером
Балар
(1802 – 1876)
13. История открытия йода
Бернар Куртуа(1777 –
1838 )
В 1811 году французский химик
Бернар Куртуа открыл
иод
путём
перегонки маточных растворов от своего
азотнокислого
кальция
с
серной
кислотой Чтобы другие химики могли
изучать новое вещество, Б. Куртуа
подарил его (правда, очень небольшое
количество) фармацевтической фирме в
Дижоне.
В 1813 году Ж.-Л.Гей-Люссак подробно
изучил этот элемент и дал ему
современное название. Название "иод"
происходит от греческого слова "иодэс"
- "фиолетовый" (по цвету паров).
14. История открытия астата
В 1869 г Д.И.Мендеелеев предсказал егосуществование и возможность открытия в будущем (как
«эка-иод»).
Впервые астат был получен искусственно в 1940 г
открыт
Д.Корсоном,
К.Маккензи
и
Э.Сегре
(Калифорнийский университет в Беркли) . Для синтеза
изотопа 211At они облучали висмут альфа-частицами.
В 1943-1946 годах изотопы астата были обнаружены в
составе природных радиоактивных рядов. Астат
является наиболее редким элементом среди всех,
обнаруженных в природе. В поверхностном слое земной
коры толщиной 1,6 км содержится всего 70 мг астата.
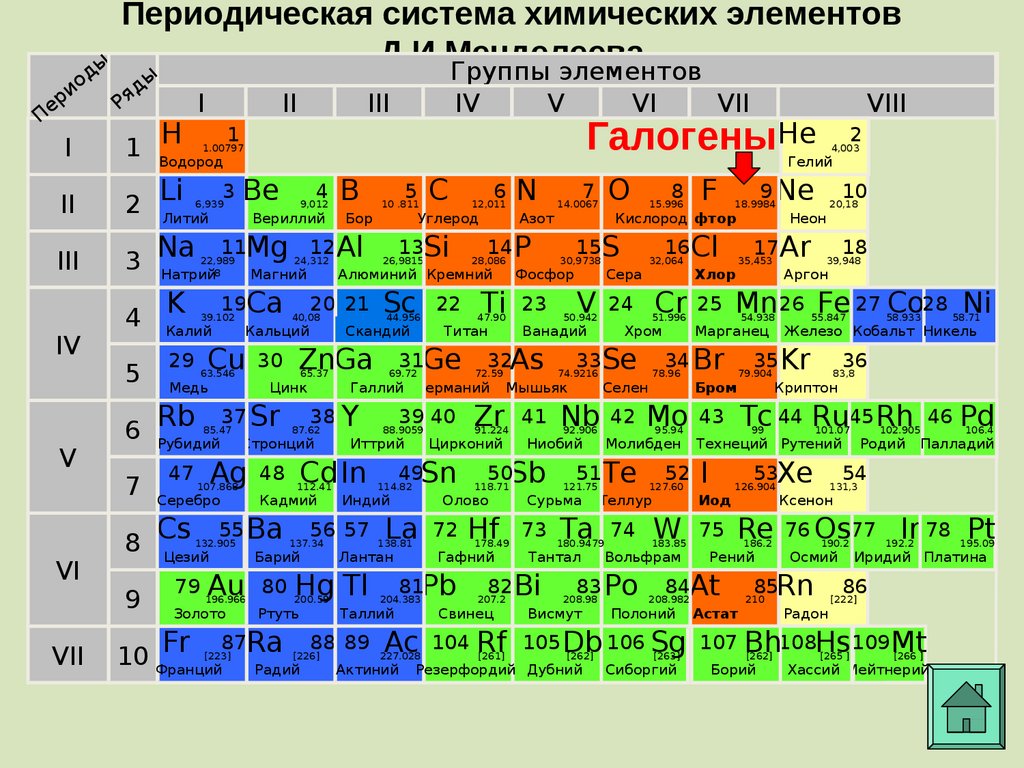
15. Периодическая система химических элементов Д.И.Менделеева
Группы элементовП
ды
о
ды
и
я
р
Р
е
I
H
II
III
IV
V
VI
1
II
2
III
11Mg 12 Al
13Si
14 P
15S
3 Na
Натрий
Магний
Алюминий Кремний
Фосфор
Сера
IV
V
VI
VII
1.00797
Водород
3
6,939
Be
Литий
5
6
7
8
9
K
Калий
Cu
Медь
Рубидий
47
Ag
Цезий
Fr
48
Au
196.966
Барий
80
Ртуть
87Ra
10 Франций
[223]
Y
Радий
44.956
Ti
22
Титан
Цирконий
La
Лантан
72
Hf
81Pb
Таллий
Ac
227.028
Актиний
178.49
Гафний
204.383
41
Rf
[261]
92.906
42
74
52
127.60
W
183.85
Вольфрам
83 Po
Висмут
95.94
Теллур
180.9479
208.98
Mo
Молибден
51 Te
Ta
9 Ne
18.9984
Хлор
25
Полоний
Резерфордий Дубний
[263]
Сиборгий
18
39,948
Аргон
54.938
Марганец
55.847
Бром
58.933
36
83,8
Криптон
Tс 44 Ru45 Rh
43
99
101.07
102.905
Технеций Рутений
I
53Xe
Иод
75
126.904
Re
186.2
Рений
Астат
Родий
46
[262]
106.4
Палладий
54
Ксенон
76 Os77
190.2
Осмий
Ir 78 Pt
192.2
86
Радон
[222]
[265 ]
195.09
Иридий Платина
Bh108Hs 109Mt
Борий
Pd
131,3
85Rn
210
58.71
Железо Кобальт Никель
35 Kr
79.904
105 Db 106 Sg 107
[262]
20,18
Mn 26 Fe 27 Co28 Ni
84At
208.982
10
Неон
17 Ar
35,453
34 Br
78.96
Селен
Nb
Тантал
82 Bi
207.2
Свинец
104
33Se
Сурьма
73
Cr
51.996
Хром
74.9216
121.75
F
16 Cl
32,064
24
Ниобий
50Sb
118.71
Олово
138.81
V
50.942
Мышьяк
91.224
8
15.996
Кислород фтор
Ванадий
Zr
49Sn
O
7
14.0067
30,9738
32As
72.59
39 40
114.82
Азот
23
47.90
31Ge
88.9059
N
28,086
69.72
Индий
88 89
[226]
Sс
Иттрий
Hg Tl
200.59
6
12,011
Галлий Германий
56 57
137.34
C
Углерод
Скандий
Cd In
112.41
Кадмий
55 Ba
132.905
Золото
38
87.62
Стронций
107.868
79
65.37
5
10 .811
26,9815
ZnGa
Цинк
Серебро
Cs
30
37 Sr
85.47
Бор
20 21
40,08
Кальций
63.546
Rb
В
24,312
19Ca
29
4
9,012
Вериллий
39.102
2
4,003
Гелий
22,989
8
4
VIII
ГалогеныHe
1
I
Li
VII
[266 ]
Хассий Мейтнерий
16.
Пды
о
ды
и
я
р
Р
е
I
1
II
2
III
3
IV
V
VI
VII
4
5
6
7
8
9
10
I
II
III
Группы элементов
IV
V
VI
VII
Фтор/Fluorum (F)
VIII
Внешний вид
Бледно-жёлтый
простого вещества газ.
Очень ядовит.
Электронная
коефигуранция
ЭО
(по Полингу)
[He] 2s2 2p5
3,98
Степень окисления −1
Плотность
(при −189 °C)1,108
г/см ³
Температура
плавления
Температура
кипения
53,53К
85,01 К
17.
Пды
о
ды
и
я
р
Р
е
I
1
II
2
III
3
IV
V
VI
VII
4
5
6
7
8
9
10
I
II
III
Группы элементов
IV
V
VI
VII
VIII
Хлор / Chlorum (Cl)
Внешний вид
Газ жёлто-зеленого
простого вещества цвета с резким
запахом. Ядовит.
Электронная
коефигуранция
ЭО
(по Полингу)
[Ne] 3s2 3p5
3.16
Степень окисления 7, 6, 5, 4, 3, 1, −1
Плотность
(при −33.6 °C)1,56
г/см ³
Температура
плавления
Температура
кипения
172.2 К
238.6 К
18.
Пды
о
ды
и
я
р
Р
е
I
1
II
2
III
3
IV
V
VI
VII
4
5
6
7
8
9
10
I
II
III
Группы элементов
IV
V
VI
VII
VIII
Бром / Bromum (Br)
Внешний вид
красно-бурая
простого вещества жидкость с
сильным
неприятным
запахом
Электронная
конфигуранция
ЭО
(по Полингу)
[Ar] 3d10 4s2 4p5
Степень окисления
Плотность
Температура
плавления
Температура
кипения
7, 5, 3, 1, -1
3,12 г/см³
2,96
265,9 К
331,9 К
19.
Пды
о
ды
и
я
р
Р
е
I
1
II
2
III
3
IV
V
VI
VII
4
5
6
7
8
9
10
I
II
III
Группы элементов
IV
V
VI
VII
Ио́д / Iodum (I)
VIII
Черно-фиолетовые
Внешний вид
простого вещества кристаллы с
металлическим
блеском
Электронная
конфигуранция
ЭО
(по Полингу)
[Kr] 4d10 5s2 5p5
2,66
Степень окисления 7, 5, 3, 1, -1
Плотность
4,93г/см³
Температура
плавления
Температура
кипения
386,7 К
457,5 К
20.
Пды
о
ды
и
я
р
Р
е
I
1
II
2
III
3
IV
V
VI
VII
4
5
6
7
8
9
10
I
II
III
Группы элементов
IV
V
VI
VII
VIII
Аста́т / Astatium (At)
Внешний вид
Нестабильные
простого вещества чёрно-синие
кристаллы
Электронная
конфигуранция
ЭО
(по Полингу)
[Xe] 4f14 5d10 6s2 6p
5
2,2
Степень окисления 7, 5, 3, 1, −1
Плотность
n/a г/см
Температура
плавления
Температура
кипения
517 К
582 К
21.
918,998
• Название "фтор" (от греческого phthoros разрушение, гибель)
• В свободном состоянии фтор был получен
26 июня 1886 г. французским химиком
Муассаном.
• Это зеленовато-желтый газ, немного
тяжелее воздуха, с характерным
запахом и необыкновенной химической
активностью.
• Ни один из химических элементов не
принес химикам столько трагических
событий, как фтор.
22.
1735,45
3
• Хлор был открыт шведским химиком
Карлом Шееле в 1774 г.
• в 1810 году сэр Гемфри Дэви назвал газ
"хлорином"(Chlorine), от греческого "зелёный".
Этот термин используется в английском
языке,
а в других языках закрепилось
название "хлор".
• Газ желто-зеленого цвета с резким
запахом, ядовит
• в 2,5 раза тяжелее воздуха
в 1 объеме воды при 20 °С
растворяется около 2 объемов
хлора
23.
3579,9
79
Вr (50,56%)
81
Вr (49,44%)
• от греч. bromos – зловоние
• единственный неметалл, жидкий при
комнатной температуре
• тяжелая
красно-бурая
жидкость
с
неприятным запахом
• пары брома имеют желто-бурый цвет
• при температуре –7,25° C бром затвердевает,
превращаясь в красно-коричневые игольчатые
кристаллы со слабым металлическим блеском
24.
53126,
9
• от греч. iodes—имеющий фиалковый цвет
• в парообразное состояние переходит при
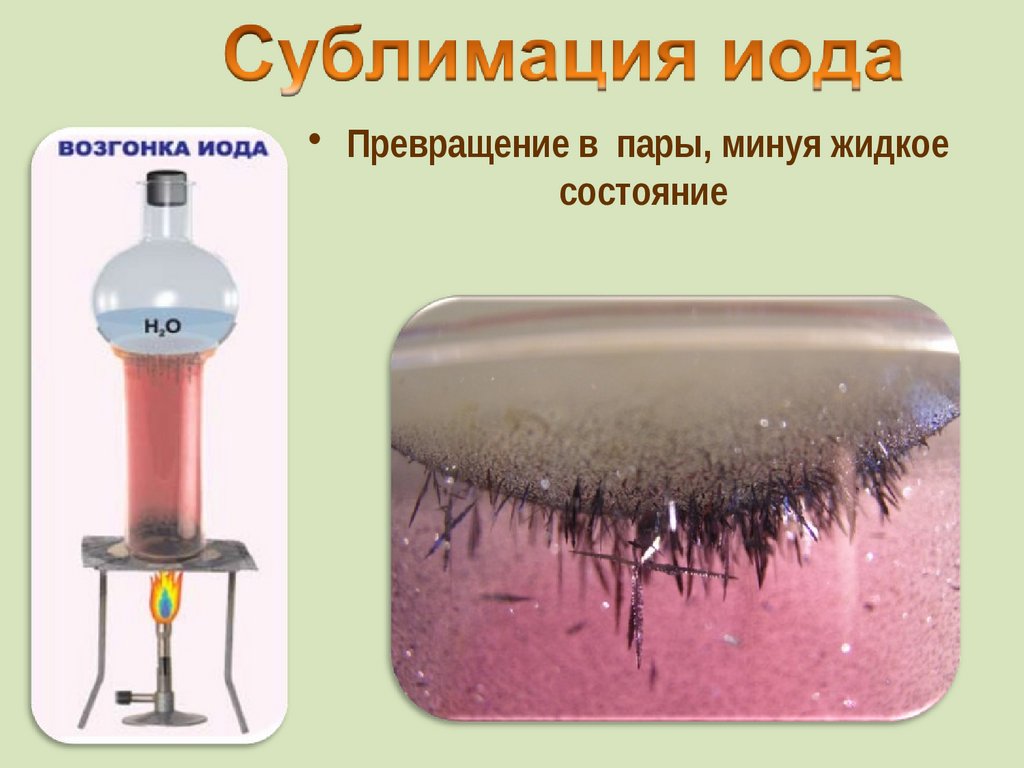
комнатной t°, не плавясь (сублимация);
• пары -фиолетового цвета
Иод был открыт в 1811 г. Куртуа в золе
морских водорослей, а с 1815 г. ГейЛюссак стал рассматривать его как
химический элемент
Известны 37 изотопов иода с
массовыми числами от 108 до 144.
25.
• Превращение в пары, минуя жидкоесостояние
26.
• Молекулы галогенов состоят из двух атомов.Cl + Cl → Cl Cl
• Связь – ковалентная неполярная
27.
• Галогены – типичные окислители0
-1
• Окислительные и неметаллические свойства
атомов уменьшаются от фтора к иоду
28. Сравнение окислительных свойств
))+9
2 7
Хлор
Cl
)))
+17
2 8 7
Br
+35
))))
2 8 18 7
Иод
I
+53
)))))
2 8 18 18 7
Астат
At
+85
))))))
2 8 18 32 18 7
Радиус атома
Бром
Неметаллические свойства
F
Окислительные свойства
Фтор
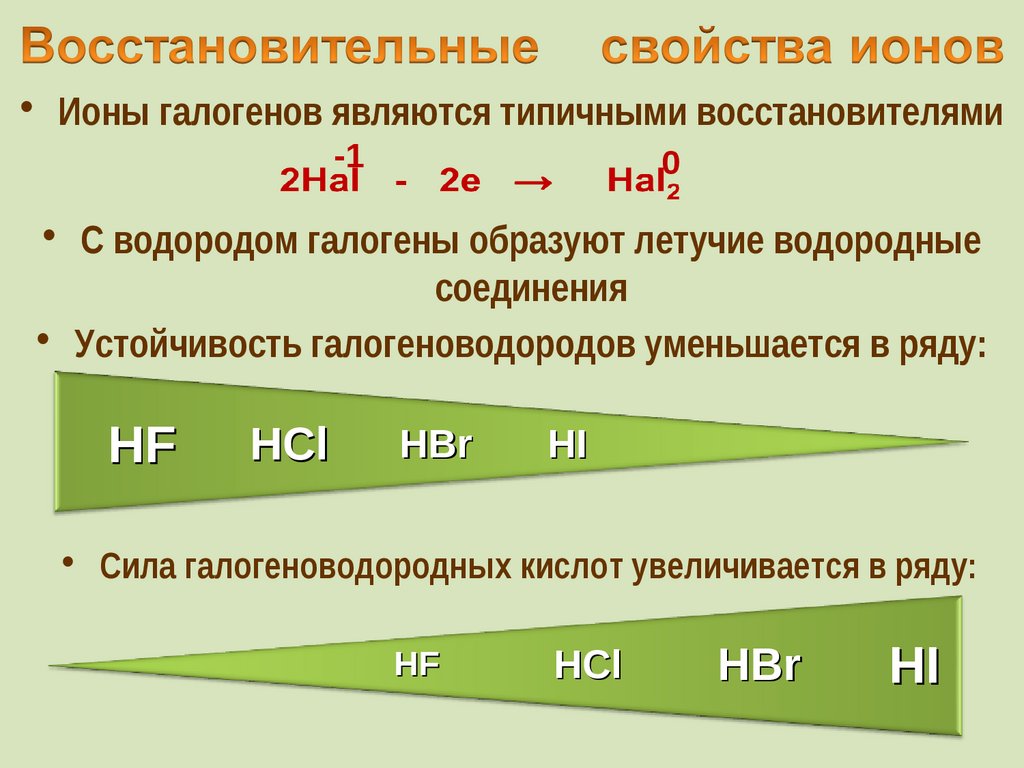
29. Восстановительные свойства ионов
• Ионы галогенов являются типичными восстановителями-1
0
• С водородом галогены образуют летучие водородные
соединения
• Устойчивость галогеноводородов уменьшается в ряду:
HF
HCl
HBr
HI
• Cила галогеноводородных кислот увеличивается в ряду:
HF
HCl
HBr
HI
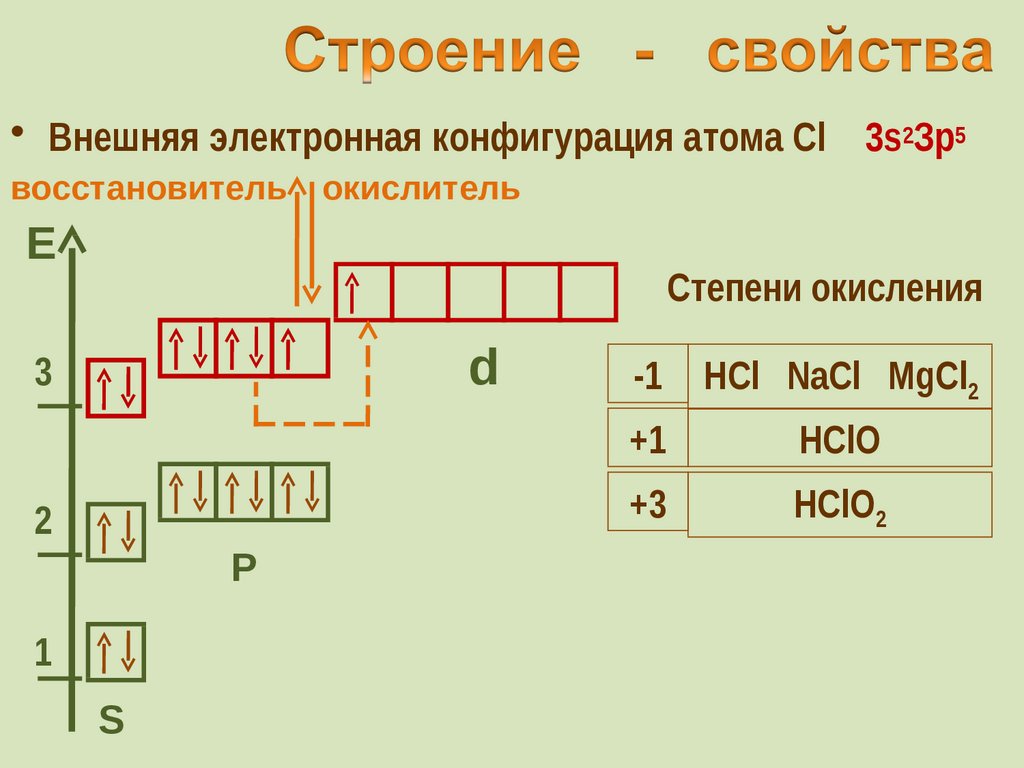
30. Строение - свойства
• Внешняя электронная конфигурация атома Cl 3s2Зр5восстановитель
окислитель
Е
Степени окисления
d
3
2
Р
1
S
-1
HCl NaCl MgCl2
+1
HClO
+3
HClO2
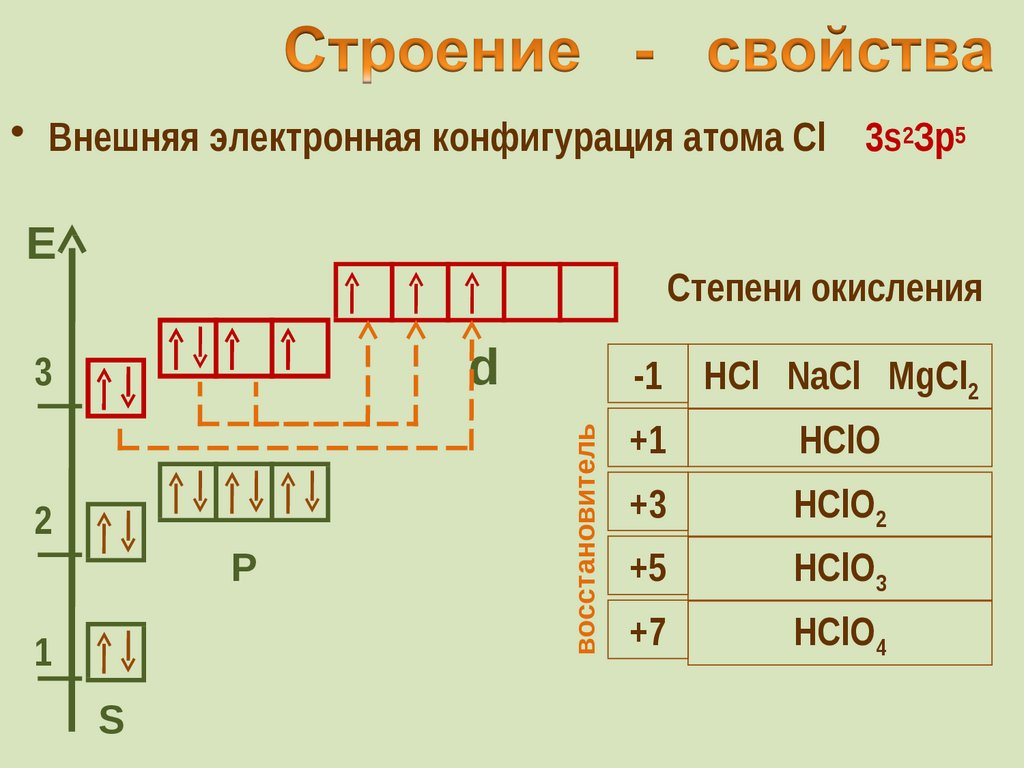
31. Строение - свойства
• Внешняя электронная конфигурация атома Cl 3s2Зр5Е
Степени окисления
2
Р
1
S
восстановитель
d
3
-1
HCl NaCl MgCl2
+1
HClO
+3
HClO2
+5
HClO3
+7
HClO4
32.
1. Взаимодействие с металламиХлор непосредственно реагирует почти со
всеми металлами (с некоторыми только в
присутствии влаги или при нагревании):
-1
-1
2. Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота,
кислорода и инертных газов), образует
соответствующие хлориды.
-1
-1
33.
3. Взаимодействие с водойс образованием смеси кислот
0
-1
соляная
+1
хлорноватистая
4. Взаимодействие с солями других галогенов
более активные галогены вытесняют менее активные из
0
-1
-1
0
растворов их солей
5. Взаимодействие с растворами щелочей
с образованием солей
t
34.
1. В промышленности: электролиз расплава илираствора хлорида натрия
2. В лаборатории:
35.
производстволекарственных
средств
ядохимикаты
производство
соляной
кислоты
отбеливание
бумаги и тканей
пластмассы
каучуки
36.
В медицине- 5 % спиртовой раствор йода используется для
дезинфекции кожи вокруг
повреждения
- В рентгенологических и томографических
исследованиях применяются йодсодержащие
контрастные препараты
В технике - Галоге́ нная ла́ мпа — лампа накаливания, в
баллон которой добавлены пары галогенов
(брома или йода)
Лазерный
термоядерный
синтез
иодорганические соединения применяются для
производства сверхмощных газовых лазеров на
возбужденных атомах
37. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt.
С простыми веществами:С металлами
С неметаллами
Na + F2 →
H2 + F2 →
Mo + F2 →
Xe +
F2 →
Со сложными веществами:
H2O + F2 →
KCl + F2 →
KBr + F2 →
KI
+ F2 →
38. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt.
С простыми веществами:С металлами
С неметаллами
2Na + F2 → 2NaF
H2 + F2 → 2HF
Mo + 3F2 → MoF6
Xe + 2F2 → XeF4
Со сложными веществами:
2H2O + F2 → 4HF + O2
2KCl + F2 → Cl2 + 2NaF
2KBr + F2 → Br2 + 2КF
2KI
+ F2 → I2 + 2КF
39. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.)
С простыми веществами:С металлами
С неметаллами
Fe + Cl2 →
H2 + Cl2 →
Cu + Cl2 →
P +
Cl2 →
Со сложными веществами:
H2O + Cl2 →
NaOH + Cl2 →
KBr + Cl2 →
KI
+ Cl2 →
Горение железа в хлоре
40. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.)
С простыми веществами:С металлами
С неметаллами
2Fe + 3Cl2 → 2FeCl3
H2 + Cl2 → 2HCl (tº, hυ)
Cu + Cl2 → Cu Cl2
2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2)
Со сложными веществами:
H2O + Cl2 → HCl+HClO хлорная вода
2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода
2KBr + Cl2 → Br2 + 2КCl
2KI
+ Cl2 → I2 + 2КCl
41. Химические свойства Br2 - реакционноспособен
С простыми веществами:С металлами
С неметаллами
Al + Br2 →
H2 + Br2 →
Cu + Br2 →
P +
Br2 →
Со сложными веществами:
Br2 + H2O →
KI
+ Br2 →
42. Химические свойства Br2 - реакционноспособен
С простыми веществами:С металлами
С неметаллами
2Al + 3Br2 → 2AlBr3
H2 + Br2 → 2HCl
Cu + Br2 → Cu Br2
2P + 5Br2 → 2PBr5
Со сложными веществами:
Br2 + H2O → HBr + HBrO бромная вода
2KI
+ Br2 → I2 + 2КCl
43. Химические свойства I2 - химически наименее активен
С простыми веществами:С металлами
С неметаллами
Hg + I2 →
H2 + I2 →
Al + I2 →
P + Br2 →
Со сложными веществами:
I2 + H2O →
I2 + р-р крахмала →
Действие крахмала на
йод
44. Химические свойства I2 - химически наименее активен
С простыми веществами:С металлами
С неметаллами
Hg + I2 → HgI2
H2 + I2 → 2HCl (tº)
2Al + 3I2 → 2AlI3
2P + 3Br2 → 2PI3
Со сложными веществами:
I2 + H2O → HI + HIO
I2 + р-р крахмала → темно-синее окрашивание
45.
• Что значит название «Галогены»?• В чём сходство
электронного строения этих
элементов?
• Какие свойства в окислительно-восстановительном
плане проявляют галогены?
• Какой галоген наиболее химически активен?
• Как изменяется активность галогенов вниз по группе?






































 chemistry
chemistry