Similar presentations:
Галогены. Химические свойства
1.
2.
Галогены1. История открытия галогенов
2. Положение в Периодической системе
3. Химические свойства
4. Применение
5.Проверка знаний
6.Домашнее задание. Итоги урока.
Главная
3. История открытия галогенов
ФторХлор
Бром
Йод
Астат
4. История открытия фтора
В 1886 году французский химик А. Муассан,используя электролиз жидкого фтороводорода,
охлажденного до температуры –23°C (в жидкости
должно содержаться немного фторида калия,
который обеспечивает ее электропроводимость),
смог на аноде получить первую порцию нового,
газа. В первых опытах для получения фтора
Муассан
использовал
очень
дорогой
электролизер, изготовленный из платины и
иридия. При этом каждый грамм полученного
фтора «съедал» до 6 г платины.
Анри
Муассан
(1852 – 1907)
5. История открытия хлора
КарлВильгельм
Шееле
(1742 – 1786)
В 1774 году шведский ученый К. Шееле
открыл хлор, который принял за сложное
вещество и назвал "дефлогистированной
соляной кислотой".
В 1807 году английский химик Гемфри
Дэви получил тот же газ. Он пришел к
выводу, что получил новый элемент и
назвал его "хлорин" (от "хлорос" - желтозеленый).
В 1812 году Гей-Люсеок дал газу
название хлор.
6. История открытия брома
В 1825 году французский химик А.Ж.Баларпри изучении маточных рассолов выделил
темно-бурую жидкость, который он назвал "мурид" (от латинского слова muria,
означающего "рассол"). Комиссия Академии,
проверив это сообщение, подтвердила
открытие Балара и предложила назвать
элемент бромом (от "бромос", с греческого
"зловонный").
Антуан Жером
Балар
(1802 – 1876)
7. История открытия йода
Бернар Куртуа(1777 – 1838 )
В 1811 году французский химик Бернар
Куртуа открыл иод
путём перегонки
маточных
растворов
от
своего
азотнокислого кальция с серной кислотой
Чтобы другие химики могли изучать
новое вещество, Б. Куртуа подарил его
(правда, очень небольшое количество)
фармацевтической фирме в Дижоне.
В 1813 году Ж.-Л.Гей-Люссак подробно
изучил этот элемент и дал ему
современное название. Название "иод"
происходит от греческого слова "иодэс" "фиолетовый" (по цвету паров).
8. История открытия астата
В 1869 г Д.И.Мендеелеев предсказал его существование ивозможность открытия в будущем (как «эка-иод»).
Впервые астат был получен искусственно в 1940 г открыт
Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский
университет в Беркли) . Для синтеза изотопа 211At они облучали
висмут альфа-частицами.
В 1943-1946 годах изотопы астата были обнаружены в
составе природных радиоактивных рядов. Астат является
наиболее редким элементом среди всех, обнаруженных в
природе. В поверхностном слое земной коры толщиной 1,6 км
содержится всего 70 мг астата.
9. Периодическая система химических элементов Д.И.Менделеева
II
1
H
II
2
Li
III
3
Na
4
K
IV
5
6
V
7
8
VI
9
VII
10
II
Группы элементов
IV
V
VI
III
Водород
3
Литий
11 Mg
22,9898
Cu
63.546
Медь
Rb
37
85.47
Рубидий
Ag
107.868
Серебро
Cs
55
132.905
Цезий
79
Au
196.966
Золото
Fr
Франций
65.37
Цинк
38
87.62
Стронций
Sс
44.956
Скандий
Иттрий
112.41
Кадмий
Индий
56 57
137.34
Барий
Ртуть
200.59
Радий
Ac
227.028
Актиний
Ti
47.90
Zr
91.224
Цирконий
Hf
178.49
Гафний
Свинец
Rf
[261]
Резерфордий
O
8
15.996
Кислород
15 S
Фосфор
V
23
50.942
Ванадий
33
74.9216
Мышьяк
41
Nb
92.906
Ниобий
73
Ta
180.9479
Тантал
83
208.98
Висмут
105
Db
[262]
Дубний
F
фтор
16 Cl
32,064
Сера
Cr
24
51.996
Хром
Se
34
78.96
Селен
42
Mo
95.94
Молибден
51 Te
121.75
Сурьма
82 Bi
207.2
7
14.0067
30,9738
50 Sb
118.71
Олово
104
Азот
32 As
72.59
Германий
72
N
14 P
28,086
Титан
81 Pb
204.383
Таллий
88 89
[226]
La
138.81
Лантан
Hg Tl
80
22
49 Sn
114.82
12,011
Кремний
39 40
88.9059
6
Углерод
31 Ge
69.72
Галлий
Y
C
13 Si
26,9815
Алюминий
Cd In
48
87 Ra
[223]
5
10 .811
Zn Ga
30
Ba
Бор
20 21
40,08
Кальций
Sr
В
12 Al
24,312
Магний
19 Ca
39.102
Калий
47
4
9,012
Вериллий
Натрий
29
Be
VIII
Галогены
1
1.00797
6,939
VII
Теллур
74
52
127.60
W
183.85
Вольфрам
Po
25
Br
Бром
43
Sg
[263]
Сиборгий
9
18.9984
Ne
10
Неон
18
Аргон
75
54.938
107
27
55.847
Железо
35 Kr
79.904
Co 28 Ni
58.933
Кобальт
99
126.904
Re
186.2
36
Криптон
101.07
Родий
[262]
Pd
106.4
Палладий
Ксенон
131,3
Os 77 Ir 78 Pt
190.2
192.2
Осмий
Иридий
86
Радон
[222]
Bh 108 Hs 109 Mt
Борий
46
54
85 Rn
210
102.905
Рутений
76
58.71
Никель
83,8
Tс 44 Ru 45 Rh
Рений
Астат
39,948
Mn 26 Fe
53 Xe
Иод
4,003
20,18
17 Ar
35,453
Технеций
I
2
Гелий
Марганец
84 At
208.982
Полоний
106
Хлор
He
[265 ]
Хассий
[266 ]
Мейтнерий
195.09
Платина
10.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Фтор/Fluorum (F)
Внешний вид
Бледно-жёлтый
простого вещества газ.
Очень ядовит.
Электронная
[He] 2s2 2p5
коефигуранция
ЭО
3,98
(по Полингу)
Степень окисления −1
Плотность
(при −189 °C)1,108
г/см ³
53,53К
Температура
плавления
Температура
85,01 К
кипения
11.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Хлор / Chlorum (Cl)
Внешний вид
Газ жёлто-зеленого
простого вещества цвета с резким
запахом. Ядовит.
Электронная
[Ne] 3s2 3p5
коефигуранция
ЭО
3.16
(по Полингу)
Степень окисления 7, 6, 5, 4, 3, 1, −1
Плотность
(при −33.6 °C)1,56
г/см ³
Температура
172.2 К
плавления
Температура
238.6 К
кипения
12.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Бром / Bromum (Br)
Внешний вид
красно-бурая
простого вещества жидкость с
сильным
неприятным
запахом
Электронная
[Ar] 3d10 4s2 4p5
конфигуранция
ЭО
2,96
(по Полингу)
Степень окисления 7, 5, 3, 1, -1
Плотность
3,12 г/см³
265,9 К
Температура
плавления
Температура
331,9 К
кипения
13.
Периодическая система химических элементов Д.И.МенделееваI
I
II
III
1
2
III
VII
IV
5
6
V
7
8
VI
9
10
VIII
Ио́д / Iodum (I)
Черно-фиолетовые
Внешний вид
простого вещества кристаллы с
металлическим
блеском
3
4
VII
II
Группы элементов
IV
V
VI
Электронная
конфигуранция
ЭО
(по Полингу)
Степень окисления
Плотность
[Kr] 4d10 5s2 5p5
Температура
плавления
Температура
кипения
386,7 К
2,66
7, 5, 3, 1, -1
4,93г/см³
457,5 К
14.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
II
III
Группы элементов
IV
V
VI
VII
Аста́т / Astatium (At)
Внешний вид
Нестабильные
простого вещества чёрно-синие
кристаллы
Электронная
[Xe] 4f14 5d10 6s2 6p
5
конфигуранция
ЭО
2,2
(по Полингу)
Степень окисления 7, 5, 3, 1, −1
Плотность
n/a г/см
7
8
VI
9
VII
10
VIII
Температура
плавления
Температура
кипения
517 К
582 К
15. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt.
С простыми веществами:С металлами
С неметаллами
Na + F2 →
H 2 + F2 →
Mo + F2 →
Xe + F2 →
Со сложными веществами:
H2O + F2 →
KCl + F2 →
KBr + F2 →
KI + F2 →
Проверить
16. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt.
С простыми веществами:С металлами
С неметаллами
2Na + F2 → 2NaF
H2 + F2 → 2HF
Mo + 3F2 → MoF6
Xe + 2F2 → XeF4
Со сложными веществами:
2H2O + F2 → 4HF + O2
2KCl + F2 → Cl2 + 2NaF
2KBr + F2 → Br2 + 2КF
2KI + F2 → I2 + 2КF
17. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.)
С простыми веществами:С металлами
С неметаллами
Fe + Cl2 →
H2 + Cl2 →
Cu + Cl2 →
P + Cl2 →
Со сложными веществами:
H2O + Cl2 →
NaOH + Cl2 →
KBr + Cl2 →
KI + Cl2 →
Горение железа в хлоре
Проверить
18. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.)
С простыми веществами:С металлами
С неметаллами
2Fe + 3Cl2 → 2FeCl3
H2 + Cl2 → 2HCl (tº, hυ)
Cu + Cl2 → Cu Cl2
2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2)
Со сложными веществами:
H2O + Cl2 → HCl+HClO хлорная вода
2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода
2KBr + Cl2 → Br2 + 2КCl
2KI + Cl2 → I2 + 2КCl
19. Химические свойства Br2 - реакционноспособен
С простыми веществами:С металлами
С неметаллами
Al + Br2 →
H2 + Br2 →
Cu + Br2 →
P + Br2 →
Со сложными веществами:
Br2 + H2O →
KI + Br2 →
Проверить
20. Химические свойства Br2 - реакционноспособен
С простыми веществами:С металлами
С неметаллами
2Al + 3Br2 → 2AlBr3
H2 + Br2 → 2HCl
Cu + Br2 → Cu Br2
2P + 5Br2 → 2PBr5
Со сложными веществами:
Br2 + H2O → HBr + HBrO бромная вода
2KI + Br2 → I2 + 2КCl
21. Химические свойства I2 - химически наименее активен
С простыми веществами:С металлами
С неметаллами
Hg + I2 →
H2 + I 2 →
Al + I2 →
P + Br2 →
Со сложными веществами:
I2 + H2 O →
I2 + р-р крахмала →
Действие крахмала на йод
Проверить
22. Химические свойства I2 - химически наименее активен
С простыми веществами:С металлами
С неметаллами
Hg + I2 → HgI2
H2 + I2 → 2HCl (tº)
2Al + 3I2 → 2AlI3
2P + 3Br2 → 2PI3
Со сложными веществами:
I2 + H2O → HI + HIO
I2 + р-р крахмала → темно-синее окрашивание
23.
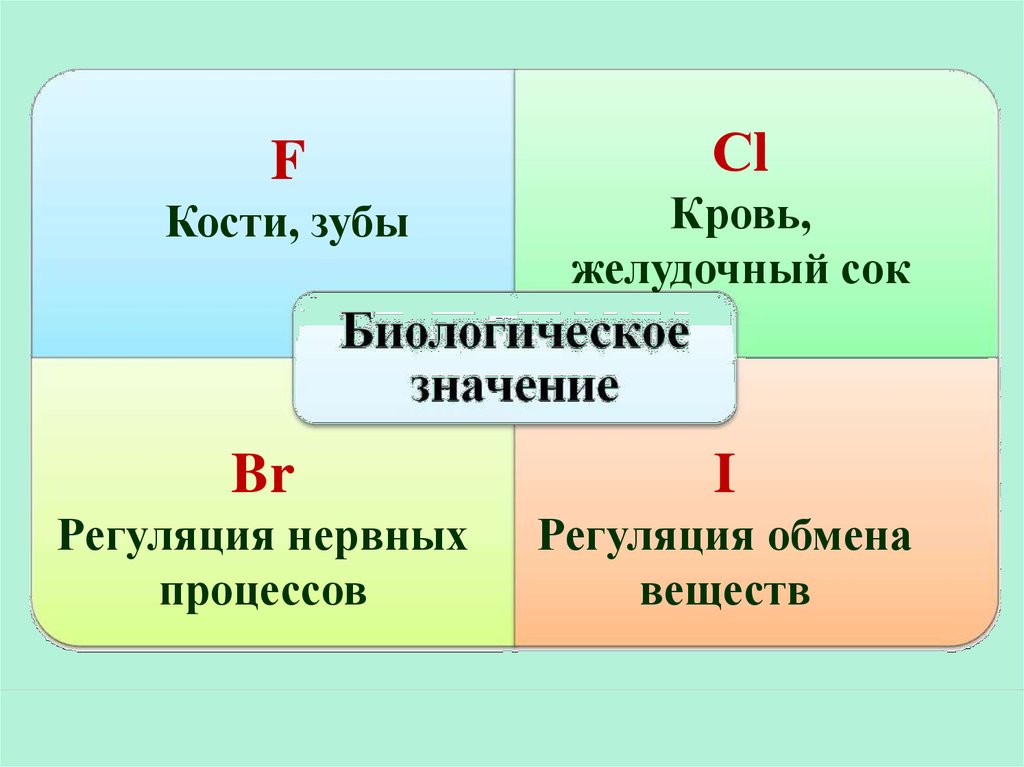
FКости, зубы
Сl
Кровь,
желудочный сок
Br
I
Регуляция нервных
процессов
Регуляция обмена
веществ
24.
ТефлонПрименение
фтора
Фреон
Окислитель
ракетного
топлива
Заменитель
крови
Фториды
в зубных
пастах
25.
Дезинфекцияводы
Органические
растворители
Лекарственные
препараты
Применение
хлора
Получение
Производство
неорганических
HCl
хлоридов
Отбеливатели
Хлорирование
органических
веществ
Получение
брома, йода
26.
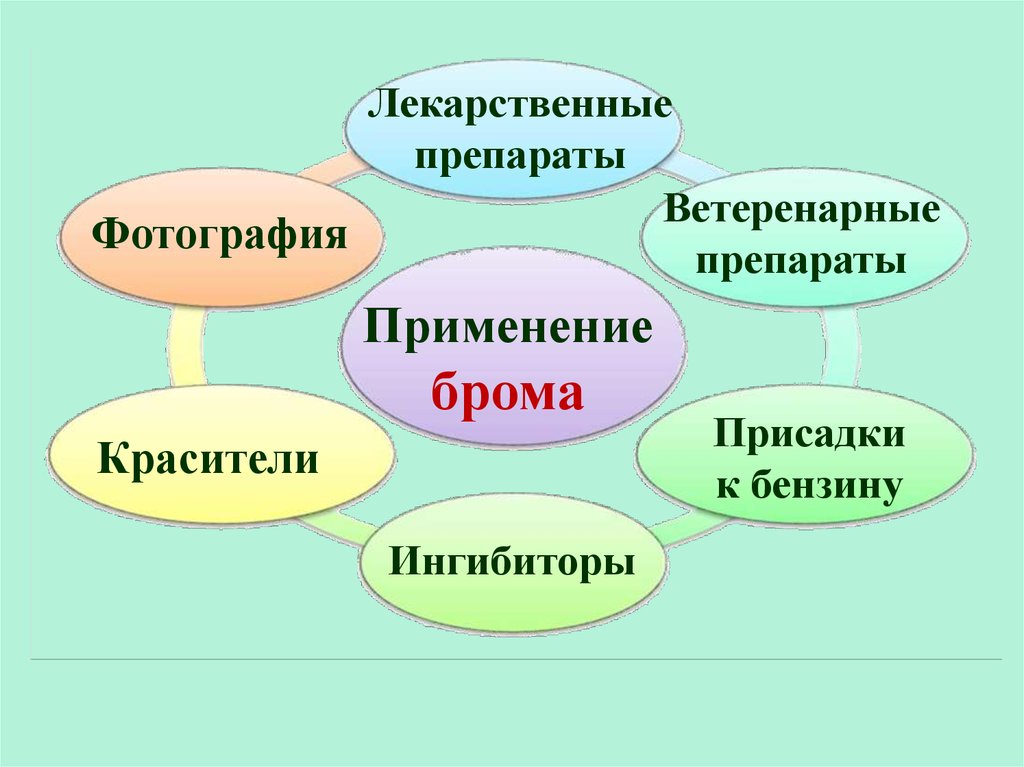
Лекарственныепрепараты
Ветеренарные
Фотография
препараты
Применение
брома
Красители
Ингибиторы
Присадки
к бензину
27.
Лекарственныепрепараты
Дезинфекция
одежды
Применение
Фотография
йода
Электролампы
Красители
28. Физические свойства галогенов Заполни пропуски
Фтор - светло-желтый газ , в воде не растворим , так как интенсивно сней взаимодействует. Хлор - желто-зеленый газ , раствор хлора в воде
практически бесцветен - хлорная вода . Бром счерно-фиолетовые кристаллы
бурая жидкость . Йод -
с металлическим блеском.
Кристаллический йод легко - переходит из твердого в газообразное
состояние. Астат похож на йод , но имеет более ярко выраженный
металлический характер. Все галогены обладают резким
запахом,
вдыхание их вызывает сильнейшее раздражение дыхательных путей и
тяжелые отравления .
29. Химические свойства галогенов Поставь коэффициенты
2 Na + Cl2 = 2 NaClS + 3 F2 = SF6
2 Fe + 3 Br = 2 FeBr
2
3
2 P + 5 Cl2 = 2 PCl5
2 NaI + Cl2 = 2 NaCl + I2
2 F2 + 2 H2O = 4 HF + O2
2 NaBr + Cl2 = 2 NaCl + Br2
6 KOH + 3 Cl2 = 5 KCl + KClO3 + 3 H2O
30. Химические свойства галогенов Найди соответствие между исходными веществами и продуктами реакций
2H2 O + 2F2 =2NaOH + H2 +Cl2
Xe + 2F2 =
2NaCl + I2
H2 + F 2 =
2AuCl3
2Au + 3Cl2 =
XeF4
2NaCl + 2H2 O =
4 HF + O2
2NaI + Cl2 =
2HF




























 chemistry
chemistry








