Similar presentations:
Галогены. История открытия фтора
1.
2. название «галоген» происходит от слов рождать соль
ФторХлор
Бром
Йод
Астат
3. История открытия фтора
В 1886 году французский химик А. Муассан,используя электролиз жидкого фтороводорода,
охлажденного до температуры –23°C (в жидкости
должно содержаться немного фторида калия,
который обеспечивает ее электропроводимость),
смог на аноде получить первую порцию нового,
газа. В первых опытах для получения фтора
Муассан
использовал
очень
дорогой
электролизер, изготовленный из платины и
иридия. При этом каждый грамм полученного
фтора «съедал» до 6 г платины.
Анри
Муассан
(1852 – 1907)
4. История открытия хлора
КарлВильгельм
Шееле
(1742 – 1786)
В 1774 году шведский ученый К. Шееле
открыл хлор, который принял за сложное
вещество и назвал "дефлогистированной
соляной кислотой".
В 1807 году английский химик Гемфри
Дэви получил тот же газ. Он пришел к
выводу, что получил новый элемент и
назвал его "хлорин" (от "хлорос" - желтозеленый).
В 1812 году Гей-Люсеок дал газу
название хлор.
5. История открытия брома
В 1825 году французский химик А.Ж.Баларпри изучении маточных рассолов выделил
темно-бурую жидкость, который он назвал "мурид" (от латинского слова muria,
означающего "рассол"). Комиссия Академии,
проверив это сообщение, подтвердила
открытие Балара и предложила назвать
элемент бромом (от "бромос", с греческого
"зловонный").
Антуан Жером
Балар
(1802 – 1876)
6. История открытия йода
Бернар Куртуа(1777 – 1838 )
В 1811 году французский химик Бернар
Куртуа открыл иод
путём перегонки
маточных
растворов
от
своего
азотнокислого кальция с серной кислотой
Чтобы другие химики могли изучать
новое вещество, Б. Куртуа подарил его
(правда, очень небольшое количество)
фармацевтической фирме в Дижоне.
В 1813 году Ж.-Л.Гей-Люссак подробно
изучил этот элемент и дал ему
современное название. Название "иод"
происходит от греческого слова "иодэс" "фиолетовый" (по цвету паров).
7. История открытия астата
В 1869 г Д.И.Мендеелеев предсказал его существование ивозможность открытия в будущем (как «эка-иод»).
Впервые астат был получен искусственно в 1940 г открыт
Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский
университет в Беркли) . Для синтеза изотопа 211At они облучали
висмут альфа-частицами.
В 1943-1946 годах изотопы астата были обнаружены в
составе природных радиоактивных рядов. Астат является
наиболее редким элементом среди всех, обнаруженных в
природе. В поверхностном слое земной коры толщиной 1,6 км
содержится всего 70 мг астата.
8. Периодическая система химических элементов Д.И.Менделеева
II
1
H
II
2
Li
III
3
Na
4
K
IV
5
6
V
7
8
VI
9
VII
II
Группы элементов
IV
V
VI
III
Водород
11 Mg
Натрий
Rb
65.37
Цинк
37 Sr
85.47
Рубидий
112.41
Кадмий
Иттрий
Барий
Лантан
79 Au
80 Hg Tl
Золото
Ртуть
196.966
10 Франций
87 Ra
[223]
200.59
Радий
Таллий
88 89
[226]
47.90
Zr
91.224
Цирконий
Олово
178.49
Гафний
Свинец
Актиний
[261]
Резерфордий
92.906
51.996
Хром
Селен
Хлор
10
20,18
Неон
17 Ar
35,453
54.938
Марганец
34 Br
78.96
95.94
Молибден
51 Te
121.75
Сурьма
Ta
180.9479
Тантал
82 Bi
207.2
Сера
32,064
9 Ne
18.9984
18
Аргон
39,948
Бром
55.847
35 Kr
79.904
58.933
Железо
Кобальт
58.71
Никель
36
Криптон
83,8
Nb 42 Mo 43 Tс 44 Ru 45 Rh 46 Pd
Ниобий
73
фтор
16 Cl
33 Se
74.9216
Мышьяк
41
F
4,003
V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni
50.942
Ванадий
50 Sb
118.71
Ac 104 Rf
227.028
Фосфор
8
15.996
Кислород
15 S
30,9738
32 As
72.59
Германий
81 Pb
204.383
7 O
14.0067
Ti 23
La 72 Hf
138.81
Азот
14 P
28,086
Титан
49 Sn
114.82
Индий
56 57
137.34
22
39 40
88.9059
12,011
Кремний
31 Ge
69.72
Галлий
38 Y
87.62
Стронций
55 Ba
132.905
Цезий
Fr
44.956
Скандий
Ag 48 Cd In
107.868
Серебро
Cs
Кальций
Sс
6 N
Углерод
13 Si
26,9815
Алюминий
20 21
40,08
5 C
10 .811
Cu 30 Zn Ga
63.546
Медь
47
Бор
12 Al
24,312
Магний
19 Ca
39.102
Калий
29
4 В
9,012
Вериллий
22,9898
2
Гелий
3 Be
Литий
VIII
Галогены He
1
1.00797
6,939
VII
Теллур
74
Висмут
Дубний
101.07
53 Xe
Иод
126.904
102.905
Рутений
Родий
106.4
Палладий
54
Ксенон
131,3
W 75 Re 76 Os 77 Ir 78 Pt
183.85
186.2
Рений
84 At
208.982
Полоний
105 Db 106
[262]
52 I
127.60
Вольфрам
83 Po
208.98
99
Технеций
Sg
[263]
Сиборгий
Астат
190.2
85 Rn
210
192.2
Осмий
Иридий
86
Радон
[222]
107 Bh 108 Hs 109 Mt
[262]
Борий
[265 ]
Хассий
[266 ]
Мейтнерий
195.09
Платина
9.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Фтор/Fluorum (F)
Внешний вид
Бледно-жёлтый
простого вещества газ.
Очень ядовит.
Электронная
[He] 2s2 2p5
коефигуранция
ЭО
3,98
(по Полингу)
Степень окисления −1
Плотность
(при −189 °C)1,108
г/см ³
53,53К
Температура
плавления
Температура
85,01 К
кипения
10.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Хлор / Chlorum (Cl)
Внешний вид
Газ жёлто-зеленого
простого вещества цвета с резким
запахом. Ядовит.
Электронная
[Ne] 3s2 3p5
коефигуранция
ЭО
3.16
(по Полингу)
Степень окисления 7, 6, 5, 4, 3, 1, −1
Плотность
(при −33.6 °C)1,56
г/см ³
Температура
172.2 К
плавления
Температура
238.6 К
кипения
11.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Бром / Bromum (Br)
Внешний вид
красно-бурая
простого вещества жидкость с
сильным
неприятным
запахом
Электронная
[Ar] 3d10 4s2 4p5
конфигуранция
ЭО
2,96
(по Полингу)
Степень окисления 7, 5, 3, 1, -1
Плотность
3,12 г/см³
265,9 К
Температура
плавления
Температура
331,9 К
кипения
12.
Периодическая система химических элементов Д.И.МенделееваI
I
II
III
1
2
III
IV
5
6
V
7
8
VI
9
10
VII
VIII
Ио́д / Iodum (I)
Черно-фиолетовые
Внешний вид
простого вещества кристаллы с
металлическим
блеском
3
4
VII
II
Группы элементов
IV
V
VI
Электронная
[Kr] 4d10 5s2 5p5
конфигуранция
ЭО
2,66
(по Полингу)
Степень окисления 7, 5, 3, 1, -1
Плотность
4,93г/см³
Температура
плавления
Температура
кипения
386,7 К
457,5 К
13.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
II
III
Группы элементов
IV
V
VI
VII
Аста́т / Astatium (At)
Внешний вид
Нестабильные
простого вещества чёрно-синие
кристаллы
Электронная
[Xe] 4f14 5d10 6s2 6p
5
конфигуранция
ЭО
2,2
(по Полингу)
Степень окисления 7, 5, 3, 1, −1
Плотность
n/a г/см
7
8
VI
9
VII
10
VIII
Температура
плавления
Температура
кипения
517 К
582 К
14. Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt.
С простыми веществами:С металлами(в том числе золотом и
платиной.)
2Na + F2 → 2NaF
Mo + 3F2 → MoF6
Со сложными веществами:
2H2O + F2 → 4HF + O2
2KCl + F2 → Cl2 + 2NaF
2KBr + F2 → Br2 + 2КF
2KI + F2 → I2 + 2КF
С неметаллами
H2 + F2 → 2HF
Xe + 2F2 → XeF4
15.
Фтор не может быть растворим в воде, так как энергично разлагает еѐ.SiO2 +2 F2 = SiF4 + O2 + 157 ккал
2H2O + 2F2 = 4 HF + O2+ 143 ккал
Фтор является самым сильным окислителем.
Непосредственно фтор не реагирует только с
кислородом, азотом и
углеродом (в виде алмаза).
.
16. Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.)
С простыми веществами:С металлами
С неметаллами
2Fe + 3Cl2 → 2FeCl3
H2 + Cl2 → 2HCl (tº, hυ)
Cu + Cl2 → Cu Cl2
2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2)
Со сложными веществами:
H2O + Cl2 → HCl+HClO хлорная вода
2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода
2KBr + Cl2 → Br2 + 2КCl
2KI + Cl2 → I2 + 2КCl
17.
Хлор непосредственно взаимодействует со всемипростыми веществами за исключением кислорода, азота и
благородных газов.
Такие неметаллы как фосфор, мышьяк, сурьма и кремний при
высокой температуре реагируют с хлором с выделением
большого количества тепла.
.
18. Химические свойства Br2 - реакционноспособен
С простыми веществами:С металлами
С неметаллами
2Al + 3Br2 → 2AlBr3
H2 + Br2 → 2HBr
Cu + Br2 → Cu Br2
2P + 5Br2 → 2PBr5
Со сложными веществами:
Br2 + H2O → HBr + HBrO бромная вода
2KI + Br2 → I2 + 2КBr
19. Химические свойства I2 - химически наименее активен
С простыми веществами:С металлами
С неметаллами
Hg + I2 → HgI2
H2 + I2 → 2HI (tº)
2Al + 3I2 → 2AlI3
2P + 3Br2 → 2PI3
Со сложными веществами:
I2 + H2O → HI + HIO
I2 + р-р крахмала → темно-синее окрашивание
20.
Йод с водородом реагируеттолько при достаточно сильном
нагревании, и не полностью, т.к.
начинает идти обратная реакцияразложение жидкого водорода:
H2 + J2 2HJ -12, 7 ккал.
.
21.
Сравнение химических свойствгалогенов показывает, что их
относительная активность
последовательно уменьшается от
фтора к астату.
Этот эффект проявляется в
способности более легких
галогенов в виде
простых веществ окислять галоген
- ионы более тяжелых галогенов:
F2+CI2 2F+CI2
CI2+Br2 2CI+Br2
• все галогены активно взаимодействуют
со всеми простыми веществами.
Особенно быстро и с выделением
большого количества теплоты
• протекает реакция соединения галогенов
с металлами.
• Так, расплавленный металлический
натрий в атмосфере хлора сгорает
ослепительной вспышкой, а на стѐклах
сосуда появляется белый налѐт хлорида
натрия:
2Nа + C12=2Na C1
Br2+2J 2Br+J2
J2+2CIO3 2JO3+CI2
.
22. Физические свойства галогенов
Фтор газ светло–желтого цвета,
обладающий резким
запахом. Ядовит
.
23.
. Хлор – газсветло-зеленого цвета,
также как и фтор имеет
резкий запах. Сильно
ядовит. При повышенном
давлении и комнатной
температуре легко
переходит в жидкое
состояние
24.
.Бром – тяжелая
жидкость красно-бурого
цвета с характерным
неприятным резким
запахом. Жидкий бром, а
также его пары сильно
ядовиты. Бром плохо
растворяется в воде и
хорошо в неполярных
растворителях
25.
. Йод – твердоевещество темно-серого
цвета с металлическим
блеском. Пары йода
имеют фиолетовый цвет.
Йод легко возгоняется,
т.е. переходит в
газообразное состояние
из твердого, при этом
минуя жидкое состояние.
.
26.
• Астат — твёрдоевещество сине-чёрного цвета,
по внешнему виду похожее
на иод. Для него характерно
сочетание свойств неметаллов
(галогенов) и металлов
(полоний, свинец и другие). Как
и иод, астат хорошо
растворяется в органических
растворителях и легко ими
экстрагируется. По летучести
немного уступает иоду, но
также может легко возгоняться.
.
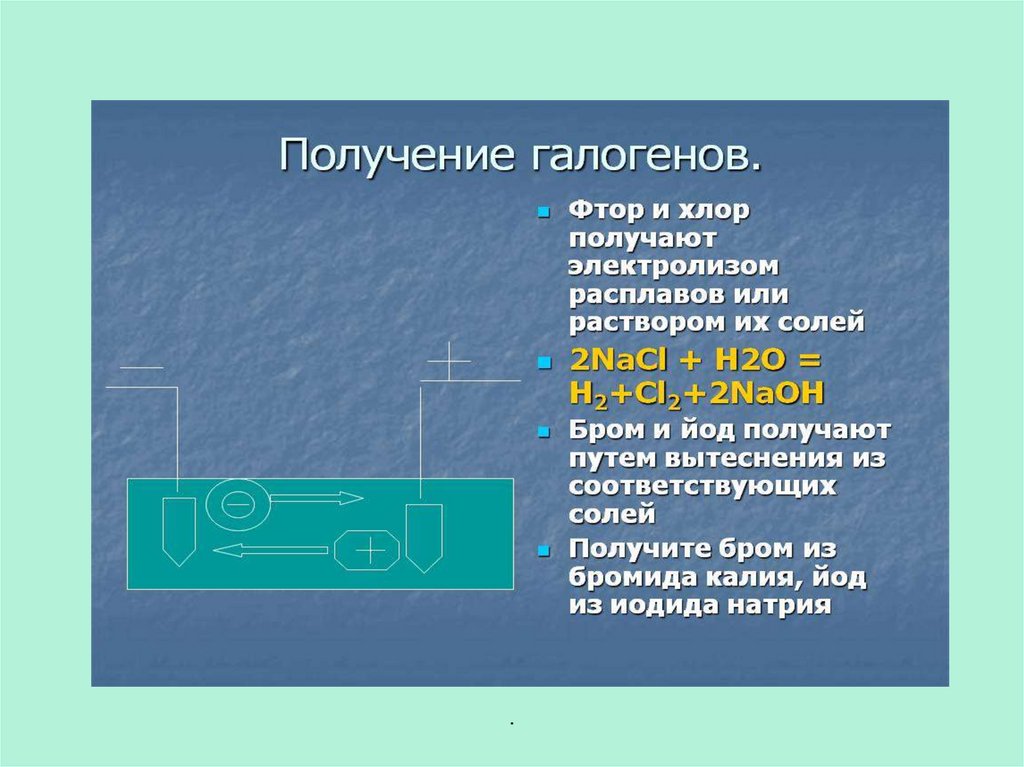
27. Получение галогенов
Галогены можно получить при
электролизе растворов или расплавов
галогенидов:
MgCl2 = Mg + Cl2 (расплав).
Наиболее часто галогены получают по
реакции окисления галогенводородных
кислот:
MnO2 + 4HCl = MnCl2 + Cl2↑ +2H2O;
K2Cr2O7 + 14HCl = 3Cl2↑ + 2KCl
+2CrCl3 +7H2O;
2KMnO4 +16HCl = 2MnCl2 +5Cl2↑
+8H2O +2KCl.
.
28.
29.
.30.
.31.
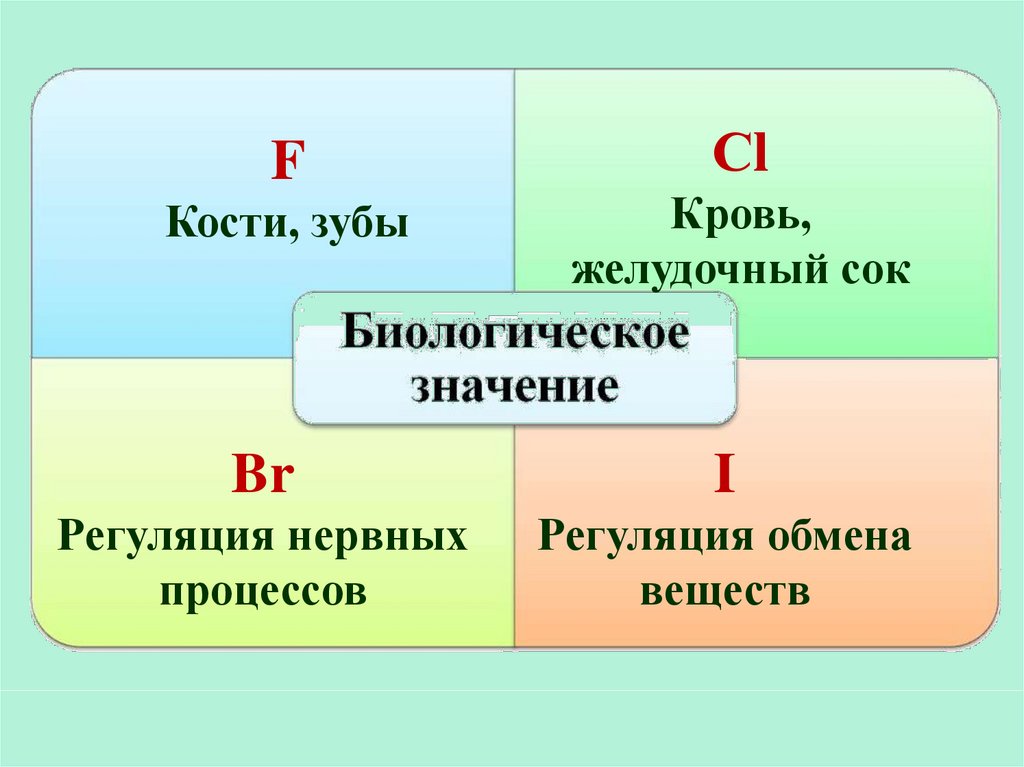
FСl
Кости, зубы
Кровь,
желудочный сок
Br
I
Регуляция нервных
процессов
Регуляция обмена
веществ
32.
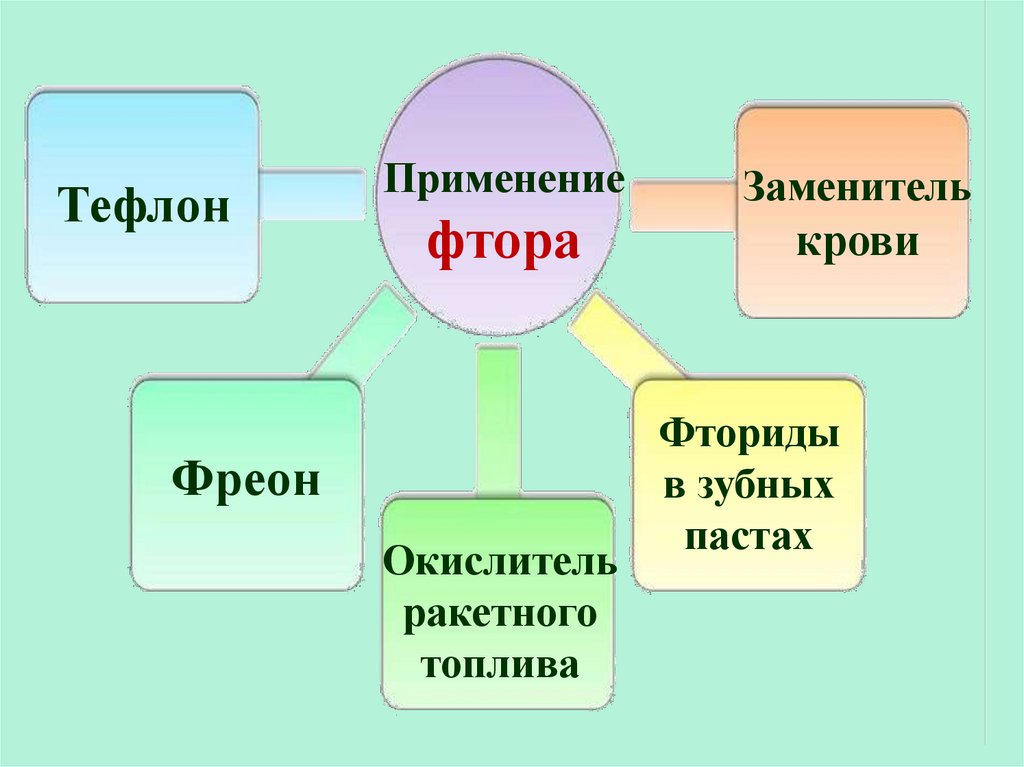
ТефлонПрименение
фтора
Фреон
Окислитель
ракетного
топлива
Заменитель
крови
Фториды
в зубных
пастах
33.
Содержание фтора в организме человекаоколо 10-5% – в костной
ткани, ногтях и зубах. В зубах в виде
фторапатита Ca5(PO4)3F содержится
0,01% фтора.
При избытке фтора повышается хрупкость
костей (флюороз).
У рабочих электролизных цехов
алюминиевых заводов со стажем работы
более 10 лет заболеваемость флюорозом
превышает 10%
Фтор - сильное ядовитое вещество,
вызывает воспаление слизистых
оболочек и сильные, долго незаживающие
ожоги кожи.
Соединения фтора приводят к сильным
отравлениям. Например, при отравлении
фтористым натрием наблюдаются
следующие признаки: рвота, иногда кровью,
понос, сильное возбуждение, порезы мышц,
судороги, паралич дыхательного
центра.
Оказание первой помощи: промывание
желудка, солевое слабительное,
известковая вода, и обратится к врачу!
.
34.
Органическиерастворители
Отбеливатели
Лекарственные Применение
препараты
хлора
Хлорирование
органических
веществ
Получение
Производство
неорганических
HCl
хлоридов
Получение
брома, йода
Дезинфекция
воды
35.
Содержание хлора в организме человекаоколо 0,15%.
Массовая доля соляной кислоты в
желудочном соке (рН 1÷3) около 0,3%. Она
необходима для перехода фермента пепсина
в активную форму.
Хлорид-анион участвует вместе с катионами
калия и натрия в солевом обмене между
клетками и межклеточными тканями.
Суточная потребность в хлориде натрия – 510 г.
Это сильное ядовитое вещество. При
вдыхании паров вызывает ожог
слизистых дыхательных путей, кашель,
удушье, боли в груди и в глазах,
слезотечение, отѐк легких, ослабление
сердца. При приеме внутрь – рвота, боли в
желудке, мокрота, спазм голосовой
щели..
Первая помощь: вдыхание кислорода,
вдыхать тѐплые водяные пары с
нашатырьным спиртом. Полный покой,
постельный режим. При попадании в
глаз – промывание 2% раствором соды и
обратится к врачу.
36.
Лекарственныепрепараты
Ветеренарные
Фотография
препараты
Применение
брома
Красители
Ингибиторы
Присадки
к бензину
37.
02.02.2025Содержание брома в организме человека
10-5% – преимущественно в
гипофизе. Бромид-анионы накапливаются в
мозге и действуют
успокаивающе. В 1910 г. один из учеников
И.П.Павлова, П.М.Никифоровский,
установил в опытах на собаках, что
бромиды не снижают возбудимость, а
усиливают торможение.
Бром - ядовитое вещество. При вдыхании
паров брома: насморк, кашель,
удушье, явление бронхита и
бронхопневмонии, слезотечение,
конъюктивит.
Слизистая рта и языка имеет коричневый
цвет. При внутреннем приеме: боли
в животе, рвота и понос.
Первая помощь: вдыхать водяные пары с
небольшой примесью нашатырного спирта,
ингаляции с содовым раствором. При
отравлении через рот – промывание желудка
0,5% раствором тиосульфата
натрия.
Сафиканов А.Ф.
38.
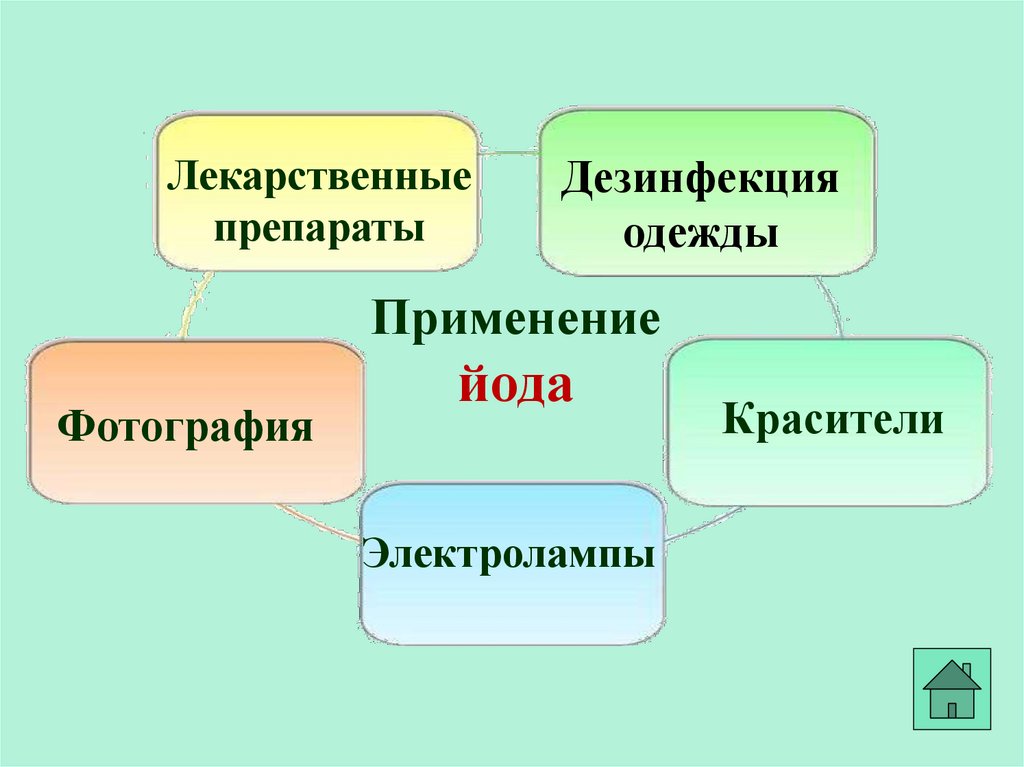
Лекарственныепрепараты
Дезинфекция
одежды
Применение
Фотография
йода
Электролампы
Красители
39.
Йод - ядовитое вещество. Симптомыострого отравления: бурое окрашивание
языка и слизистой оболочки рта, рвота
бурыми и синими
массами, понос, головная боль, насморк,
кожная сыпь. В тяжелых случаях - судороги,
коматозное состояние.
Помощь при отравлениях: промывание
желудка 0,5% раствором тиосульфата
натрия, внутрь 20-30г активированного угля
в водной взвеси. Промывать, прополоскать,
нос, рот, глотку 2% раствором
двууглекислого натрия.
Больше половины содержащегося в
человеке иода (всего 4*10-5%) находится в
щитовидной железе – в составе гормонов
тироксина и
трииодтиронина. В небольших дозах
регулирует работу щитовидной железы. При
недостатке йода возникает базедова болезнь.
Йод применяют для йодной настойки(5%
раствора йода в спирте,) йодид калия
используют в медицине, аналитической
химии, а йодид серебра – при изготовлении



































 chemistry
chemistry