Similar presentations:
Аминокислоты.Транспорт аминокислот. Тема 12
1.
Пути образования и поддержани пула аминокислотв организме. Транспорт аминокислот в клетки.
Белки выполняют в организме большинство функций
и с ними связаны практически все проявления жизни.
Белки делят на такие группы:
1. Каталитические белки - это специализованный
класс белков – ферменты.
2. Сократительные белки выполняют функцию
движения (актин и миозин).
3. Защитные белки (антитела, другие антимикробные
факторы; защита от кровопотери – фибриноген,
факторы свертывания крови.)
4. Регуляторные белки. Сигнальные белки и
олигопептиды, гормоны, рецепторы.
2.
Пути образования и поддержани пула аминокислот ворганизме. Транспорт аминокислот в клетки.
5. Транспортные белки (транспорт веществ в крови,
через мембраны). Сейчас известно свыше 6 тысяч
транспортных белков.
6. Структурные белки – мембраные, соединительной
ткани (коллаген, эластин т.д.), волос (α–кератин).
7. Пищевые – содержатся в продуктах питания.
8. Запасные.
3.
Биологические функции аминoкислoт.1. Стpуктуpные элeменты пeптидов и белков. В состав
белков входят 20 протеиногенных аминокислот, которые кодиpyютcя
генетичеcким кодом и постоянно oбнapyживaютcя в белкax. Некоторые из
них пoдвеpгaютcя посттрансляционной модификации, т.е. мoгyт быть
фocфopилиpовaны, aцилиpoваны или гидpoксилирoваны.
2. Структурные элeмeнты дpyгих природных
соeдинeний. Аминoкиcлoты и их производные входят в cocтaв
коферментов, желчных кислот, антибиотиков.
3. Пepeнoсчики сигналов. Некоторые из aминoкиcлoт являются
нейромедиаторами или предшественниками нейромедиаторов,
медиаторов или гормонов.
4. Метаболиты. Аминoкиcлоты — важнейшие, а некоторые из них
жизненно важные компоненты питания. Некоторые aминoкиcлoты
принимают участие в обмене веществ, нaпpимep, cлyжaт донорами азота.
Непротеиногенные aминoкиcлoты oбpaзyютcя в качестве прoмeжyточныx
продуктов при биоcинтeзе и деградации протеиногенных аминокислот
или в цикле мочевины.
4.
Пути образования и поддержани пула аминокислот в организме.Пищевые белки
Аминокислоты
Анаболические пути
Синтез внутри и
внеклеточных белков
Синтез физиологически
активных соединений
белковой природы
Белки и пептиды клеток
5.
Пищевые белкиАминокислоты
Катаболические пути
Tрансаминирование
Метаболиты
Гликолиза и ЦТК
Деаминирование
Мочевина
(главный продукт
метаболизма азота),
CO2 and H2O
Декарбоксилирование
Биологические
амины
6.
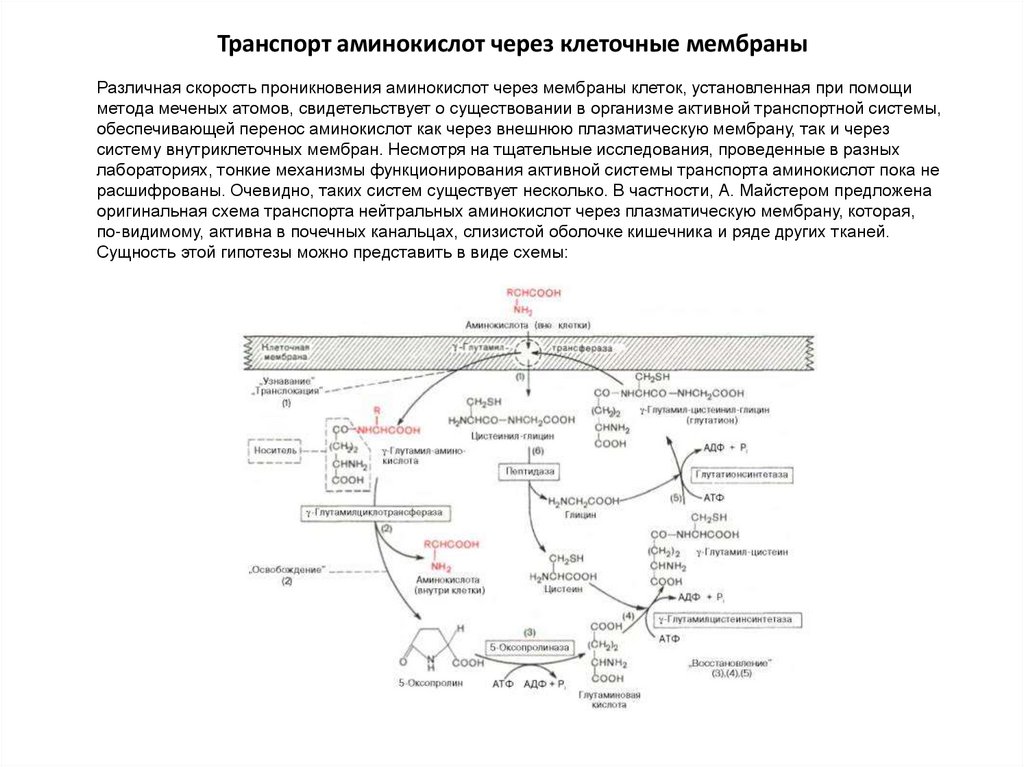
Транспорт аминокислот через клеточные мембраныРазличная скорость проникновения аминокислот через мембраны клеток, установленная при помощи
метода меченых атомов, свидетельствует о существовании в организме активной транспортной системы,
обеспечивающей перенос аминокислот как через внешнюю плазматическую мембрану, так и через
систему внутриклеточных мембран. Несмотря на тщательные исследования, проведенные в разных
лабораториях, тонкие механизмы функционирования активной системы транспорта аминокислот пока не
расшифрованы. Очевидно, таких систем существует несколько. В частности, А. Майстером предложена
оригинальная схема транспорта нейтральных аминокислот через плазматическую мембрану, которая,
по-видимому, активна в почечных канальцах, слизистой оболочке кишечника и ряде других тканей.
Сущность этой гипотезы можно представить в виде схемы:
7.
Транспорт аминокислот через клеточные мембраны8.
Аминокислота (вне клетки)R CH COOH
Клеточная мембрана
NH2
-глутамил
транспептидаза(*)
Цитоплазма
R
CH2
NH C
COO
-
C
CH NH C O
O CH2
CH2
SH
CH COO
-
CH2
CH2
CH2
+
+
Глутатион
CH N H3
( -Глутамил
COO
цистеинил глицин)
CH N H3
COO
-
-Глутамил аминоацил
(*)
CH2
COO
-глутамил
NH C
-
циклотрансфераза
+
CH N H3
Аминокислота
внутри клетки
O
Цистеинил глицин
CH2 COO
+
N H3
-
CH COO
ATФ
-
+
5-оксопролиназа
N H3
CH2 SH
OOC
COO
CH NH C O
CH2
HC NH3
COO
-
CH2
CH2
-
-Глутамил цистеин
AДФ + Фн
-
5-Оксопролин
CH2 SH
+
N
CH COO
H
пептидаза
ATФ
-
+
SH
глутатион
синтаза
COO
N H3
O CH2
AДФ + Фн
-
R CH
ATФ
-глутамил
цистеин синтаза
CH2
HC
COO
NH3
-
-Глутамат
AДФ + Фн
9.
ПРОМЕЖУТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ В ТКАНЯХПромежуточный метаболизм аминокислот белковых
молекул, как и других питательных веществ в живых
организмах, включает катаболические (распад до
конечных продуктов обмена), анаболические
(биосинтез аминокислот) процессы, а также ряд
других специфических превращений,
сопровождающихся образованием биологически
активных соединений.
Условно промежуточный метаболизм аминокислот
можно разделить на общие пути обмена и
индивидуальные превращения отдельных
аминокислот.
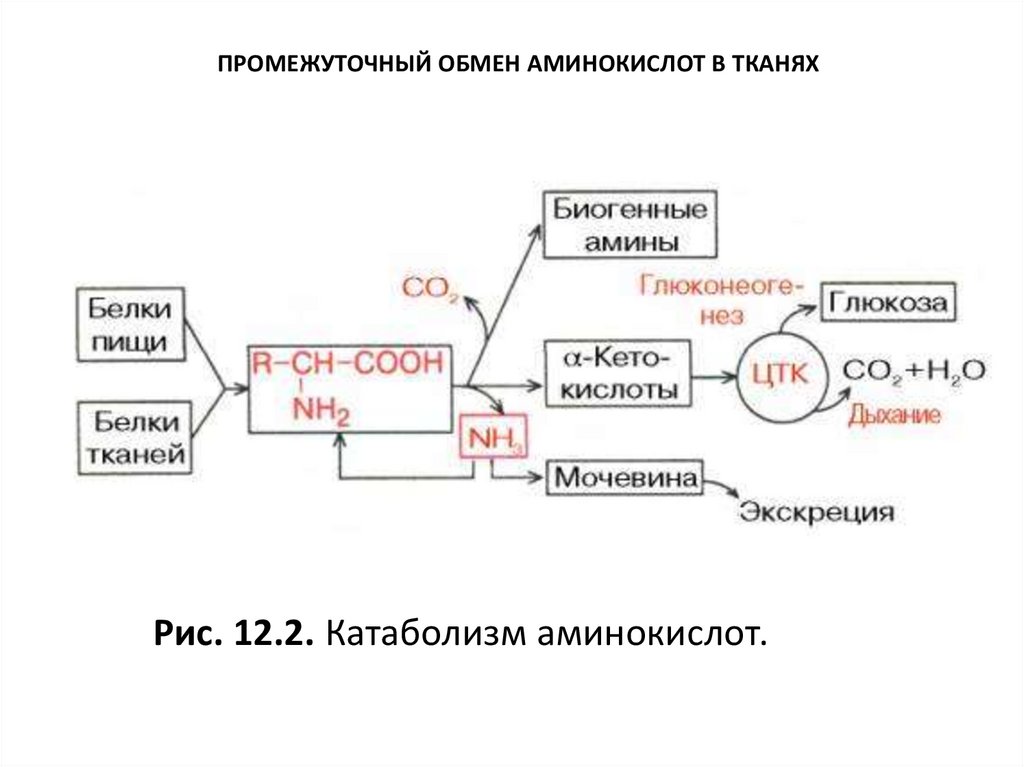
10.
ПРОМЕЖУТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ В ТКАНЯХРис. 12.2. Катаболизм аминокислот.
11.
Общие пути обмена аминокислотОбщие пути превращения аминокислот включают
реакции
деаминирования,
трансаминирования,
декарбоксилирования,
биосинтеза и
рацемизации.
Реакции рацемизации характерны только для
микроорганизмов;
открыты ферменты, катализирующие рацемизацию ряда аминокислот
(Ала, Глу, Про, Мет, Лиз, Сер) и эпимеризацию оксипролина и α,εдиаминопимелиновой кислоты. Физиологическая роль рацемаз
микроорганизмов сводится, вероятно, к синтезу D-изомеров
аминокислот для построения клеточной оболочки.
12.
Общие пути обмена аминокислотДеаминирование аминокислот
Доказано существование 4 типов деаминирования
аминокислот (отщепление аминогруппы).
Во всех случаях NH2-группа
освобождается в виде аммиака.
аминокислоты
13.
1. Восстановительное деаминирование2[H]
R CH COOH
R CH2 COOH
NH2
Аминокислота
Насыщенная кислота
+
NH3
2. Гидролитическое деаминирование
H2O
R CH COOH
NH2
Аминокислота
+
(Аммиак или NH4 )
R CH COOH + NH3
OH
Гидроксикислота
14.
3. Внутримолекулярное деаминирование (элиминирование)R CH2
R CH CH COOH + NH3
CH COOH
NH2
2-ен-карбоновая кислота
( ненасыщенная
карбоновая кислота)
Аминокислота
4. Окислительное деаминирование
1/2 O2
R CH COOH
NH2
Аминокислота
R C COOH
+ NH3
O
Oксокарбоновая кислота
( Кетокарбоновая кислота)
15.
Окислительное деаминированиеоксидаза
Механизм:
L или D-аминокислот (E)
R C COOH
R CH COOH
H 2O
NH
H NH
Аминокислота
ФMН
or
ФAД
ФMНH2
or
ФAДH2
R C COOH +
Иминокислота
NH3
O
Кетокислота
Первая стадия завершается образованием неустойчивой
промежуточной иминокислоты, которая на второй стадии
спонтанно без участия фермента, но в присутствии воды
распадается на аммиак и α-кетокислоту.
16.
Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Для животныхтканей, растений и большинства аэробных микроорганизмов преобладающим типом реакций является окислительное
дезаминирование аминокислот, за исключением гистидина, подвергающегося внутримолекулярному деаминированию.
Рассмотрим более подробно механизм окислительного дезаминиро-вания аминокислот, протекающего в две стадии.
Первая стадия является ферментативной и завершается
образованием
неустойчивого
промежуточного
продукта
(иминокислота), который на второй стадии спонтанно без
участия фермента, но в присутствии воды распадается на аммиак
и α-кетокислоту.
Следует указать, что оксидазы аминокислот (L- и D-изомеров) являются сложными
флавопротеинами, содержащими в качестве кофермента ФМН или ФАД, которые
выполняют в этой реакции роль акцепторов двух электронов и протонов,
отщепляющихся от аминокислоты. Оксидазы L-аминокислот могут содержать как ФМН,
так и ФАД, а оксидазы D-аминокислот – только ФАД в качестве простетической группы.
17.
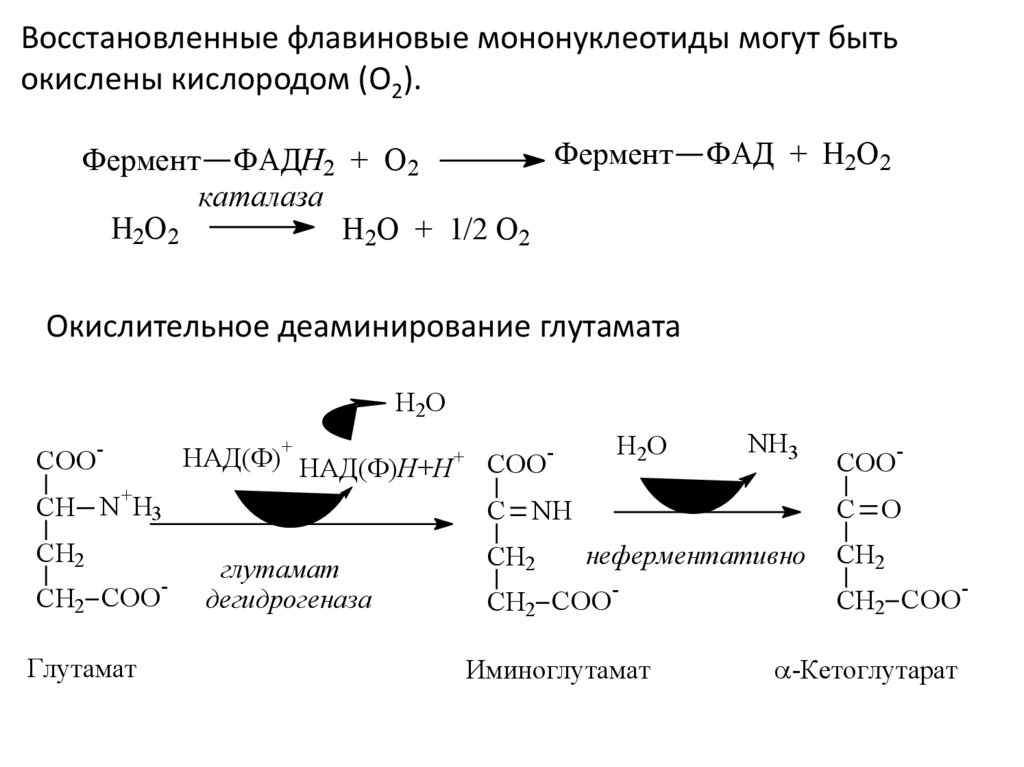
Восстановленные флавиновые мононуклеотиды могут бытьокислены кислородом (O2).
Фермент
Фермент ФAДH2 + O2
каталаза
H2O2
H2O + 1/2 O2
ФAД + H2O2
Окислительное деаминирование глутамата
H 2O
COO
H 2O
+
-
НAД(Ф) НAД(Ф)H+H+ COO+
CH N H3
CH2
CH2 COO
Глутамат
-
NH3
CH2
-
C O
C NH
глутамат
дeгидрогеназа
COO
неферментативно
CH2 COO
-
Иминоглутамат
CH2
CH2 COO
-Кетоглутарат
-
18.
Схематически реакции окислительногодеаминирования аминокислот с участием
коферментов могут быть представлены в следующем
виде:
19.
Восстановленные флавин-нуклеотиды оксидаз L- иD-аминокислот могут непосредственно окисляться
молекулярным кислородом. При этом образуется
перекись
водорода,
которая
подвергается
расщеплению под действием каталазы на воду и
кислород.
20.
Впервые в лаборатории Д. Грина из ткани печени и почек крыс была выделена оксидаза, катализирующая деаминирование 12природных (L-изомеров) аминокислот. Оказалось, однако, что этот фермент имеет оптимум действия в щелочной среде (рН
10,0) и при физиологических значениях рН его активность на порядок ниже, чем при рН 10,0. В тканях животных и человека
отсутствует подобная среда, поэтому оксидазе L-ами-нокислот принадлежит, вероятнее всего, ограниченная роль в процессе
окислительного дезаминирования природных аминокислот. В животных тканях оксидазным путем со значительно большей
скоростью дезами-нируются D-изомеры аминокислот. Эти данные подтвердились после того, как из животных тканей был
выделен специфический фермент оксидаза D-аминокислот, который в отличие от оксидазы L-аминокислот оказался
высокоактивным при физиологических значениях рН среды. Не до конца ясным остается вопрос о том, каково значение столь
активной оксидазы D-аминокислот в тканях, если поступающие с пищей белки и белки тела животных и человека состоят
исключительно из природных (L-изомеров) аминокислот.
В животных тканях Г. Эйлером открыт высокоактивный при физиологических значениях рН специфический фермент
(глутаматдегидрогеназа), катализирующий окислительное дезаминирование L-глутаминовой кислоты. Он является
анаэробным ферментом и чрезвычайно широко распространен во всех живых объектах. В качестве кофермента глутаматдегидрогеназа содержит НАД (или НАДФ). Реакция включает анаэробную фазу дегидрирования глутаминовой кислоты с
образованием промежуточного продукта – иминоглутаровой кислоты и спонтанный гидролиз последней на аммиак и αкетоглутаровую кислоту в соответствии со следующей схемой:
21.
22.
Неокислительное деаминирование Cерина, Треонина и Цистеина.COO
пиридоксаль
H2O
фосфат
+
CH N H3
CH2 OH
серин дегидратаза
COO
C N H3
+
C NH
CH2
CH3
COO
пиридоксаль H2O
фосфат
CH NH2
CH OH
CH3
треонин
дегидратаза
COO
пиридоксаль
фосфат
H2S
+
CH N H3
CH2 SH
Цистеин
COOC O
неферментативно
CH3
COO
-
COO
Пируват
H2O
-
C NH2
C NH
CH
CH2
CH3
CH3
цистатионин
лиаза
-
CH2
CH3
-Keтобутират
COO
C N H3
+
C NH
CH2
CH3
Иминоаланат
COO
неферментативно
-
COO
NH3
C O
-Иминобутират
Треонин
-
-
Иминоаланат
Серин
-
NH3
H2O
-
COO
-
H2O
NH3
COO
-
C O
неферментативно
CH3
Пируват
23.
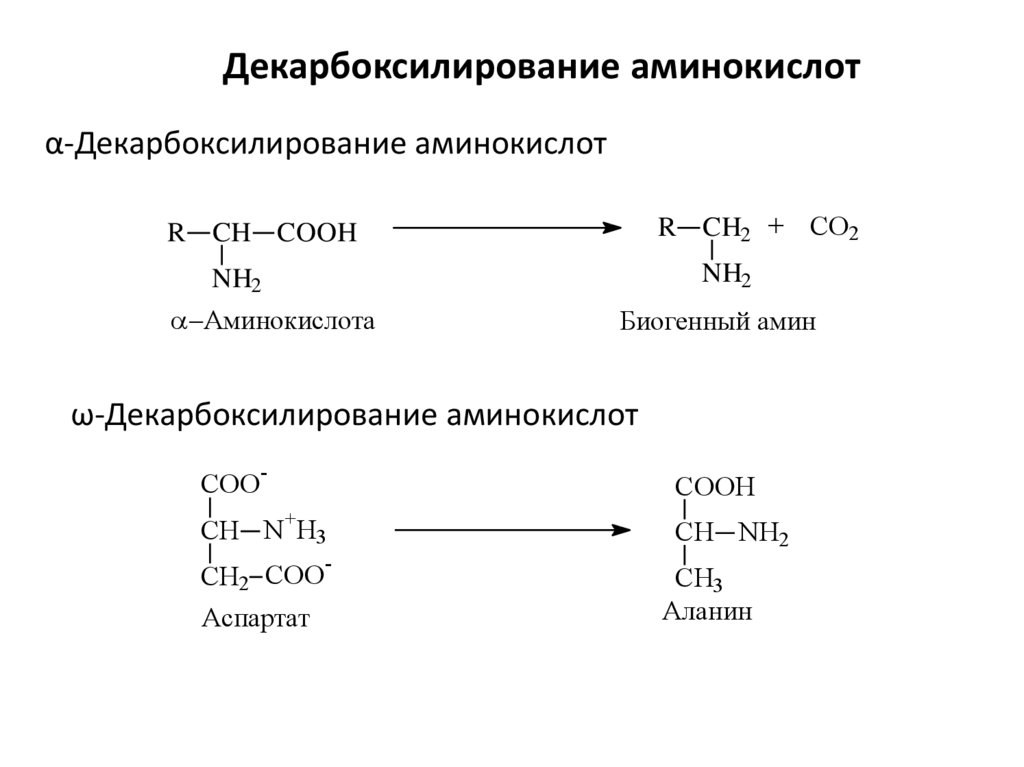
Декарбоксилирование аминокислотα-Декарбоксилирование аминокислот
R CH2 + CO2
R CH COOH
NH2
NH2
Аминокислота
Биогенный амин
ω-Декарбоксилирование аминокислот
COO
-
COOH
+
CH N H3
CH2 COO
Аспартат
-
CH NH2
CH3
Аланин
24.
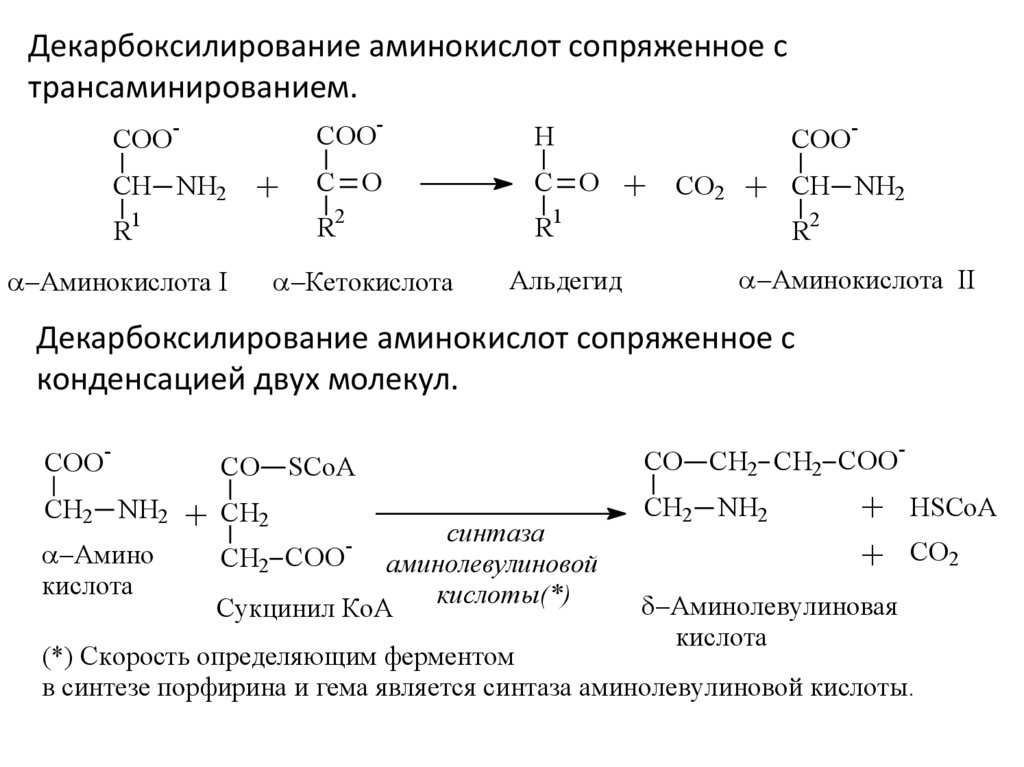
Декарбоксилирование аминокислот сопряженное странсаминированием.
COO-
COO
CH NH2
R1
+
-
C O
2
Аминокислота I
C O
1
R
COO-
H
+
CO2
+
R
Кетокислота
Альдегид
CH NH2
R2
Аминокислота II
Декарбоксилирование аминокислот сопряженное с
конденсацией двух молекул.
COO
-
CH2 NH2
Амино
кислота
CO
+
SCoA
CH2
синтаза
CH2 COO
аминолевулиновой
кислоты(*)
Сукцинил КoA
-
CO CH2 CH2 COO
CH2 NH2
+
+
Aминолевулиновая
кислота
-
HSCoA
CO2
(*) Скорость определяющим ферментом
в синтезе порфирина и гема является синтаза аминолевулиновой кислоты.
25.
CO2CH2 CH COOH
NH2
гистидин
декарбоксилаза
Гистидин
CH2
NH2
Гистамин
COO
-
CH2 CH NH2
COO
Глутамат
CH2 CH2
-
CO2
CH2
глутамат
декарбоксилаза
COO
-
CH2 CH2 NH2
Аминомасляная кислота
(ГАМК)
26.
CH2COOH
HO
NH2
NH
CH2
NH2
NH
5-Гидрокситриптофан
Триптофан
- CO2
CH2
- CO2
CH2
HO
CH2
NH2
NH
CH2
CH2
NH2
NH
Триптамин
HO
COOH
Серотонин
COOH
NH2
HO
3,4-Диоксифенилаланин (ДОФА)
- CO2
CH2
HO
CH2
NH2
HO
Дофамин





















 biology
biology chemistry
chemistry