Similar presentations:
Классификация химических реакций, протекающих с изменением состава веществ
1.
2.
По признаку изменения числа и состававеществ среди химических реакций
выделяют реакции соединения,
разложения, замещения и обмена.
3.
Реакции соединения2С + О2 = 2СО
2СО + О2 = 2СО2
СО2 + Н2О = Н2СО3
4.
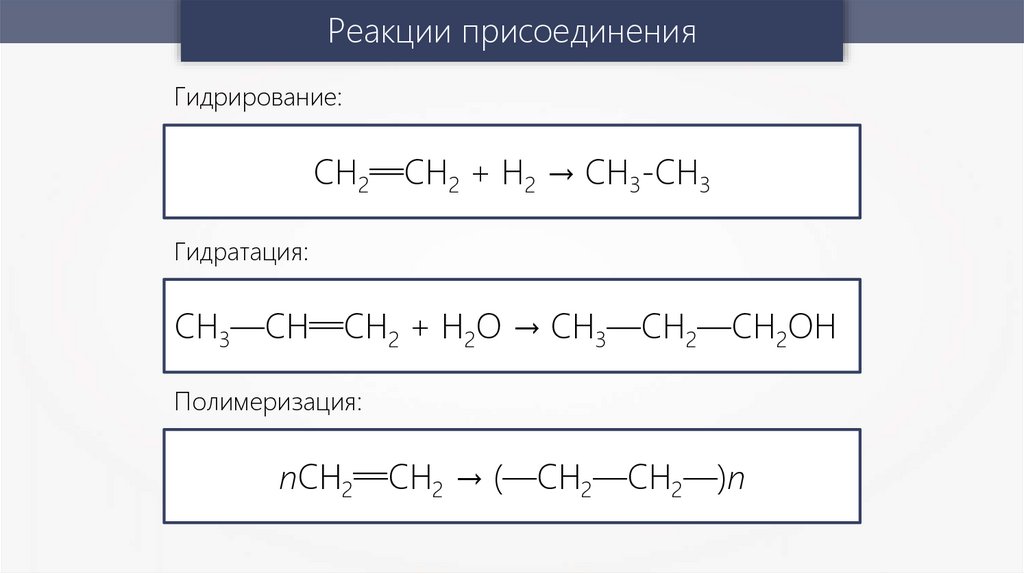
Реакции присоединенияГидрирование:
СН2—
—СН2 + Н2 → СН3-СН3
Гидратация:
— 2 + Н2О → СН3—СН2—СН2ОН
СН3—СН—СН
Полимеризация:
пСН2—
—СН2 → (—СН2—СН2—)п
5.
Реакции разложенияHgO = Hg + O2
Zn(OH)2 = ZnO + H2O
2Cu(NO3)2 = 2CuO + 4NO2 + O2
6.
Реакции замещенияK + H2O = KOH + H2
Al + H2SO4 = Al2(SO4)3 + H2
Zn + CuCl2 = ZnCl2 + Cu
7.
Реакции замещения в органических веществахСН4 + Сl2 = СН3Сl + НСl
С6Н6 + Br2 = C6H5Br + HBr
8.
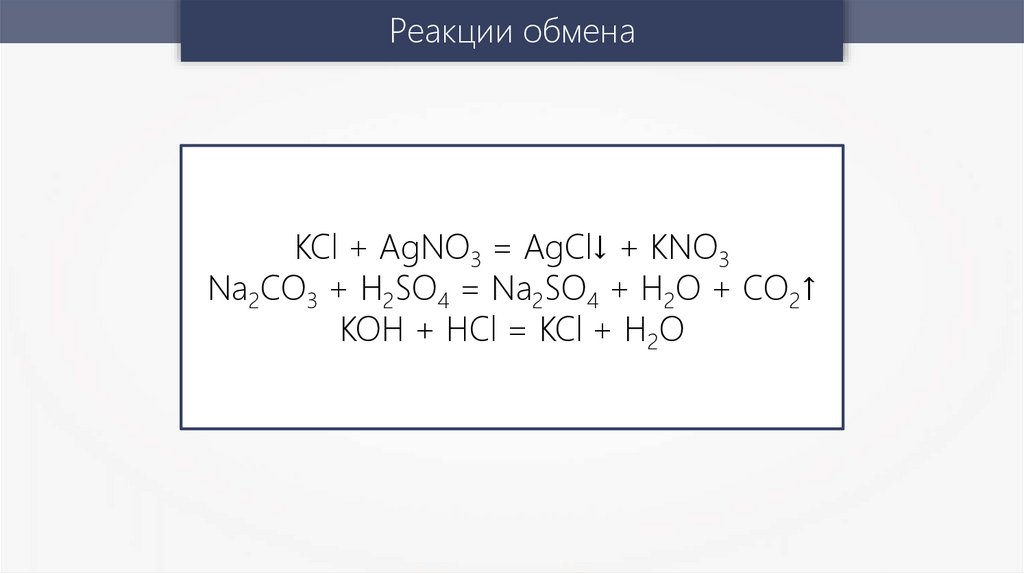
Реакции обменаKCl + AgNO3 = AgCl↓ + KNO3
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
KOH + HCl = KCl + H2O
9.
По признаку выделения или поглощениятеплоты среди химических реакций
выделяют экзотермические и
эндотермические реакции.
10.
Экзотермические реакции2H2 + O2 = 2H2O + Q
NaOH + HCl = NaCl + H2O + Q
11.
Эндотермические реакцииСu(OH)2 = CuO + H2O - Q
N2 + O2 = 2NO - Q
12.
Тепловой эффект — количество теплоты, котораявыделяется или поглощается в ходе химической
реакции.
13.
Термохимические реакцииS + O2 = SO2 + 297 кДж
4Al + 3O2 = 2Al2O3 + 3350 кДж
СaCO3 = CaO + CO2 – 179 кДж










 chemistry
chemistry








