Similar presentations:
Классификация химических реакций по числу и составу реагентов и образующихся веществ
1.
2. Классификация химических реакций по числу и составу реагентов и образующихся веществ
1. Реакции соединения – это реакции, при которых из двух или болееисходных веществ образуется одно сложное. А + В = АВ
Простое вещество + простое вещество = сложное вещество
А
В
АВ
S + O2 = SO2
Сложное вещество + простое вещество = сложное вещество
А
В
АВ
2SO2 + O2 = 2SO3
Сложное вещество + сложное вещество = сложное вещество
А
В
АВ
H2O + SO3 = H2SO4
3.
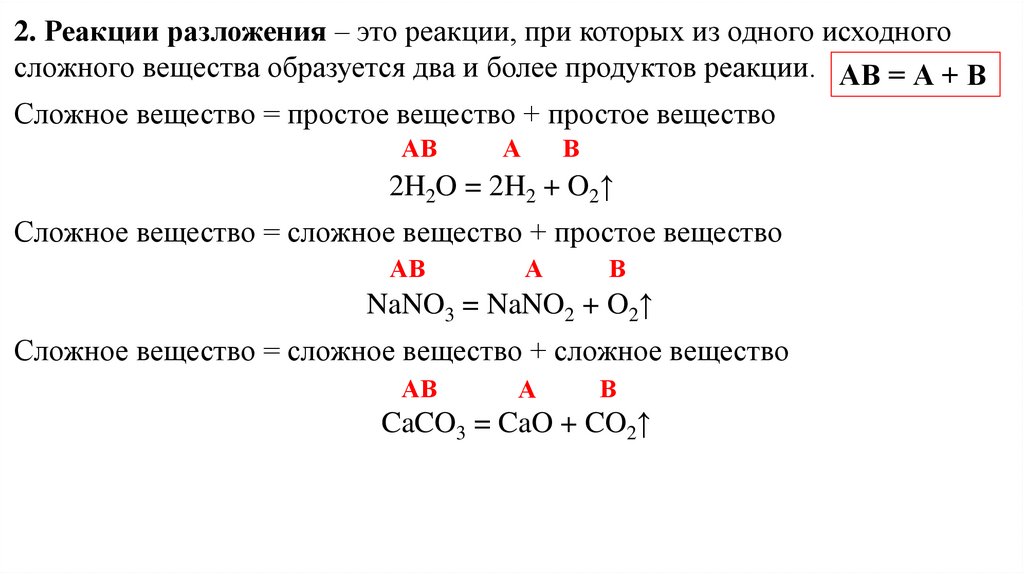
2. Реакции разложения – это реакции, при которых из одного исходногосложного вещества образуется два и более продуктов реакции. АВ = А + В
Сложное вещество = простое вещество + простое вещество
АВ
А
В
2H2O = 2H2 + O2↑
Сложное вещество = сложное вещество + простое вещество
АВ
А
В
NaNO3 = NaNO2 + O2↑
Сложное вещество = сложное вещество + сложное вещество
АВ
А
В
CaCO3 = CaO + CO2↑
4.
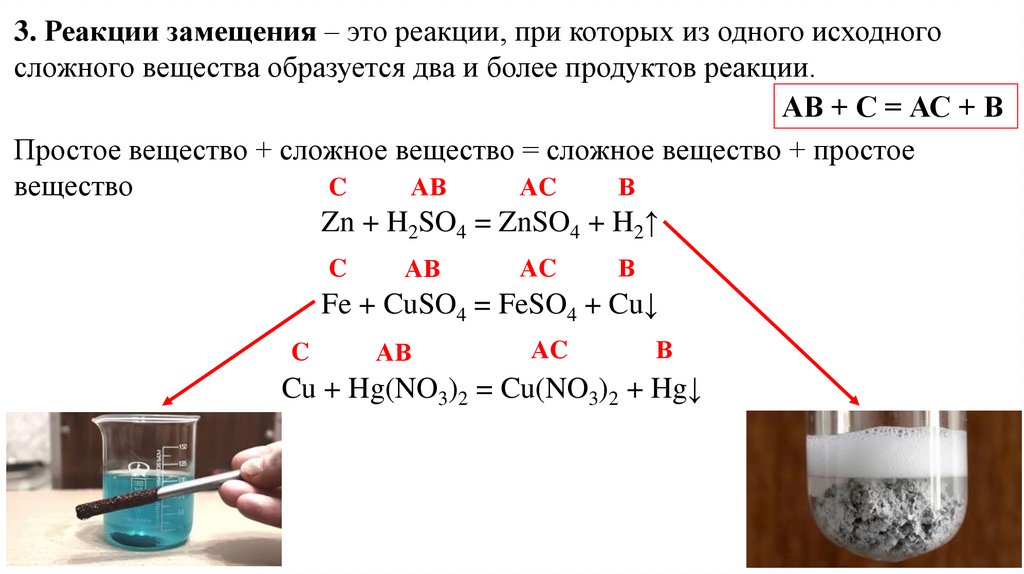
3. Реакции замещения – это реакции, при которых из одного исходногосложного вещества образуется два и более продуктов реакции.
АВ + С = АС + В
Простое вещество + сложное вещество = сложное вещество + простое
вещество
C
АВ
АC
В
Zn + H2SO4 = ZnSO4 + H2↑
C
АВ
АC
В
Fe + CuSO4 = FeSO4 + Cu↓
C
АВ
АC
В
Cu + Hg(NO3)2 = Cu(NO3)2 + Hg↓
5.
4. Реакции обмена – это реакции, при которых два сложных веществаобмениваются составными частями. АВ + СD = АD + CB
Сложное вещество + сложное вещество = сложное вещество + сложное
вещество
АD
CB
АВ
CD
H2SO4 + BaCl2 = BaSO4↓ + 2HC1 Белый
кристаллический
осадок
Реакцию, с помощью которой определяют наличие того или иного вещества,
называют качественной реакцией на это вещество.
Реакции нейтрализации – это тип реакций обмена, протекающих между
растворами сильных кислот и щелочей.
Малодиссоциирующее
АВ
CD
АD
CB
вещество
H2SO4 + 2KOH = K2SO4 + 2H2O
Реакция среды образовавшегося раствора становится нейтральной
6. Допишите химические реакции, расставьте коэффициенты и определите тип каждой реакции по числу и составу реагентов и продуктов
Na + Cl2 =NaHCO3 =
Al + O2 =
CaO + HCl =
Mg + H2SO4 =
H2SO4 + BaCl2 =
H2 + O2 =
NaOH =
CaO + H3PO4 =
7. Классификация химических реакций по тепловому эффекту
1. Экзотермические реакции – это реакции,в результате которых выделяется теплота.
2Mg + O2 = 2MgO + Q
Q>0
2. Эндотермические реакции – это реакции,
в результате которых поглощается теплота.
2HgO = Hg + O2↑ - Q
Q<0
Эндотермические Экзотермические
реакции
реакции
Тепловой эффект – это количество теплоты, выделяющейся или
поглощающейся в результате протекания химической реакции.
Тепловой эффект обозначают буквой Q и измеряют в килоджоулях (кДж) или
килоджоулях в расчёте на один моль какого-либо участника реакции (кДж/моль)
8.
Термохимические уравнения – это уравнения химических реакций, вкоторых указан тепловой эффект.
H2SO4 + 2NaOH = Na2SO4 + 2H2O + 114 кДж
Q = 114 кДж или 57 кДж/моль NaOH, Q > 0, реакция экзотермическая
2SO3 = 2SO2 + O2↑ - 188 кДж
Q = -188 кДж или -94 кДж/моль SO3, Q < 0, реакция эндотермическая
Экзотермическая реакция
Эндотермическая реакция
Экзотермическая реакция
9. Распределите химические реакции на экзотермические и эндотермические
ЭкзотермическиеЭндотермические
4NH3 + 5O2 = 4NO + 6H2O + Q
С + О2 = СО2 + 393 кДж
СаСО3 = СаО + СО2 – 178 кДж
Cu(OH)2 = CuO + H2O – 37 кДж
N2 + O2 = 2NO − 180 кДж
2KNO3 = 2KNO2 + O2 – Q
C + 2H2 = CH4 + 76 кДж
10. Классификация химических реакций по агрегатному состоянию реагентов и продуктов реакции
1. Гомогенные реакции – этореакции, в которых реагирующие
вещества и продукты реакции
находятся в одном агрегатном
состоянии (в одной фазе).
2SO2(г.) + O2(г.) = 2SO3(г.)
2. Гетерогенные реакции - это
реакции, в которых реагирующие
вещества находятся в разных
агрегатных состояниях (в разных
фазах).
4FeS2(тв.) + 11O2(г.) = 2Fe2O3 + 8SO2
Условное обозначение
Расшифровка
р-р., ж.
раствор, жидкость
г.
газ
тв., к.
твердое, кристаллическое вещество
11. Определите тип химических реакций по агрегатному состоянию реагентов и продуктов реакции
HCl (водный раствор) + NaOH (водный раствор) = NaCl (раствор) + H2OCaCO3(твёрдый) = CaO (твёрдый) + CO2 (газ)
H2 (газ) + I2 (газ) = 2HI (газ)
Нагревание смеси кислорода (г.) и азота (г.) с образованием оксида азота.
Сжигание древесины (тв.) в присутствии кислорода (г.).
12. Классификация химических реакций по обратимости
1. Необратимые реакции – этореакции, протекающие только в
одном направлении.
S + O2 = SO2
Признаки необратимых реакций:
Выпадение осадка (↓):
2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
Выделение газа (↑):
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
Образование малодиссоциирующего
соединения:
NaOH + HCl = NaCl + H2O
2. Обратимые реакции – это
реакции, которые в одних и тех же
условиях протекают в двух взаимно
противоположных направлениях.
2SO2 + O2 = 2SO3
2SO3 = 2SO2 + O2↑
2SO2 + O2 ⇄ 2SO3
13. Определите, какие из приведённых ниже реакций являются обратимыми, а какие — необратимыми
Определите, какие из приведённых нижереакций являются обратимыми, а какие —
необратимыми
N2 + 3H2 ⇄ 2NH3
Mg + O2 → MgO
H2CO3 ⇄ CO2 + H2O
C + O2 → CO2
CH3COOH + C2H5OH ⇄ CH3COOC2H5 + H2O
14. Классификация химических реакций по использованию катализатора
1. Каталитические реакции – этореакции, проходящие с применением
катализатора.
Fe
N2 + 3H2 = 2NH3
2. Некаталитические реакции – это
реакции, в которых катализатор не
используется.
NaOH + HCl = NaCl + H2O
Катализатор – это вещество, которое
изменяет скорость химической реакции,
но само в ней не расходуется.
Ферментативные реакции – это реакции, протекающие с участием
биологических катализаторов белковой природы – ферментов.
Каталаза
2H2O = 2H2 + O2↑
15. Классификация химических реакций по изменению степеней окисления элементов
1. Окислительно – восстановительные реакции(ОВР) – это реакции, в ходе которых происходит
изменение степеней окисления элементов,
образующих реагирующие вещества.
2. Химические
реакции, проходящие
без изменения
степеней окисления.
Восстановители – это частицы, которые
отдают электроны. При этом степень
окисления восстановителя повышается,
а сами восстановители окисляются.
+2 -1 +1 -2 +2 -2
Cu(OH)2 = H2O + CuO
Окислители – это частицы, которые
принимают электроны. При этом
степень окисления окислителя
понижается, а сами окислители
восстанавливаются.
0
0
+2 -2
2Са + O2 = 2СаО
16. Установите соответствие между схемой процесса, происходящего в окислительно-восстановительной реакции, и названием этого
Установите соответствие между схемойпроцесса, происходящего в окислительновосстановительной реакции, и названием этого
процесса
Схема процесса
А) Al+3 → Al0
Б) Br20 → 2Br+5
В) N-3 → N+2
Название процесса
1) окисление
2) восстановление
Схема процесса
А) C+4 → C0
Б) Cu0 → Cu+2
В) O20 → 2O-2
Название процесса
1) окисление
2) восстановление
17. В химических реакциях расставьте все степени окисления и определите окислитель и восстановитель
Zn + 2HCl = ZnCl2 + H2↑2Al + 3S = Al2S3
2NaCl + Pb(NO3)2 = PbCl2↓ + 2NaNO3
18. Выберите все типы для реакции 2NaI + Cl₂→ 2NaCl + I₂
Реакция обменаГомогенная реакция
Реакция соединения
Гетерогенная реакция
Реакция замещения
Обратимая реакция
Реакция разложения
Необратимая реакция
Экзотермическая реакция
Каталитическая реакция
Эндотермическая реакция
Окислительно – восстановительная
реакция















 chemistry
chemistry








