Similar presentations:
Методы анализа качества воды
1. Методы анализа качества воды
Филимонова Антонина Андреевна2. Кислотно-основное титрование
Метод определения концентрациикислот или оснований, основанный
на реакции нейтрализации.
В
теплоэнергетике
методом
кислотно-основного
титрования
определяют показатели качества
воды - кислотность, щелочность и
карбонатную жесткость и др.
3. Кислотность
показатель качества воды
определяется
методом
титрования
единицы измерения –
моль-экв/л
• титруемое
вещество –
кислоты в растворе
• титрант – щелочь
NaOH
кислотно-основного
4. Кислотность
• Индикаторы –фенолфталеин
(рН=8,0-10,0)
метилоранж
(рН=3,1-4,4)
5. Кислотность
Одновременноеприсутствие сильных и
слабых кислот в воде два скачка титрования
на кривой.
Кривая титрования смеси кислот (НСl и СН3СООН) раствором NaOH
1 точка эквивалентности – сильные
кислоты:
HCl + NaOH → NaСl + H2O
Н3PO4 + NaOH → NaH2PO4 + H2O
H2SO4+ 2NaOH → Na2SO4 + 2H2O
2 точка эквивалентности – слабые
кислоты:
H2CO3 + NaOH → NaHCO3 + H2O
H2SiO3 + NaOH → Na2SiO3 + H2O
NaH2PO4 + NaOH → Na2HPO4 + H2O
6. Кислотность
• Чтобы узнать концентрацию угольнойкислоты по II ступени и фосфорной по III
используется
метод
обратного
титрования.
• Для этого к анализируемому раствору
добавляют заведомый избыток NaOH.
Щелочь взаимодействует со всеми
кислотами, находящимися в растворе.
Непрореагировавший остаток щелочи
титруют соляной кислотой.
• Разность между результатом обратного
титрования и результатом прямого
титрования
будет
соответствовать
концентрации
угольной кислоты по
второй ступени и фосфорной по третьей.
7. Щелочность
• показатель качества воды• определяется методом кислотно-основного
титрования
• единицы измерения – моль-экв/л
8. Щелочность
Виды щелочностиЩелочность
Гидратная
• NaOH; Ca(OH)2; NH4OH; N2H5OH
Гидрокарбонатная
• NaHCO3; Сa(HCO3)2; Mg(HCO3)2
• НСО3- + Н2O → Н2СО3 + ОН-
Карбонатная
• Na2CO3; MgCO3; CaCO3
• СО32- + НОН→ НСО3- + ОН-
Фосфатная
• Na3PO4; PO43- + H2O → HPO42- + OH• Na2HPO4; HPO42- + H2O → H2PO4- + OH• NaH2PO4; H2PO4- + H2O → H+ + H2PO4- + OH-
Силикатная
• Na2SiO3; SiО32- + Н2O → НSiО3- + ОН• NaHSiO3; НSiО3- + Н2O → Н2SiО3 + ОН-
Гуматная
•NaHum; Hum- + Н2O → НHum + ОН-
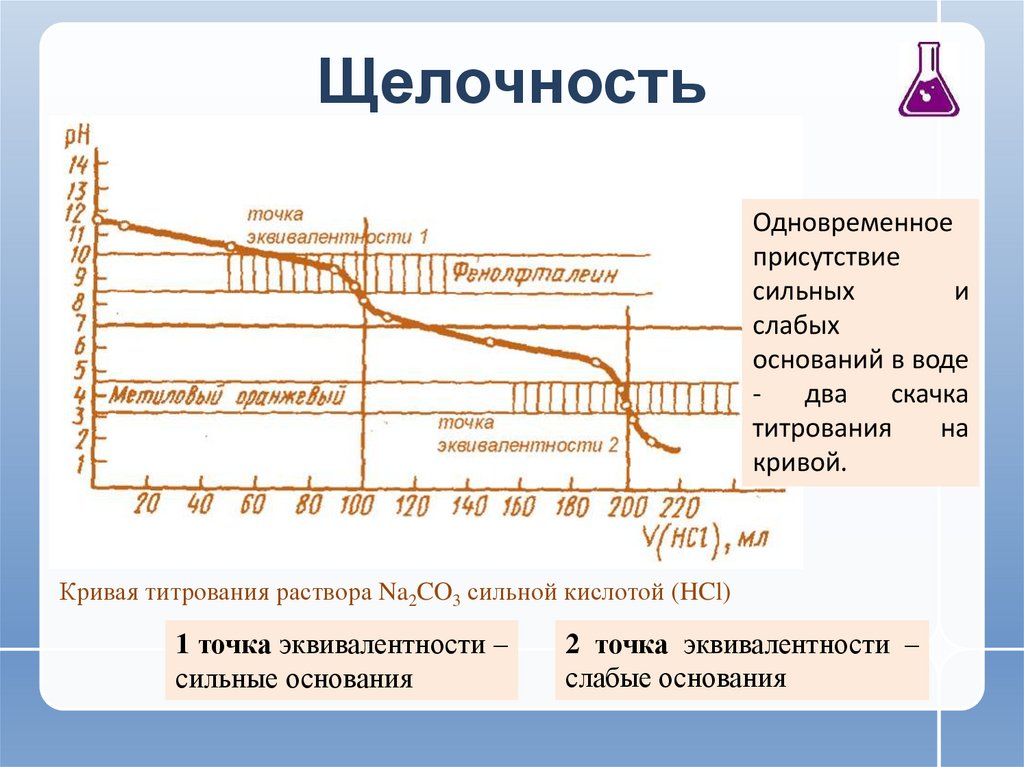
9. Щелочность
Одновременноеприсутствие
сильных
и
слабых
оснований в воде
два
скачка
титрования
на
кривой.
Кривая титрования раствора Na2CO3 сильной кислотой (HCl)
1 точка эквивалентности –
сильные основания
2 точка эквивалентности –
слабые основания
10. Щелочность
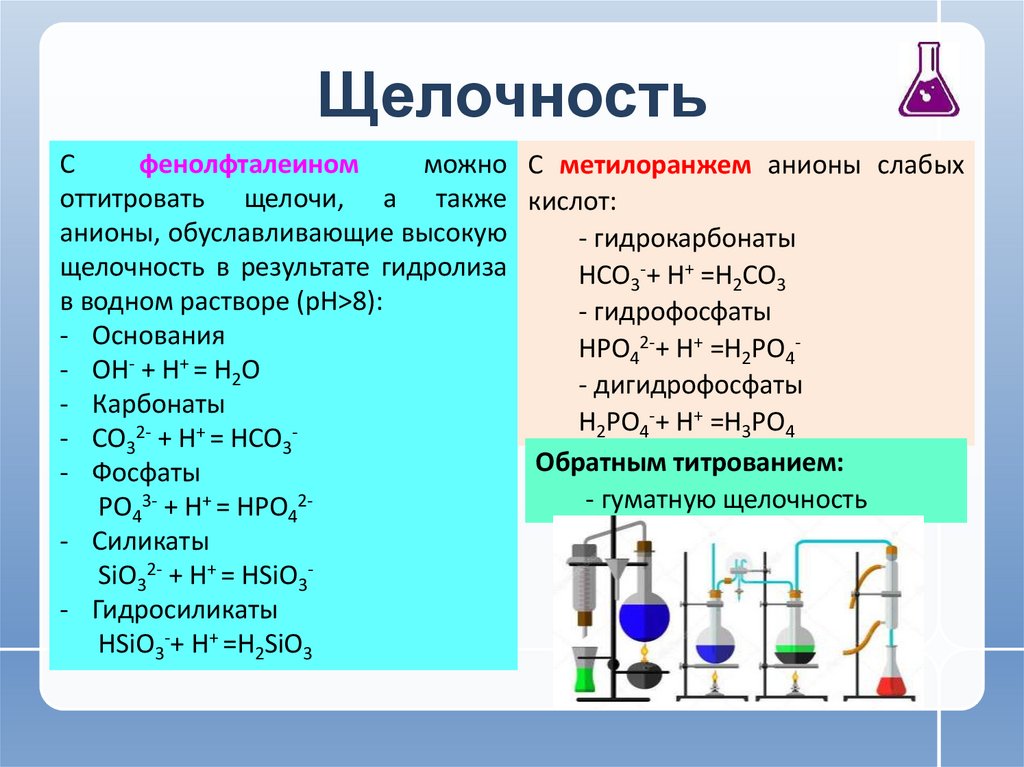
Сфенолфталеином
можно C метилоранжем анионы слабых
оттитровать щелочи, а также кислот:
анионы, обуславливающие высокую
- гидрокарбонаты
щелочность в результате гидролиза
HСO3-+ H+ =H2СO3
в водном растворе (рН>8):
- гидрофосфаты
- Основания
2-+ H+ =H PO HPO
4
2
4
- OH- + H+ = H2O
- дигидрофосфаты
- Карбонаты
H2PO4-+ H+ =H3PO4
2+
- CO3 + H = HCO3
Обратным титрованием:
- Фосфаты
- гуматную щелочность
PO43- + H+ = HPO42- Силикаты
SiO32- + H+ = HSiO3- Гидросиликаты
HSiO3-+ H+ =H2SiO3
11. Жесткость
Дляопределения
общей
жесткости воды используется
метод комплексонометрического
титрования
Комплексонометрическое
титрование – титриметрический
метод количественного анализа,
основанный
на
реакции
комплексообразования
ионов
металлов
с
полидентантными
хелатобразующими
агентами
–
комплексонами.
12. Жесткость
• Хелатные(клешневидные)
полидентантные
комплексные
соединения – это те, в которых лиганды при взаимодействии с
комплексообразователем образуют замкнутые циклы.
• Центральный ион в таких соединениях оказывается внутри
молекулы.
Поэтому
подобные
соединения
называются
внутрикомплексными.
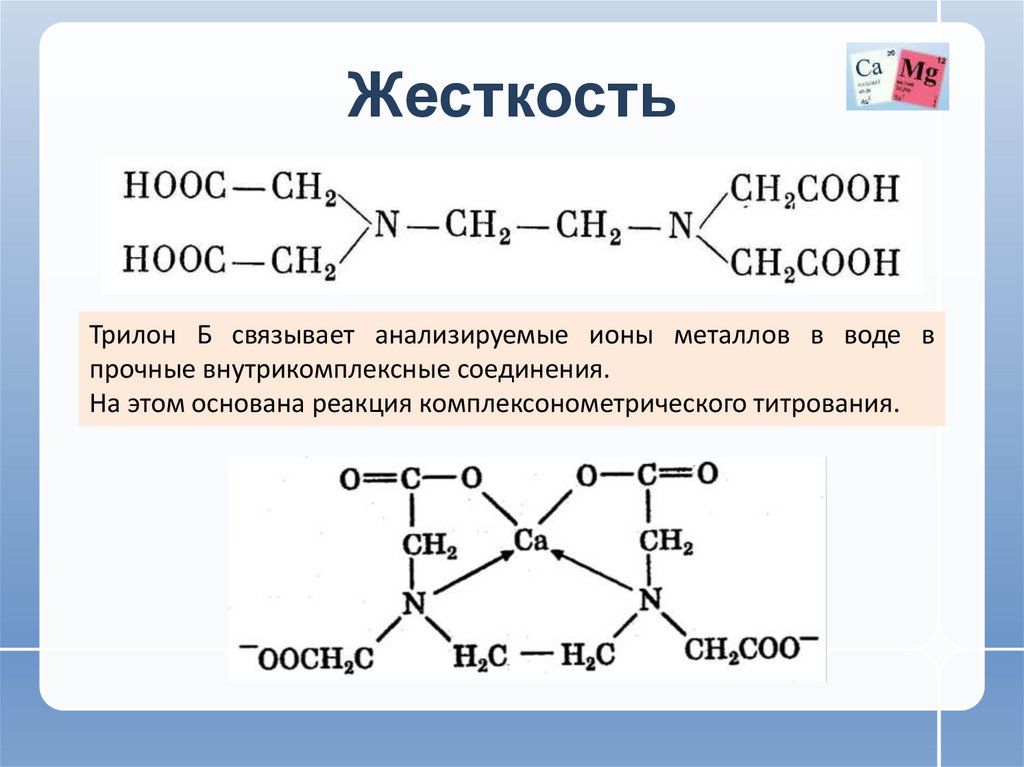
• Одним из наиболее важных полидентантных лигандов
(гексадентантных) является анион ЭДТА (трилон Б).
13. Жесткость
Трилон Б связывает анализируемые ионы металлов в воде впрочные внутрикомплексные соединения.
На этом основана реакция комплексонометрического титрования.
14. Металлоиндикаторы
Для обнаружения конечной точки титрования обычно используютметаллоиндикаторы – вещества, которые образуют с ионами
металлов интенсивно окрашенные комплексные соединения, цвет
которых отличается от окраски самого металлоиндикатора.
15. Металлоиндикаторы
При добавлении в анализируемую на ионы металла водуметаллоиндикатора он связывается в комплексное соединение с
определяемым металлом по реакции:
Me + Ind (окраска1) → MeInd (комплексное соединение с окраской2)
При последующем титровании полученного раствора MeInd трилоном Б
комплекс индикатора с металлом полностью разрушается, замещаясь
более прочным комплексом металла с титрантом (трилоном Б), при этом
раствор приобретает окраску свободного индикатора:
MeInd (комплексное соединение с окраской2) + трилон Б → Ind
(окраска1) + Me трилон Б
По объему трилона Б, израсходованного до изменения окраски
индикатора, рассчитывают концентрацию ионов кальция и магния.
16. Металлоиндикаторы
Для успешного обнаружения конечной точки титрования спомощью металлохромного индикатора необходимы условия:
• комплекс MеInd должен быть достаточно устойчив, и
образовываться уже при малых концентрациях индикатора;
• устойчивость комплекса MеInd должна быть меньше
устойчивости комплекса металла с трилоном Б;
• комплекс MеInd должен быть кинетически лабильным, и его
разрушение при взаимодействии с трилоном Б должно
происходить быстро;
• окраска комплекса MеInd должна
отличаться от окраски свободного
индикатора при данном значении рН.
17. Металлоиндикаторы
18. Окисляемость
Определение окисляемости основано на методеокислительно-восстановительного титрования,
т.е. определения анализируемого вещества в
результате
прохождения
окислительновосстановительных реакций.
Концентрацию
органических
примесей выражают через
окисляемость воды, которая
показывает расход сильного
окислителя, необходимого для
окисления
органические
примесей, содержащихся в 1 л
воды. Результаты выражают в
кислородных единицах (мг/дм3
О2).
19. Окисляемость
• В качестве сильного окислителя обычно применяют перманганаткалия (КМnO4) или бихромат калия (К2Сг2О7), различая
соответственно перманганатную и бихроматную окисляемость.
• Бихроматная окисляемость показатель более правильный, так как
при взаимодействии с бихроматом окисляется около 90%
органических примесей, а с перманганатом калия 30-50%.
• Бихроматная окисляемость – метод более трудоемкий, требующий
наличия катализатора и индикаторов.
• Для определения как бихроматной, так и перманганатной
окисляемости используют метод обратного титрования.
• Окисляемость показатель условный, так как кроме органических
веществ при определении окисляемости происходит окисление
содержащихся в воде ионов железа, сероводорода, нитритов,
хлоридов.
20. Окисляемость
Бихроматная окисляемость:Все органические примеси в воде окисляют избытком
бихромата калия в кислой среде:
После того как все органические примеси окислились, в воде
остался некоторый избыток бихромата калия, количество которого
определяют титрованием с сульфатом железа в присутствии
индикатора фенилантраниловой кислоты:
21. Окисляемость
Перманганатная окисляемость:Все органические примеси в воде окисляют избытком
перманганата калия в кислой среде:
После того как все органические примеси окислились, в воде
остался некоторый избыток перманганата калия, количество
которого определяют добавлением оксалата натрия и
последующим титрованием. Индикатор не требуется.


















 chemistry
chemistry








