Similar presentations:
Кальций (Са)
1. Кальций
zПодготовил
Мударисов Данил 9А
Школы №1
2.
Название элементапроисходит от
латинского слова cals— «известь»,
«мягкий камень».
Оно было предложено
английским химиком Г.
Дэви в 1808 г.,
выделившим
металлический кальций
электролитическим
методом.
3.
Порядковый № 20Элемент главной
подгруппы второй группы,
большого четвёртого
периода периодической
системы химических
элементов Д. И.
Менделеева
Это - мягкий, химически активный щёлочноземельный металл серебристо-белого цвета. На
воздухе он быстро окисляется, а при небольшом
нагреве сгорает ярко-красным пламенем.
4.
МелИзвестняк
Мрамор
СаСО3
CaSO4
Распространенн
ые соединения
кальция
Ca3(PO4)2
5.
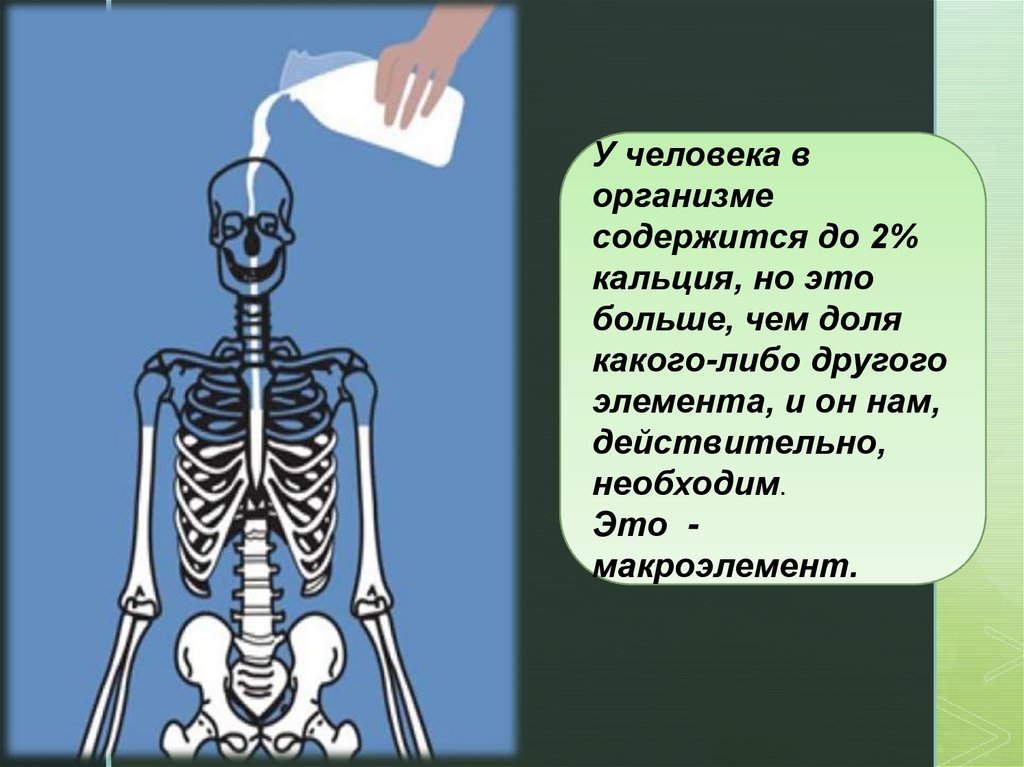
zУ человека в
организме
содержится до 2%
кальция, но это
больше, чем доля
какого-либо другого
элемента, и он нам,
действительно,
необходим.
Это макроэлемент.
6. Кальций в организме человека
zЗубы и кости:
главная функция
его – это роль
структурного
материала,
создание и
поддержание
полноценных зубов
и костей.
В составе костной
ткани кальций
содержится в
связанной форме –
в виде фосфата
7. Кальций в продуктах питания
z8.
Химические свойства1. Взаимодействует с простыми веществами
– неметаллами:
2Са + О2 = 2СаО
Ca + 2C = CaC2 (карбид кальция)
С фтором реагирует на холоду:
Са+F2 = CaF2
C хлором и бромом при температуре свыше
400°C:
Са+Сl2 =CaCl2
Са+Br2 =CaBr2
2. Взаимодействует со сложными веществами:
1) с водой
Ca + 2H2O = Ca(OH)2 + H2
2) с кислотами:
Ca + 2HCl = CaCl2 + H2
9.
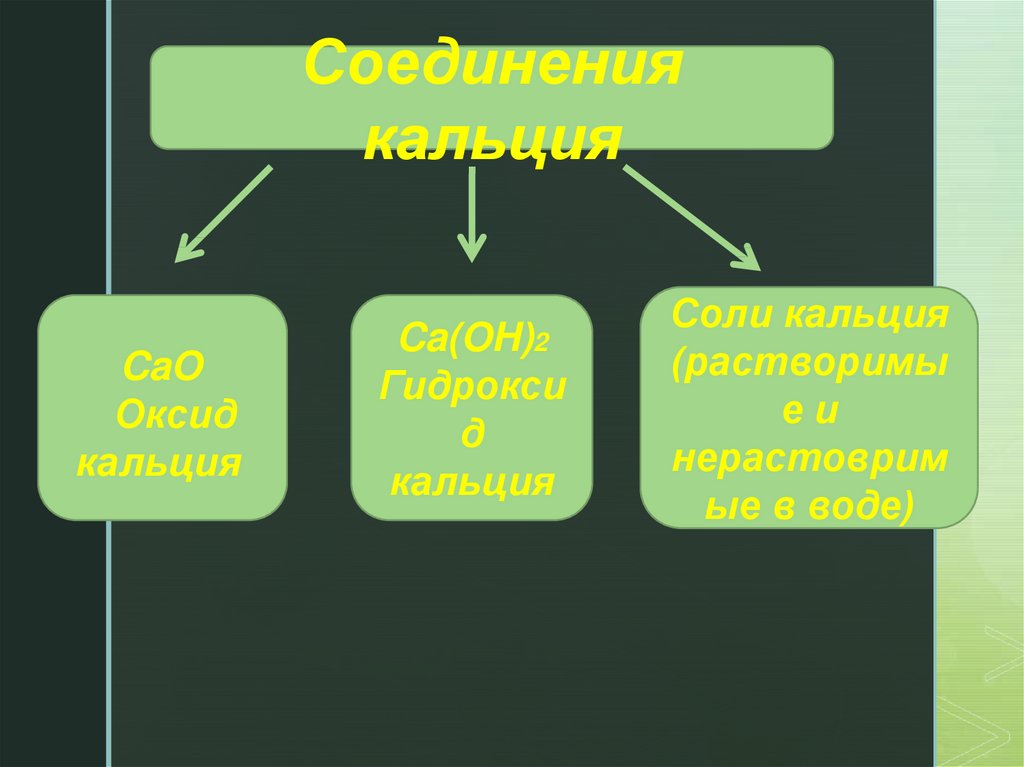
Соединениякальция
CaO
Оксид
кальция
Ca(OH)2
Гидрокси
д
кальция
Соли кальция
(растворимы
еи
нерастоврим
ые в воде)







 chemistry
chemistry








