Similar presentations:
Кальций и его соединения
1.
Кальций и егосоединения
2.
•Из истории открытия•Строение атома
•Нахождение в природе
•Физические свойства
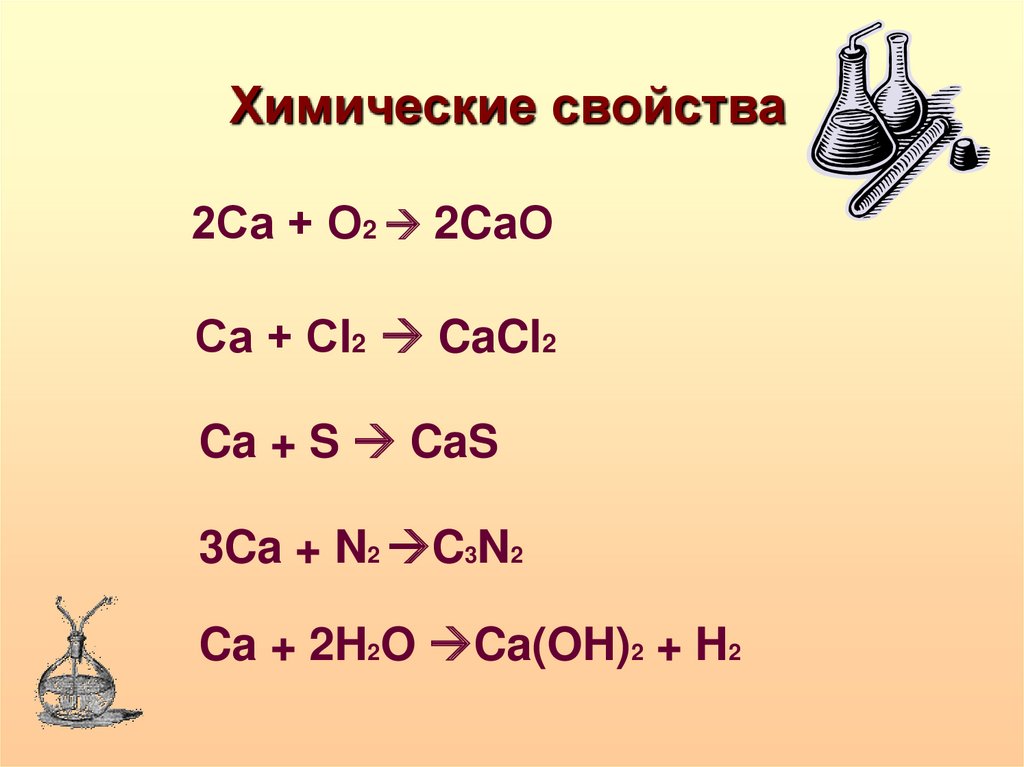
•Химические свойства
•Получение
•Оксид кальция
•Гидроксид кальция
•Применение
•Биологическая роль
3.
Из истории открытия1808г англ. химик Хэмфри Дэви выделил
металлический кальций электролитическим
методом.
Calcis – «известь», «мягкий камень»
4.
Строение атомаСа +20 ) ) )
)
2е 8е 8е 2е
Степени окисления: 0, +2
5.
Нахождение в природе3,6% в земной коре
CaCO3 - карбонат кальция( мел, мрамор,
известняк)
СаSO4 Н2О – гипс
СаF2– флюорит
СaCO3 MgCO3 - доломит
Са3(РО4)3– фосфат кальция ( апатиты,
фосфориты)
6.
СталактитыСталагмиты
7.
Физические свойства1.
2.
3.
4.
Цвет : серебристо – белый
Твёрдый
Лёгкий (плотность 1,55 г / см3)
Температура плавления ( 8390С)
8.
Химические свойства2Са + О2 2CаО
Са + Сl2 CaCl2
Ca + S CaS
3Ca + N2 C3N2
Ca + 2H2O Ca(OH)2 + H2
9.
Получениеэлектролиз расплава
СаСl2 Ca + Cl2
алюминотермия
3СаО + 2Аl 3Ca + Al2O3
10.
В промышленности кальций получаютдвумя способами:
1.Электролизом расплава CaCl2 и KCl с жидким меднокальциевым катодом приготовляют сплав Cu-Ca(65%Ca),из
которого Ca отгоняют при температуре 950-1000˚С в
вакууме 0,1-0,001 мм.рт.ст.
2.Нагреванием брикетированной смеси СаО и порошка Al
при 1200˚С в вакууме 0,01-0,02 мм.рт.ст.Выделяющиеся по
реакции пары кальция конденсируются на холодной
поверхности;
11.
Биологическая роль12.
Соединения кальция13.
Оксид кальция СаОнегашёная известь
жжёная известь
кипелка
СаО + Н2О Са(ОН)2
СаО + 2НСl CaCl2+H2O
14.
Гидроксид кальция Са(ОН)2гашеная известь
пушонка
известковое молоко
Са(ОН)2 + СО2 CaCO3 + H2O
15.
Применение кальция и его соединений16.
Са-восстановитель U,Th,Cr,V,Zr,Cs,Rb инекоторых других металлов.
Са-раскислитель сталей,бронз и других
сплавов.
Са используют для очистки аргона от
примеси азота
для удаления серы из нефтепродуктов,
в качестве поглотителя газов в
электровакуумных приборах.
Са используют в медицине для устранения
нарушений,связанных с недостатком ионов
Са2+ в организм.
17.
Тест1. Природное соединение кальция гипс отвечает формуле:
а) CaCО3 б) CaSО4 в) Ca3(PО4)2 г) CaSО4 * 2H2O
2. Названиям: гашенная известь, известковое молоко,
известковая вода – соответствует химическая формула
а) СаO б) Ca(OH)2 в) CaC2 г) CaSО4
3.Взаимодействие негашеной извести с водой относится к
реакциям: а) разложения б)соединения
в) окислительно-восстановительным
4. Для определения углекислого газа можно использовать
соединение кальция: а)CaCl2 б)Ca(OH)2 в) Ca(HCO3)2
г)СаО
18.
Домашнее задание§43, вопросы и
задания письменно с.
200 № 1-7.
Осуществить превращение
Ca CaO Ca(OH)2 CaCO3 Ca(HCO3)2
















 chemistry
chemistry








