Similar presentations:
Фенолы. Историческая справка
1. Фенолы
ФЕНОЛЫ2. Историческая справка
В 1834г. немецкий химикорганик ФридлибФердинанд Рунге
обнаружил в продуктах
перегонки
каменноугольной смолы
белое кристаллическое
вещество с характерным
запахом. Ему не удалось
определить состав
вещества.
3.
1842г. Огюст Лоранопределил состав вещества.
Новое вещество обладало
выраженными кислотными
свойствами и было
производным открытого
незадолго до этого бензола.
Лоран называл бензол
"феном", поэтому новая
кислота получила название
фениловой.
4.
Шарль ФридерикЖерар считал
полученное вещество
спиртом и предложил
называть его фенолом.
Было установлено, что
целая группа веществ
обладает подобным
строением и свойствами,
поэтому их назвали
"фенолами".
5.
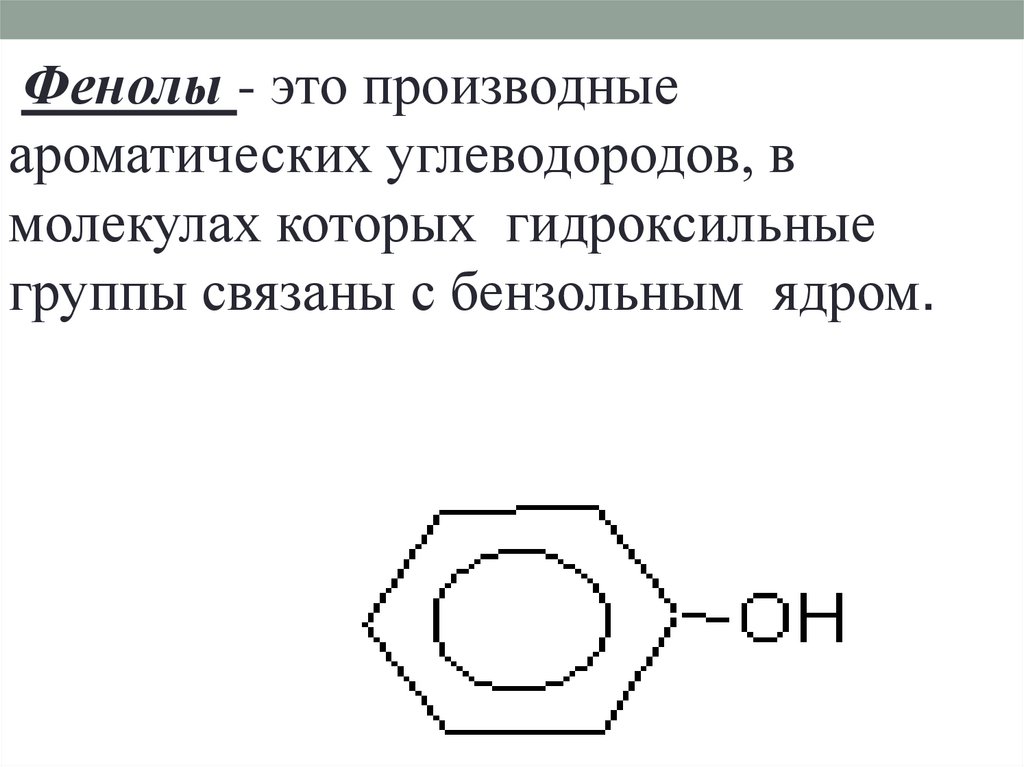
Фенолы - это производныеароматических углеводородов, в
молекулах которых гидроксильные
группы связаны с бензольным ядром.
6.
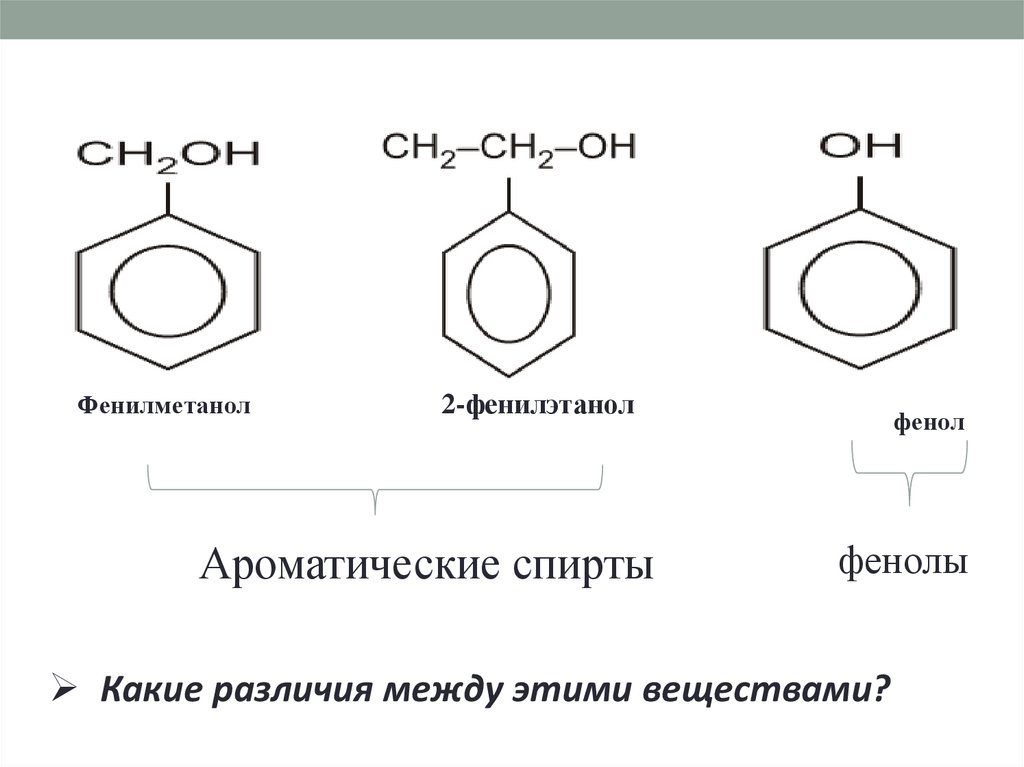
Фенилметанол2-фенилэтанол
Ароматические спирты
фенол
фенолы
Какие различия между этими веществами?
7.
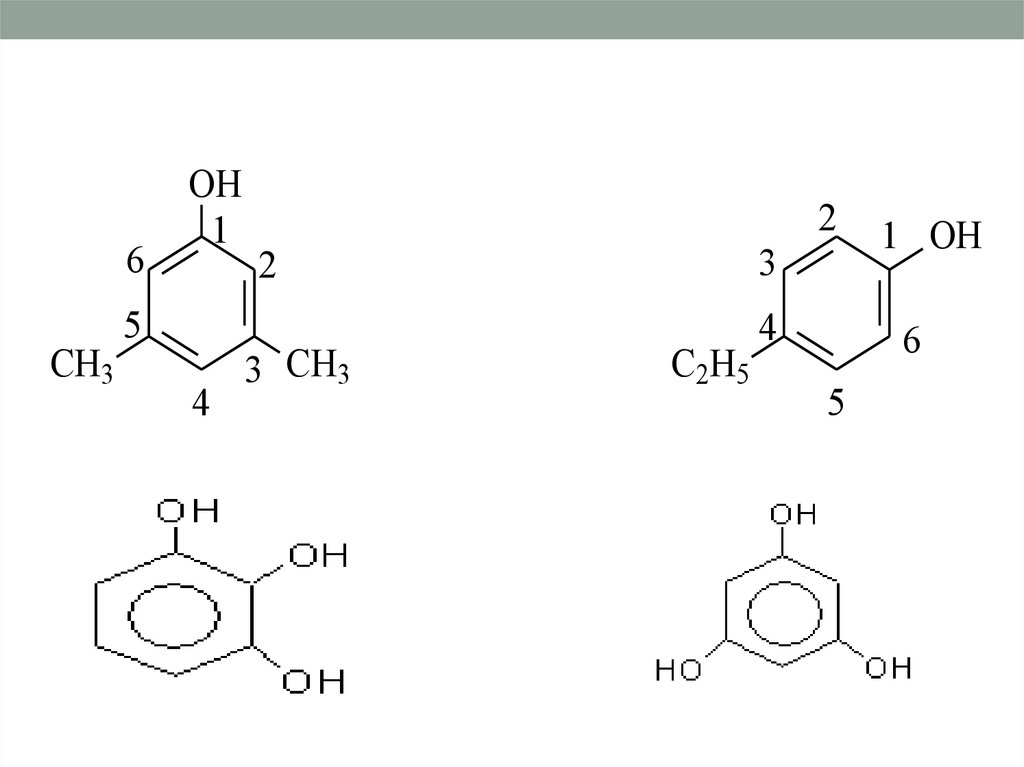
Классификация по атомностиодноатомные
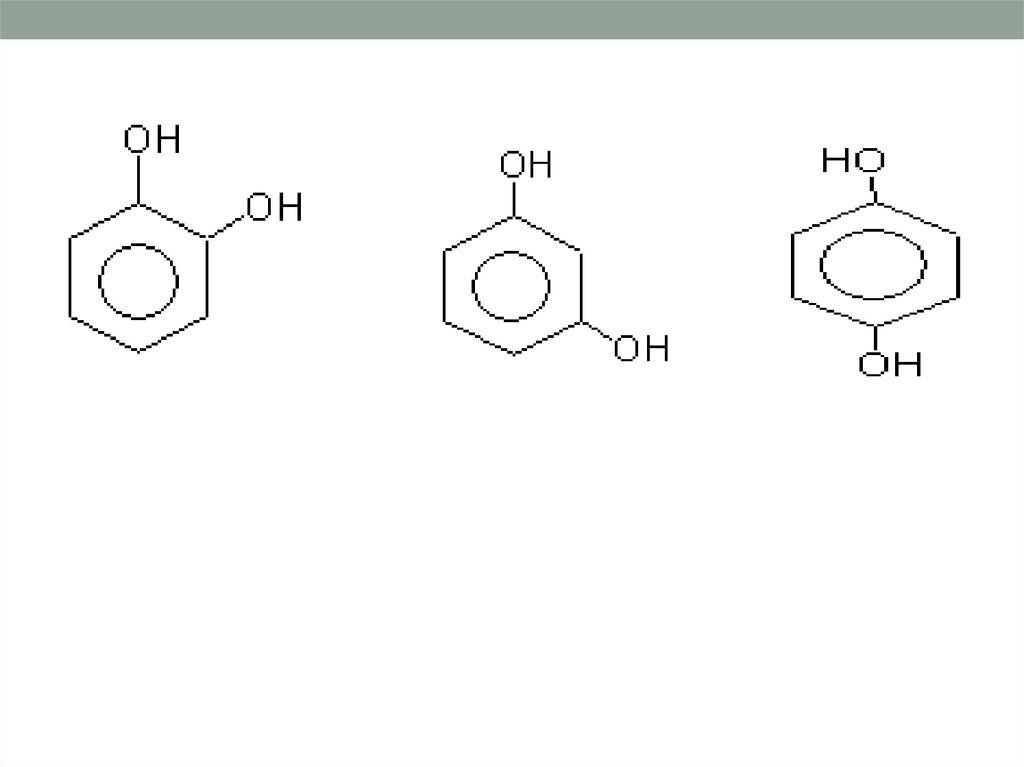
многоатомные
1,2 дигидроксибензол
(пирокатехин)
1,3 - дигидроксибензол
(резорцин)
8. номенклатура
• Родоначальная структура- фенол• Нумерацию в кольце начинают от
атома, связанного с OH-группой,
таким образом,чтобы имеющиеся
заместители получили наименьшие
номера
9.
6CH3
OH
1
5
4
2
3
2
3 CH3
C2H5
4
1 OH
6
5
10.
11. Физические свойства фенола
Растворяется при нагреванииТвердое кристаллическое
С резким характерным запахом
вещество
Фенол ядовит!!!
При попадании на кожу вызывает ожоги.
Соблюдай правила техники безопасности!!!!
12.
13.
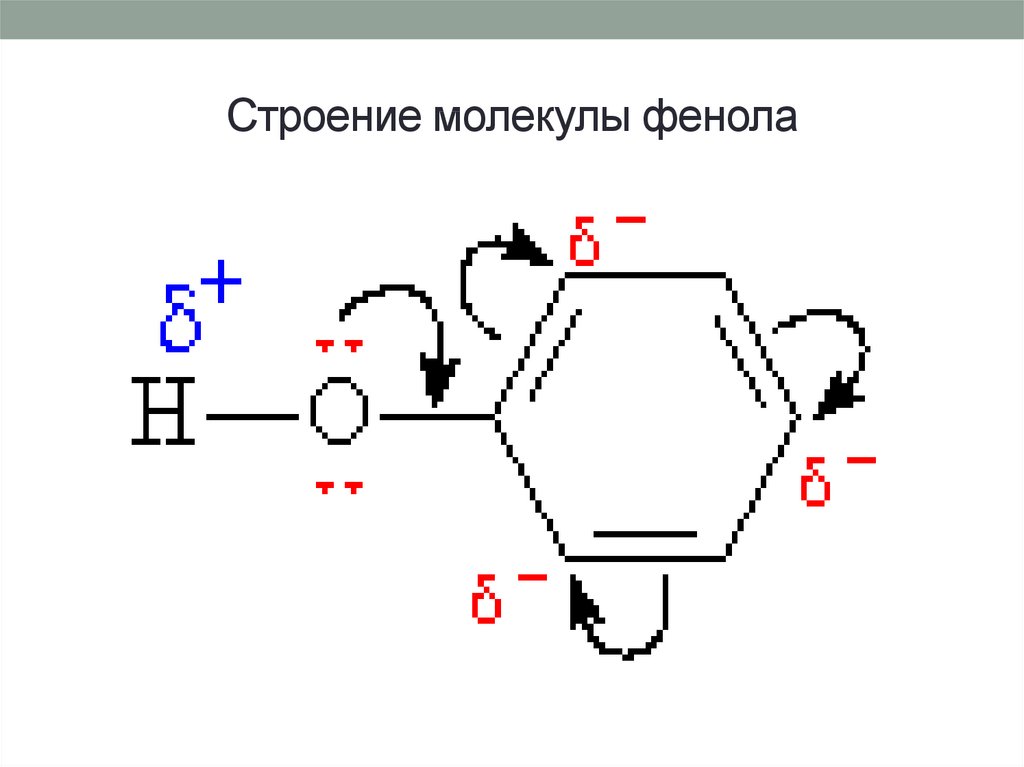
Неподеленнаяэлектронная
пара
атома
кислорода притягивается 6-ти электронным
облаком бензольного кольца, из – за чего связь
О–Н еще сильнее поляризуется. Фенол - более
сильная кислота, чем вода и спирты.
В
бензольном
кольце
нарушается
симметричность
электронного
облака,
электронная
плотность
повышается
в
положении 2, 4, 6. Это делает более
реакционноспособными
связи
С-Н
в
положениях 2, 4, 6. и – связи бензольного
кольца.
14.
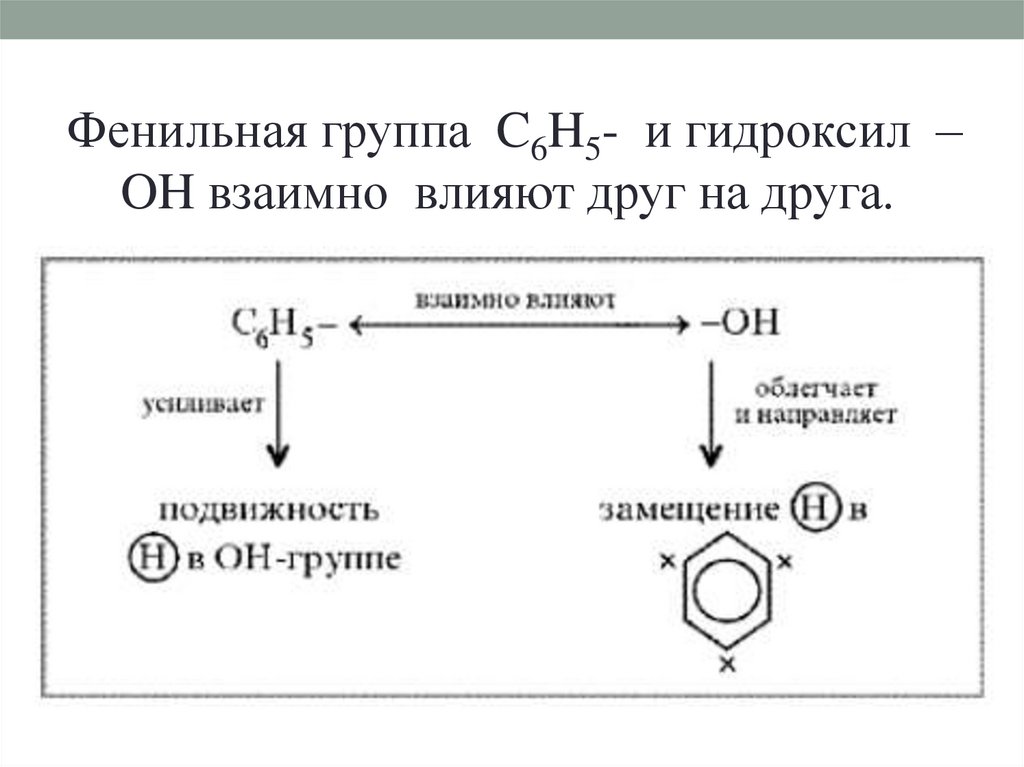
Фенильная группа C6H5- и гидроксил –OH взаимно влияют друг на друга.
15. Строение молекулы фенола
16. Химические свойства фенола
I) Кислотные свойства фенола: замещениеатома водорода гидроксильной группы.
1)Взаимодействие с активными металлами
2C6H5OH + 2Na
2C6H5ONa + H2
2) Взаимодействие со щелочами
C6H5OH + NaOH
C6H5ONa + H2 O
17. 3) Взаимодействие с галогенопроизводными Образуются простые эфиры
Сначала получают болеереакционноспособные феноляты, а затем
проводят их алкилирование.
C6H5ONa+C2H5Br→C6H5OC2H5+NaBr
Этилфеноловый эфир
18.
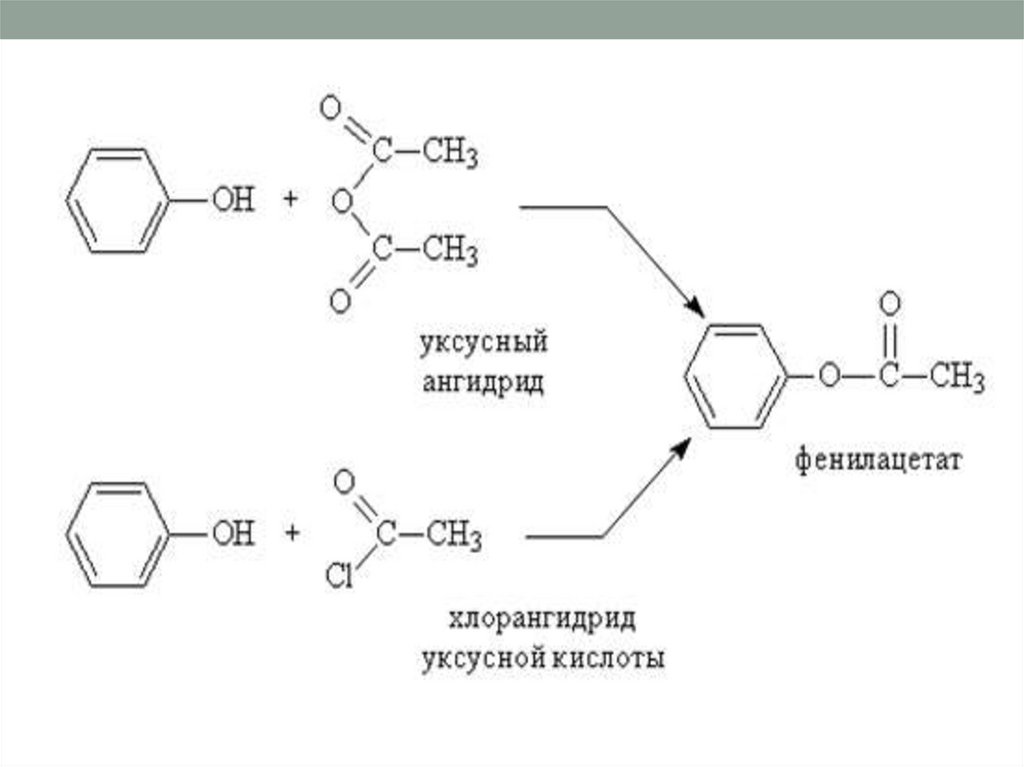
О-Ацилирование фенолов. Сложныеэфиры фенолов можно получить
только взаимодействием
фенолятов с галогенангидридами,
ангидридами карбоновых
кислоткислот:
• 4)
19.
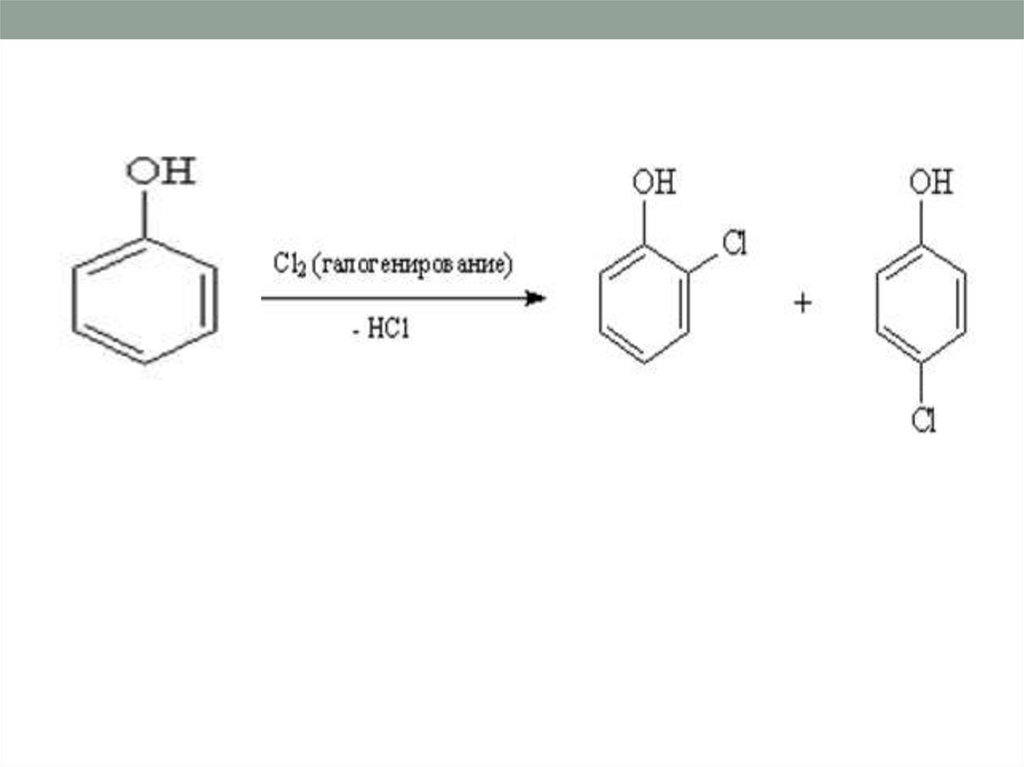
20. Реакции замещения атомов водорода в бензольном кольце (реакции электрофильного замещения).
21.
22.
1) Нитрование фенола разбавленной кислотой2) Нитрование фенола концентрированной кислотой
+ HNO3 =
+
H2O
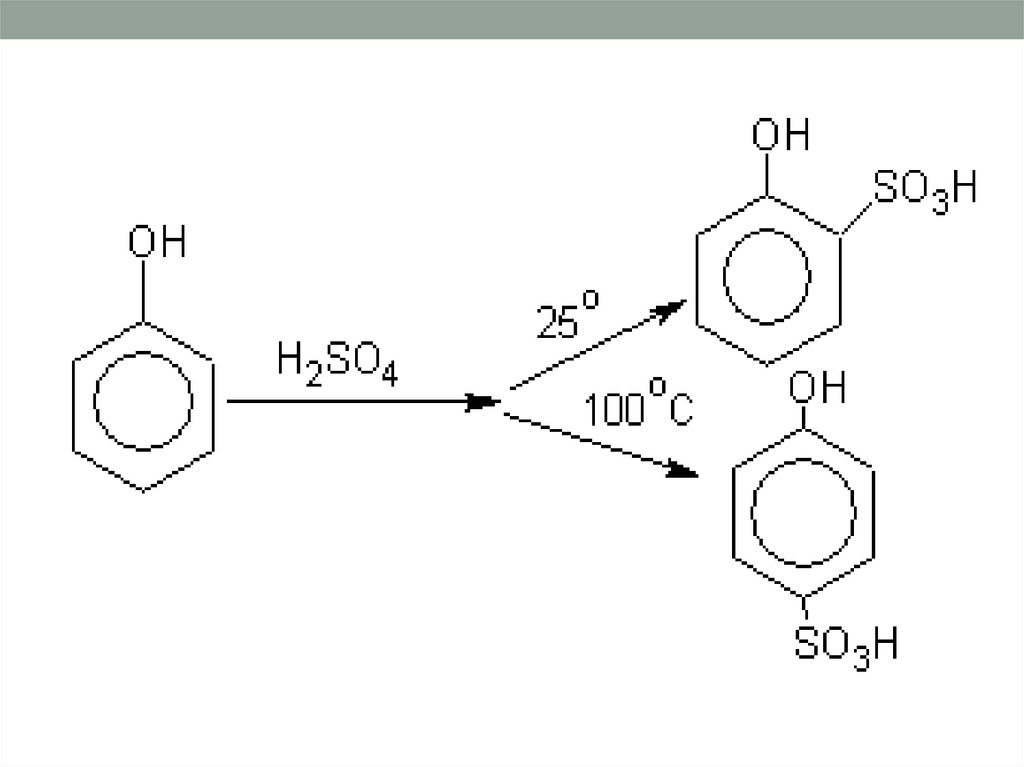
23. Реакция сульфирования . Фенол легко сульфируется концентрированной H2SO4, при этом при температуре 15-20оС преимущественно
получается о-изомер,а при 100оС – п-изомер.
24.
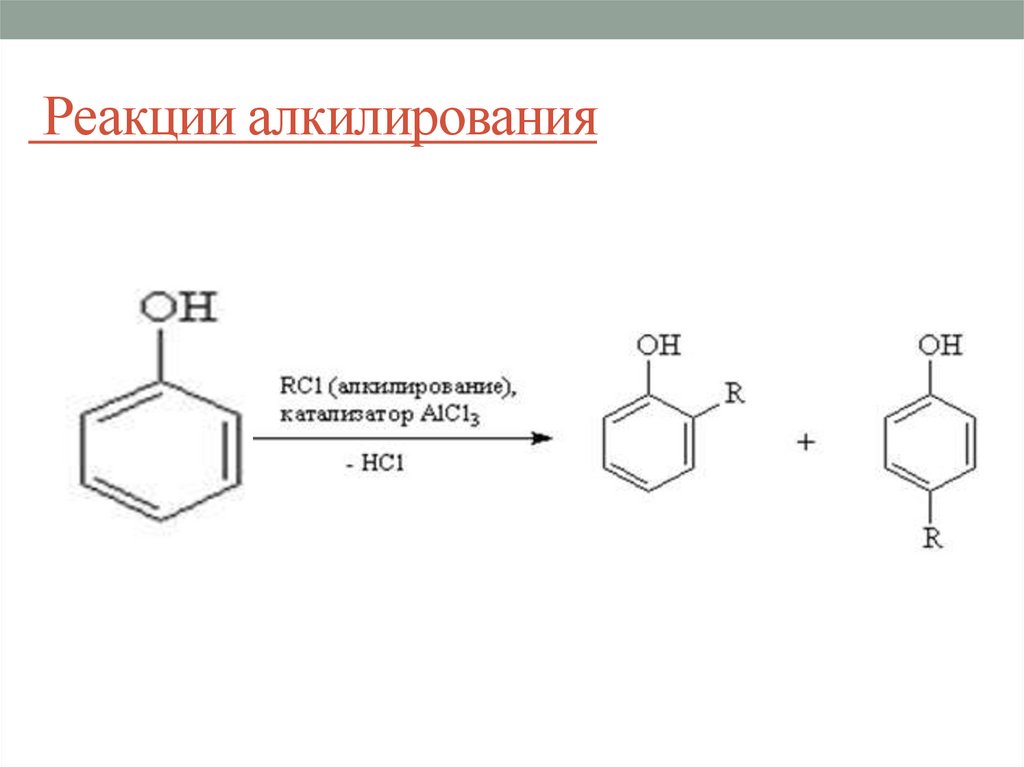
25. Реакции алкилирования
26. реакция Кольбе
OHONa
CO2
OH
COONa
HCl
OCOCH3
COOH
CH3COCl
COOH
125oC, P
салициловая кислота
(о-гидроксибензойная)
ацетилсалициловая
кислота
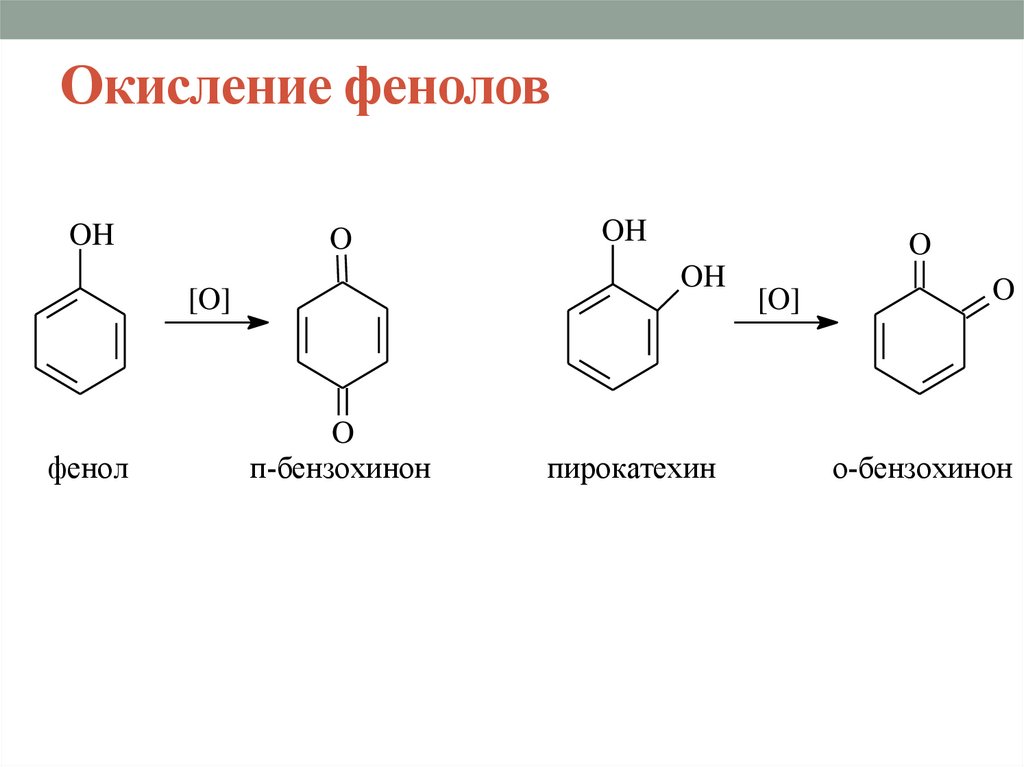
27. Окисление фенолов
OHO
O
OH
[O]
фенол
OH
O
п-бензохинон
пирокатехин
[O]
O
о-бензохинон
28.
IV) Реакции присоединениягидрирование фенола
C6H5OH + 3H2 = C6H11OH
циклогексанол
б) Поликонденсация фенола с альдегидами
29.
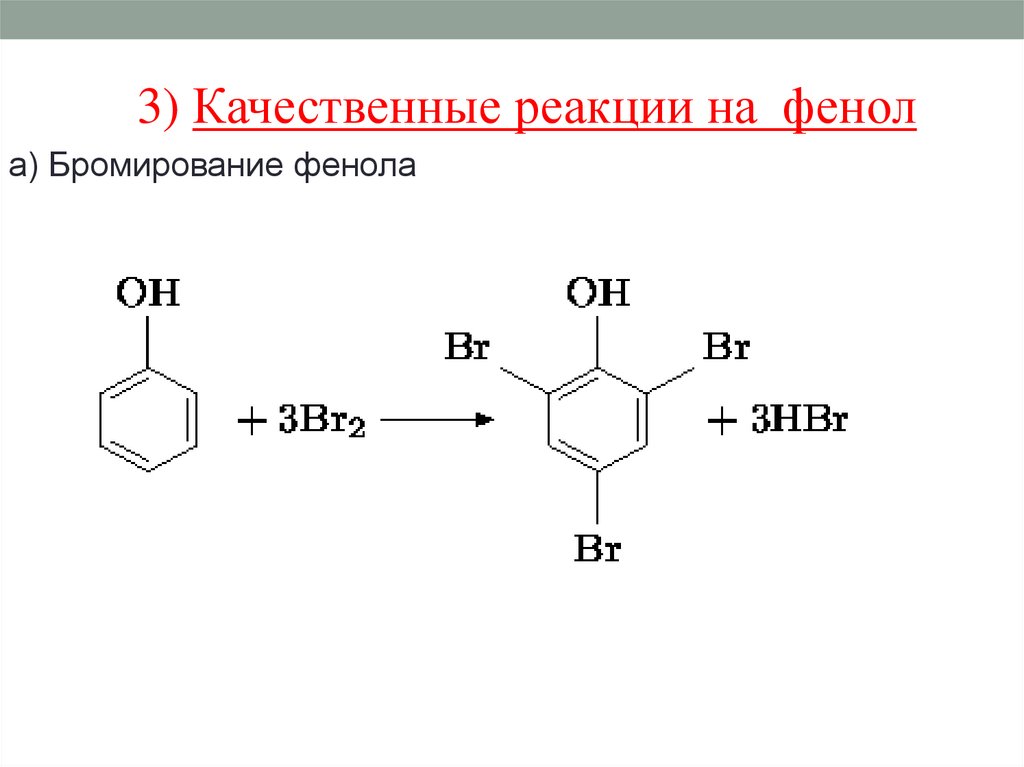
3) Качественные реакции на фенола) Бромирование фенола
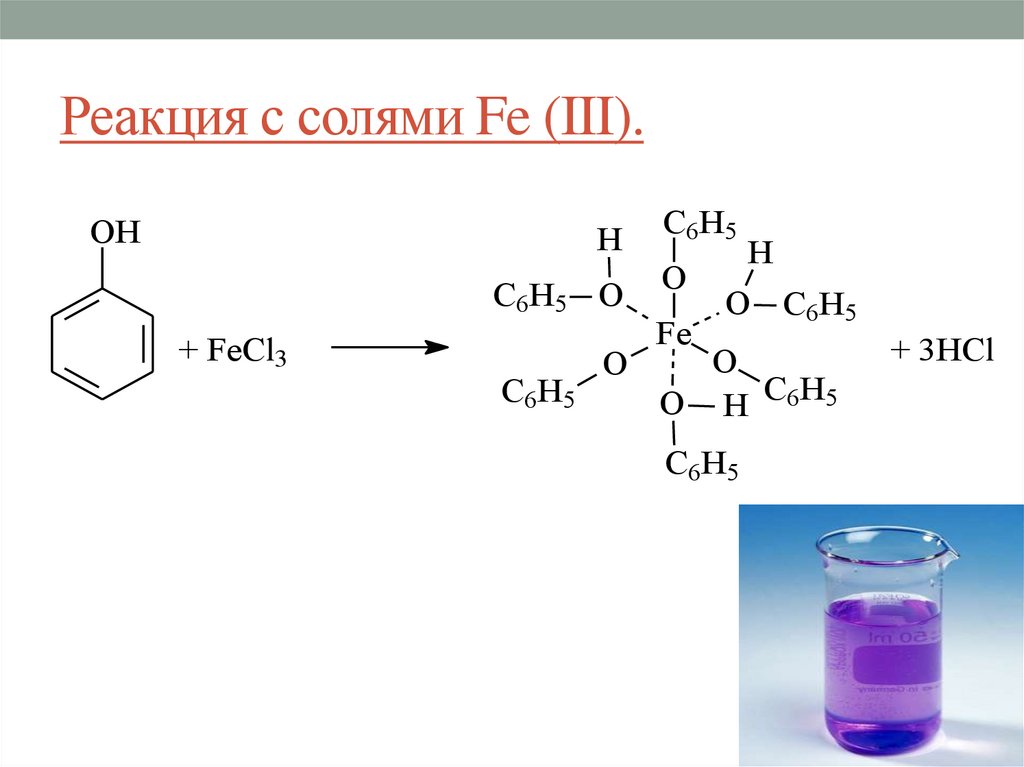
30. Реакция с солями Fe (III).
OHH
C6H5 O
+ FeCl3
C6H5
O
C6H5
O
Fe
H
O C6H5
O
O H C6H5
C6H5
+ 3HCl
31.
Резорцин – при взаимодействии сFeCl3 дают фиолетовое окрашивание, образуя
трирезорцинолят железа, пирокатехин –
грязно-зеленое,
гидрохинон – грязнозелёное, при избытке реактива
жёлтое
окрашивание.
32. Применение фенола
33.
• Раствор фенола применяется в медицинекак антисептическое средство.
• В качестве антисептика — препарат
«Орасепт» и «Фукорцин».
• Для производство фенолформальдегидных
смол;
• антиоксидантов, лекарственных препаратов,
антисептиков и пестицидов.
Фенол и его производные обусловливают
консервирующие
свойства коптильного дыма.




















 chemistry
chemistry








