Similar presentations:
Кислородсодержащие соединения азота
1.
КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ АЗОТА.Я никто. Меня не сыщешь: я
невидимый, дружище.
Электрический разряд – мой
родитель, друг и брат.
Когда я в воздух выделяюсь,
то постепенно окисляюсь. …
Оксид азота (II)
NO
В печи однажды прокалят аммония нитрат. Теперь
я газ. Прощай, нитрат! Признаться, я не рад…
Но ни людей, ни печь, я в этом не виню;
наоборот, развеселю и даже… опьяню! ...
Найди меня. Я газ. Я прост. Я
рыжий, словно лисий хвост. Я
образуюсь из нитрата, а в
воздухе - из газа-брата.
А если встречусь я с водой, то
стану сильной кислотой. ...
Оксид азота (I)
N2O
«веселящий газ»
Оксид азота (IV)
NO2
Бурый газ
2.
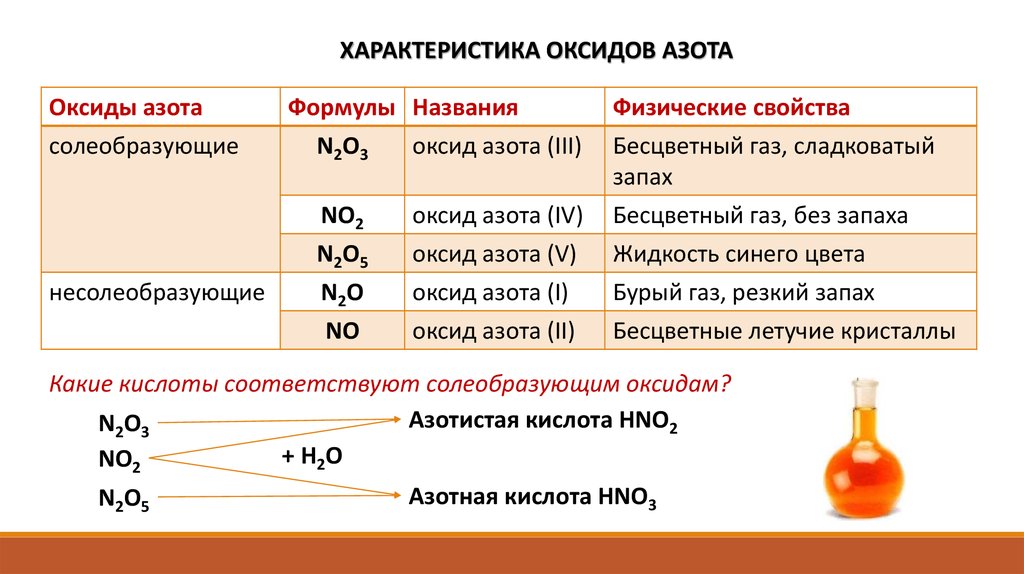
ХАРАКТЕРИСТИКА ОКСИДОВ АЗОТАОксиды азота
солеобразующие
несолеобразующие
Формулы Названия
N2O3
оксид азота (III)
Физические свойства
Бесцветный газ, сладковатый
запах
NO2
N2O5
N2O
оксид азота (IV)
оксид азота (V)
оксид азота (I)
Бесцветный газ, без запаха
Жидкость синего цвета
Бурый газ, резкий запах
NO
оксид азота (II)
Бесцветные летучие кристаллы
Какие кислоты соответствуют солеобразующим оксидам?
Азотистая кислота НNO2
N2O3
+ Н2O
NO2
N2O5
Азотная кислота НNO3
3.
Особенные химические свойства азотной и азотистой кислотыt
1. 4HNO3 →
2H2O + 4NO2 + O2
hν
4HNO3 →
2H2O + 4NO2 + O2
2. HNO3 окрашивает белки в
оранжево-желтый цвет
("ксантопротеиновая реакция")
3. HNO3 + Me = соль + H2O + Х
Чем больше разбавлена кислота, тем
ниже степень окисления азота.
HNO3(конц.ω>60%)
4.
4. Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет благородные металлы.HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
5. HNO3 (конц.) + неметалл = HnЭОm + NO2 + вода
HNO3 (р.) + неметалл + вода = HnЭОm + NO
Р4 + 20 НNО3 = 4 НРО3 + 20 NО2↑ + 8 Н2О
3P + 5HNO3 + 2H2O → 5NO↑ + 3H3PO4
2НNO2 + O2 = 2HNO3
2HNO2 + 2HI = I2 + 2NO + 2H2O
Э – неметалл в
высшей степени
окисления
Азотистая кислота – слабый
электролит
5.
ПОЛУЧЕНИЕ АЗОТНОЙ КИСЛОТЫ1. Лабораторный способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
2. Промышленный способ
Осуществляется в три этапа:
a)
Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
6. ДОМАШНЕЕ ЗАДАНИЕ:
§18 с.95-98,№5,8 (письменно





 chemistry
chemistry








