Similar presentations:
Кислородные соединения азота
1.
2.
Подумай и ответь на следующие вопросы:1. Какие степени окисления проявляет азот в соединениях с
кислородом?
2. Запишите формулы возможных оксидов азота.
Задание. Проверьте правильность ответов, используя слайд
презентации.
Зафиксируйте в тетради новую для себя информацию.
3.
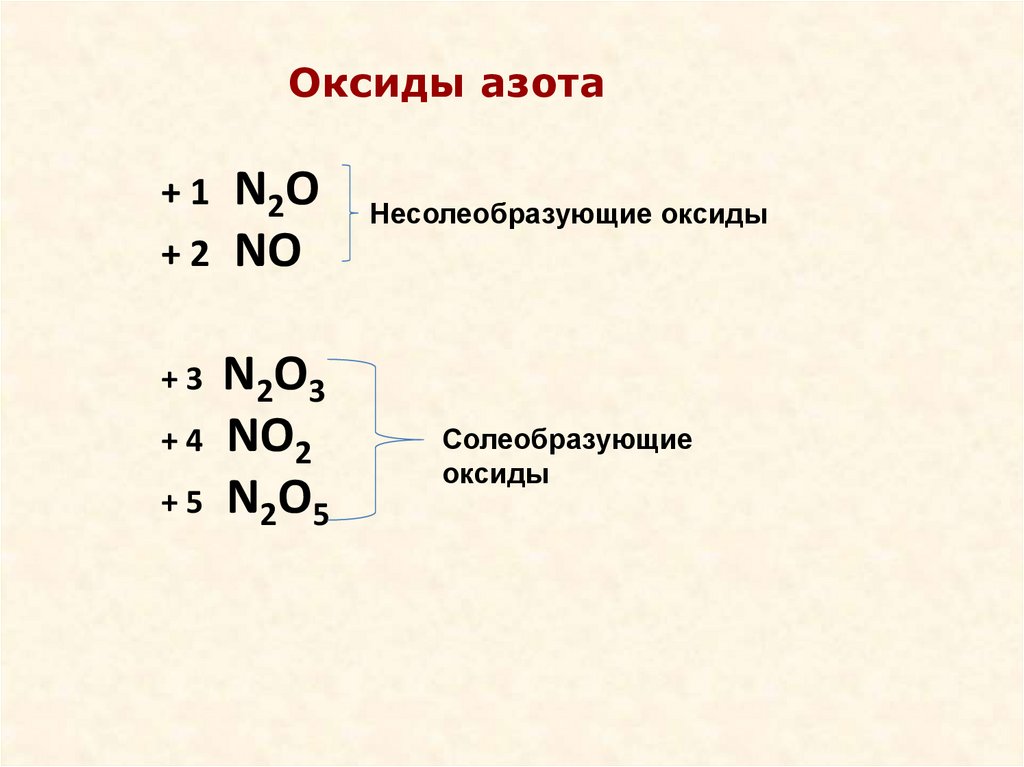
Оксиды азотаАзот образует шесть кислородных соединений.
степени окисления +1 N2O
+2 NO
+3 N2O3
+4 NO2, N2O4
+5 N2O5
4.
Оксиды азота+ 1 N2O
+ 2 NO
Несолеобразующие оксиды
+ 3 N2O3
+ 4 NO2
+ 5 N2O5
Солеобразующие
оксиды
5.
N 2Oоксид азота (I), закись азота или «веселящий
газ», возбуждающе действует на нервную
систему человека, используют в медицине как
анестезирующее средство.
Физические свойства: Бесцветный газ со слабым запахом и
сладковатым вкусом, растворим в воде.
Получение:
NH4NO3 = N2O +2H2O
Химические свойства:
несолеобразующий
1. разложение при нагревании
2N2+1O = 2N20+O2
2. с водородом
(проявляет окислительные свойства)
N2+1O +H2 = N20 +H2O
6.
NOБесцветный газ, без запаха. Малорастворим в
воде. Быстро окисляется на воздухе. Ядовит!
Получение:
1. В природе:
N2 + O2
2. В промышленности:
2NO
4NH3 + 5O2 = 4NO +6H2O
Химические свойства:
несолеобразующий
1. Легко окисляется: 2N+2O + O2 = 2N+4O2
2. окислитель:
2N+2O + 2SO2 = 2SO3 +N20
7.
N 2O 3жидкость темно-синего цвета хорошо растворимая
в воде , термически неустойчивая, t кип.= 3,5 0С,
т. е. существует в жидком состоянии только при
охлаждении, в обычных условиях переходит в
газообразное состояние.
Получение:
NO 2 + NO
Химические свойства:
N2O3
кислотный оксид
ВСЕ свойства кислотных оксидов.
8.
NO2Газ бурого цвета, со специфическим
запахом. Хорошо растворим в воде. Ядовит!
Получение: 2NO + O2 = 2NO2
Cu + 4HNO3(к) = Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства:
Оксид азота (IV) NO2 является смешанным оксидом. При
взаимодействии его с водой, образуются две кислоты.
2NO2 + H2O = HNO2 + HNO3
При взаимодействии NO2 с водой в присутствии кислорода
образуется только азотная кислота.
4NO2 + 2H2O + О2 = 4HNO3
При растворении оксида в щелочи, образуются две соли.
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
9.
N 2O 5Белое кристаллическое вещество. Растворяется в
воде с образованием азотной кислоты.
Получение:
2NO2 + O3 = N2O5 + O2
2HNO3 + P2O5 = 2HPO3 + N2O5
Химические свойства:
кислотный оксид
ВСЕ свойства кислотных оксидов.
1. легко разлагается
2N2O5 = 4NO2 + O2
10.
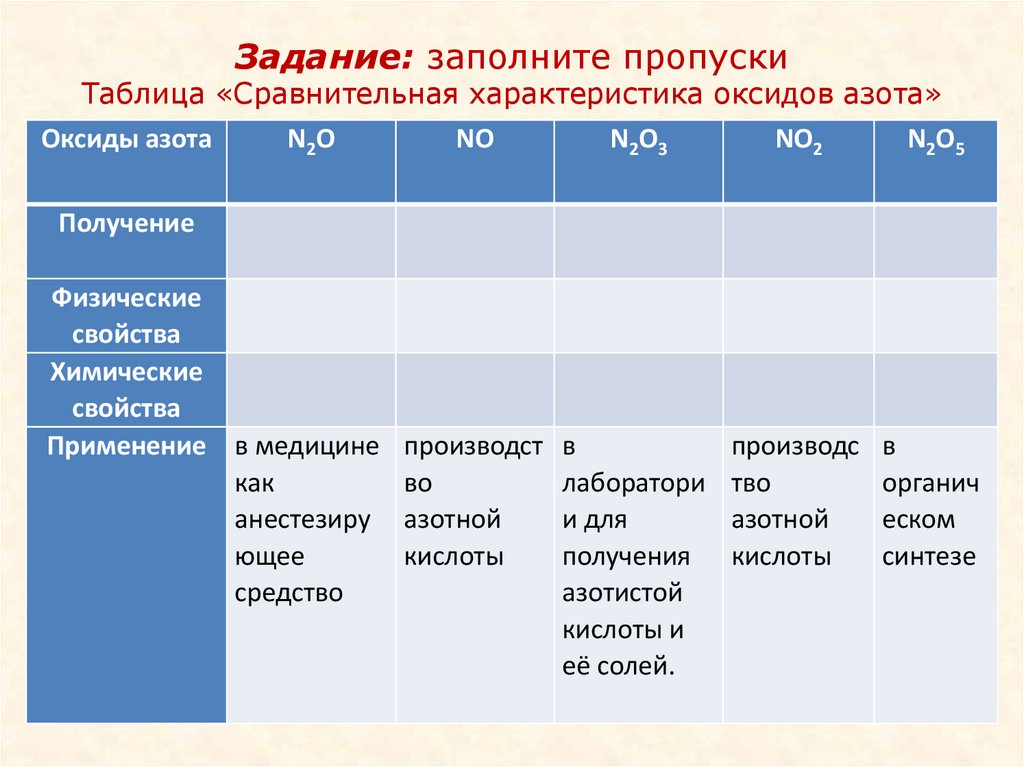
Задание: заполните пропускиТаблица «Сравнительная характеристика оксидов азота»
Оксиды азота
N2O
NO
N2O3
NO2
N2O5
производс
тво
азотной
кислоты
в
органич
еском
синтезе
Получение
Физические
свойства
Химические
свойства
Применение в медицине
как
анестезиру
ющее
средство
производст в
во
лаборатори
азотной
и для
кислоты
получения
азотистой
кислоты и
её солей.
11.
HNO3Классификация по:
наличию кислорода:
кислородсодержащая
основности:
одноосновная
растворимости в воде:
растворимая
летучести:
летучая
степени электролитической диссоциации:
сильная
12.
HNO3Азотная кислота – бесцветная гигроскопичная жидкость, c
резким запахом, «дымит» на воздухе, неограниченно растворимая
в воде. Температура плавления −41,59 °C, кипения +82,6 °C с
частичным разложением. Азотная кислота ядовита.
При хранении на свету разлагается на оксид азота (IV), кислород и
воду, приобретая желтоватый цвет:
4HNO3 = 4NO2 + O2 + 2H2O
13.
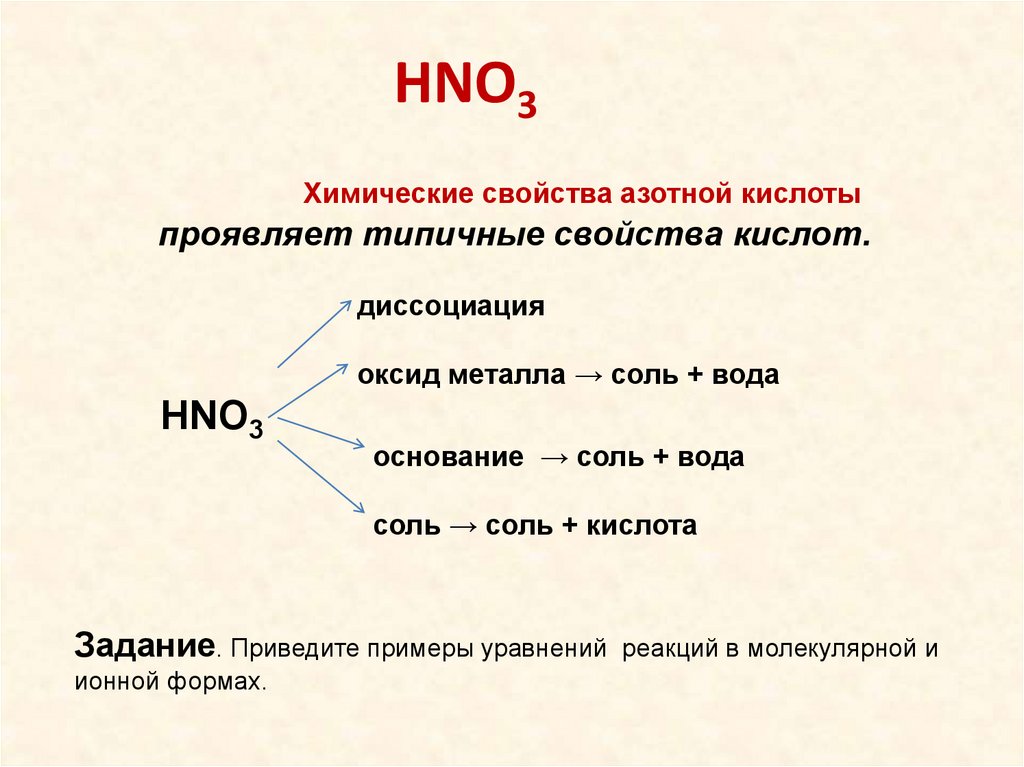
HNO3Химические свойства азотной кислоты
проявляет типичные свойства кислот.
диссоциация
оксид металла → соль + вода
HNO3
основание → соль + вода
соль → соль + кислота
Задание. Приведите примеры уравнений реакций в молекулярной и
ионной формах.
14.
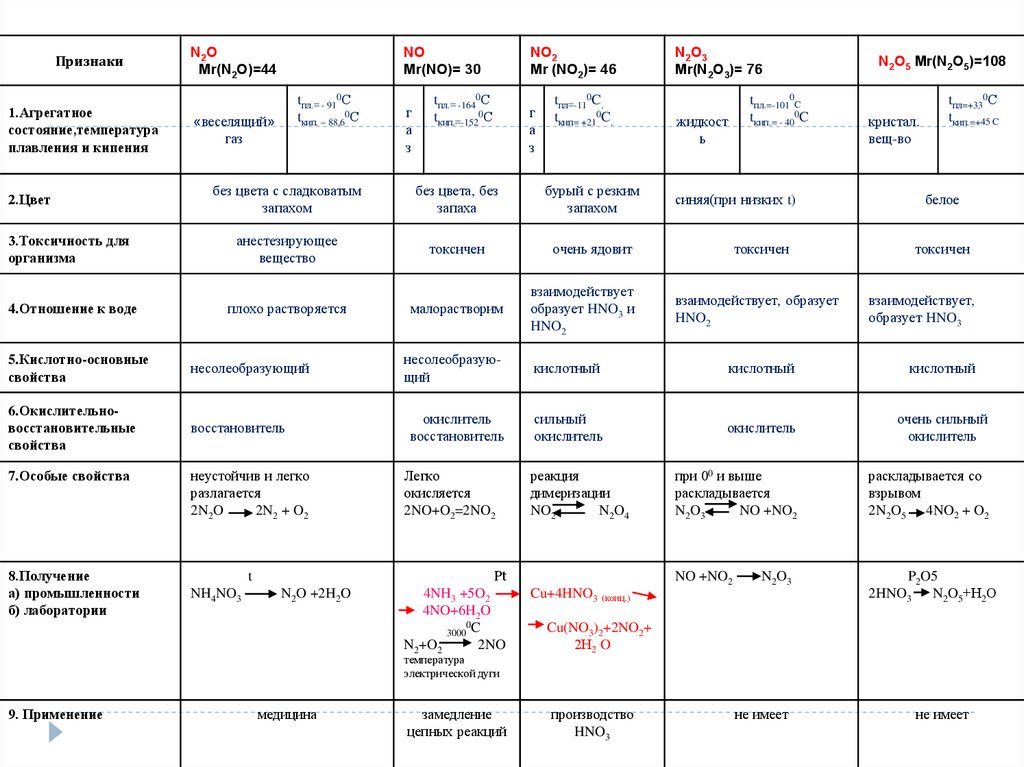
Признаки1.Агрегатное
состояние,температура
плавления и кипения
N2O
Mr(N2O)=44
NO
Mr(NO)= 30
tпл.= - 910С
tкип. – 88,60С
«веселящий»
газ
г
а
з
tпл.= -1640С
tкип.=-1520С
NO2
Mr (NO2)= 46
г
а
з
tпл=-110C.
tкип= +210C.
N2O3
Mr(N2O3)= 76
tпл.=-1010C
tкип.= - 400C
жидкост
ь
без цвета с сладковатым
запахом
без цвета, без
запаха
бурый с резким
запахом
синяя(при низких t)
3.Токсичность для
организма
анестезирующее
вещество
токсичен
очень ядовит
токсичен
4.Отношение к воде
плохо растворяется
малорастворим
взаимодействует
образует HNO3 и
HNO2
взаимодействует, образует
HNO2
2.Цвет
N2O5 Mr(N2O5)=108
кристал.
вещ-во
tпл=+330С
tкип.=+45 C
белое
токсичен
взаимодействует,
образует HNO3
5.Кислотно-основные
свойства
несолеобразующий
несолеобразующий
кислотный
кислотный
кислотный
6.Окислительновосстановительные
свойства
восстановитель
окислитель
восстановитель
сильный
окислитель
окислитель
очень сильный
окислитель
неустойчив и легко
разлагается
2N2O
2N2 + O2
Легко
окисляется
2NO+O2=2NO2
реакция
димеризации
NO2
N2O4
при 00 и выше
раскладывается
N2O3
NO +NO2
раскладывается со
взрывом
2N2O5 4NO2 + O2
t
Pt
4NH3 +5O2
4NO+6H2O
0
3000 C
N2+O2
2NO
NO +NO2
P2O5
2HNO3
N2O5+Н2О
7.Особые свойства
8.Получение
а) промышленности
б) лаборатории
NH4NO3
N2O +2H2O
температура
электрической дуги
9. Применение
медицина
замедление
цепных реакций
N 2O 3
Cu+4HNO3 (конц.)
Cu(NO3)2+2NO2+
2Н2 O
производство
HNO3
не имеет
не имеет
15.
Домашнее задание:1. Заполните таблицу в тетради.
2. Задание. Приведите примеры уравнений
реакций , характеризующие общие кислотные
свойства азотной кислоты, в молекулярной и
ионной формах.











 chemistry
chemistry








