Similar presentations:
Кислородсодержащие соединения азота
1.
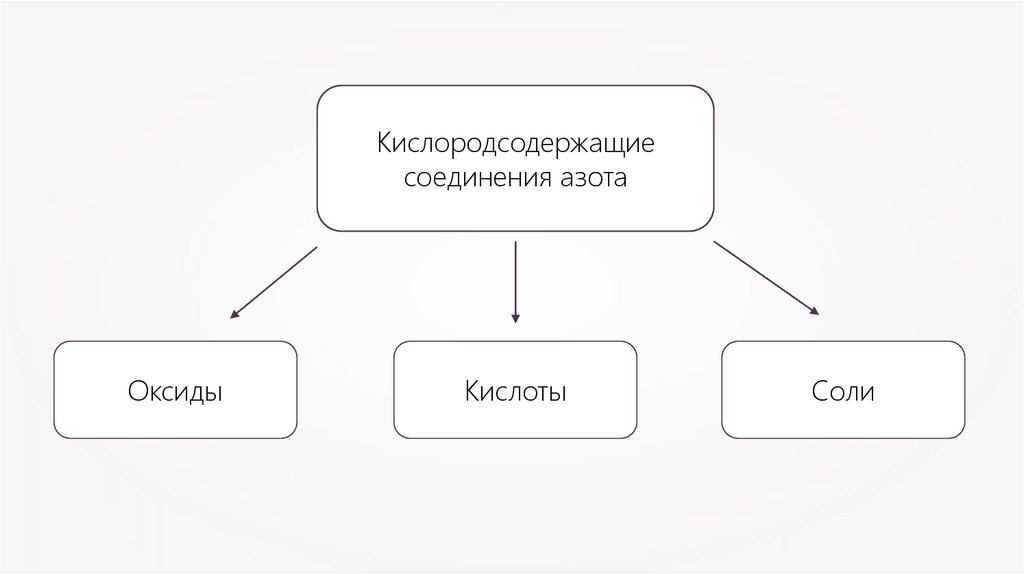
Кислородсодержащиесоединения азота
Оксиды
Кислоты
Соли
2.
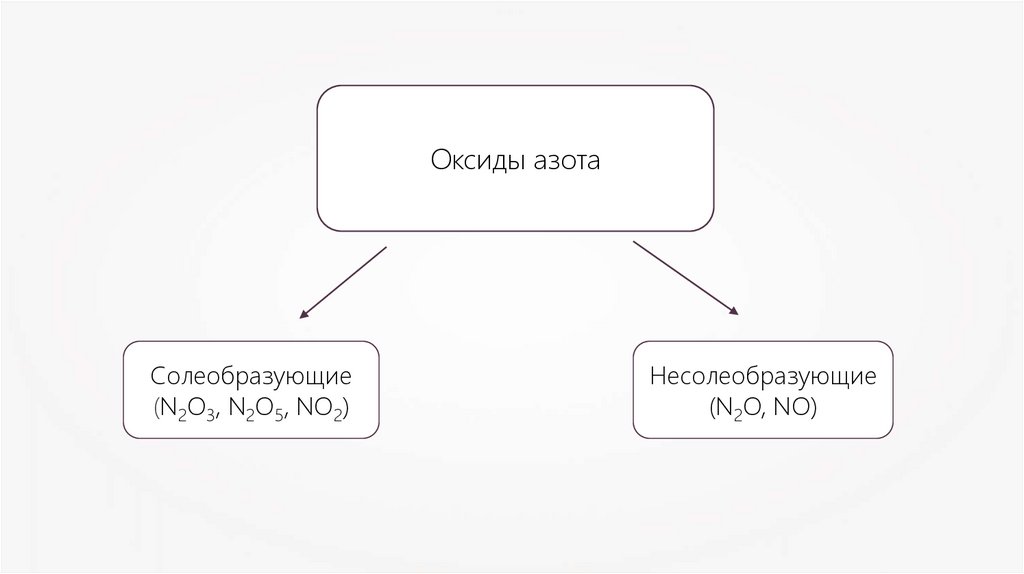
Оксиды азотаСолеобразующие
(N2O3, N2O5, NO2)
Несолеобразующие
(N2O, NO)
3.
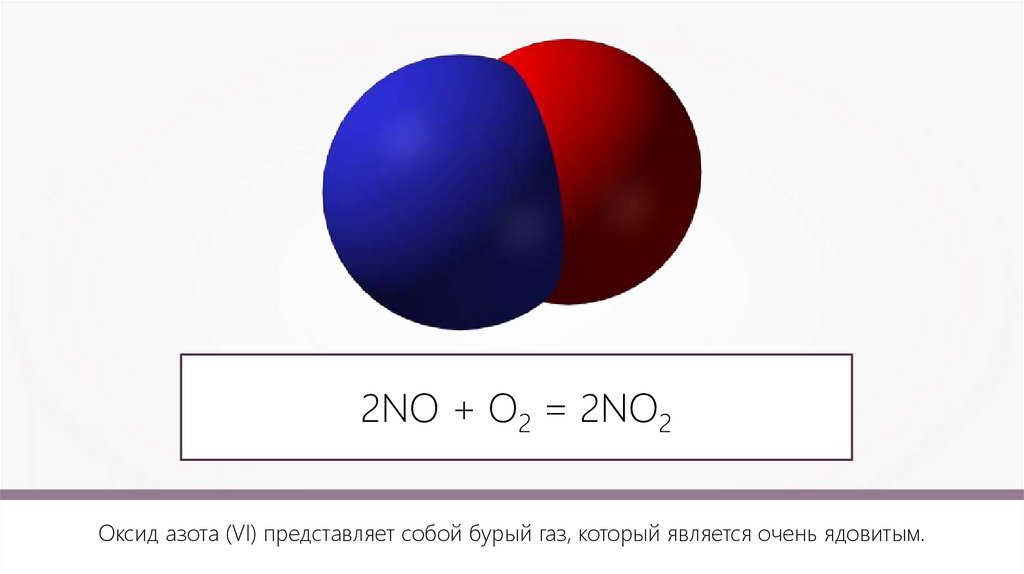
2NO + О2 = 2NO2Оксид азота (VI) представляет собой бурый газ, который является очень ядовитым.
4. АЗОТНАЯ КИСЛОТА
5.
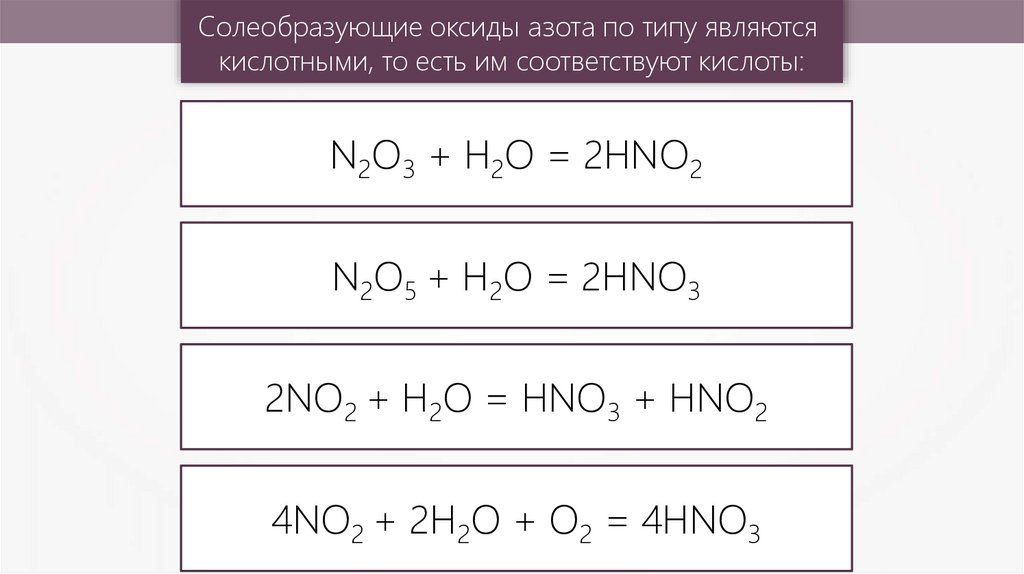
Солеобразующие оксиды азота по типу являютсякислотными, то есть им соответствуют кислоты:
N2O3 + Н2О = 2HNO2
N2O5 + Н2О = 2HNO3
2NO2 + Н2О = HNO3 + HNO2
4NO2 + 2Н2О + О2 = 4HNO3
6.
4HNO3 = 2Н2О + О2↑ + 4NO2↑Азотная кислота представляет собой бесцветную жидкость, «дымящуюся» на воздухе.
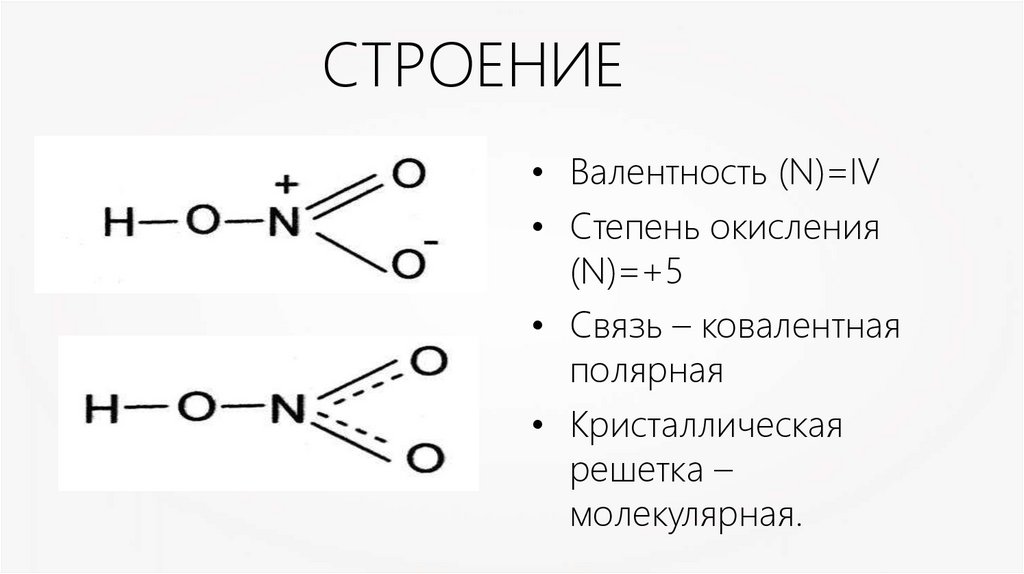
7. СТРОЕНИЕ
• Валентность (N)=IV• Степень окисления
(N)=+5
• Связь – ковалентная
полярная
• Кристаллическая
решетка –
молекулярная.
8. ХАРАКТЕРИСТИКА
HNO3Одноосновная
Кислородсодержащая
Нестабильная
Летучая
Сильный электролит
Сильный окислитель
4HNO3→ 4NO2 + 2H2O + O2
9. Физические свойства
• Безводная HNO3 при обычной температуре –бесцветная летучая жидкость со специфическим
запахом, tкип.=82,6°С, концентрированная
«дымящая» HNO3 имеет желтый цвет, так как
разлагается с выделением NO2, смешивается с
водой в любых соотношениях, при t=-42°C
застывает в белоснежные кристаллы.
10.
Химические свойства азотной кислотыI. Общие с другими кислотами:
1) Действие на индикаторы
HNO3 H++NO3Синий лакмус красный
Метиловый оранжевый красный
Универсальный (pH<7) оттенки красного
11.
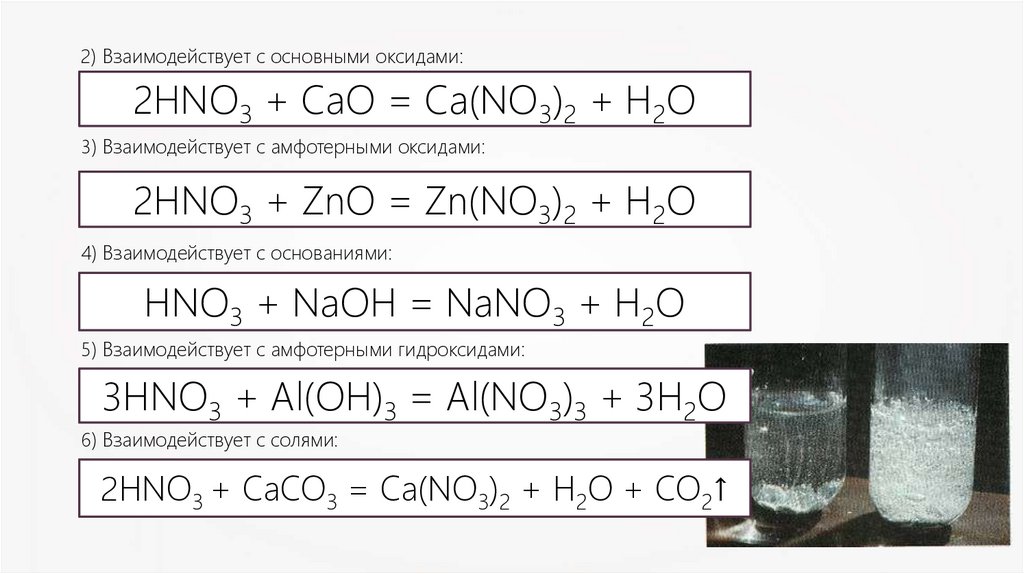
2) Взаимодействует с основными оксидами:2HNO3 + СаО = Са(NO3)2 + Н2О
3) Взаимодействует с амфотерными оксидами:
2HNO3 + ZnO = Zn(NO3)2 + Н2О
4) Взаимодействует с основаниями:
HNO3 + NaOH = NaNO3 + H2O
5) Взаимодействует с амфотерными гидроксидами:
3HNO3 + Al(OH)3 = Al(NO3)3 + 3H2O
6) Взаимодействует с солями:
2HNO3 + СaCO3 = Са(NO3)2 + Н2О + CO2↑
12.
II. Окислительные свойства.1) Взаимодействие с металлами:
При взаимодействии с металлами образуются нитрат, вода и
третий продукт по схеме:
HNO3(р.)+Me(до H2)→Ме(NO3)x+H2O+NH3/(NH4NO3)
HNO3(р.)+Me(после H2)→Ме(NO3)x+H2O+NO
HNO3(к.)+Me(до H2)→Ме(NO3)x+H2O+N2O(N2)
HNO3(к.)+Me(после H2)→Ме(NO3)x+H2O+NO2
Концентрированная HNO3 на Al, Cr, Fe, Au, Pt не
действует.
13.
При взаимодействии азотной кислоты с металлами невыделяется водород.
Продукт реакции зависит от нескольких факторов:
положения металла в ряду активности, концентрации
кислоты, условий проведения реакции.
8HNO3(разб.) + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
4HNO3(конц.) + Cu = Cu(NO3)2 + 2NO2↑ + 2H2O
14.
15.
2) Взаимодействие с неметалламиПри взаимодействии с неметаллами образуется
кислота, в которой у неметалла высшая степень
окисления, и продукт по схеме:
конц.
разб.
NO2
NO
неMe + HNO3
3P+5HNO3(р)+2H2O 3H3PO4+5NO
P+5HNO3(к.) H3PO4+5NO2+H2O
16. Вывод:
HNO3 – очень реакционно-способноевещество. В химических реакциях
проявляет себя как сильная кислота и как
сильный окислитель.
17.
Азотная кислота — сильный окислитель. Она способна окислятьмногие органические вещества, обесцвечивать красители.
18.
Применение азотной кислоты:– производство минеральных азотных удобрений;
– производство искусственных волокон;
– производство пластических масс;
– производство лекарств;
– производство органических красителей и лаков;
– производство взрывчатых веществ.
19.
Нитраты — соли азотной кислоты.Соли азотной кислоты, такие как нитрат
натрия NaNO3, нитрат калия KNO3, нитрат
кальция Ca(NO3)2, нитрат аммония NH4NO3
называют селитрами и используют
в качестве азотных удобрений.
20.
KNO3 используют при изготовлениичёрного пороха.
NH4NO3 применяют в изготовлении
аммонала.
AgNO3 используют в медицине в качестве
прижигающего средства.
21.
При нагревании нитраты разлагаютсяс выделением кислорода:
Ca(NO3)2 = Ca(NO2)2 + O2↑












 chemistry
chemistry








