Similar presentations:
Химическая связь и строение молекул
1. Химическая связь и строение молекул
Лекция 72. Химическая связь
3. Потенциальная кривая
U ( r ) D e 1 e( r re ) 2
4.
5. Атомная орбиталь
АО = nlm6. Спин – орбиталь электрона.
(i)( ) ms = +1/2 а.е.
( ) ms = -1/2 а.е.
Пример
( )
В общем случае 1 (1)
7. Полная волновая функция атома и молекулы.
Состояние системы содержащейнесколько электронов описывается
полной волновой функцией,
учитывающей квантовые состояния
для всех электронов, т.е. совокупностью спин-орбиталей I .
ат = П I ; мол = П I
8. Метод валентных схем (МВС)
Рассмотрим молекулу Н2, которуюпостроим из двух АО атомов Н.
AO для Н1 – 1s0 и 1 = 1s0,a* (1)= 1s0,a(1)= H,a (1)
для Н2 – 1s0 и 2 = 1s0,b * (2)= 1s0,b(2) = H,b (2)
H2
*
1
2
9. Метод молекулярных орбиталей (ММО)
1Ha
(1) (1)
Hb
H2
*
2
1
Ha
2
(2) (2)
Hb
10. Метод молекулярных орбиталей
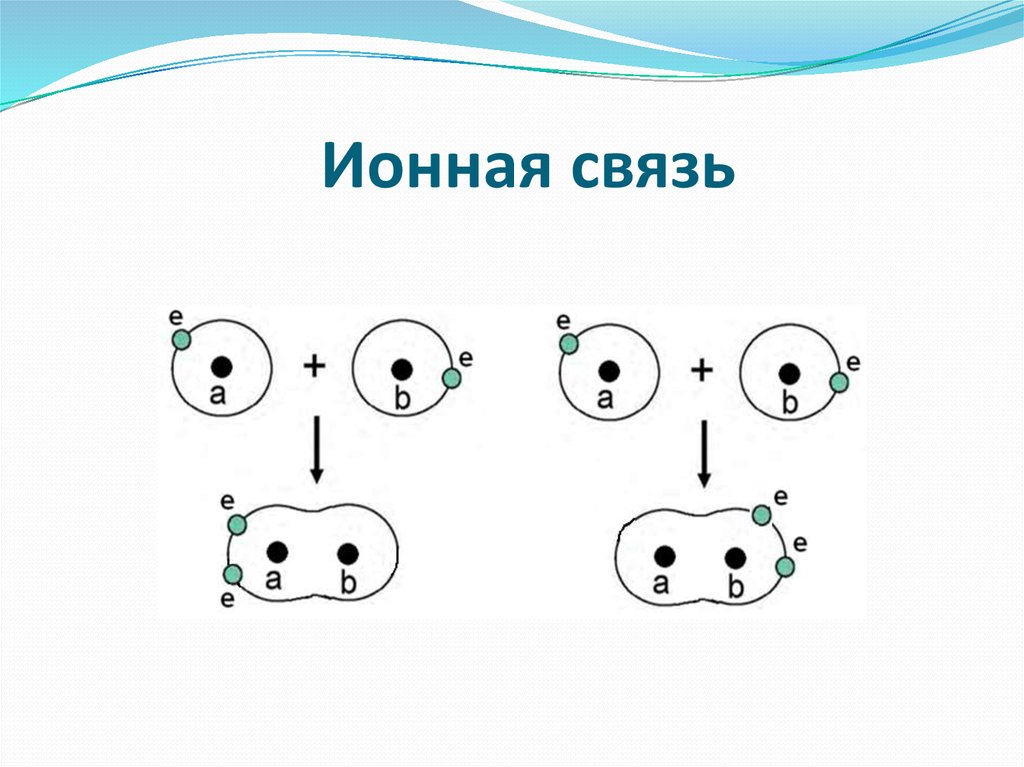
11. Ионная связь
12. МВС
Связь образуется между атомами, имеющиминеспаренные электроны с антипараллельными
спинами.
Образование химической связи обусловлено
повышенной электронной плотностью между
ядрами. Возникает ковалентная двухэлектронная двухцентровая связь, которую наглядно
можно изобразить в виде черточки
валентности Н-Н.
Прочность химической связи в большой
степени определяется перекрыванием
электронных облаков взаимодействующих
атомов, или АО.
13.
Метод валентных схем (МВС)14. Гипервалентность и гибридизация ОА
15. Донорно-акцепторное взаимодействие
16.
17. Метод молекулярных орбиталей
H = Te1 +Te2 + Uaei + Ue1e2 + UabH = -1/2∇2е1-1/2∇2е2 - Za/ri + 1/r12 + Z2/R в а.е.
18. Точное решение уравнения Шредингера
Точное решение уравненияШредингера для многоэлектронной
молекулы решить невозможно
Причина:
Потенциальная энергия взаимодействия между электронами е1 и е2
Ueiej = 1/rij
19. Решение для Н2+
Решение для+
Н2
Ĥ М(r, , ) = E М(r, , )
H = -1/2∇2е1- (Za/r1 + Zb/r2 ) +Z2/R (в а.е.)
Общий подход к решению молекулярных
структур
М = R(r) ( ) ( ) = Z( )H( ) ( ) = f(n,l, )
Сферические Цилиндрические
координаты
коoрдинаты
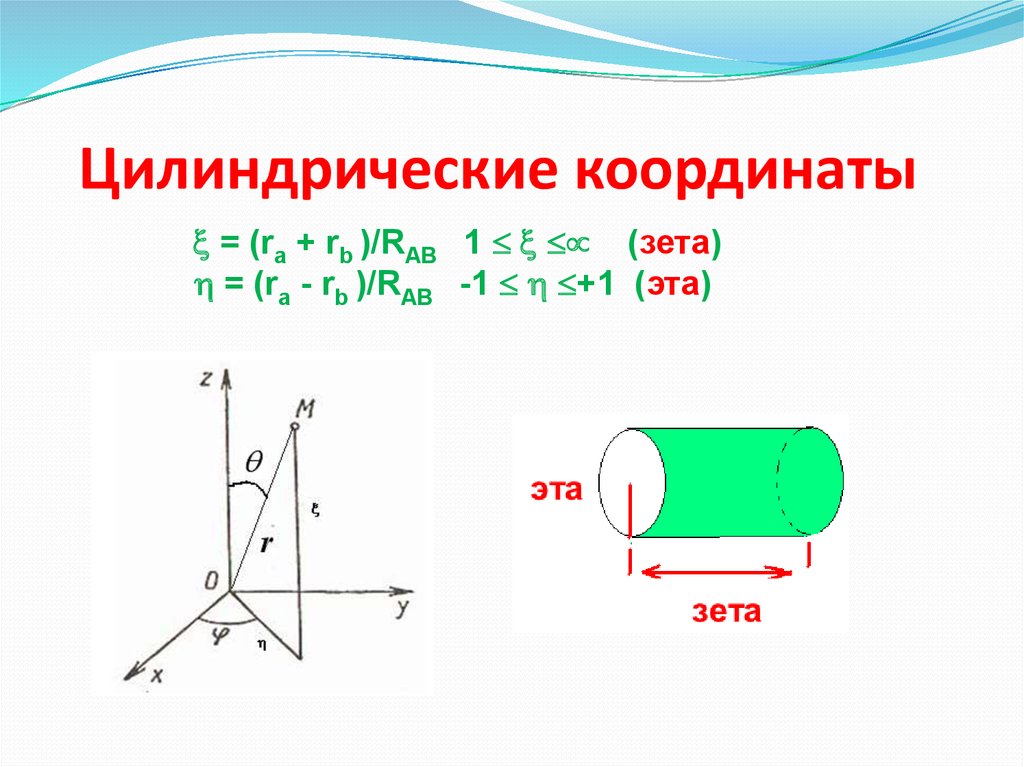
20. Цилиндрические координаты
= (ra + rb )/RAB 1 (зета)= (ra - rb )/RAB -1 +1 (эта)
21. Анализ решения
Для молекулы квантовые числа n и lне имеют физического смысла и не
постоянные.
Квантовое число является
решением ( ) = Аexp(i ) и
называется осевым квантовым
числом | | = 0, 1, 2, 3
22. Обозначение МО для двухатом-ных молекул
Обозначение МО для двухатомных молекул| |
МО
0 1
2
3
МО = N
где N – номер МО по мере возрастания энергии.
- индекс указывающий симметрию относительно
операции инверсии î. Возможны два случая:
î = +1* ( g – четная) или
î = -1* (u – нечетная) функция
23. Осевое квантовое число
Осевое квантовое числоКвантовое число в молекуле может быть
сопоставлено с кв.числом m в атоме, если
расположить молекулу по оси Z и
рассмотреть проекцию на плоскость XY
î = +1*
24. Осевое квантовое число =1
Осевое квантовое число = 12 u,x = 2px1 + 2px2 =+1 ; 2 u,y = 2py1 + 2py2 =-1
î = -1*






















 chemistry
chemistry








